Wnt/β-catenin信号通路调控哮喘气道重塑的机制研究*
2017-09-22贾宵宵郑榕颖曾泽宇张维溪
贾宵宵, 郑榕颖, 黄 悦, 曾泽宇, 张维溪
(温州医科大学附属第二医院,育英儿童医院儿童变态反应(过敏)与免疫科, 浙江 温州 325027)
Wnt/β-catenin信号通路调控哮喘气道重塑的机制研究*
贾宵宵, 郑榕颖, 黄 悦, 曾泽宇, 张维溪△
(温州医科大学附属第二医院,育英儿童医院儿童变态反应(过敏)与免疫科, 浙江 温州 325027)
目的: 探讨Wnt/β-catenin 信号通路调控哮喘气道平滑肌细胞(ASMC)的功能和参与哮喘气道重塑的机制。方法: 建立大鼠哮喘模型,提取大鼠ASMC。Western blot法检测哮喘组和正常组大鼠ASMC中β-连环蛋白(β-catenin)、糖原合成酶激酶-3β(GSK-3β)、原癌基因c-Myc和细胞周期蛋白D1(cyclin D1)的蛋白表达。抑制哮喘组和对照组ASMC中β-catenin和转录辅助因子p300/CBP间的相互作用后,采用CCK-8法和流式细胞术检测ASMC的细胞活力和周期变化。抑制P38丝裂原活化蛋白激酶(MAPK)活性后,采用Western blot法检测c-Myc和cyclin D1的蛋白表达变化。结果: Western blot法显示哮喘组ASMC中β-catenin、c-Myc和cyclin D1的蛋白表达水平均明显高于对照组(P<0.05), 同时GSK-3β的蛋白表达水平则低于对照组(P<0.05)。抑制β-catenin和p300/CBP间相互作用后,哮喘组ASMC的细胞活力下降幅度和细胞周期改变程度均较对照组更为明显(P<0.05)。抑制P38 MAPK活性后,哮喘模型大鼠及对照大鼠ASMC中Wnt/β-catenin信号通路的靶蛋白c-Myc 和cyclin D1的表达均下调,差异有统计学意义(P<0.05)。结论: Wnt/β-catenin信号通路可能通过上调c-Myc和cyclin D1的表达、 与P38 MAPK信号通路相互作用以及调控ASMC的生长和分化等途径,影响ASMC的功能,参与哮喘气道重塑。
哮喘; 气道重塑; 气道平滑肌细胞; Wnt/β-catenin信号通路; β-连环蛋白
支气管哮喘(简称哮喘)是一种由多种细胞和细胞因子参与,以慢性气道炎症为特征的异质性疾病[1]。气道重塑是哮喘最主要的病理生理特征,其形成机制十分复杂,目前的研究表明,气道平滑肌细胞(airway smooth muscle cell,ASMC)的增殖和迁移是导致气道重塑发生和发展的关键因素[2]。Wnt/β-连环蛋白(β-catenin)信号通路与哮喘的关系十分密切[3],对ASMC的增殖和分化功能亦有影响[4-5]。糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)调控β-catenin在细胞内的表达,而核内原癌基因c-Myc和细胞周期蛋白D1(cyclinD1)均为Wnt/β-catenin信号通路下游的靶基因,已被证明参与哮喘气道重塑过程[6-7]。 因此,Wnt/β-catenin信号通路可能通过调节其下游靶基因的表达水平和影响ASMC的增殖和分化功能等途径,参与哮喘气道重塑的形成和发展。此外,细胞内的信号转导途径并非单独孤立的存在,事实上各信号通路间存在着功能上的关联,目前的研究表明,Wnt/β-catenin和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路间存在着大量的相互串话[8],但Wnt/β-catenin和MAPK信号通路是否共同调控哮喘气道重塑过程,目前尚未完全阐明。
本研究通过建立慢性哮喘模型大鼠,获取大鼠AMSC,研究Wnt/β-catenin 信号通路在哮喘气道重塑过程中对ASMC功能的调控,探讨Wnt/β-catenin 信号通路参与哮喘气道重塑的具体机制。
材料和方法
1实验材料
1.1实验动物 选用SPF级雄性SD大鼠16只,年龄为8周,体重180~200 g,购自上海斯莱克实验动物有限公司,许可证编号为SCXK(沪)2012-0002,饲养于温州医科大学实验动物中心SPF级实验室。
1.2主要试剂 澳洲胎牛血清、DMEM高糖培养基、0.25%胰蛋白酶、0.02%EDTA溶液及链、青霉素等购自Thermo Fisher Scientific;兔抗大鼠α-actin单克隆抗体、兔抗大鼠c-Myc单克隆抗体和兔抗大鼠cyclin D1单克隆抗体购自Abcam;免疫组化 II 抗试剂盒购自北京中杉金桥生物技术有限公司;P38 MAPK信号通路抑制剂SB203580、β-catenin/CBP特异性抑制剂ICG-001和β-catenin/p300特异性抑制剂IQ1均购自Selleck Chemicals; CCK-8试剂盒购自Dojindo;细胞周期检测试剂盒购自BD Biosciences;卵清蛋白(ovalbumin,OVA)购自Sigma。
2实验方法
2.1动物模型的建立 参照课题组既往成功建立模型的方法复制慢性哮喘气道重塑模型[9-10]。实验动物分别分成哮喘组和对照组。模型建立过程分为致敏和激发2个阶段,共10周。致敏阶段共2周,分别在第1天、第8天给哮喘组大鼠腹腔注射OVA/Al(OH)3混合液1.5 mL [内含OVA 1 mg,Al(OH)3100 mg],相应给予对照组大鼠腹腔注射生理盐水1.5 mL。从第3周第 1天开始,隔天使用超声雾化器向处于密闭塑料箱内的哮喘组大鼠用1% OVA生理盐水溶液进行雾化,每次30 min,共持续8周,对照组大鼠予生理盐水替代进行雾化。
2.2ASMC和肺组织的提取 末次雾化后16~24 h内用10%水合氯醛(4 mL/kg)腹腔注射处死大鼠,在超净台上获取大鼠气管、支气管。在显微镜下操作,剪取一小块肺叶,浸入4%多聚甲醛予以固定,用于苏木精-伊红(HE)染色观察肺组织病理结构。继续剔除粘附在气管上的剩余肺组织、支气管血管和脂肪组织等,纵向剖开气管、支气管,轻轻刮除外膜及内膜,将气管段剪成1 mm3或更小组织块。使用胶原酶-胰酶混合消化法去除上皮细胞和成纤维细胞等杂质,获取纯度较高的ASMC后进行传代培养,取第3~6代ASMC进行实验。
2.3肺组织HE染色 将固定后的肺组织常规石蜡包埋,切片(4 μm),行HE染色后观察肺组织病理结构。
2.4ASMC的鉴定 在倒置相差显微镜下观察细胞形态并拍摄照片。将贴壁的ASMC消化制作成细胞悬液,接种至无菌细胞爬片上并置于12孔板中,待细胞生长汇聚至70%~80%左右,倒去培养液,使用PBS洗涤细胞3次,每次5 min。4%多聚甲醛固定15 min,再经过洗涤、封闭等步骤后,滴加稀释的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)Ⅰ抗(1:100)4 ℃孵育过夜。然后使用相应的 II 抗(1:100)室温孵育细胞1 h,经清洗、染色等步骤后镜检。
2.5CCK-8实验检测细胞活力 从哮喘组和对照组大鼠获取的ASMC分别进行分组处理:①阴性对照(negative control,NC)组:正常培养的细胞不加任何处理;(2)DMSO组:细胞培养液中添加0.5%的DMSO,检测0.5‰浓度DMSO是否影响细胞活力;(3)β-catenin/CBP抑制剂ICG-001组:2种ASMC用特异性抑制剂ICG-001在100 μmol/L、50 μmol/L、25 μmol/L和5 μmol/L浓度作用下培养24 h;(4)β-catenin/p300抑制剂IQ1组:2种ASMC用特异性抑制剂IQ1在100 μmol/L、50 μmol/L、25 μmol/L和5 μmol/L浓度作用下培养24 h。2种抑制剂ICG-001和IQ皆使用DMSO溶解,并且根据各处理组条件,分别配置相应浓度的药物,最终使各处理组培养液中DMSO浓度固定为0.5‰。每个处理组设6个复孔,去除最大值和最小值后,取平均值作为最终实验结果,每组实验重复3次。
用0.25%胰蛋白酶消化贴壁培养的哮喘组和对照组ASMC,以含10%胎牛血清的高糖DMEM培养基制成单细胞悬液,将各组ASMC以1×108/L浓度接种于96孔板内,每孔100 μL体积,置于恒温培养箱内(37 ℃、5% CO2)培养1 d左右。待细胞生长汇聚至50%~60%左右时,换无血清DMEM培养基培养细胞24 h,使所有细胞处于相同生长状态。然后对上述分组的细胞进行药物干预。药物影响下培养细胞24 h后,吸弃培养基,PBS洗板2次,重新加入含10% CCK-8试剂的培养液,避光37 ℃下作用2 h,使用多功能酶标仪在450 nm下检测各孔细胞的吸光度(A)值,根据公式计算结果,判断各组细胞的生长情况,以无处理的阴性对照组细胞活力为100%。
2.6流式细胞术检测细胞周期的分布 哮喘组和对照组ASMC各自分为(1)NC组:正常培养的细胞不添加任何处理;(2)ICG-001组:使用50 μmol/L ICG-001培养ASMC 24 h;(3)IQ1组:使用50 μmol/L IQ1培养ASMC 24 h。
使用0.25%胰蛋白酶消化贴壁的各组ASMC,制成单细胞悬液后分别收集细胞至各15 mL离心管,离心收集细胞;用预冷的PBS吹打洗涤细胞, 1 000 r/min离心5 min后弃上清,重复1次;加入预冷70%乙醇,于4 ℃固定过夜(18 h以上);离心收集固定后的细胞, PBS洗涤细胞1次,再次离心5 min,弃上清;每个样品加入500 μL细胞周期检测试剂碘化丙啶(propidium iodide,PI)染色,室温避光孵育20 min;以流式细胞仪标准程序检测细胞,计数2~3万个细胞,结果用细胞周期拟和软件分析。
2.7Western blot法检测c-Myc、GSK-3β、β-catenin和cyclin D1蛋白水平的变化 将长满正常对照组和哮喘组平滑肌细胞的培养皿置于冰上,使用预冷的PBS清洗细胞3次,加入细胞裂解液RIPA,裂解30 min后,用细胞刮刮脱细胞,收集液体至EP管,超声裂解5秒、3次,将EP管移至高速离心机中,4 ℃ 12 000 r/min离心20 min,取上清液。使用BCA试剂盒测定蛋白浓度,配置成等体积等浓度的蛋白体系,采用8% SDS-PAGE分离蛋白、300 mA恒流转膜以及5%脱脂牛奶室温封闭2 h后,加入相应单克隆 I 抗4 ℃孵育过夜。16~18 h后将膜浸入TBST中,置于摇床上漂洗3次,加入 II 抗孵育2 h,TBST洗涤后进行化学发光、显色、显影。
3统计学处理
实验数据经SPSS 22.0统计软件进行分析,计量资料采用均数±标准(mean±SD)表示;均数间差异比较采用独立样本t检验;两变量之间的相关性分析采用直线相关分析法。以P<0.05为差异有统计学意义。
结 果
1动物一般情况观察
与对照组大鼠比较,哮喘组大鼠雾化激发后明显更为烦躁不安、易激惹,出现抓耳挠腮、呼吸加深加快、腹肌痉挛等症状,雾化结束后大鼠多呈俯伏不动的姿态,密封雾化箱内的大小便排泄物明显较对照组大鼠增多。对照组大鼠在用生理盐水雾化过程中仍活动自如,无明显异常表现。经过多次激发之后,哮喘组大鼠相较对照组毛色苍黄、无光泽。
2肺组织病理学改变
正常对照组大鼠肺组织HE染色显示正常小气道和肺泡结构完整,黏膜上皮完整,支气管管腔规则,支气管、血管周围未见炎性细胞的浸润。哮喘组大鼠肺组织HE染色显示气道壁明显增厚,基底膜不规则增厚,黏膜褶皱增多,可见黏液腺增生、黏液栓形成和黏膜下水肿,管腔内可见渗出物和炎性细胞增多,支气管黏膜下、支气管和血管周围可见嗜酸性细胞、中性粒细胞和淋巴细胞等炎症细胞的广泛浸润(图1)。综合肺组织切片HE染色结果,表明本实验大鼠哮喘气道重塑模型成功建立。
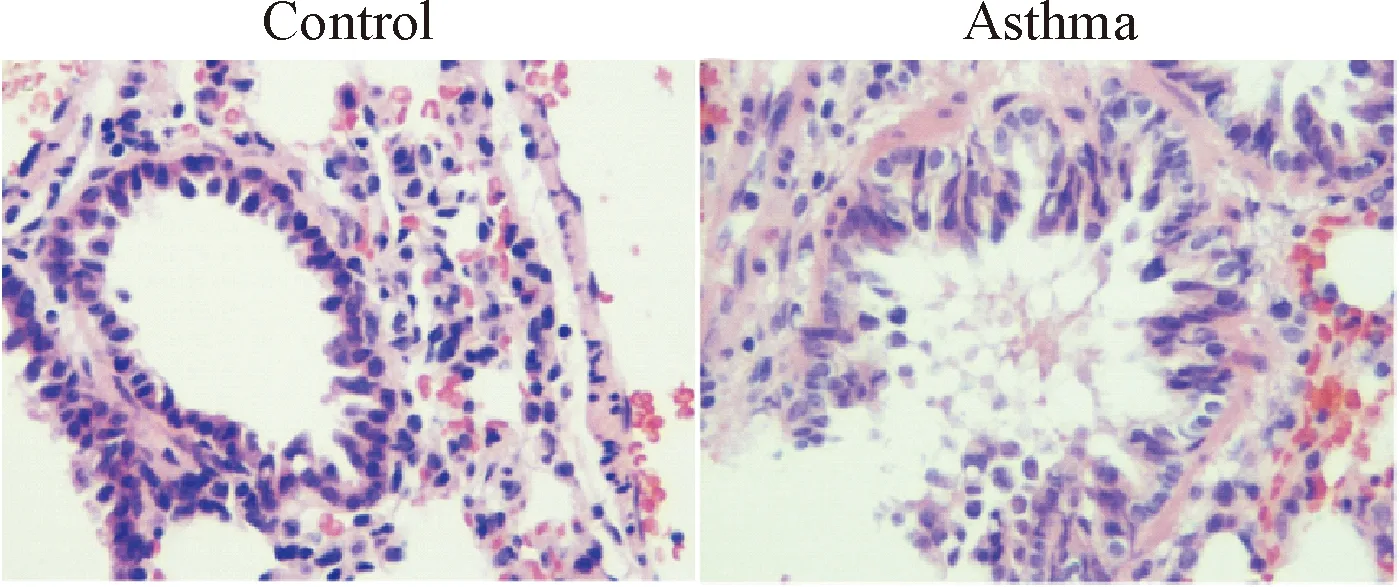
Figure 1. HE-stained lung tissues from the rat (×400).
图1大鼠肺组织HE染色
3大鼠ASMC的鉴定
于倒置相差显微镜下观察分离培养的细胞形态,镜下可见单个平滑肌细胞呈梭形或不规则三角形, 有多个细胞突起, 胞质丰富, 密度高, 核圆形居中, 有多个核仁。细胞生长致密时平行排列成束, 部分重叠, 表现为典型的“谷峰”形态。对ASMC使用SP法进行特异的α-SMA免疫细胞化学染色后,99%以上细胞呈强阳性染色,胞浆呈棕黄色或棕红色,证实为ASMC,见图2、3。
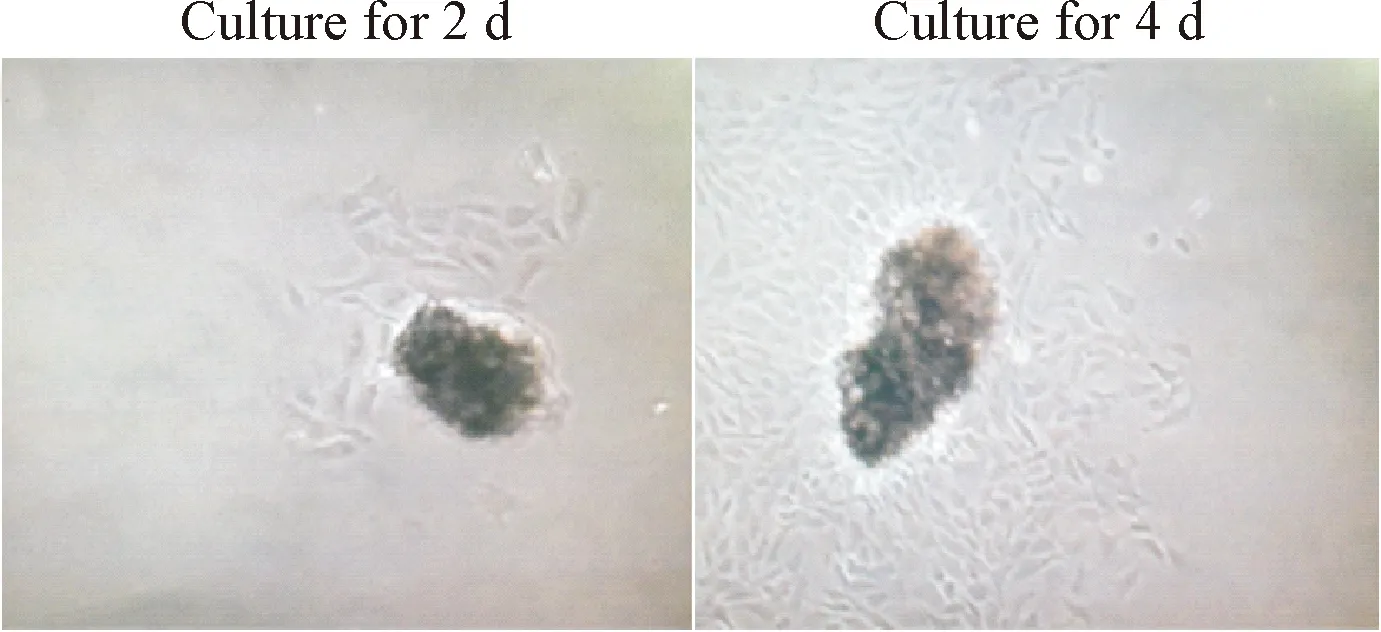
Figure 2. Images of ASMC under microscope observation (×100).
图2静置培养后ASMC的形态观察
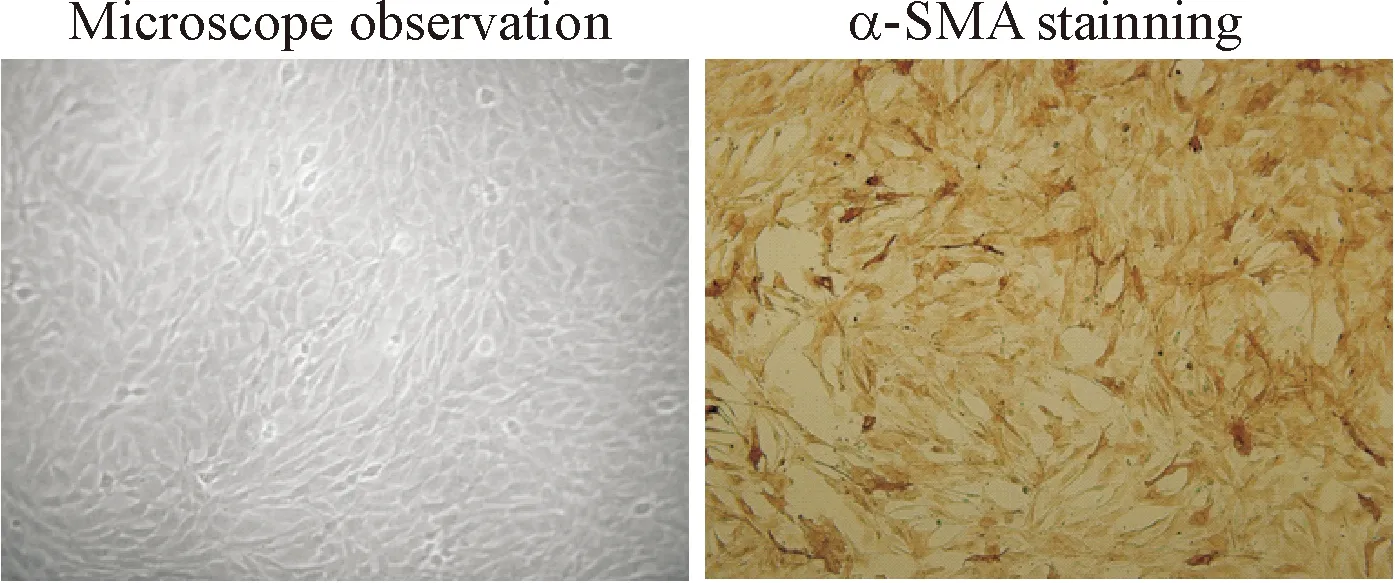
Figure 3. The identification of ASMC by α-SMA stainning (×100).
图3ASMC的培养鉴定
4Wnt/β-catenin信号通路对ASMC生长的调控
4.1细胞活力的变化 0.5‰浓度的DMSO对细胞活力无明显抑制。对哮喘组和正常组ASMC使用β-catenin/CBP特异性抑制剂ICG-001和β-catenin/p300特异性抑制剂IQ1干预培养细胞24 h,抑制β-catenin和p300或CBP间的相互作用,结果显示ICG-001在4个浓度(5 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L)均抑制哮喘组ASMC的细胞活力(P<0.01),但在5 μmol/L浓度时对正常组ASMC的活力无明显抑制作用。对比各浓度ICG-001对哮喘组和正常组ASMC活力影响,发现相同处理条件下哮喘组ASMC的活力明显低于正常组ASMC,差异具有统计学显著性(P<0.05),见图4。
另一方面,IQ1浓度在5 μmol/L 、25 μmol/L、50 μmol/L、100 μmol/L时,均对哮喘组ASMC的细胞活力有明显抑制(P<0.01),但在浓度为5 μmol/L 、25 μmol/L时对正常组ASMC的活力无明显抑制作用。相同IQ1浓度作用时,各哮喘组ASMC的活力明显低于正常组ASMC,差异均具有统计学显著性(P<0.05),见图5。
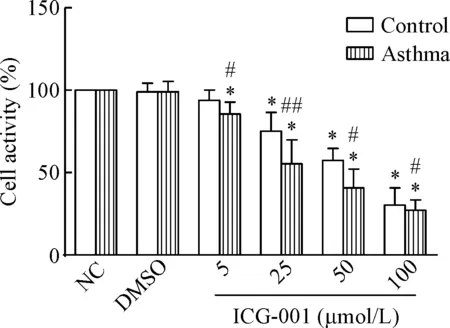
Figure 4. The cell activity of the ICG-001 treated ASMC in asthma group and control group. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05,##P<0.01vscontrol group.
图4使用ICG-001干预24h后ASMC的细胞活力变化
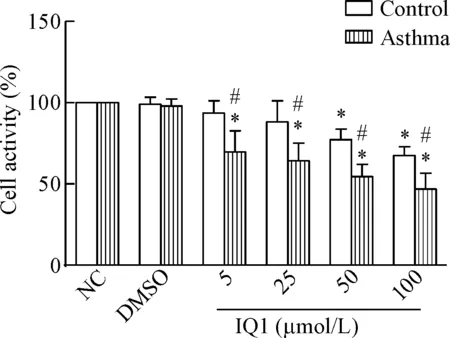
Figure 5. The cell activity of the ASMC in IQ1 treated asthma group and control group. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vscontrol group.
图5使用IQ1干预后ASMC的活力变化
4.2细胞周期分布的变化 使用50 μmol/LICG-001和IQ1干预培养正常对照组ASMC后,与NC组相比,各处理组ASMC 的G0/G1期占细胞周期百分比有所上升,S期少许下降,但差异均无统计学显著性,见图6。而使用抑制剂处理的哮喘组ASMC,与NC组比较,各处理组ASMC 的G0/G1期延长,S期和G2/M期占细胞周期的百分比均明显下降,差异均具有统计学显著性(P<0.05),见图7。
5ASMC中β-catenin、GSK-3β、c-Myc和cyclinD1蛋白表达量的变化
检测2组ASMC中β-catenin、GSK-3β、c-Myc和cyclin D1蛋白表达量的变化,结果显示哮喘组ASMC中的β-catenin、c-Myc、cyclin D1蛋白的相对灰度值均高于正常对照ASMC,差异有统计学显著性(P<0.05)。哮喘组ASMC中GSK-3β蛋白的相对灰度值低于对照组ASMC,差异有统计学显著性(P<0.05),见图8、表1。
Figure 6. The change of cell cycle distribution in ICG-001 or IQ1 treated ASMC of control rats. Mean±SD.n=3.
图6正常组ASMC经2种抑制剂处理后细胞周期的变化
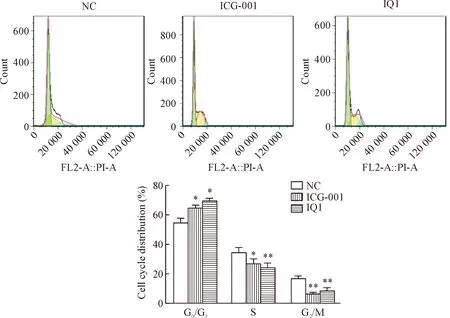
Figure 7. The change of cell cycle distribution in ICG-001 or IQ1 treated ASMC of asthma rats. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图7哮喘组ASMC经2种抑制剂处理后细胞周期的变化
6抑制P38MAPK信号通路后c-Myc、cyclinD1蛋白表达量变化
使用特异性P38 MAPK信号通路抑制剂SB2023580干预培养哮喘大鼠ASMC 24 h后,位于Wnt/β-catenin信号通路下游的c-Myc和cyclin D1蛋白表达量与对照组ASMC相比均明显下降,差异具有统计学显著性(P<0.01),见图9、表2。
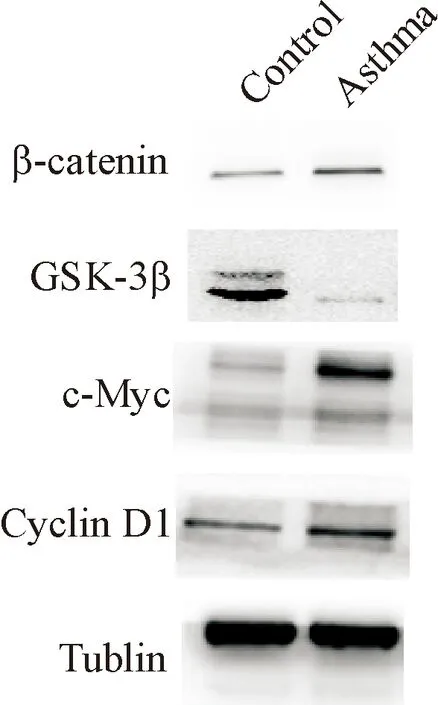
Figure 8. The protein expressions of β-catenin,GSK-3β, c-Myc and cyclin D1 in the ASMC.
图8β-catenin、GSK-3β、c-Myc和cyclinD1的蛋白表达
表1GSK-3β、β-catenin、c-Myc和cyclinD1的蛋白表达
Table 1. The protein expressions of β-catenin, GSK-3β, c-Myc and cyclin D1 in the ASMC (Mean±SD.n=8)

Groupβ-cateninGSK-3βc-MycCyclinD1Control0.27±0.060.75±0.330.25±0.110.17±0.03Asthma0.49±0.16*0.30±0.08*0.44±0.04**0.65±0.12**
*P<0.05,**P<0.01vscontrol group.

Figure 9. The protein expressions of cyclin D1 and c-Myc in the ASMC of asthma rats.
图9c-Myc和cyclinD1蛋白在ASMC中的表达
表2c-Myc和cyclinD1蛋白在ASMC中的表达
Table 2. The protein expressions of c-Myc and cyclin D1 in ASMC of asthma rats (Mean±SD.n=8)

Groupc-MycCyclinD1NC0.49±0.130.72±0.16SB2035800.08±0.04**0.29±0.07**
**P<0.01vsNC group.
讨 论
气道重塑是哮喘最主要的病理生理特征,表现为ASMC肥大增生、气道上皮纤维化、气道壁增厚、管腔面积缩窄、黏膜下新血管形成、黏液腺体肥厚增生和炎症细胞浸润等[11-12]。ASMC是主动参与哮喘炎症过程的效应细胞,它通过与其它炎症细胞的相互作用,改变自身收缩性能,分泌各种炎症介质、细胞因子和细胞外基质蛋白等各种方式,参与哮喘气道重塑[2]。同时,平滑肌细胞的增殖伴有细胞核内β-catenin蛋白含量增加以及β-catenin mRNA增多,β-catenin还参与ASMC的有丝分裂过程,其在胞内聚集和核内转移对维持ASMC的生长具有重要作用,可参与调控ASMC分泌细胞外基质的过程[4-5]。考虑到β-catenin与ASMC的功能关系十分密切,两者同时又和哮喘气道重塑的形成具有相关性,因此我们开展此研究,旨在探讨Wnt/β-catenin信号通路对ASMC的相关功能的调控作用及参与哮喘气道重塑的机制。
1Wnt/β-catenin信号通路对哮喘ASMC生长的调控
CBP和p300是组蛋白乙酰转移酶中一种重要的大分子蛋白,其结构存在高度的同源性,因而时常被合称为p300/CBP,它们能调节许多转录因子,介导转录激活,同时还参与细胞内的一系列生物活性调节,如细胞周期调节、分化、细胞凋亡和DNA损伤修复等[13-14]。已有研究表明,Wnt/β-catenin信号通路上存在着p300/CBP的作用位点,并且β-catenin/CBP和β-catenin/p300影响细胞的增殖和分化功能[4, 15]。
我们的研究发现,阻断CBP及p300两个位点与β-catenin间的相互作用后,ASMC的活力明显降低,并且相同处理条件下,哮喘组ASMC的活力下降幅度明显大于正常组,表明Wnt/β-catenin可能通过调控ASMC的生长,参与哮喘气道重塑。
2Wnt/β-catenin信号通路激活使下游靶基因表达上升
原癌基因c-myc和cyclin D1是Wnt/β-catenin信号通路的下游靶基因,与哮喘气道重塑的形成表现出一定的相关性,课题组既往的研究亦表明,β-catenin和c-Myc参与哮喘气道重塑的形成[6]。
本研究中,我们使用Western blot法检测哮喘组以及正常对照组ASMC中Wnt/β-catenin通路的核心转录因子β-catenin及其通路下游的靶基因c-Myc和cyclin D1的表达变化,结果显示哮喘组ASMC中β-catenin表达上升,而对β-catenin的表达有抑制作用的GSK-3β则表达下降,表明哮喘气道重塑大鼠ASMC中存在Wnt信号通路的激活。提示Wnt/β-catenin信号通路的激活可能通过上调c-Myc和cyclin D1的表达,影响平滑肌细胞的相关功能,从而参与气道重塑过程。
3Wnt/β-catenin信号通路通过与MAPK信号通路间的相互作用
MAPK信号通路被证明可能参与哮喘气道重塑中ASMC的增殖过程[16],MAPK还可以通过磷酸化导致GSK-3β的抑制,引发β-catenin在胞质内积累,引起Wnt相关敏感基因的表达[17]。多项研究报道[8, 17-18]Wnt信号家族可以激活p38 MAPK通路,表明p38 MAPK信号通路与Wnt信号通路关系密切,然而两者是否通过相互作用共同参与哮喘气道重塑过程以及其在ASMC中作用的具体机制尚未清楚。
我们的研究显示,使用特异性抑制剂SB203580抑制哮喘大鼠ASMC中p38 MAPK活性后,Wnt信号通路下游的c-Myc和cyclin D1表达量下降,提示p38 MAPK信号通路可以调节c-Myc和cyclin D1的蛋白表达,表明MAPK信号通路很可能通过与Wnt/β-catenin信号通路间相互作用共同影响ASMC功能,参与哮喘气道重塑。
综上所述,本研究通过建立大鼠慢性哮喘模型,获取大鼠ASMC,探究Wnt/β-catenin信号通路参与哮喘气道重塑的相关机制,结果提示Wnt/β-catenin信号通路可能通过上调c-Myc和cyclin D1的表达,与MAPK信号通路相互作用和调控ASMC的增殖与分化等途径,影响ASMC功能,参与哮喘气道重塑。
[1] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3):167-181.
[2] Prakash YS. Airway smooth muscle in airway reactivity and remodeling: what have we learned?[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(12):L912-L933.
[3] Kwak HJ, Park DW, Seo JY, et al. The Wnt/β-catenin signaling pathway regulates the development of airway remodeling in patients with asthma[J]. Exp Mol Med, 2015, 47:e198.
[4] Ma H, Guo M, Shan B, et al. Targeted functional analysis of p300 coactivator in Wnt/β-catenin signaling pathway using phosphoproteomic and biochemical approaches[J]. J Proteomics, 2012, 75(9):2601-2610.
[5] Gosens R, Baarsma HA, Heijink IH, et al. De novo synthesis of β-catenin via H-Ras and MEK regulates airway smooth muscle growth[J]. FASEB J, 2010, 24(3):757-768.
[6] 朱婷婷,温翠叶,贾宵宵,等. Wnt7b/β-catenin信号通路在大鼠哮喘气道重塑中的作用[J]. 温州医科大学学报, 2017, 47(1):14-18.
[7] 杨 卫,杨红申,杜 宇,等. 支气管哮喘大鼠细胞周期蛋白D1与气道重塑关系的研究[J]. 国际呼吸杂志, 2012, 32(21):1601-1604.
[8] Bikkavilli RK, Malbon CC. Mitogen-activated protein kinases and Wnt/beta-catenin signaling: Molecular conversations among signaling pathways[J]. Commun Integr Biol, 2009, 2(1):46-49.
[9] Zhang W, Nie Y, Chong L, et al. PI3K and Notch signal pathways coordinately regulate the activation and proliferation of T lymphocytes in asthma[J]. Life Sci, 2013, 92(17-19):890-895.
[10] Chong L, Zhang W, Nie Y, et al. Protective effect of curcumin on acute airway inflammation of allergic asthma in mice through Notch1-GATA3 signaling pathway[J]. Inflammation, 2014, 37(5):1476-1485.
[11] Berair R, Saunders R, Brightling CE. Origins of increased airway smooth muscle mass in asthma[J]. BMC Med, 2013, 11:145-150.
[12] Hirota N, Martin JG. Mechanisms of airway remodeling[J]. Chest, 2013, 144(3):1026-1032.
[13] Shiama N. The p300/CBP family: integrating signals with transcription factors and chromatin[J]. Trends Cell Biol, 1997, 7(6):230-236.
[14] 邵阳光,张国平,陆 军,等. 转录辅激活子p300/CBP的结构、功能及其在白细胞介素基因表达调控中的作用[J]. 科学通报, 2004, 49(23):2386-2393.
[15] Miyabayashi T, Teo JL, Yamamoto M, et al. Wnt/β-catenin/CBP signaling maintains long-term murine embryonic stem cell pluripotency[J]. Proc Natl Acad Sci U S A, 2007, 104(13):5668-5673.
[16] 白 晶,刘先胜,徐用健,等. ERK在慢性哮喘大鼠气道平滑 肌细胞增殖中的作用[J]. 中国病理生理杂志, 2008, 24(3): 417-422
[17] Bikkavilli RK, Feigin ME, Malbon CC. p38 mitogen-activated protein kinase regulates canonical Wnt-beta-catenin signaling by inactivation of GSK3β[J]. J Cell Sci, 2008, 121(Pt 21):3598-3607.
[18] Caverzasio J, Manen D. Essential role of Wnt3a-mediated activation of mitogen-activated protein kinase p38 for the stimulation of alkaline phosphatase activity and matrix mineralization in C3H10T1/2 mesenchymal cells[J]. Endocrinology, 2007, 148(11):5323-5230.
(责任编辑: 林白霜, 余小慧)
Effects of Wnt/β-catenin signal pathway on asthma airway remodeling
JIA Xiao-xiao, ZHENG Rong-ying, HUANG Yue, ZENG Ze-yu, ZHANG Wei-xi
(Department of Pediatric Allergy and Immunology, The Second Affiliated Hospital and Yuying Children’s Hospital, Wenzhou Medical University, Wenzhou 325027, China. E-mail: zhangweixi112@163.com)
AIM: To explore the effect of Wnt/β-catenin signaling pathway in airway smooth muscle cells (ASMC) on asthmatic airway remodeling.METHODS: The asthmatic airway remodeling model in rats was established and the ASMC was isolated and cultured. The protein expression of β-catenin, glycogen synthase kinase-3β (GSK-3β), c-Myc and cyclin D1 in the ASMC was determined by Western blot. After depressing the interaction between β-catenin and p300/CBP, the cell activity was measured by CCK-8 assay and the change of cell cycle distribution was analyzed by flow cytometry. Meanwhile, the protein expression of c-Myc and cyclin D1 in the ASMC was determined by Western blot after inhibiting P38 mitogen-activated protein kinase (MAPK) activity.RESULTS: The protein levels of β-catenin, c-Myc and cyclin D1 were significantly increased in asthma group while the protein level of GSK-3β was decreased in the same group (P<0.05). After depressing the interaction between β-catenin and p300/CBP, the cell activity of ASMC was decreased in asthma group compared with control group (P<0.05), and the change of the cell cycle distribution in asthma group was also more obvious (P<0.05). After inhibiting P38 MAPK activity, the protein levels of c-Myc and cyclin D1 were all decreased compared with control group in ASMC asthma and control rats (P<0.05).CONCLUSION: Wnt/β-catenin signaling pathway may participates in airway remodeling in asthma by increasing the protein expression of c-Myc and cyclin D1, reacting with the P38 MAPK signaling pathway and regulating the growth of ASMC.
Asthma; Airway remodeling; Airway smooth muscle cells; Wnt/β-catenin signaling pathway; β-catenin
1000- 4718(2017)09- 1683- 07
2017- 03- 07 [
] 2017- 05- 09
浙江省自然科学基金项目(No. LY15H010006);浙江省科技厅项目(No. 2016C33182);浙江省卫生高层次创新人才项目
R562.25
A
10.3969/j.issn.1000- 4718.2017.09.024
△通讯作者 Tel: 0577-88002125; E-mail: zhangweixi112@163.com
