瑞巴派特对阿司匹林诱导的小鼠小肠上皮屏障损伤的修复*
2017-09-22夏忠胜王思仪毕文婷陈其奎
石 柳, 夏忠胜, 赖 宇△, 王思仪, 毕文婷, 刘 雨, 于 涛, 陈其奎
(1赣州市人民医院消化内科,江西 赣州 341000; 2中山大学孙逸仙纪念医院消化内科,广东 广州 510120)
瑞巴派特对阿司匹林诱导的小鼠小肠上皮屏障损伤的修复*
石 柳1, 夏忠胜2, 赖 宇2△, 王思仪2, 毕文婷2, 刘 雨2, 于 涛2, 陈其奎2
(1赣州市人民医院消化内科,江西 赣州 341000;2中山大学孙逸仙纪念医院消化内科,广东 广州 510120)
目的: 探讨瑞巴派特能否通过促进肠道上皮屏障结构和功能的修复改善阿司匹林导致的小肠黏膜损伤。方法: 本研究利用BALB/c小鼠,使用阿司匹林(200 mg·kg-1·d-1)连续5 d灌胃的方法制作小肠损伤模型,并根据是否诱导小肠损伤及接受瑞巴派特(320 mg·kg-1·d-1)的处理将小鼠分为正常对照组、模型组、瑞巴派特对照组及瑞巴派特治疗组。通过透射电镜、免疫组化、qPCR和Western blot等方法,在不同时点系统地观察瑞巴派特对阿司匹林所致的小鼠小肠黏膜损伤模型中小肠黏膜结构及屏障功能蛋白表达的影响。结果: 阿司匹林所致的小肠黏膜损伤小鼠,经瑞巴派特(320 mg·kg-1·d-1)连续5 d处理后,小肠上皮细胞间紧密连接结构的损害明显减轻,小肠组织中紧密连接蛋白ZO-1及occludin在mRNA及蛋白质水平的表达均明显增加(P<0.05),环氧化酶2(COX-2)和增殖相关信号分子β-catenin、c-Myc的表达也高于对照组(P<0.05),组织匀浆中前列腺素E2浓度显著增加(P<0.05),而COX-1的表达在治疗组中无明显改变。同时,治疗组血清中的D-乳酸水平明显降低(P<0.05)。结论: 瑞巴派特能够通过上调COX-2的表达,促进阿司匹林所致的小鼠小肠黏膜损伤的修复,改善肠屏障的结构与功能。
瑞巴派特; 阿司匹林; 小肠黏膜损伤; β-catenin; 环氧化酶2
非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)是一类临床广泛应用的药物。其中乙酰水杨酸(acetylsalicylic acid,ASA;又称阿司匹林)应用最为普遍。而随着肠溶阿司匹林的广泛应用,阿司匹林所致的小肠黏膜损伤(small intestinal injury, SII)越来越受到关注[1]。阿司匹林主要通过抑制环氧化酶(cyclooxygenase,COX)减少前列腺素(prostaglandin,PG)的生成,进而对胃肠黏膜造成损伤[2]。为了减少或修复该种损伤,临床上需要一种能够增加胃肠黏膜中PG或COX水平,从而促进小肠黏膜修复的药物。瑞巴派特(rebamipide, Reb)作为一种PG诱导剂,一直用于胃黏膜的保护及促进胃黏膜的修复。虽然有少数报道提示,瑞巴派特可能通过线粒体保护改善肠道黏膜的结构和功能,但影响肠上皮增殖、屏障功能改善的通路机制尚不明确,需要进一步探讨[3-4]。
本研究通过观察瑞巴派特对阿司匹林诱导的小鼠小肠黏膜损伤模型中小肠上皮黏膜屏障结构与功能,以及主要功能分子表达的影响,评价瑞巴派特对COX及相关上皮增殖通路的作用,从而初步探讨瑞巴派特对小鼠小肠黏膜损伤修复及改善屏障结构与功能的机制。
材料和方法
1实验动物及分组
BALB/c小鼠,雌雄各半,共72只,体重19~20 g,8周龄,购于中山大学北校区动物实验中心,在中山大学北校区动物实验中心的清洁级(SPF级)环境中饲养。
BALB/c小鼠72只,随机分为4组,每组18只。分组如下:(1)正常对照(control,Con)组:正常饮食;(2)Reb对照组(Con-Reb组)组:前5 d胃饲生理盐水,第5 d开始胃饲瑞巴派特(320 mg·kg-1·d-1),溶于生理盐水,每天分3次给药,连续5 d;(3)SII组:胃饲阿司匹林(200 mg·kg-1·d-1)连续5 d,第5 d开始胃饲生理盐水;(4)瑞巴派特治疗组(SII-Reb组):阿司匹林(200 mg·kg-1·d-1)连续5 d处理,成模后给予瑞巴派特(320 mg·kg-1·d-1),一天分3次给药,连续胃饲5 d。以上各组分别于第0、5、10天组内随机处死小鼠,常规取材,每组每个时点处死6只。上述第0天代表各组小鼠造模前,第5天代表小鼠小肠损伤造模后、治疗前,第10天代表瑞巴派特干预后。
2实验方法
2.1小肠上皮(肠屏障)间隙的观察 常规取材、固定标本[5],采用透射电子显微镜(transmission electron microscope,TEM)观察各组小肠上皮细胞之间的间隙改变情况。
2.2上皮紧密连接蛋白、COX及增殖通路分子的表达 分别采用定量RT-PCR和Western blot 的方法从mRNA及蛋白质水平测定各组中待测分子的表达。其中,上皮紧密连接蛋白为ZO-1及occludin;COX家族为COX-1及COX-2;增殖通路分子为β-catenin及c-Myc。常规提取总RNA及蛋白质,各分子的引物由上海生工公司设计、合成。小鼠ZO-1的上游引物为5’-CCA CCT CTG TCC AGC TCT TC-3’,下游引物为5’-CAC CGG AGT GAT GGT TTT CT-3’; occludin的上游引物为5’-CCT CCA ATG GCA AAG TGA AT-3’,下游引物为5’-CTC CCC ACC TGT CGT GTA GT-3’; COX-1的上游引物为5’-ATT CCT TCA TGT CGG ACG AG-3’,下游引物为5’-ACT GAG AAG CCC CCT CAA AT-3’; COX-2的上游引物为5’-ACG AAA TCA ACA ACC CCG TA-3’, 下游引物为5’-GGC AGA ACG ACT CGG TTA TC-3’; β-catenin的上游引物为5’-GTG CAA TTC CTG AGC TGA CA-3’,下游引物为5’-CTT AAA GAT GGC CAG CAA GC-3’; c-Myc的上游引物为5’-TCC TGT ACC TCG TCC GAT TC-3’, 下游引物为5’-GGT TTG CCT CTT CTC CAC AG-3’; 18S核糖体的上游引物为5’-GCT AGG AAT AAT GGA ATA GG-3’,下游引物为5’-ACT TTC GTT CTT GAG GAA TG-3’。qPCR的试剂购于TaKaRa。Western blot所需的抗体购于北京博奥森生物技术有限公司。qPCR的结果通过2-ΔΔCt法表示;Western blot的结果通过以β-actin为内参照的相对灰度法表示。
2.3肠屏障功能的测定 测定各组小鼠血清中D-乳酸(D-lactate,D-LAC)的水平反映肠屏障的状态,试剂盒购于上海的西唐生物科技有限公司,通过分光光度计并进行比色检测各组小鼠血清中D-LAC的水平。
2.4小肠上皮增殖状态的测定 采用增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)标记的免疫组化法测定上皮细胞中处于增殖状态的细胞,通过计算增殖指数(一个绒毛-隐窝上皮单位中PCNA阳性细胞的比例)评价各组小鼠小肠上皮的增殖状态,抗体购于北京博奥森生物技术有限公司。
2.5小肠局部PGE2水平的测定 常规取材,制作小肠组织匀浆,离心后提取上清液,采用ELISA法测定各组小肠组织中PGE2的水平,试剂盒购于北京博奥森生物技术有限公司。
3统计学处理
所有资料统计均采用SPSS 20.0统计软件进行统计分析。所有计量资料以均数±标准误(mean±SEM)描述,两组成对资料均数的比较采用t检验,多组均数之间采用单因素方差分析并用Bonferroni法进行各组均数间的两两比较,以P<0.05为差异有统计学意义。
结 果
1瑞巴派特促进阿司匹林诱导小肠损伤后(肠屏障)小肠上皮细胞间隙的修复
透射电镜观察的结果显示,SII及SII-Reb组模型小鼠经200 mg·kg-1·d-1剂量的阿司匹林连续5 d处理后小肠上皮细胞间隙明显增宽。而SII-Reb组小鼠经320 mg·kg-1·d-1瑞巴派特连续5 d处理后,其小肠上皮细胞间的间隙较SII组明显变小,见图1。
其三,巡检工作不到位。在城市燃气管道投入运行之后,城市燃气管道相关单位承担着管道运行维护的责任,它们需要组织人员对管道日常运行进行巡检,及时发现并排除一些潜在的安全隐患或是突发问题,这样可以最大程度的避免燃气泄露事故的发生。然而在实际工作中,管道运行巡检工作不到位的情况十分常见,这也为燃气泄露埋下了隐患。
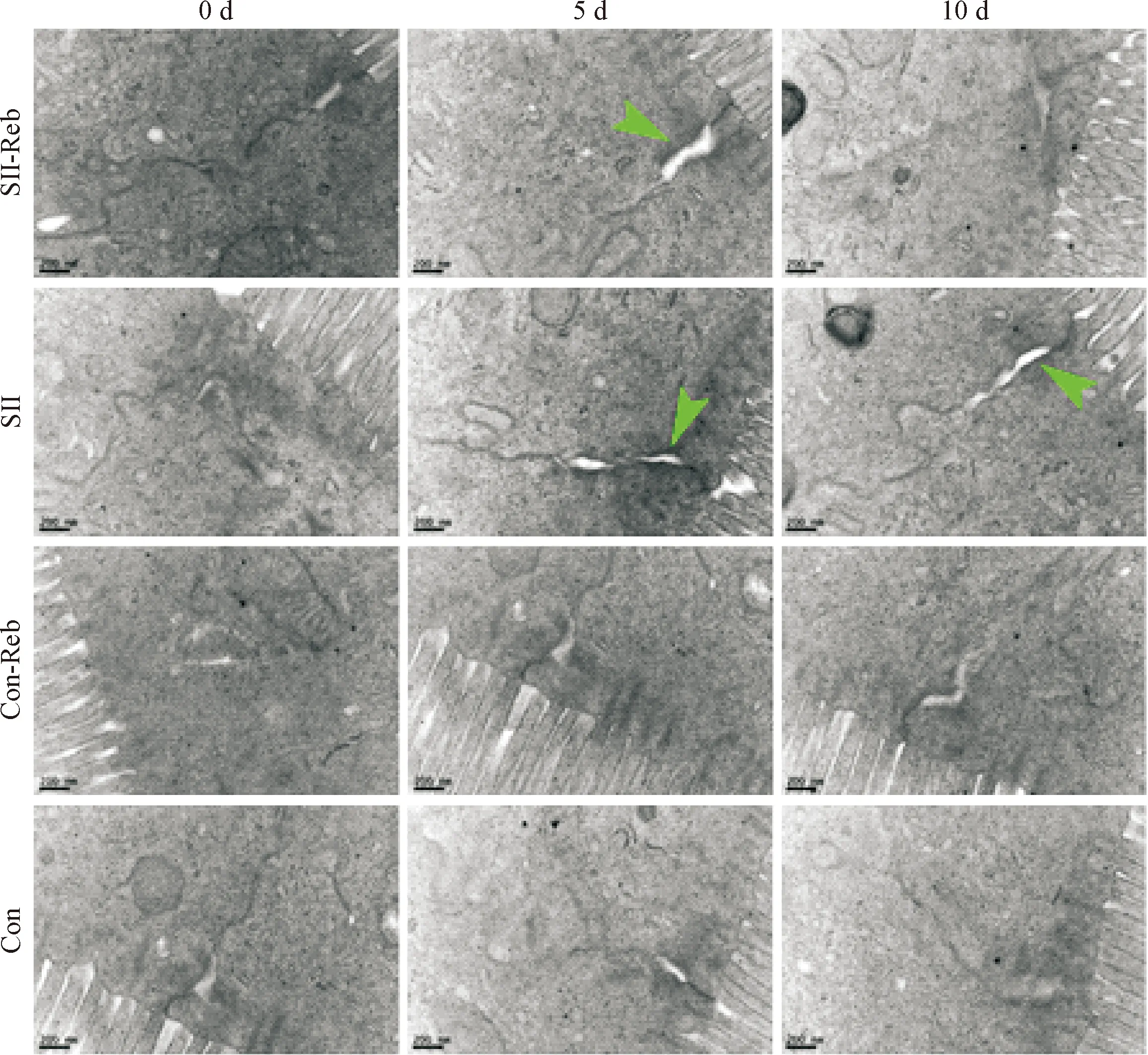
Figure 1. The intervals between the intestinal epithelial cells observed under TEM at different time points. The wider intervals (green arrowheads) between the intestinal epithelial cells were indicated. The scale bar=200 nm.
图1透射电镜显示的各组不同时点的小肠上皮细胞间隙
2瑞巴派特上调肠上皮紧密连接蛋白的表达
SII及SII-Reb组小鼠经200 mg·kg-1·d-1阿司匹林连续5 d诱导损伤后,小肠标本中ZO-1以及occludin的mRNA及蛋白表达水平均比Con-Reb组及Con组显著下降(P<0.05),提示阿司匹林可以导致小肠紧密连接结构受损。 损伤后通过瑞巴派特的处理,实验第10天时SII-Reb组小肠组织中紧密连接蛋白ZO-1及occludin的mRNA及蛋白质表达水平较均对照组SII-Sal组明显上调(P<0.05),见图2。
3瑞巴派特改善小肠损伤后的肠屏障功能
对血中D-LAC水平的分析显示,阿司匹林(200 mg·kg-1·d-1)连续5 d的处理后可以使SII组及SII-Reb组小鼠肠道的通透性明显增加,肠屏障功能受损(P<0.05),而非小肠损伤的对照组中则无明显改变。实验第10天,通过连续5 d的瑞巴派特处理,SII-Reb组升高的血D-LAC水平较未接受处理的SII组明显减低(P<0.05),提示瑞巴派特可以改善受损的小肠屏障功能,见图3。
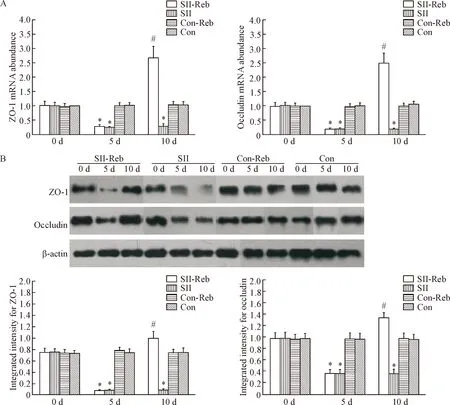
Figure 2. The mRNA (A) and protein (B) expression of ZO-1 and occludin in the small intestine of the 4 groups. Mean±SEM.n=6.*P<0.05vsCon-Reb;#P<0.05vsSII.
图2紧密连接蛋白ZO-1及occludin的mRNA和蛋白质在各组小鼠小肠组织中的表达情况
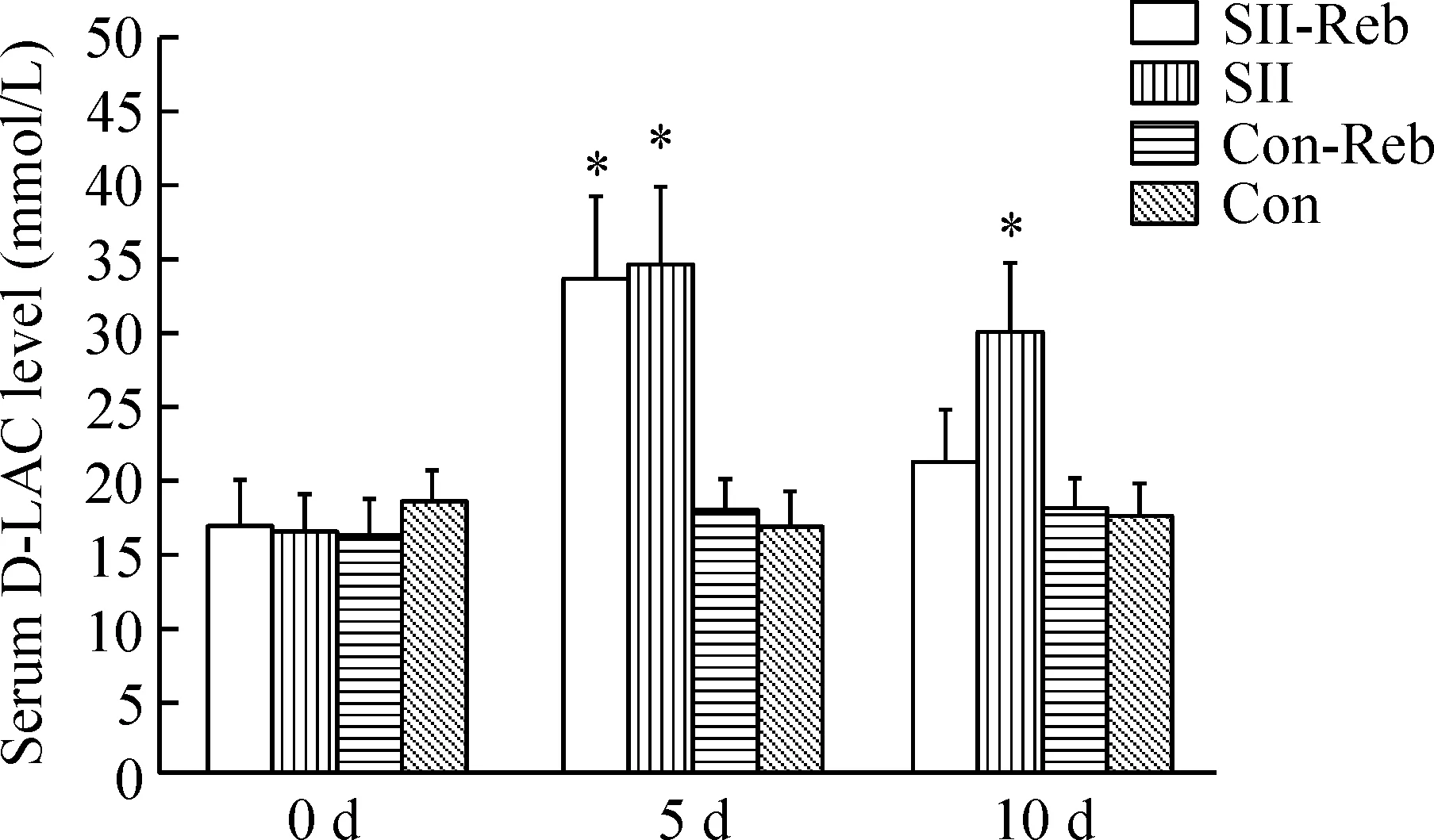
Figure 3. The serum levels of D-LAC in the mice of the 4 groups. Mean±SEM.n=6.*P<0.05vsCon-Reb.
图3各组小鼠血中的D-LAC水平
4瑞巴派特促进小肠损伤后的上皮细胞增殖
免疫组化结果显示,增殖指数PCNA表达于肠上皮细胞的细胞核。经阿司匹林诱导小肠损伤后SII-Reb组及SII-Sal组的小鼠小肠上皮增殖指数均明显较Con-Reb及Con组减低(P<0.05)。损伤后经过瑞巴派特连续5 d的处理,在实验第10天时SII-Reb组小鼠小肠上皮PCNA细胞增殖指数明显增高,达(82.5±2.84)%,显著高于SII组(P<0.05),见图4。
5瑞巴派特对小肠上皮COX、PGE2及增殖通路分子表达的影响
在阿司匹林诱导小肠损伤后,SII及SII-Reb组小鼠小肠组织中COX-1、COX-2、β-catenin及c-Myc的mRNA及蛋白质水平均明显减低(P<0.05);同时,小鼠肠组织匀浆上清液中PGE2的水平也明显下降(P<0.05)。实验第10天时,经320 mg·kg-1·d-1瑞巴派特连续5 d处理后,SII-Reb组小肠组织中的COX-2、β-catenin和c-Myc的表达较对照的RII-Reb组显著增加(P<0.05), 组织匀浆中减低的PGE2也明显增加(P<0.05),但COX-1的表达无明显改变,见图5。
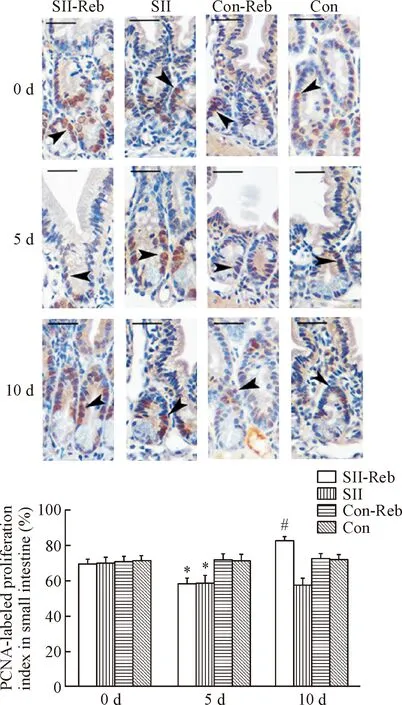
Figure 4. The intestinal PCNA-positive cells (arrowheads) in the 4 groups detected by immunohistochemistry. The scale bar=50 μm. Mean±SEM.n=6.*P<0.05vsCon-Reb;#P<0.05vsSII.
图4免疫组化法显示各组肠上皮的PCNA阳性细胞及增殖指数
讨 论
目前,随着胶囊内镜等小肠黏膜检查手段的发展,阿司匹林诱发的小肠损伤也逐渐受到临床的重视[6]。而目前对阿司匹林所致的小肠黏膜屏障的损伤仍没有较为明确的预防及治疗方法。瑞巴派特作为促进前列腺素增加的药物,可以显著提高胃肠黏膜的血流,使胃肠黏膜得到充分的血液供应和营养,目前已有研究提示其对肠道黏膜屏障有预防损伤的作用,但具体机制尚不明确[3, 7-8]。
为了研究阿司匹林经过胃肠道吸收后所致的小肠损伤,本实验组在其它相关研究的基础上[9-11],使用胃饲小鼠的方法进行给药,并评估了不同的阿司匹林剂量下小鼠小肠的损伤情况,从而确定了较为稳定的阿司匹林诱导小肠损伤的小鼠模型条件,即阿司匹林200 mg·kg-1·d-1,连续5 d,为本次实验提供了基础。
完整的小肠黏膜屏障由小肠上皮、上皮细胞间紧密连接及上皮间质构成,是小肠功能的重要结构基础。ZO-1和occludin是上皮细胞间紧密连接结构的主要蛋白分子,对肠上皮起稳定作用[12]。因此,当ZO-1及occludin的表达水平减低时可提示肠上皮黏膜结构屏障受损。在本次研究中,经阿司匹林诱导小肠损伤后SII-Reb组小鼠给予320 mg·kg-1·d-1的瑞巴派特连续5 d处理后,其小肠组织中ZO-1及occludin分子的表达水平显著上升,与对照的SII-Sal组相比有显著差异,这一结果与电镜下观察到的上皮间隙改变趋势是一致的,提示瑞巴派特可以通过上调紧密连接蛋白的表达,改善肠上皮的屏障结构。
阿司匹林可以导致小鼠小肠上皮黏膜屏障结构破坏,同时亦可影响其功能,导致通透性增加[13]。作为肠道内细菌固定产物之一的D-LAC,在肠屏障受损而通透性增加时,血中D-LAC水平会明显升高[14]。本次研究显示,经阿司匹林诱导小肠损伤后的小鼠血中D-LAC水平显著升高,随后给予320 mg·kg-1·d-1瑞巴派特连续处理5 d后,SII-Reb组血液中D-LAC的水平较未经瑞巴派特处理的SII组明显降低。这一结果提示,瑞巴派特在修复阿司匹林损伤的小肠上皮屏障结构的同时,还改善了小肠黏膜屏障的功能。
本次研究通过PCNA标记的增殖状态的肠上皮细胞,并通过计算增殖指数推测各组小肠上皮的增殖情况。结果显示阿司匹林可以减低小肠上皮细胞的增殖,使得小肠上皮损伤后短期内难以修复,而瑞巴派特处理后的SII-Reb组小肠上皮细胞增殖指数明显增高,提示瑞巴派特可以促进小鼠小肠上皮细胞损伤后的增殖及修复。
本次研究显示,经阿司匹林诱导损伤后小鼠小肠黏膜的COX-1和COX-2都明显受到抑制,同时PGE2显著减少,提示阿司匹林造成小肠黏膜的损伤可能与其诱发胃黏膜损伤的机制相似。一些相关研究提示,上调肠道中的COX-2及PGE2可通过Wnt/β-catenin通路促进肠道上皮细胞的增殖[15-16]。同时,COX及增殖相关通路分子的测定显示,经瑞巴派特处理后小肠组织中COX-2明显升高,PGE2水平也同步增加,β-catenin通路中的重要调节分子β-catenin及其下游的c-Myc表达也在瑞巴派特处理后显著上调,与COX-2及PGE2的改变趋势一致,但COX-1的表达在阿司匹林诱导减低后并未随着瑞巴派特的处理而回升。这一结果提示,瑞巴派特可增加阿司匹林诱导的小肠损伤组织中COX-2的表达水平,并促进局部PGE2的产生,进而通过上调β-catenin增殖相关通路促进肠上皮的增殖、修复和屏障结构与功能的改善。这一过程中,COX-1持续处于低表达的受抑制状态,提示瑞巴派特主要通过上调COX-2对损伤的小鼠小肠上皮黏膜进行修复,而不是COX-1。
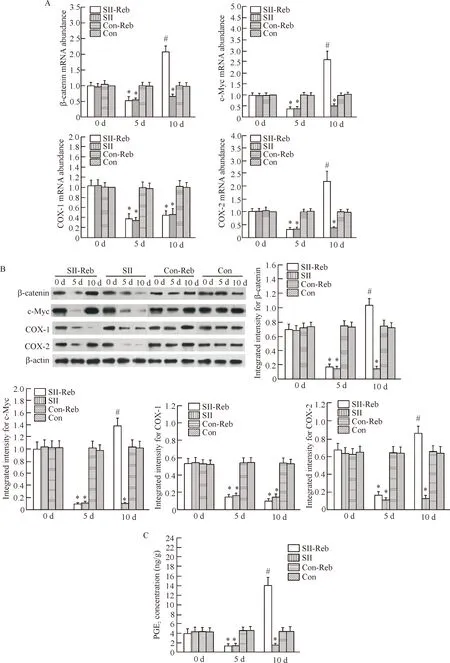
Figure 5. The mRNA (A) and protein (B) expression of β-catenin, c-Myc and COX, and PGE2concentration (C) in the mouse small intestine after rebamipide administration in the 4 groups. Mean±SEM.n=6.*P<0.05vsCon-Reb;#P<0.05vsSII.
图5β-catenin、c-Myc、COX及PGE2水平在各组肠上皮组织中的变化
总之,本次研究证实瑞巴派特可通过上调COX-2及PGE2促进阿司匹林诱导的小鼠小肠上皮损伤后的修复及肠屏障结构与功能的恢复,这一过程与β-catenin增殖通路上调有关。
[1] Leung WK, Bjarnason I, Wong VW, et al. Small bowel enteropathy associated with chronic low-dose aspirin therapy [J]. Lancet, 2007, 369(9561):614.
[2] Thomas SS, Makar KW, Li L, et al. Tissue-specific patterns of gene expression in the epithelium and stroma of normal colon in healthy individuals in an aspirin intervention trial [J]. BMC Med Genet, 2015, 16:18.
[3] Diao L, Mei Q, Xu JM, et al. Rebamipide suppresses diclofenac-induced intestinal permeability via mitochondrial protection in mice [J]. World J Gastroenterol, 2012, 18(10):1059-1066.
[4] Kurokawa S, Katsuki S, Fujita T, et al. A randomized, double-blinded, placebo-controlled, multicenter trial, healing effect of rebamipide in patients with low-dose aspirin and/or non-steroidal anti-inflammatory drug induced small bowel injury[J]. J Gastroenterol, 2014, 49(2):239-244.
[5] 刘克玄, 吴伟康, 罗汉川, 等. 四逆汤对大鼠肠缺血再灌注后小肠上皮细胞超微结构的影响[J]. 中国病理生理杂志, 2004, 20(4):636-639.
[6] Endo H, Sakai E, Higurashi T, et al. Differences in the severity of small bowel mucosal injury based on the type of aspirin as evaluated by capsule endoscopy [J]. Dig Liver Dis, 2012, 44(10):833-838.
[7] Ota K, Takeuchi T, Nouda S, et al. Determination of the adequate dosage of rebamipide, a gastric mucoprotective drug, to prevent low-dose aspirin-induced gastrointestinal mucosal injury [J]. J Clin Biochem Nutr, 2016, 59(3): 231-237.
[8] Watanabe T, Takeuchi T, Handa O, et al. A multicenter, randomized, double-blind, placebo-controlled trial of high-dose rebamipide treatment for low-dose aspirin-induced moderate-to-severe small intestinal damage[J]. PLoS One, 2015, 10(4):e0122330.
[9] Sequeira IR, Kruger MC, Hurst RD, et al. Ascorbic acid may exacerbate aspirin-induced increase in intestinal permeability [J]. Basic Clin Pharmacol Toxicol, 2015, 117(3):195-203.
[10] Iijima K, Shimosegawa T. Geographic differences in low-dose aspirin-associated gastroduodenal mucosal injury [J]. World J Gastroenterol, 2015, 21(25): 7709-7717.
[11] 刘 宇, 高 东, 钟静静, 等. 阿司匹林与氟尿嘧啶协同抑制结肠癌细胞生长增殖的机制研究[J]. 中国病理生理杂志, 2014, 30(6):633-639.
[12] Yu T, Lu XJ, Li JY, et al. Overexpression of miR-429 impairs intestinal barrier function in diabetic mice by down-regulating occludin expression [J]. Cell Tissue Res, 2016, 366(2):341-352.
[13] Ikemura K, Iwamoto T, Okuda M. MicroRNAs as regulators of drug transporters, drug-metabolizing enzymes, and tight junctions: implication for intestinal barrier function [J]. Pharmacol Ther, 2014, 143(2):217-224.
[14] Min XH, Yu T, Qing Q, et al. Abnormal differentiation of intestinal epithelium and intestinal barrier dysfunction in diabetic mice associated with depressed Notch/NICD transduction in Notch/Hes1 signal pathway[J]. Cell Biol Int, 2014, 38(10):1194-1204.
[15] Miyoshi H, VanDussen KL, Malvin NP, et al. Prostaglandin E2promotes intestinal repair through an adaptive cellular response of the epithelium [J]. EMBO J, 2017, 36(1):5-24.
[16] Li JY, Yu T, Xia ZS, et al. Enhanced proliferation in colorectal epithelium of patients with type 2 diabetes correlates with β-catenin accumulation [J]. J Diabetes Complications, 2014, 28(5):689-697.
(责任编辑: 陈妙玲, 罗 森)
Rebamipide repairs injury of small intestinal epithelial barrier induced by aspirin in mice
SHI Liu1, XIA Zhong-sheng2, LAI Yu2, WANG Si-yi2, BI Wen-ting2, LIU Yu2, YU Tao2, CHEN Qi-kui2
(1Department of Gastroenterology, Ganzhou People’s Hospital, Ganzhou 341000, China;2Department of Gastroenterology, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou 510120, China. E-mail: ayang_lai@163.com)
AIM: To investigate whether rebamipide repairs the small intestinal epithelial barrier in aspirin-induced small intestinal injury (SII) in mice and its mechanism.METHODS: Small intestinal injury was induced by aspirin (200 mg·kg-1·d-1for 5 d) in BALB/c mice. Based on the treatment with aspirin and/or rebamipide (320 mg·kg-1·d-1), the mice were divided into 4 groups (n=18 in each group). The living mice in each group (n=6) were sacrificed via cervical dislocation method at day 0, day 5, and day 10. The structure and function of intestinal barrier and the levels of the signaling pathway factors were measured by transmission electron microscopy, immunohistochemistry, qPCR, and Western blot.RESULTS: Tight junctions between intestinal epithelial cells improved significantly after reba-mipide treatment. The expression of ZO-1 and occludin in the injured small intestine showed a gradually increasing trend after rebamipide administration (P<0.05). There was a decreased trend of D-lactate level in rebamipide-treated SII mice (P<0.05). The expression of cyolooxygenase-2 (COX-2), β-catenin, and c-Myc, and prostaglandin E2concentration in small intestinal tissues were significantly increased in rebamipide treatment group (P<0.05). However, down-regulated COX-1 expression in the SII mice was sustained at a low level after rebamipide administration.CONCLUSION: Rebami-pide repairs the injury of small intestinal mucosa and improves the structure and function of small intestinal barrier in aspirin-induced SII mice by up-regulating the expression of COX-2.
Rebamipide; Aspirin; Small intestinal injury; β-catenin; Cyclooxygenase-2
1000- 4718(2017)09- 1669- 07
2016- 12- 19 [
] 2017- 05- 03
国家自然科学基金资助项目(No. 81370475)
R965; R363
A
10.3969/j.issn.1000- 4718.2017.09.022
△通讯作者 Tel: 020-34078169; E-mail: ayang_lai@163.com
