内源性一氧化氮合酶抑制物在糖尿病大鼠勃起功能障碍中的作用*
2017-09-22雷艳萍李晓媚
黄 程, 雷艳萍, 李晓媚, 林 瑗, 肖 钦, 熊 燕
(广州医科大学药学院, 广州蛇毒研究所, 广东 广州 511436)
内源性一氧化氮合酶抑制物在糖尿病大鼠勃起功能障碍中的作用*
黄 程, 雷艳萍▲, 李晓媚, 林 瑗, 肖 钦, 熊 燕△
(广州医科大学药学院, 广州蛇毒研究所, 广东 广州 511436)
目的: 探讨内源性一氧化氮合酶(NOS)抑制物非对称性二甲基精氨酸(ADMA)在糖尿病大鼠勃起功能障碍中的作用及其机制。方法: 采用高脂饲养加小剂量链脲佐菌素腹腔注射诱导8周病程的2型糖尿病大鼠模型;麻醉下分离大鼠阴茎海绵体,用器官浴槽方法检测海绵体对乙酰胆碱的内皮依赖性舒张反应以反映其勃起功能;检测血清ADMA含量;检测海绵体组织NOS活性及一氧化氮(NO)和环磷酸鸟苷(cGMP)含量;用Western blot检测海绵体ADMA信号通路蛋白和磷酸二酯酶5(PDE5)的表达;检测超氧化物歧化酶活性和脂质过氧化产物丙二醛含量以评价氧化应激。结果: 糖尿病大鼠血糖升高,胰岛素敏感性降低,表明糖尿病大鼠模型建立成功;与正常对照组比较,糖尿病大鼠海绵体舒张功能明显降低,血清ADMA浓度升高,海绵体组织NOS活性及NO和cGMP含量降低,ADMA生成酶蛋白精氨酸甲基转移酶1表达上调,ADMA代谢酶二甲基精氨酸二甲胺水解酶1、2及ADMA靶酶内皮型NOS和神经元型NOS表达下调,PDE5蛋白表达上调,氧化应激增加;体外用ADMA孵育正常大鼠离体海绵体,亦可产生与糖尿病大鼠海绵体相似的舒张功能障碍及NO和cGMP含量减少。结论: 内源性NOS抑制物ADMA蓄积是导致糖尿病大鼠勃起功能障碍的重要原因,其机制可能与减少NO生成、增加氧化应激有关。
糖尿病; 非对称性二甲基精氨酸; 勃起功能障碍; 阴茎海绵体; 一氧化氮
糖尿病(diabetes mellitus,DM)是严重危害人们健康的常见病[1],糖尿病易并发性功能障碍,在男性主要表现为阴茎勃起功能障碍(erectile dysfunction,ED;俗称阳痿)。临床调查研究发现,50%以上男性糖尿病患者伴有ED,糖尿病患者罹患ED的风险为非糖尿病个体3倍,并比非糖尿病个体提前10~15年发生;有研究预计到2025年全球ED患者将达到3.22亿[2]。虽然糖尿病性功能障碍没有糖尿病心血管并发症的高致死率,但严重影响人们的身心健康与生活质量。随着人们对生活水平和质量要求的不断提高,阐明糖尿病性功能障碍的发生机制,研发有效的靶向药物以及治疗糖尿病性功能障碍已引起病人、家庭和社会的普遍重视与广泛关注。
阴茎勃起实际上是神经调节的血管活动,主要依赖于海绵体神经和内皮细胞合成、释放一氧化氮(nitric oxide,NO),后者通过活化海绵体平滑肌细胞中鸟苷酸环化酶,催化三磷酸鸟苷转化成环磷酸鸟苷(cyclic guanosine monophosphate,cGMP),从而使阴茎海绵体动脉平滑肌舒张、海绵体血窦充血使阴茎胀大勃起[3-4];随后腹下神经的交感神经纤维兴奋,激活海绵体平滑肌细胞磷酸二酯酶5(phosphodiesterase 5,PDE5)促使cGMP降解,引起海绵体平滑肌收缩,阻止动脉血流入阴茎而使勃起终止。由此可见,阴茎勃起与其海绵体平滑肌舒张功能密切相关,而NO释放量和PDE5活性是影响其勃起功能的重要因素。已知PDE5抑制剂是临床上治疗ED的一线药物,但近年的临床研究发现,PDE5抑制剂对糖尿病ED患者的疗效并不理想[5],提示糖尿病ED可能不是由于cGMP的降解加快所致,而是由于NO的合成、释放减少导致cGMP来源不足所引起。研究表明内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)催化合成的NO在阴茎勃起功能调节中起主导作用。机体内存在一种调节NO合成的内源性机制: L-精氨酸的同系物非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)可与L-精氨酸竞争NOS结合位点,抑制NOS,减少NO生成;因此,ADMA被公认为机体内主要的内源性NOS抑制物[6]。ADMA抑制NOS,不仅可减少NO合成,还可使NOS解偶联,增加超氧阴离子生成,导致氧化应激增加[7]。体内ADMA主要是由蛋白精氨酸甲基转移酶1(protein arginine methyltransferase 1,PRMT1)催化含精氨酸残基蛋白质甲基化,再经蛋白水解作用而释放,并主要经二甲基精氨酸二甲胺水解酶(dimethylarginine dimethylaminohydrolase,DDAH)代谢;因此,PRMT1和DDAH是体内调节ADMA水平的重要因子[8]。我室和国内外学者大量研究表明,糖尿病患者和动物血清内源性ADMA水平明显升高,血管性和老龄性ED患者和动物血清内源性ADMA浓度也明显升高[9-12],提示内源性ADMA蓄积可能参与了ED的病理生理过程。因此,本研究拟在8周糖尿病大鼠模型揭示糖尿病ED与内源性ADMA蓄积的相关性;再在正常大鼠离体海绵体,观察内源性NOS抑制物ADMA对海绵体平滑肌舒张功能的直接影响,证明内源性ADMA蓄积在糖尿病ED中的重要作用,为阐明糖尿病ED的发生机制提供新的实验依据。
材料和方法
1主要试剂
链脲佐菌素(streptozotocin,STZ)、ADMA、Nω-硝基-L-精氨酸(Nω-nitro-L-arginine,L-NNA)、苯肾上腺素(phenylephrine,PE)和乙酰胆碱(acetylcholine,ACh)均购自Sigma;抗PRMT1、DDAH1和DDAH2多克隆抗体购自Abcam;抗eNOS、nNOS、 诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和β-actin多克隆抗体购自Santa Cruz;NO含量、NOS活性、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量检测试剂盒及RIPA裂解液、BCA蛋白浓度测定试剂盒、ECL发光试剂盒均购自Beyotime; ELISA检测cGMP试剂盒购自上海研吉生物科技有限公司;其余试剂为国产分析纯。
2动物模型制备及分组
体重为180~200 g雄性SPF级Sprague-Dawley(SD)大鼠购自广东省医学实验动物中心,合格证号为SYXK(粤)2010-0104。2型糖尿病大鼠模型制备采用我室已建立的高脂饲养加小剂量STZ诱导的方法[13],大鼠经适应性喂养1周后,随机分为正常对照(control)组和糖尿病(DM)组,每组5只。Control组大鼠常规饲养、自由进食及饮水;DM组大鼠采用高脂饲料(基础饲料79%、猪油10%、蛋黄10%、胆固醇1%和胆汁酸盐0.1%)饲养4周,再给予一次性腹腔注射小剂量STZ(30 mg/kg,溶于0.1 mol/L柠檬酸缓冲液),STZ注射后连续3 天检测尿糖为强阳性者再行连续2次隔日检测随机血糖≥16 mmol/L 则认为糖尿病大鼠模型成立,继续高脂饲养8周,以制备病程为8周的糖尿病大鼠模型。
3实验方法
3.1口服糖耐量试验 在大鼠饲养结束前行口服糖耐量试验以评价胰岛素敏感性,按我室已建立的方法[13],将大鼠禁食12 h后经尾静脉采血,测定空腹血糖值(即BG0 min),然后一次性灌胃给予40%葡萄糖溶液(2 g/kg),并分别在灌胃后30、60、90和120 min测定血糖值;绘制血糖-时间曲线,根据梯形法计算曲线下面积(area under the curve,AUC),计算公式为:AUC (mmol·L-1·min-1)=1/2×(BG0 min+BG30 min)×30 min+1/2×(BG30 min+BG60 min)×30 min+1/2×(BG60 min+BG90 min)×30 min+1/2×(BG90 min+BG120 min)×30 min。
3.2血清ADMA浓度测定 大鼠血清ADMA浓度按以前建立的方法[14],用高效液相色谱测定。取0.1 mL血清,加入5-磺基水杨酸2 mg混匀后冰上静置10 min,在4 ℃下离心15 min (2 000×g)以沉淀蛋白;取上清10 μL与100 μL衍生试剂邻苯二醛混匀,室温静置3 min后进行荧光检测,激发波长为338 nm,发射波长为425 nm,通过比较样品和标准品的峰面积计算样品中ADMA浓度。
3.3海绵体舒张功能测定 本实验通过检测大鼠离体海绵体对ACh的舒张反应以反映阴茎勃起功能。大鼠在麻醉(水合氯醛 300 mg/kg,ip)下,经颈动脉插管收集血标本后迅速摘除阴茎,置于预冷的Krebs-Henseleit(K-H)液中,持续充以95% O2和5% CO2混合气体;按照文献介绍方法[15],将阴茎海绵体一端固定于盛有5 mL K-H液的器官浴槽中,另一端连接张力换能器和生理信号记录仪;保持浴槽内K-H液37 ℃恒温,并持续充以95% O2和5% CO2混合气体,平衡后先用3 μmol/L 的PBS-EDTA(PE)溶液预收缩海绵体,待张力达坪值后分别依次加入累积浓度为10-7~10-3mol/L的 ACh舒张海绵体,记录各浓度点海绵体张力,并计算海绵体在药物处理前的舒张百分率。在正常大鼠的离体海绵体实验,记录第一次海绵体对ACh的舒张反应后,分别加入浓度为10、30和100 μmol/L的ADMA孵育15、30和 45 min,再观测海绵体在ADMA处理后对ACh的舒张百分率;并用ADMA孵育前后两次最大舒张百分率的比值以评价ADMA对离体海绵体舒张功能的影响。
3.4海绵体组织蛋白表达的测定 采用Western blot检测海绵体组织PRMT1/DDAH/NOS/PDE5通路蛋白表达。按已建立的方法[16],取20 mg海绵组织,加入10倍体积的RIPA裂解液,剪碎,用匀浆机(BBY24M, Next Advance)间隙匀浆 2 min,4 ℃下离心10 min(15 000×g),取上清用BCA法测定蛋白浓度;取30 μg蛋白经SDS-PAGE分离蛋白,用湿转法将蛋白条带电转至PVDF膜,用5%脱脂奶粉室温封闭1 h后依次加入Ⅰ抗和辣根过氧化酶标记的相应Ⅱ抗,洗膜后用ECL化学发光法显影,用凝胶成像系统(ChemiDocTMXRS+Imaging System, Bio-Rad)采集图像,用Image-Pro Plus软件进行图像灰度扫描。
3.5海绵体组织生化指标测定 采用NOS检测试剂盒荧光探针DAF-FM DA法测定海绵体组织NOS活性,并检测海绵体组织NO的稳定代谢产物亚硝酸盐含量以反映NO生成;用cGMP ELISA检测试剂盒测定大鼠海绵体组织cGMP含量以反映NO信号转导;用WST-8显色法测定海绵体组织SOD活性;用硫代巴比妥酸法测定脂质过氧化产物MDA含量,以反映氧化应激;采用BCA法测定海绵体组织匀浆蛋白含量,用于标化上述生化指标[16]。
4统计学处理
数据以均数±标准差(Mean±SD)表示,两组间比较采用双向非配对Studentt检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1糖尿病大鼠口服糖耐量降低
糖尿病大鼠的空腹血糖较正常对照组明显升高(P<0.01),给予葡萄糖灌胃(2 g/kg)后糖尿病大鼠血糖水平迅速上升,各时点的血糖水平均明显高于正常对照组(P<0.01);糖尿病大鼠的AUC明显大于正常对照组(P<0.01),提示糖尿病大鼠口服糖耐量降低,见图1。

Figure 1. Increases in plasma glucose level and area under curve (AUC) in diabetic rats. A: the plasma glucose level; B: the AUC of plasma glucose. Mean±SD.n=5.**P<0.01vscontrol group.
图1糖尿病大鼠口服糖耐量降低
2糖尿病大鼠海绵体舒张功能障碍
如图2所示,糖尿病大鼠离体海绵体对ACh(10-7~10-3mol/L)的舒张反应明显低于正常对照组,表现为最大舒张反应(Emax)降低(P<0.01),半数有效浓度(EC50)升高(331.60 μmol/Lvs87.42 μmol/L,P<0.01),提示糖尿病大鼠海绵体舒张功能受到抑制,阴茎勃起功能出现障碍。
3糖尿病大鼠血清ADMA浓度、海绵体NOS活性、NO含量和cGMP含量的变化
与正常对照组比较,糖尿病大鼠血清ADMA浓度显著升高(P<0.01),海绵体组织NOS活性明显抑制(P<0.05),NO和cGMP含量均明显降低(P<0.01),见图3。
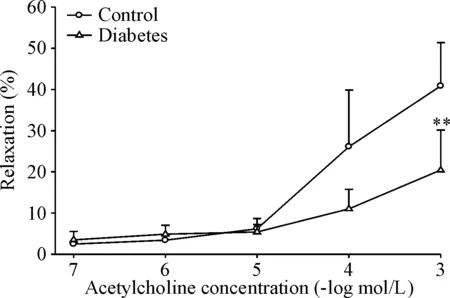
Figure 2. Impairment of relaxation response to acetylcholine of corpus cavernosum in diabetic rats. Mean±SD.n=5.**P<0.01vscontrol group.
图2糖尿病大鼠海绵体对乙酰胆碱的舒张反应降低
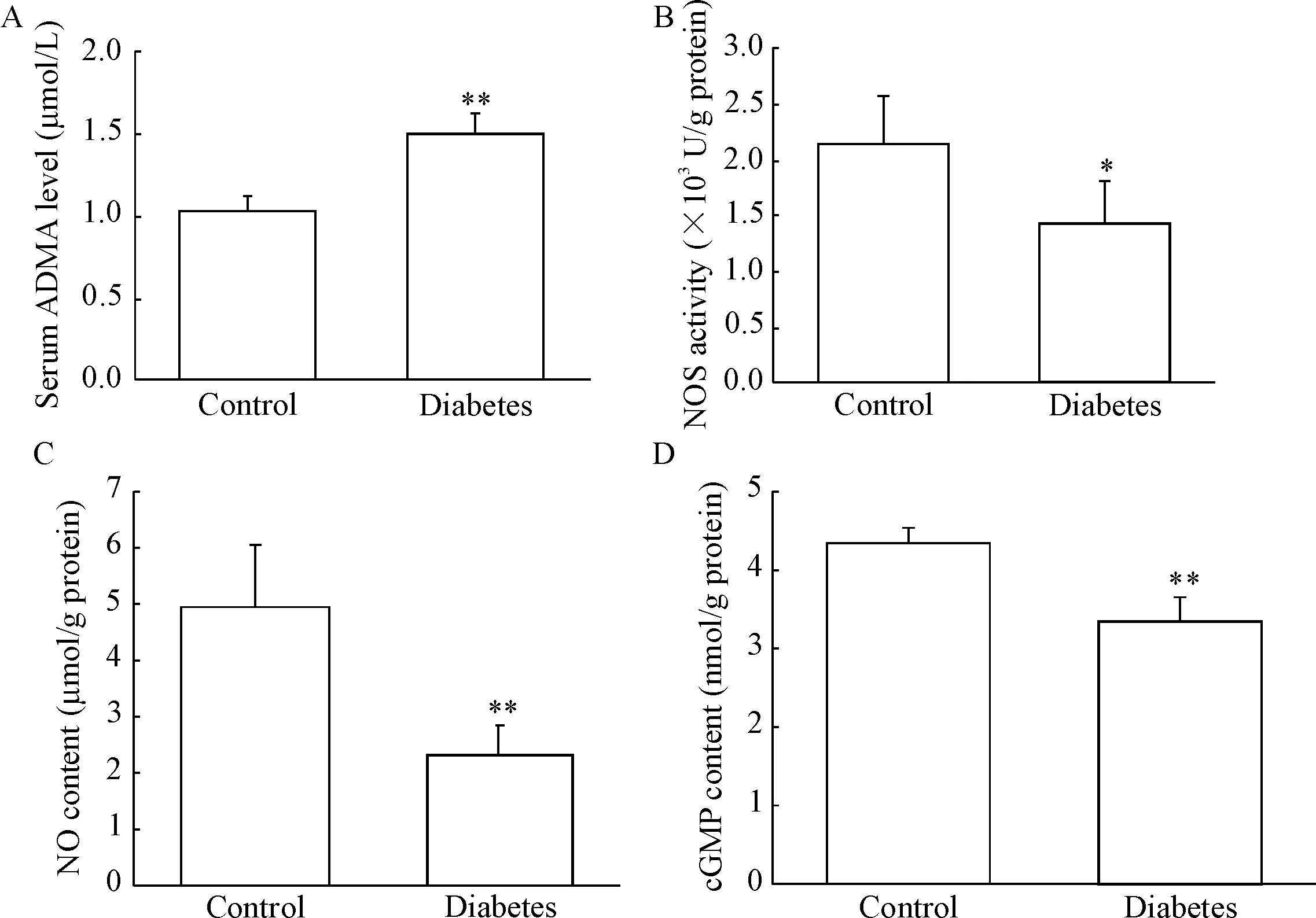
Figure 3. Changes of serum ADMA level (A), and NOS activity (B), NO content (C) and cGMP content (D) in the corpus cavernosum of diabetic rats. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图3糖尿病大鼠血清ADMA水平及海绵体NOS活性、NO含量和cGMP含量的变化
4糖尿病大鼠海绵体组织氧化应激增加
糖尿病大鼠海绵体组织抗氧化酶SOD活性显著低于正常对照组(P<0.01),而脂质过氧化产物MDA水平则明显高于正常对照组(P<0.05),提示糖尿病大鼠海绵体组织氧化应激增加,见图4。

Figure 4. Increase in oxidative stress in the corpus cavernosum of diabetic rats. Increased oxidative stress was reflected by the suppresion of superoxide dismutase (SOD) activity (A) and the elevation of malondialdehyde (MDA) content (B). Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图4糖尿病大鼠海绵体组织氧化应激增加
5血清ADMA浓度与海绵体舒张功能障碍关键指标的相关性分析
将大鼠血清ADMA浓度分别与其海绵体对ACh的最大舒张反应、海绵体组织NO和cGMP含量进行相关性分析,结果发现,糖尿病大鼠血清ADMA浓度与其海绵体最大舒张反应(r=-0.766,P<0.01)、NO含量(r=-0.810,P<0.01)和cGMP含量(r=-0.963,P<0.01)呈现明显负相关,提示糖尿病大鼠ADMA蓄积与其海绵体舒张功能障碍密切相关,见图5。

Figure 5. Linear correlation analysis between serum ADMA level and the maximal relaxation response to acetylcholine (A), NO content (B) and cGMP content (C) in the corpus cavernosum of control and diabetic rats. The Pearson correlation coefficients were -0.766 (P<0.01), -0.810 (P<0.01) and -0.963 (P<0.01), respectively.
图5血清ADMA浓度与海绵体最大舒张反应、NO含量和cGMP含量的相关性分析
6糖尿病大鼠海绵体PRMT1/DDAH/NOS/PDE5通路蛋白表达变化
与正常对照组比较,糖尿病组大鼠海绵体ADMA生成酶PRMT1蛋白表达上调(P<0.01),ADMA主要代谢酶DDAH1和DDAH2蛋白表达均明显下调(P<0.01),ADMA作用靶酶eNOS和nNOS的表达也降低(P<0.05),而cGMP降解酶PDE5的蛋白表达则显著增加(P<0.01),提示糖尿病时海绵体PRMT1/DDAH/NOS/PDE5通路蛋白表达紊乱,见图6。
7体外ADMA孵育对正常大鼠离体海绵体舒张功能的影响
为了观察NOS抑制物ADMA对大鼠海绵体舒张功能的直接影响,在体外用不同浓度(10 μmol/L、30 μmol/L 和100 μmol/L)的ADMA孵育正常大鼠离体海绵体不同时间(15 min、30 min和 45 min)后,检测了对海绵体舒张反应影响的量效和时效。结果发现,与对照组比较,用10~100 μmol/L的ADMA孵育正常大鼠离体海绵体30 min均可明显抑制对ACh的舒张反应(P<0.05);用30 μmol/L的ADMA孵育正常大鼠离体海绵体15~45 min呈时间依赖性抑制对ACh的舒张反应(P<0.05 at 30 min,P<0.01 at 45 min),提示ADMA对大鼠海绵体舒张功能具有直接的抑制作用,见图7。

Figure 6. The protein expression of PRMT1/DDAH/NOS/PDE5 pathway-related molecules in the corpus cavernosum of diabetic rats detected by Western blot. Mean±SD.n=3~4.*P<0.05,**P<0.01vscontrol group.
图6糖尿病大鼠海绵体PRMT1/DDAH/NOS/PDE5通路相关蛋白表达的变化

Figure 7. Dose-dependent (A) and time-dependent (B) effects of NOS inhibitor ADMA on relaxation function of isolated corpus ca-vernosum from normal rats. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图7体外ADMA孵育对正常大鼠离体海绵体舒张功能的时效和量效影响
8体外ADMA孵育对正常大鼠离体海绵体NO及cGMP含量的影响
在体外用30 μmol/L ADMA孵育正常大鼠离体海绵体30 min,不仅明显抑制对ACh的舒张反应(P<0.05),也显著降低海绵体组织NO和cGMP含量(P<0.01),提示ADMA对海绵体组织NO产生和cGMP形成具有直接的抑制作用,见图8。
讨 论
本研究首次发现2型糖尿病大鼠海绵体对ACh诱导的舒张反应显著降低,并伴随血清内源性NOS抑制物ADMA浓度明显升高以及海绵体组织PRMT1/ADMA/DDAH/NOS/NO/cGMP/PDE5信号通路紊乱,相关分析揭示糖尿病大鼠海绵体舒张功能障碍与ADMA 蓄积及其信号通路紊乱密切相关。这些结果表明,糖尿病大鼠内源性ADMA蓄积是导致糖尿病ED的重要因素。意大利学者Paroni 等[9]研究报道,在排除了吸烟、糖尿病、高血压、冠心病、充血性心衰、肾衰、恶性肿瘤和全身性炎症疾病以外,年龄为36~53岁的男性动脉性ED患者,其血浆ADMA浓度明显升高,并与阴茎勃起功能呈负相关;希腊学者Ioakeimidis等[10]研究报道,在排除了急性感染、肾衰等疾病以及在两月内使用过抗菌、抗炎药物治疗的病人以外,年龄为(56±9)岁的吸烟、高脂和高血压的ED患者,其血清ADMA浓度也显著升高,并与刺激后阴茎勃起功能呈负相关;这些研究结果都支持我们认为内源性ADMA升高是导致糖尿病ED重要因素的观点。其他学者在伴有ED的老龄大鼠模型[11]和皮下注射香烟烟雾抽提物致ED的日本白兔模型[12]也测得海绵体组织ADAM含量增加而cGMP含量降低;以及在糖尿病ED大鼠模型测得海绵体组织的cGMP含量也显著低于正常对照组[17]。这些结果都不同程度地支持我们的观点。
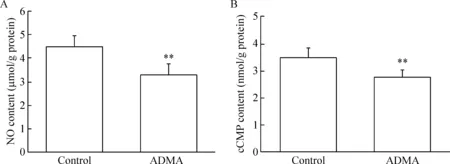
Figure 8. The effects of NOS inhibitor ADMA on NO (A) and cGMP (B) contents in isolated corpus cavernosum from normal rats. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图8体外ADMA孵育对正常大鼠海绵体NO和cGMP含量的影响
内源性ADMA蓄积不仅可竞争性抑制NOS,减少NO合成;还可使NOS解偶联,增加超氧阴离子生成,导致氧化应激[7]。因此,本研究检测海绵体组织SOD的活性以及脂质过氧化产物MDA的含量以反映氧化应激,结果发现,糖尿病大鼠海绵体组织MDA含量明显高于正常对照组,而SOD活性则显著低于正常对照组,提示糖尿病大鼠海绵体组织氧化应激增加;该结果与我室以前在2型糖尿病大鼠肝脏组织检测到的结果以及其他学者在老龄大鼠海绵体组织检测到的结果一致[11,13]。氧化应激或超氧阴离子生成增加可加快NO灭活,使ED加重。最近有研究发现,白藜芦醇通过增加海绵体组织SOD活性、降低脂质过氧化产物MDA含量,从而改善糖尿病大鼠ED[18]。
为了确定糖尿病大鼠海绵体组织中是否存在ADMA蓄积,本研究检测了海绵体组织ADMA的主要生成酶PRMT1以及ADMA主要代谢酶DDAH1和DDAH2的蛋白表达。结果发现,与正常对照组比较,糖尿病大鼠海绵体组织PRMT1表达显著上调,DDAH1和DDAH2表达明显下调。这些结果提示糖尿病大鼠海绵体组织中也存在内源性ADMA蓄积。相似的研究结果最近也被发现在伴有ED的老龄大鼠模型海绵体组织[11]。为了进一步查明糖尿病大鼠海绵体组织NO和cGMP含量降低的原因,本研究还检测了ADMA作用的靶酶eNOS和nNOS以及促进cGMP降解的PDE5蛋白表达。结果发现,与正常大鼠比较,糖尿病大鼠海绵体eNOS和nNOS表达下调,而PDE5表达明显上调;该结果与Bai等[17]在糖尿病大鼠海绵体组织的研究结果一致。这些结果提示,糖尿病大鼠海绵体NO含量降低不仅由于ADMA升高,直接抑制NOS活性,还可能是由于eNOS和nNOS的表达降低所致;糖尿病大鼠海绵体cGMP含量减少不仅是由于NO合成释放减少,使cGMP形成减少,也可能是由于PDE5的表达增加,使cGMP降解加快所致。
为了确定糖尿病时蓄积的内源性ADMA与勃起功能障碍的因果关系,本研究在正常大鼠的离体海绵体观测了ADMA对海绵体舒张功能的直接影响。结果发现,用10、30、100 μmol/L 的ADMA孵育正常大鼠离体海绵体30 min均可明显抑制海绵体对ACh的舒张反应,并呈时间依赖性;此外,还明显降低海绵体组织NO含量及其效应分子cGMP的生成。这些结果进一步证明,糖尿病时蓄积的ADMA是导致阴茎勃起功能障碍的重要因子,它通过抑制NO合成、降低cGMP生成所致。
总之,本研究在病程为8周的糖尿病大鼠揭示,海绵体的最大舒张功能与血清ADMA浓度呈高度负相关,并伴有海绵体组织PRMT1/DDAH/NOS/NO/cGMP/PDE5信号通路紊乱,提示糖尿病时内源性NOS抑制物ADAM蓄积是导致阴茎勃起功能障碍的重要因子,其机制与增强氧化应激、抑制NOS活性与表达、减少NO合成与cGMP生成有关。这些结果为阐明糖尿病ED发生机制提供了新的实验依据,并为其临床防治及药物研发提供新的启示。
[1] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9):948-959.
[2] Lo WH, Fu SN, Wong CK, et al. Prevalence, correlates, attitude and treatment seeking of erectile dysfunction among type 2 diabetic Chinese men attending primary care outpatient clinics[J]. Asian J Androl, 2014, 16(5):755-760.
[3] Dashwood MR, Crump A, Xu XW, et al. Identification of neuronal nitric oxide synthase (nNOS) in human penis: a potential role of reduced neuronally-derived nitric oxide in erectile dysfunction[J]. Curr Pharm Biotechnol, 2011, 12(9):1316-1321.
[4] Bivalacqua TJ, Champion HC, Usta MF, et al. RhoA/Rho-kinase suppresses endothelial nitric oxide synthase in the penis: a mechanism for diabetes-associated erectile dysfunction[J]. Proc Natl Acad Sci U S A, 2004, 101(24):9121-9126.
[5] González-Corrochano R, La Fuente J, Cuevas P, et al. Ca2+-activated K+channel (KCa) stimulation improves relaxant capacity of PDE5 inhibitors in human penile arteries and recovers the reduced efficacy of PDE5 inhibition in diabetic erectile dysfunction[J]. Br J Pharmacol, 2013, 169(2):449-461.
[6] Vallance P, Leone A, Calver A, et al. Endogenous dimethylarginine as an inhibitor of nitric oxide synthesis[J]. J Cardiovasc Pharmacol, 1992, 20(Suppl 12):S60-S62.
[7] Winnica D, Que LG, Baffi C, et al. L-citrulline prevents asymmetric dimethylarginine-mediated reductions in nitric oxide and nitrosative stress in primary human airway epithelial cells[J]. Clin Exp Allergy, 2016, 47(2):190-199.
[8] Onozato ML, Tojo A, Leiper J, et al. Expression ofNG,NG-dimethylarginine dimethylaminohydrolase and protein arginineN-methyltransferase isoforms in diabetic rat kidney: effects of angiotensin II receptor blockers[J]. Diabetes, 2008, 57(1):172-180.
[9] Paroni R, Barassi A, Ciociola F, et al. Asymmetric dimethylarginine (ADMA), symmetric dimethylarginine (SDMA) and L-arginine in patients with arteriogenic and non-arteriogenic erectile dysfunction[J]. Int J Androl, 2012, 35(5):660-667.
[10] Ioakeimidis N, Vlachopoulos C, Rokkas K, et al. Relationship of asymmetric dimethylarginine with penile Doppler ultrasound parameters in men with vasculogenic erectile dysfunction[J]. Eur Urol, 2011, 59(6):948-955.
[11] Chen D, Zhang KQ, Li B, et al. Epigallocatechin-3-gallate ameliorates erectile function in aged rats via regulation of PRMT1/DDAH/ADMA/NOS metabolism pathway[J]. Asian J Androl, 2017, 19(3): 291-297.
[12] Imamura M, Waseda Y, Marinova GV, et al. Alterations of NOS, arginase, and DDAH protein expression in rabbit cavernous tissue after administration of cigarette smoke extract[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 293(5):R2081-R2089.
[13] Leng YP, Qiu N, Fang WJ, et al. Involvement of increased endogenous asymmetric dimethylarginine in the hepatic endoplasmic reticulum stress of type 2 diabetic rats[J]. PLoS One, 2014, 9(2):e97125.
[14] 邱 霓,方伟进,李 聪,等. 内源性一氧化氮合酶抑制物上调4周运动大鼠骨骼肌收缩功能和线粒体生物合成[J]. 中国病理生理杂志, 2016, 32(7):1259-1265.
[15] Lizarte FS, Morgueti M, Tirapelli CR, et al. Chronic alcoholism associated with diabetes impairs erectile function in rats[J]. BJU Int, 2010, 105(11):1592-1597.
[16] 邱 霓,李 聪,方伟进,等. 限食8周对大鼠不同类型骨骼肌收缩功能及线粒体生物合成的影响[J]. 中国病理生理杂志, 2015, 31(2):193-200.
[17] Bai Y, An R. Resveratrol and sildenafil synergistically improve diabetes-associated erectile dysfunction in streptozotocin-induced diabetic rats[J]. Life Sci, 2015, 135:43-48.
[18] Yu W, Wan Z, Qiu XF, et al. Resveratrol, an activator of SIRT1, restores erectile function in streptozotocin-induced diabetic rats[J]. Asian J Androl, 2013, 15(5): 646-651.
(责任编辑: 陈妙玲, 罗 森)
Role of endogenous nitric oxide synthase inhibitor in erectile dysfunction of diabetic rats
HUANG Cheng, LEI Yan-ping, LI Xiao-mei, LIN Yuan, XIAO Qin, XIONG Yan
(Guangzhou Institute of Snake Venom Research, School of Pharmaceutical Sciences, Guangzhou Medical University, Guangzhou 511436, China. E-mail: xiongyan2001@yahoo.com)
AIM: To investigate the role of nitric oxide synthase (NOS) inhibitor asymmetric dimethylarginine (ADMA) in erectile dysfunction of diabetic rats.METHODS: Type 2 diabetic rat model was established by 4 weeks of high-fat diet plus a single intraperitoneal injection of streptozotocin and continued high-fat diet feeding for 8 weeks. Corpus cavernosum was isolated from the rats under anesthetization, and the endothelium-dependent relaxation response to acetylcholine (ACh) was tested in an organ chamber to reflect erectile function. The level of ADMA in serum was detected. The NOS activity, nitric oxide (NO) content and cyclic guanosine monophosphate (cGMP) content in corpus cavernosum were measured. The protein expression of ADMA-NOS-NO pathway-related molecules and phosphodiesteras 5 (PDE5) in the corpus cavernosum was detected by Western blot. Superoxide dismutase activity and malondialdehyde content were analyzed to evaluate oxidative stress.RESULTS: Elevated blood glucose and lowered insulin sensitivity were observed in the diabe-tic rats, indicating that type 2 diabetic rat model was successfully established. Compared with control group, the relaxation response to ACh of corpus cavernosum from diabetic rats was significantly decreased, which was accompanied with the elevation of serum ADMA level and reduction of NOS activity, NO content and cGMP content in the corpus cavernosum. The protein expression of ADMA-generating enzyme protein arginine methyltransferase 1 was up-regulated, while ADMA-metabolic enzymes dimethylarginine dimethylaminohydrolases 1 and 2, and ADMA-targeting enzymes endothelial NOS and neuronal NOS were down-regulated. The protein expression of PDE5 was up-regulated, accompanied with an increase in oxidative stress in the corpus cavernosum of diabetic rats. Incubation of isolated corpus cavernosum from normal rats with NOS inhibitor ADMA induced the similar relaxation dysfunction of corpus cavernosum response to ACh and decreased NO and cGMP contents in diabetic rats.CONCLUSION: Elevated endogenous NOS inhibitor ADMA plays an important role in erectile dysfunction of diabetic rats. The underlying mechanism may be related to the reduction of NO production and the increase in oxidative stress.
Diabetes mellitus; Asymmetric dimethylarginine; Erectile dysfunction; Corpus cavernosum; Nitric oxide
1000- 4718(2017)09- 1654- 08
2016- 11- 16 [
] 2017- 07- 17
广东省科技计划(No.2013B021800098);广州市科技计划(No.2014J4100067)
R363; R587.1
A
10.3969/j.issn.1000- 4718.2017.09.020
△通讯作者 Tel: 020-37103273; E-mail: xiongyan2001@yahoo.com
▲并列第1作者
