微小RNA-7敲减对ConA诱导的小鼠急性肝损伤的影响*
2017-09-22岳东旭赵娟娟张忆雄陈慧子
岳东旭, 赵娟娟, 张忆雄, 丁 涛, 陈慧子, 徐 林△
(遵义医学院 1免疫学教研室暨贵州省生物治疗人才基地,2贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义 563099)
微小RNA-7敲减对ConA诱导的小鼠急性肝损伤的影响*
岳东旭1, 2, 赵娟娟1, 2, 张忆雄1, 2, 丁 涛1, 2, 陈慧子1, 2, 徐 林1, 2△
(遵义医学院1免疫学教研室暨贵州省生物治疗人才基地,2贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义 563099)
目的: 研究微小RNA-7(miR-7)敲减(KD)对急性肝损伤(ALI)模型小鼠的影响。方法: 野生型(WT)小鼠和miR-7KD小鼠腹腔注射30 mg/kg刀豆蛋白(ConA)建立急性肝损伤模型;48 h后,观察小鼠肝脏的形态、重量及其脏器指数变化;HE染色观察小鼠肝脏组织病理学变化;血清学方法检查血清中谷丙转氨酶(ALT)的水平;ELISA法检测血清中细胞因子IL-4和IFN-γ的水平;流式细胞术检测肝脏组织中CD4+T细胞的比例及其相关的细胞因子IL-4和IFN-γ的表达变化。结果: 与对照组相比,miR-7敲减后急性肝损伤小鼠的肝脏组织颜色变浅,重量减轻,重量指数明显增加(P<0.05);HE染色显示miR-7KD小鼠血清炎症细胞浸润显著增多;血清学方法检测发现急性肝损伤小鼠血清ALT的水平明显上升(P<0.05);ELISA法检测显示miR-7KD小鼠血清中IFN-γ水平明显升高(P<0.01),而IL-4的表达水平则明显降低(P<0.01);流式细胞术检测结果显示,miR-7KD小鼠肝脏中CD4+T细胞比例显著升高(P<0.01),其相关的细胞因子IFN-γ的表达水平也显著上调(P<0.01),而IL-4的水平没有发生明显变化。结论: 敲减miR-7基因可明显促进ConA诱导的小鼠急性肝损伤。
微小RNA-7; 急性肝损伤; CD4+T细胞
急性肝损伤(acute liver injury,ALI)是肝细胞较短时间内发生损伤,功能迅速丧失或降低,伴有凝血功能障碍、黄疸等症状,常发展为肝性脑病的一种临床综合征[1]。大量研究显示,微小RNA(microRNA,miRNA,miR)与急性肝损伤的发生发展密切相关[2]。微miR-7作为miRNAs家族重要成员之一,在肝脏相关疾病的发生发展过程中也发挥了重要的调控作用[3-4]。然而,miR-7在急性肝损伤发生中的可能作用及相关机制仍未有研究报道。近年来,我们课题组发现,miR-7不仅参与了机体免疫细胞的发育和功能的变化,还与炎症相关临床疾病的发生过程密切相关[5-6],提示miR-7与机体免疫反应密切相关。因此,在本研究中,我们利用前期构建的miR-7敲减(knockdown,KD)小鼠,首次观察miR-7基因敲减对刀豆蛋白A(concanavalin A, ConA)诱导的急性免疫肝损伤模型小鼠的可能影响,为后续进一步探讨急性肝损伤的发生机制以及寻找诊断治疗新靶点提供新的策略和前期数据。
材料和方法
无特定病原体(specific pathogen free,SPF)级8~12周龄的FVB/N背景野生型(wild type,WT)小鼠和FVB/N背景miR-7KD小鼠[7-8]均饲养于遵义医学院生物医学中心SPF级动物实验室。
2主要试剂和仪器
4%多聚甲醛(重庆川东化工公司);HE染色液(泰康医疗);IC fixation buffer、Permeabilization buffer及抗小鼠CD4-PE、IFN-γ-PC5.5、IL-4-APC流式抗体(eBioscience)。SW-CJ-2FD型超净工作台(苏州净化设备厂);IX-51倒置显微镜和IX-71倒置荧光显微镜(Olympus);低温高速离心机(Thermo);流式细胞分析仪(Beckman Coulter)。
3主要方法
3.1急性肝损伤模型的建立 用ConA以30 mg/kg小鼠体重的剂量腹腔注射[9],48 h后采集相应的数据。
3.2观察小鼠肝脏组织形态学变化 断颈法处死造模成功的WT小鼠和miR-7KD小鼠,取小鼠的肝脏组织,观察肝脏形态学变化、测量肝脏重量并计算重量指数(重量指数=小鼠待测脏器重量/小鼠重量)。
3.3HE染色检测小鼠肝脏组织病理变化 断颈法处死造模成功的WT小鼠和miR-7KD小鼠,分别取所要观察小鼠的肝脏组织,4%甲醛固定24 h后,石蜡包埋切片(5 μm),行HE染色,显微镜下观察其组织病理学结构变化。
3.4血清中的谷丙转氨酶(alanine aminotransferase,ALT)的水平检测 摘除造模成功的WT小鼠和miR-7KD小鼠的眼球,收集血液,然后室温放置2 h待血液凝固,经2 000 r/min离心20 min,收集血清送至遵义医学院附属医院检验科进行生化指标ALT的检测。
当前IoT系统普遍存在多个管理域,如智慧小区、智慧学校、智慧医院等,出于安全考虑,不同管理域之间是彼此“绝缘”的,如何实现IoT跨域的互联互通及相关安全协议的研究成为新型IoT安全增强技术的重要目标之一。
3.5ELISA法检测血清中的细胞因子水平的变化 每个样品、标准品、空白对照和可选对照样品均加做副孔,每个微孔加400 μL洗涤缓冲液洗涤2次,之后进行标准品的稀释,建立浓度梯度,每个样品孔加入50 μL的样品稀释液,并向每个微孔加入50 μL的生物素抗体,孵育2 h,弃去微孔内的液体,洗板6次,每个微孔加入100 μL的蛋白链菌素-HRP,孵育1 h,弃去微孔内的液体,洗板6次,每个微孔加入100 μL TMB显色,孵育10 min,标准孔显色为暗蓝色时候加入终止液,使用分光光度计以主波长450 nm 检测各微孔吸光度。
3.6单细胞悬液的制备 断颈法处死待检测小鼠,于75%的乙醇内浸泡5 min,在超净台中取出小鼠肝脏组织后置于加有10 mL PBS缓冲液的平皿中,然后于200目无菌细胞筛上研磨组织,分别过滤2次;将获得的细胞悬液转移至15 mL 离心管中,1 200 r/min离心10 min;弃上清,混匀剩余液体和细胞,加入3 mL红细胞裂解液,置于冰上15 min;然后再加入10 mL PBS缓冲液重悬细胞,1 200 r/min离心10 min,弃上清,混匀剩余液体和细胞后,然后加入PBS缓冲液于200目筛网再次过滤,重复洗涤2次,将细胞液收集于新的15 mL离心管中,即得到肝脏组织单细胞悬液。
3.7CD4+T细胞及其相关细胞因子检测 取制备好的待测肝脏组织单细胞悬液(106~107个),用100 μL PBS缓冲液重悬细胞,转移至专用流式管中,分别加入流式抗体,抗小鼠CD4-PE 1 μL;冰上避光孵育30 min;然后用PBS缓冲液洗涤2遍,1 200 r/min离心10 min;弃上清,分别加入100 μL的IC fixation buffer Permeabilization buffer,冰上避光孵育40 min,PBS缓冲液洗涤1遍,1 200 r/min离心10 min,弃去上清,每管分别加入IFN-γ-PC5.5、IL-4-APC混匀,置于冰上避光孵育30 min,然后用PBS缓冲液洗涤2遍,1 200 r/min离心10 min;弃上清,加入300 μL PBS重悬细胞,上流式细胞仪检测。
4统计学处理
采用GraphPad Prism 5软件进行统计学分析。实验数据以均数±标准差(mean±SD)表示。组间比较采用两独立样本资料的t检验,以P<0.05为差异有统计学意义。
结 果
1ALI模型小鼠的肝脏组织形态学变化
与WT组相比,ConA诱导的miR-7KD小鼠肝脏组织颜色变浅;同时,miR-7KD小鼠肝脏重量降低(P<0.01),重量指数则增加(P<0.05),见图1。
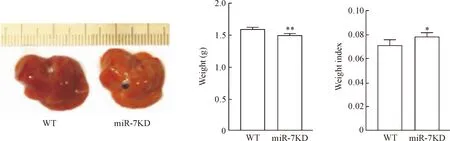
Figure 1. The morphological changes of WT mice and miR-7KD mice with acute liver injury. Mean±SD.n=6.*P<0.05,**P<0.01vsWT group.
图1急性肝损伤模型下WT与miR-7KD小鼠的肝脏组织形态学变化
2ALI模型小鼠肝脏组织病理学变化
与WT组小鼠相比,HE染色结果显示诱导的ConA miR-7KD小鼠肝脏炎性细胞浸润增加,见图2。
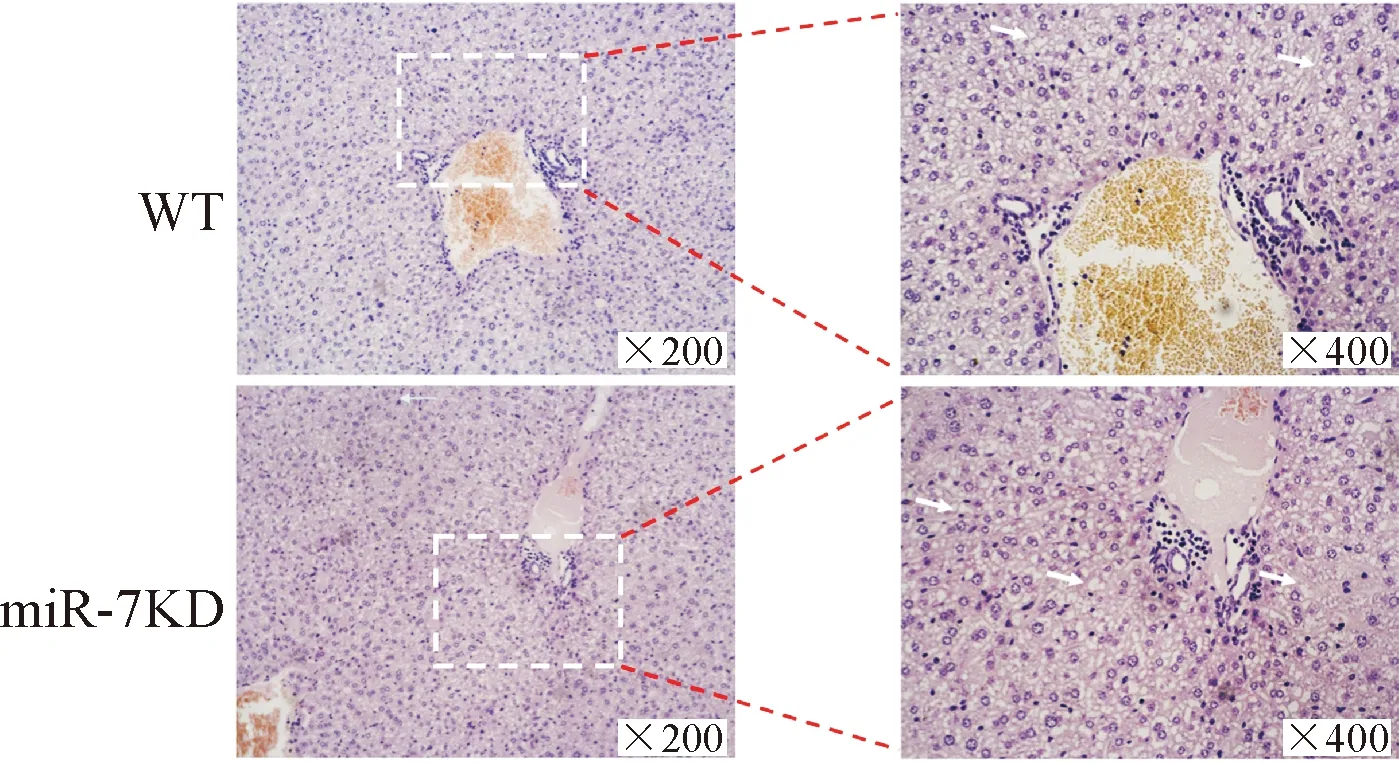
Figure 2. The pathological change in the liver tissues was observed by HE staining. The white arrowheads indicated the areas of the degenerating cells.
图2肝脏组织的病理学变化
3ALI模型小鼠血清中ALT水平的变化
与WT小鼠相比,生化指标检测显示miR-7敲减后,ConA诱导的小鼠血清中ALT 水平显著上升(P<0.05),见图3。
4ALI模型小鼠血清中细胞因子水平的变化
与WT小鼠相比,ELISA法检测显示ConA诱导的miR-7KD小鼠血清中IL-4水平明显降低(P<0.01), IFN-γ水平则明显升高 (P<0.01),见图4。
5ALI模型小鼠肝脏中CD4+T细胞比例的变化
流式细胞术检测结果显示,与WT小鼠相比,miR-7敲减后,ConA诱导的小鼠肝脏组织中CD4+T细胞比例显著增加(P<0.01),见图5。
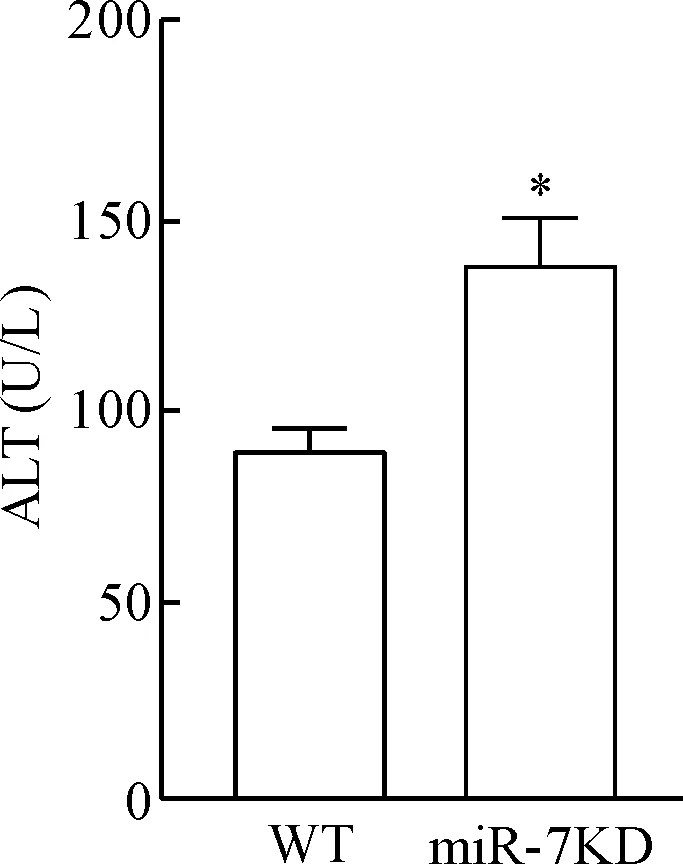
Figure 3. The levels of ALT in the serum. Mean±SD.n=6.*P<0.05vsWT group.
图3血清中ALT的水平变化
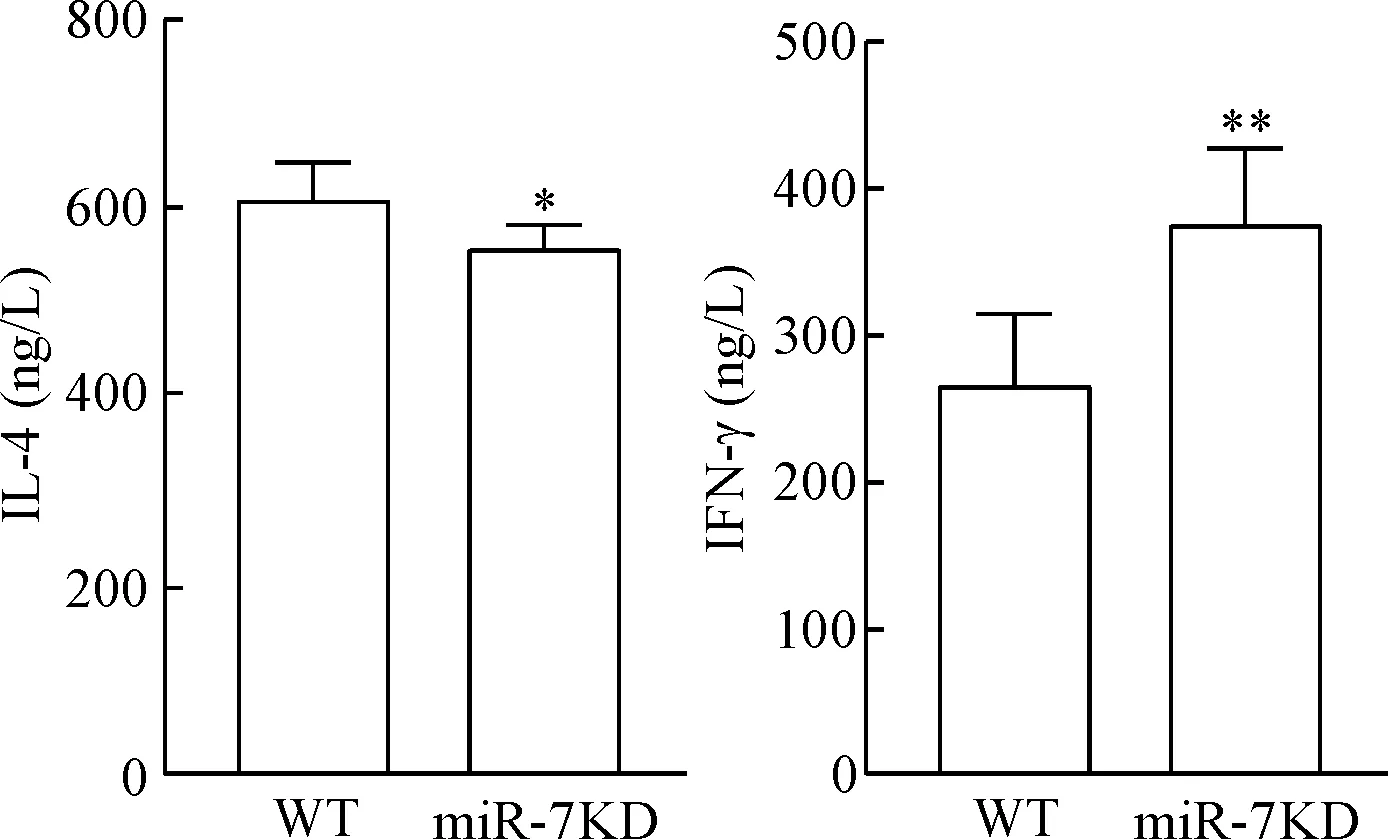
Figure 4. The levels of IFN-γ and IL-4 in the serum. Mean±SD.n=6.*P<0.05,**P<0.01vsWT group.
图4血清中IFN-γ和IL-4的水平变化
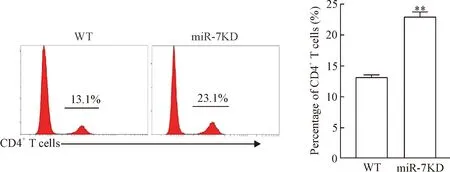
Figure 5. The effect of miR-7 knockdown on CD4+T cell ratio in the liver in acute liver injury model mice. Mean±SD.n=6.**P<0.01vsWT group.
图5miR-7敲减对ALI模型小鼠肝脏中CD4+T细胞比例的影响
6ALI模型小鼠肝脏中CD4+T细胞相关INF-γ和IL-4比例的变化
流式细胞术检测结果显示,与WT小鼠相比,miR-7敲减后,ConA诱导的小鼠肝脏组织中CD4+T细胞相关细胞因子IFN-γ的比例则显著增加(P<0.01),IL-4表达水平的变化差异没有统计学显著性,见图6。
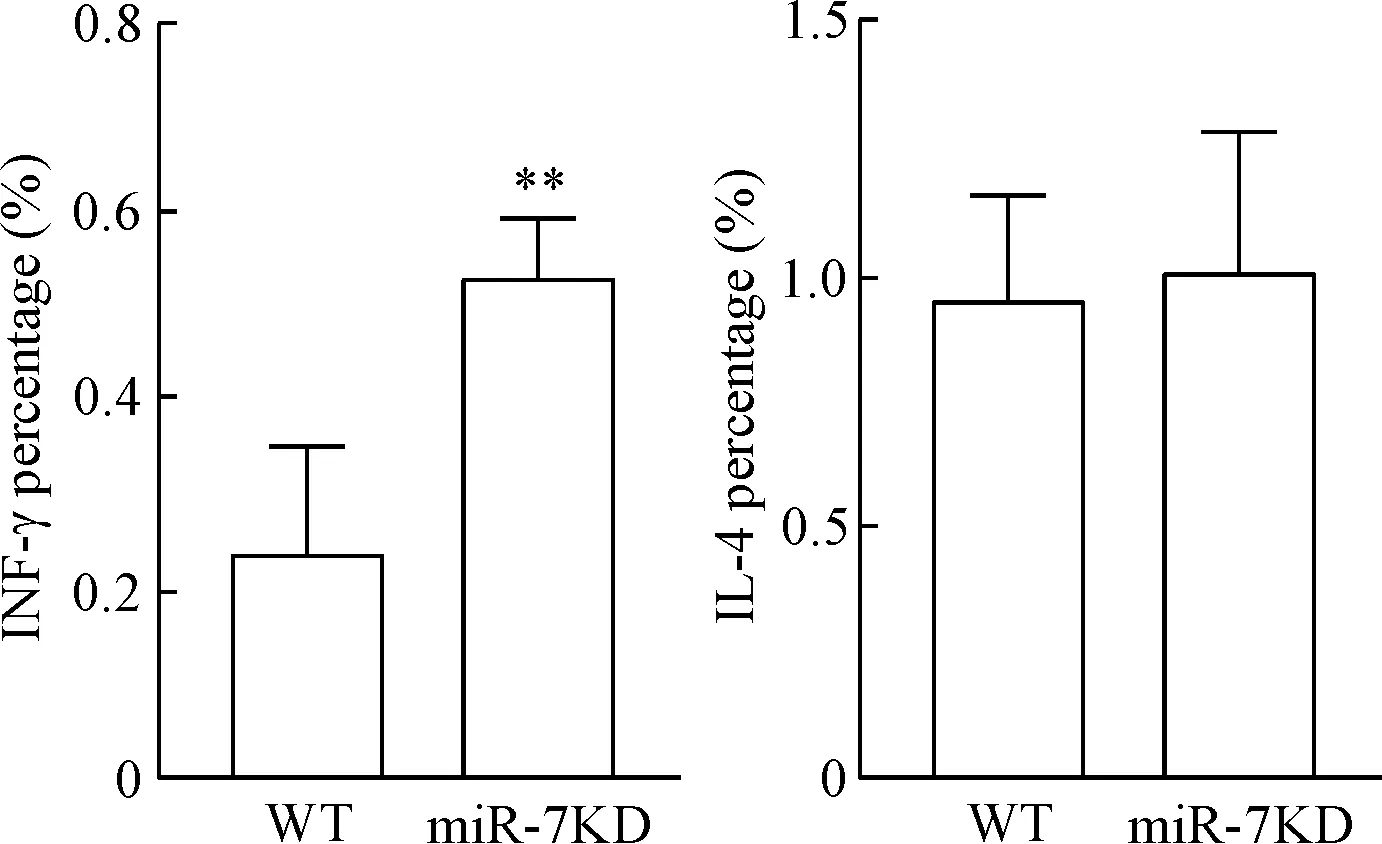
Figure 6. The effects of miR-7 knockdown on CD4+T cell-associated cytokines expression in the liver in acute liver injury model mice. Mean±SD.n=6.**P<0.01vs WT group.
图6miR-7敲减对ALI模型小鼠肝组织中CD4+T细胞相关INF-γ、IL-4表达的影响
讨 论
miRNA作为一段内源性、长18~25个核苷酸序列的非编码RNA分子,在基因的转录和mRNA的降解过程中起重要的负性调控作用。大量研究显示改变特定miRNA的表达水平可显著调节肝脏组织损伤的病理生理进程[10-12]。如,Su[13]等研究发现,下调miRNA-674-5p/5-LO的表达水平可显著上调细胞因子TNF-α和IFN-γ的水平从而加重ConA诱导的急性肝损伤的损伤状态;Yang 等[14]也发现microRNA-125b-5p作为肝细胞凋亡的重要调节子,其水平的增加可显著减轻药物作用的细胞毒性,减轻急性肝损伤。以上数据提示,微小RNA在急性肝损伤的发生发展中起到了重要的调节作用,因此,深入探讨特定miRNA对急性肝损伤病理发生过程的调节及相关分子作用机制不仅有助于加深对急性肝损伤的认识,还对后续的急性肝损伤临床诊断治疗具有积极的意义。miR-7作为miRNA家族成员之一,在包括肝脏等的多个组织、器官及细胞中表达,且与组织器官的发育、分化及损伤修复密切联系[15]。我们前期也发现,miR-7对急性肺损伤具有重要的调节作用[16]。新近一些研究报道miR-7可能是肝脏相关疾病如肝癌等发生的重要调控分子[17-18],然而miR-7与肝脏组织损伤之间的关系至今未有报道。在本研究中,我们利用前期构建的miR-7KD小鼠模型,首次通过ConA诱导小鼠急性免疫性肝损伤模型,观察miR-7敲减对该模型的影响。观察发现miR-7敲减后,小鼠肝脏组织的重量显著减轻,重量指数明显增加;HE染色显示miR-7敲减后肝脏组织炎性细胞浸润明显增多;血清中ALT的水平也明显升高; 同时我们使用ELISA法检测也发现血清中细胞因子IFN-γ的水平明显升高,而IL-4的水平则显著下降;以上结果显示miR-7敲减可明显加重ALI的病理损伤。
现已知,CD4+T细胞的生物学功能与急性肝损伤的发生密切相关。如,Zheng 等[19]曾报道ALI患者的CD4+T细胞分泌的IFN-γ水平升高,可加重急性肝损伤的发病过程;Dong 等[20]也发现,在ConA诱导的急性肝损伤中,由于细胞膜上鞘磷脂缺乏可导致CD4+T细胞功能的降低,且因此减缓了急性肝损伤的发展进程。更为重要的是,我们前期通过体外ConA诱导脾细胞增殖实验发现miR-7缺乏时,CD4+T细胞的活化、增殖能力明显增强,提示miR-7在CD4+T细胞的相关生物学功能中具有重要的调控作用[21]。然而,miR-7敲减后致使ConA诱导的急性肝损伤小鼠模型的病理损伤加重,是否由CD4+T细胞参与介导仍不清楚。因此,在本研究中我们进一步通过流式细胞术检测发现,与WT小鼠比较,miR-7敲减后,急性肝损伤小鼠的肝脏组织中CD4+T细胞的比例明显增加,重要的是,这些CD4+T细胞明显高表达细胞因子IFN-γ,由此显示miR-7敲减加重急性肝损伤的病理发生进程极可能是由于CD4+T细胞的活化等相关功能改变所致,然而CD4+T细胞在miR-7作用的急性肝损伤的病理发生过程中的具体角色及明确的相关作用机制仍需进一步阐明。
综上数据显示,miR-7敲减促进了急性肝损伤的发展进程,与CD4+T细胞的功能变化密切相关,此研究为后续急性肝损伤和基于miR-7相关炎性损伤的临床诊断治疗新策略的开发提供了重要的基础数据。
[1] Thawley V. Acute liver injury and failure[J]. Vet Clin North Am Small Anim Pract, 2017, 47(3):617-630.
[2] 周 军, 朱 灵, 曹海军, 等. 药物性肝损伤与免疫性肝损伤肝组织中lncRNA表达谱的差异分析[J]. 中国病理生理杂志, 2015, 31(2):313-318.
[3] Wang F, Qiang Y, Zhu L, et al. MicroRNA-7 downregulates the oncogene VDAC1 to influence hepatocellular carcinoma proliferation and metastasis[J]. Tumor Biol, 2016, 37(8):10235-10246.
[4] Ma C, Qi Y, Shao L, et al. Downregulation of miR-7 upregulates Cullin 5 (CUL5) to facilitate G1/S transition in human hepatocellular carcinoma cells[J]. IUBMB Life, 2013, 65(12):1026-1034.
[5] Zhao J, Tao Y, Zhou Y, et al. MicroRNA-7: a promising new target in cancer therapy[J]. Cancer Cell Int, 2015, 15:103.
[6] Nagano Y, Toiyama Y, Okugawa Y, et al. MicroRNA-7 is associated with malignant potential and poor prognosis in human colorectal cancer[J]. Anticancer Res, 2016, 36(12):6521-6526.
[7] 赵娟娟, 朱顺飞, 徐华林, 等. MicroRNA-7对小鼠肠系膜淋巴结αβT淋巴细胞组成的影响[C]. 第十届全国免疫学学术大会汇编. 2015:2.
[8] 赵娟娟,徐华林,郭萌萌,等. MicroRNA-7敲减对内毒素诱导小鼠急性肺损伤的影响[J]. 中国免疫学杂志, 2016, 32(9):1257-1261.
[9] Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A[J]. J Clin Invest, 1992, 90(1):196-203.
[10] Chen W, Han C, Zhang J, et al. miR-150 deficiency protects against FAS-induced acute liver injury in mice through regulation of AKT[J]. PLoS One, 2015, 10(7):e0132734.
[11] 邓小耿,邱荣林,伍耀豪,等. miRNA-122促进小鼠胚胎干细胞源性肝前体细胞的分化与成熟[J]. 中国病理生理杂志, 2013, 29(7):1260-1267.
[12] Qadir XV, Chen W, Han C, et al. miR-223 deficiency protects against Fas-induced hepatocyte apoptosis and liver injury through targeting insulin-like growth factor 1 receptor[J]. Am J Pathol, 2015, 185(12):3141-3151.
[13] Su K, Wang Q, Qi L, et al. MicroRNA-674-5p/5-LO axis involved in autoimmune reaction of Concanavalin A-induced acute mouse liver injury[J]. Toxicol Lett, 2016, 258:101-107.
[14] Yang D, Yuan Q, Balakrishnan A, et al. MicroRNA-125b-5p mimic inhibits acute liver failure[J]. Nat Commun, 2016, 7:11916.
[15] Vienberg S, Geiger J, Madsen S, et al. MicroRNAs in metabolism[J]. Acta Physiologica, 2016, 219(2):346-361.
[16] Zhao J, Chao C, Guo M, et al. MicroRNA-7 deficiency ameliorates the pathologies of acute lung injury through elevating KLF4[J]. Front Immunol, 2016, 7:389.
[17] Fang Y, Xue JL, Shen Q, et al. MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6):1852-1862.
[18] Zhang X, Hu S, Zhang X, et al. MicroRNA-7 arrests cell cycle in G1phase by directly targeting CCNE1 in human hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2014, 443(3):1078-1084.
[19] Zheng C, Yin S, Yang Y, et al. CD24 aggravates acute liver injury in autoimmune hepatitis by promoting IFN-γ production by CD4+T cells [J]. Cell Mol Immunol, 2017 Jan 9. [Epub ahead of print]
[20] Dong L, Watanabe K, Itoh M, et al. CD4+T-cell dysfunctions through the impaired lipid rafts ameliorate concanavalin A-induced hepatitis in sphingomyelin synthase 1-knockout mice[J]. Int Immunol, 2012, 24(5):327-337.
[21] 郑 文, 赵娟娟, 朱顺飞, 等. 微小RNA-7敲减对小鼠脾脏中T淋巴细胞体外功能的影响[J]. 现代免疫学, 2016, 36(5):358-363.
(责任编辑: 陈妙玲, 余小慧)
Effect of microRNA-7 knockdown on ConA-induced acute liver injury in mice
YUE Dong-xu1, 2, ZHAO Juan-juan1, 2, ZHANG Yi-xiong1, 2, DING Tao1, 2, CHEN Hui-zi1, 2, XU Lin1, 2
(1Department of Immunology, Talent Base of Biological Therapy of Guizhou Province,2Guizhou Provincial College-based Key Laboratory for Tumor Prevention and Treatment with Distinctive Medicines, Zunyi Medical University, Zunyi 563099, China. E-mail: xulinzhouya@163.com)
AIM: To study the effect of microRNA-7 (miR-7) knockdown (KD) on concanavalin A (ConA)-induced acute liver injury (ALI) in mice.METHODS: Wild type (WT) mice and miR-7KD mice were
ConA (30 mg/kg) to induced acute liver injury model by intraperitoneal injection, and the morphological changes, liver weight and weight index were measured 48 h later. The pathological changes of the liver tissues were observed by HE staining. The levels of serum alanine aminotransferase (ALT), IL-4 and IFN-γ were detected by ELISA. The proportional changes of CD4+T cells and the relative levels of IL-4 and IFN-γ were analyzed by flow cytometry.RESULTS: The color of the liver tissue became lighter, and the weight and weight index were changed significantly in miR-7KD mice compared with control group (P<0.05). HE staining showed that the inflammatory cell infiltration was increased in the liver of miR-7KD mice. Moreover, the level of serum ALT was significantly increased (P<0.05). The serum level of IFN-γ elevated significantly (P<0.01), while the IL-4 levels decreased significantly (P<0.01) in the serum of miR-7KD mice. Furthermore, the proportion of CD4+T cells and relative IFN-γ cells increased obviously (P<0.01).CONCLUSION: miR-7 knockdown promotes the pathogenesis of the ConA-induced acute liver injury in mice.
MicroRNA-7; Acute liver injury; CD4+T cells
1000- 4718(2017)09- 1643- 05
2017- 03- 15 [
] 2017- 04- 27
国家自然科学基金资助项目(No. 31370918);贵州省高层次创新人才计划(黔科合人才(2016)4031号);遵义医学院优秀青年人才计划项目(No. 15ZY-001)
R363; R575
A
10.3969/j.issn.1000- 4718.2017.09.018
△通讯作者 Tel: 0851-28609530; E-mail: xulinzhouya@163.com
