枸橘苷对胃癌细胞抑制作用及其机制研究
2017-09-22张韡,李忠
张 韡, 李 忠
(南阳理工学院张仲景国医国药学院, 河南 南阳 473004)
枸橘苷对胃癌细胞抑制作用及其机制研究
张 韡, 李 忠△
(南阳理工学院张仲景国医国药学院, 河南 南阳 473004)
目的: 探究枸橘苷对AGS胃癌细胞抑制作用及其机制。方法: MTT实验检测枸橘苷对AGS细胞活力的影响;流式细胞术分析细胞周期分布以及细胞凋亡;细胞核染色分析AGS细胞在枸橘苷处理之后的形态学变化;Western blot检测枸橘苷对AGS细胞中外源性凋亡通路相关蛋白 FasL、caspase-8、caspase-3和PARP,以及内源性凋亡相关蛋白Bak、Bcl-xL、Bax和caspase-9蛋白水平的影响。结果: MTT实验表明枸橘苷抑制AGS胃癌细胞活力,并且呈时间、剂量依赖性(P<0.05);流式细胞术分析结果表明枸橘苷使细胞停滞在G1期,凋亡数量增加(P<0.05);核染色结果说明,与对照组相比,150 μmol/L枸橘苷处理后细胞核明显浓缩, 细胞凋亡数量增加;Western blot实验表明枸橘苷上调FasL,激活caspase-8和caspase-3,促使活化的caspase-3底物PARP切割(P<0.05),而对线粒体调节的内源性凋亡通路相关蛋白没有影响。结论: 枸橘苷通过激活外源性凋亡通路促使AGs细胞凋亡,抑制胃癌细胞增殖,从而发挥抗肿瘤作用,在临床上可能成为治疗胃癌的新型药物。
枸橘苷; 胃癌细胞; 细胞凋亡
胃癌是全球第二大与癌症相关的死亡率最高的疾病[1]。AGS细胞是一种人胃癌细胞系,可以表达野生型p53[2],可用于多种抗肿瘤药物对于胃癌细胞的作用研究。而野生型p53是肿瘤抑制蛋白,可抑制肿瘤细胞增殖,调节肿瘤细胞周期与凋亡[3]。
近年来天然产物在控制肿瘤方面备受关注。已有报道多种蔬菜和水果含有丰富的黄酮类成分与低癌症发病率相关[4-5]。柑橘类水果含有丰富的黄酮类化合物,例如橘皮苷、川陈皮素、枸橘苷等[6-8]。枸橘苷是二氢黄酮类类化合物,味道苦涩,具有多种药理作用,包括抗氧化、抗菌、抗炎和抗肿瘤的作用[9-11]。然而很少研究报道橘皮苷对胃癌的作用及作用机制。
材料和方法
1主要试剂
噻唑蓝溴化四唑(MTT)购自上海日初生物技术公司;碘化丙啶(propidium iodide,PI)购自Sigma;Annexin V-FITC凋亡试剂盒购自Bio Vision;所有的抗体及 II 抗购自Cell Signaling Technology;枸橘苷购自上海同田生物技术公司。
2细胞来源以及培养
AGS细胞购自中国生命科学院细胞资源中心,培养在含有10% 胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基中。在5% CO2、37 ℃培养箱中培养。细胞传代时用0.25%的胰酶处理。
3方法
3.1MTT实验 细胞活力用MTT实验测定。AGS细胞培养在96孔板中,接种密度为1×104,接种24 h,并且设置6个复孔。之后分2组处理。第1组用不同浓度枸橘苷处理细胞48 h,将枸橘苷溶解于DMSO中,浓度分别为0(对照组,control group)、50、100和150 μmol/L。另外一组用100 μmol/L枸橘苷处理AGS细胞不同时间,分别为24 h、48 h和72 h。用PBS洗涤细胞之后,用20 μL的5 g/L MTT 37 ℃处理细胞4 h。弃掉MTT之后,每孔加入100 μL DMSO溶液。96孔板在室温下温和摇荡10 min。用酶联免疫检测仪在490 nm处检测吸光度值。
3.2细胞周期检测实验 枸橘苷处理AGS细胞24 h之后,PBS洗涤细胞,胰酶消化,收集细胞于流式管中。用预冷的70%的乙醇在-20 ℃固定过夜。离心之后,PBS洗涤细胞。加入500 μL PBS (含有50 mg/L PI、100 mg/L RNase A和 0.2% Triton X-100),4 ℃避光孵育30 min。采取标准程序用流式细胞仪检测,计数(2~3)×104个细胞,结果用细胞周期拟和软件ModFit分析。
3.3凋亡检测 使用Annexin V-FITC凋亡检测试剂盒根据生产商说明检测细胞凋亡,然后用流式细胞术分析。不同浓度(0、50和150 μmol/L)枸橘苷处理AGS细胞24 h。之后用PBS洗涤细胞,胰蛋白酶消化细胞并且离心(5 min, 4 ℃, 1 000 r/min)。细胞重悬于200 μL PBS中。再次离心,重悬于500 μL 1×Annexin V Binding Buffer。然后将100 μL细胞与5 μL Annexin V-FITC和5 μL碘化丙啶在室温下孵育15 min。之后用FACScan流式分析仪分析细胞凋亡情况。
3.4Western bolt实验 将AGS胃癌细胞中培养基弃掉,用PBS洗2次。每个小皿加入80 μL裂解液,在冰上裂解20 min。刮蛋白,离心(13 min, 4 ℃, 13 000 r/min)收集总蛋白裂解液。BCA工作液根据BSA(0.5 g/L)制备标准曲线,检测不同处理细胞蛋白浓度。制备上样蛋白。等量蛋白总量在8% SDS-PAGE中分离。之后电转到PVDF膜上。PVDF膜用5%脱脂牛奶在室温封闭1 h,PBS洗3次,每次5 min。孵育anti-FasL、anti-caspase-8、anti-caspase-3、anti-PARP、anti-Bak、anti-caspase-9、anti-Bax、anti-Bcl-xL和anti-β-actin抗体,放在4 ℃,过夜。PBS洗3次,每次5min。孵育相应的 II 抗。PBS洗3次,每次10 min,在膜上均匀覆盖ECL化学发光液在化学发光成像系统中显影。
3.5细胞核染色 不同浓度(0、50和150 μmol/L)枸橘苷处理AGS细胞24 h之后,PBS洗涤细胞3次。之后细胞用4%多聚甲醛固定10 min,PBS洗涤细胞3次。在常温避光下,DAPI染色10 min,PBS洗涤细胞3次,每次5 min。荧光显微镜下观察拍照。
4统计学处理
采用SPSS 17.0进行统计分析。所有的数据表示为均数±标准差(mean±SD)。计量资料行one-way ANOVA检验,组间的两两比较行LSD-t检验。以P<0.05表示差异有统计学意义。
结 果
1枸橘苷抑制AGS细胞的活力
MTT实验结果表明枸橘苷可显著抑制AGS细胞活力,并且具有时间和剂量依赖关系(P<0.01),见图1。
2枸橘苷对人胃癌AGS细胞的细胞周期及凋亡的影响
流式细胞术分析不同浓度枸橘苷处理AGS细胞之后细胞周期分布和凋亡情况。当枸橘苷浓度为50和150 μmol/L时,AGS细胞在G1分布分别增加到10.61%和21.88%。Annexin V-FITC/PI分析细胞凋亡分布情况,用0、50和150 μmol/L枸橘苷处理AGS细胞之后,细胞总凋亡率从2.6%增加到14.5%和27.2%,差异具有统计学显著性(P<0.05)。DAPI染色表明随着枸橘苷浓度增加,AGS细胞形态改变,凋亡数量增加,见图2。
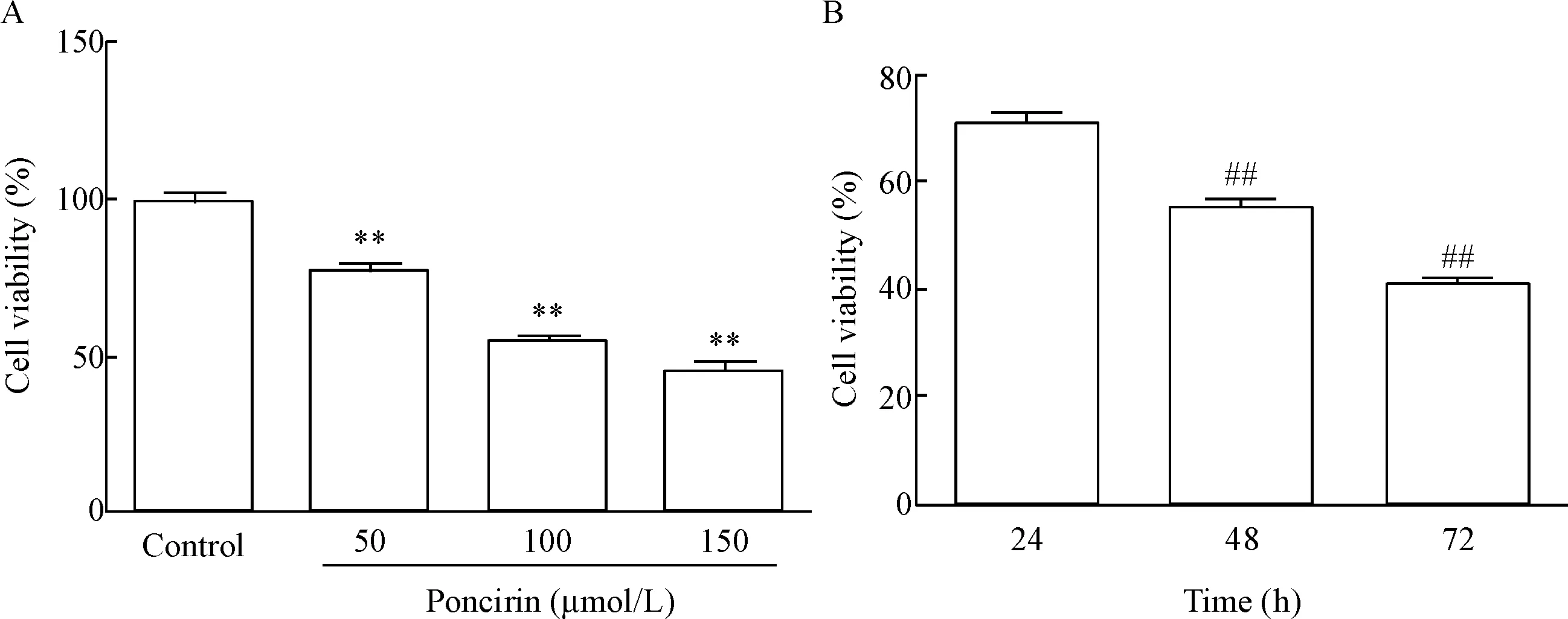
Figure 1. The effect of poncirin on AGS cell viability measured by MTT assay. A: the effect of different concentrations of poncirin for 48 h on AGS cell viability; B: the effect of 100 μmol/L poncirin for different time on AGS cell viability. Mean±SD.n=3.**P<0.01vscontrol;##P<0.01vs24 h.
图1MTT实验分析枸橘苷对AGS细胞活力的影响
3枸橘苷对胃癌细胞中FasL依赖的外源性凋亡途径影响
为了检测FasL是否参与枸橘苷诱发的配体激发外源性凋亡途径,我们采用Western blot法检测FasL的表达。结果显示枸橘苷呈剂量依赖性地上调FasL和Fas的表达(P<0.05),且枸橘苷能够以剂量依赖性方式激活FasL的下游靶蛋白caspase-8、caspase-3和PARP的切割,见图3。
4枸橘苷对胃癌细胞中线粒体介导的内源性凋亡途径影响
为了检测枸橘苷是否对内源性线粒体介导的凋亡通路有作用,用Western blot法分析枸橘苷对线粒体相关凋亡蛋白影响。与对照组相比,50和150 μmol/L枸橘苷处理细胞之后Bax/Bcl-xL比值没有变化,Bak蛋白水平也没有变化,同时与线粒体凋亡途经相关的凋亡蛋白caspase-9没有激活,见图4。
讨 论
几千年来,柑橘类植物在亚洲被广泛用于传统医药[12]。柑橘类果实中含有丰富的黄酮类化合物,例如橘皮苷、川陈皮素、枸橘苷等通过抑制细胞周期,促进凋亡、自噬、焦亡等途经抑制不同的肿瘤细胞系[13-15]。我们的研究阐明枸橘苷诱导AGS胃癌细胞凋亡的机制。我们的研究主要集中研究凋亡的2条途经(内源性凋亡途经和外源性凋亡途经)。首先,枸橘苷能够以剂量和时间依赖性方式抑制AGS肿瘤细胞增殖,以剂量依赖性方式诱导细胞凋亡;其次,枸橘苷对于AGS细胞的抑制作用涉及caspase的激活。枸橘苷诱导细胞死亡是通过上调FasL外源性凋亡途经,但是不依赖于线粒体介导的凋亡途经。
凋亡过程在维持机体稳态发挥着重要的作用。凋亡涉及一系列的生物化学过程导致细胞典型的形态学改变以及细胞死亡,细胞凋亡涉及的分子信号途经有外源性凋亡途径、内源性凋亡途径以及内质网应激诱导的凋亡途径[16-18]。细胞活性实验表明150 μmol/L枸橘苷显著抑制AGS胃癌细胞增殖。近年来有研究表明导致多种细胞系凋亡是细胞周期被改变所致[19-20]。我们研究发现枸橘苷处理之后AGS细胞被阻滞于G1期,而在S期和G2/M期的细胞比例降低。Annexin V-PI凋亡检测表明枸橘苷以剂量依赖性方式增加总凋亡细胞群。这些研究表明枸橘苷使AGS肿瘤细胞阻滞于G1期,促进细胞凋亡。
Western blot结果显示通过上调FasL蛋白表达,相继激活caspase-8和caspase-3,切割PARP,而切割的PARP是活化caspase-3的底物蛋白[21]。这些结果说明在AGS细胞中枸橘苷诱导的凋亡细胞死亡是Fas死亡受体介导的随后caspase依赖的外源性凋亡途径。而我们实验结果还表明枸橘苷处理AGS细胞之后线粒体依赖的凋亡通路并没有变化。Bcl-xL是抗凋亡蛋白,过表达此蛋白会抑制内源性凋亡途径;Bax是促凋亡蛋白,过表达之后会促进内源性凋亡通路[22]。枸橘苷处理细胞之后并没有发现Bcl-xL蛋白与Bax蛋白变化,Bcl-xL/Bax比值也没有发生变化。此外,内源性凋亡相关蛋白caspase-9在枸橘苷处理AGS胃癌细胞之后没有变化。这些结果表明线粒体诱导凋亡通路并不参与枸橘苷诱导的AGS细胞凋亡。
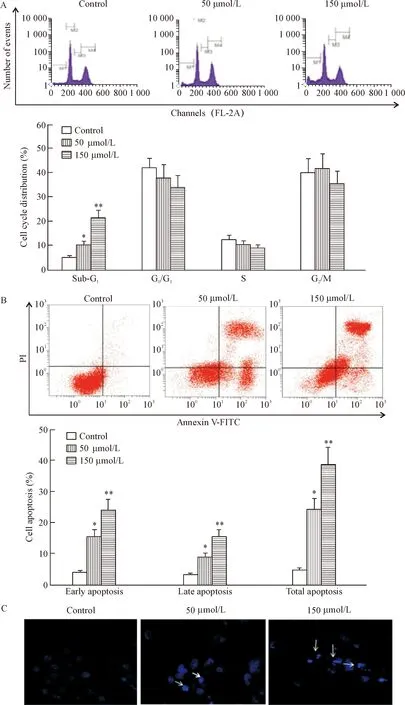
Figure 2. Effect of poncirin on cell cycle distribution and apoptosis of AGS cells. The cells were incubated with different concentrations of poncirin for 24 h. A: representative images and statistical analysis of cell cycle distribution; B: representative images and statistical analysis of cell apoptosis; C: DAPI staining showed nuclear condensation in AGS cells, as indicated by white arrows. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图2枸橘苷对AGS细胞的细胞周期分布及凋亡的影响
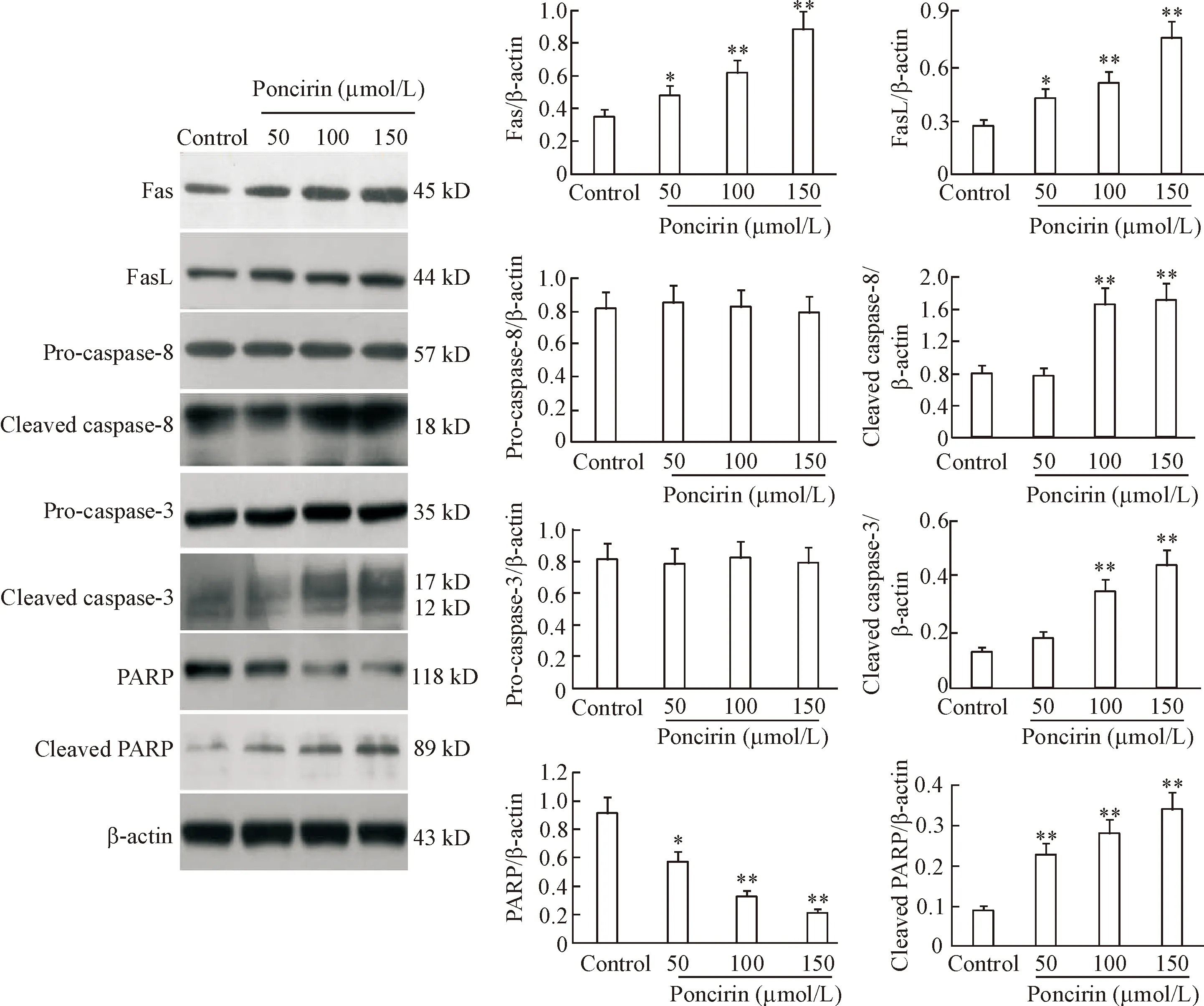
Figure 3. The effects of poncirin on Fas ligand (FasL)-mediated extrinsic apoptosis pathway in AGS cells determined by Western blot analysis. The cells were incubated with different concentrations (0, 50, 100 and 150 μmol/L) of poncirin for 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图3Westernblot检测不同浓度枸橘苷对AGS胃癌细胞中FasL介导的外源性凋亡途径的影响
[1] Amal H, Leja M, Funka K, et al. Detection of precance-rous gastric lesions and gastric cancer through exhaled breath[J]. Gut, 2016, 65(3):400-407.
[2] Kim SH, Choi SI, Won KY, et al. Distinctive interrelation of p53 with SCO2, COX, and TIGAR in human gastric cancer[J]. Pathol Res Pract, 2016, 212(10):904-910.
[3] Yue X, Zhao Y, Xu Y, et al. Mutant p53 in cancer: accumulation, gain-of-function, and therapy[J]. J Mol Biol, 2017, 429(11):1595-1606.
[4] 王竹君. 黄酮和黄酮醇对人食管癌细胞的分化诱导作用[D]. 哈尔滨: 东北农业大学, 2009.
[5] 曹 杰. 蔬菜和水果中黄酮类化合物检测方法及应用研究[D]. 哈尔滨: 哈尔滨医科大学, 2010.
[6] 宋 菲, 张 金, 王 微. 橘皮苷的提取及抑菌活性研究[J]. 科技传播, 2011(13):104-105.
[7] 苏明媛, 牛江龙, 李 林, 等. 川陈皮素的体外抑癌活性及其机制研究[J]. 中成药, 2011, 33(9):1479-1483.
[8] 李 增, 陈灵芝, 刘 晨. 枸橘苷抑制血管生成作用的研究[J]. 时珍国医国药, 2016, 27(2):277-279.
[9] Lou SN, Lai YC, Hsu YS, et al. Phenolic content, antioxidant activity and effective compounds of kumquat extracted by different solvents[J]. Food Chem, 2016, 197(Pt A):1-6.
[10] Kim DH, Bae EA, Han MJ. Anti-Helicobacterpyloriactivity of the metabolites of poncirin from Poncirus trifoliata by human intestinal bacteria[J]. Biol Pharmaceut Bull, 1999, 22(4):422-424.
[11] Kang GD, Kim DH. Ponciretin attenuates ethanol-induced gastric damage in mice by inhibiting inflammatory responses[J]. Int Immunopharmacol, 2017, 43:179-186.
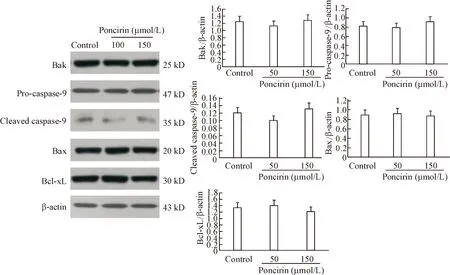
Figure 4. The effects of poncirin on intrinsic apoptosis pathway in AGS cells determined by Western blot analysis. The cells were incubated with different concentrations (0, 50 and 150 μmol/L) of poncirin for 48 h. Mean±SD.n=3.
图4Westernblot检测不同浓度枸橘苷对AGS胃癌细胞中内源性凋亡途径的影响
[12] 王道庆. 柑橘皮渣中黄酮类化合物的生物活性研究[D]. 重庆: 重庆工商大学, 2012.
[13] 张 强, 赵新淮. 黄酮和黄酮醇诱导人食管癌细胞周期停滞的分子机制[J]. 生物化学与生物物理进展, 2008, 35(9):1031-1038.
[14] 李 凌. 黄酮与过氧化氢对人角膜内皮细胞凋亡的作用研究及黄酮抗氧化分子机理初探[D]. 青岛: 中国海洋大学, 2006.
[15] 焦延娜, 韩淑燕. 抗癌中药单体对肿瘤细胞自噬的调控[J]. 中国实验方剂学杂志, 2017, 23(7):206-214.
[16] Timucin AC, Basaga H. Pro-apoptotic effects of lipid oxidation products: HNE at the crossroads of NF-κB pathway and anti-apoptotic Bcl-2[J]. Free Radic Biol Med, 2017, 111:209-218.
[17] Xu H, Zhao X, Liu X, et al. Antitumor effects of traditional Chinese medicine targeting the cellular apoptotic pathway[J]. Drug Des Devel Ther, 2015, 9:2735-2744.
[18] Bates DJ, Lewis LD. Manipulating the apoptotic pathway: potential therapeutics for cancer patients[J]. Br J Clin Pharmacol, 2013, 76(3):381-395.
[19] 余 卫, 张 洹. 细胞周期与细胞凋亡共同的调控分子——Survivin蛋白(综述)[J]. 暨南大学学报: 自然科学与医学版, 2003, 24(6):41-45.
[20] 李金萍, 谢大兴, 冯永东, 等. 细胞周期特异性细胞凋亡的形态学观察[J]. 中国组织化学与细胞化学杂志, 2005, 14(5):521-524.
[21] 高 俊, 陈洪雷. Caspase-3、PARP蛋白在肺癌组织中的表达及临床意义[J]. 数理医药学杂志, 2006, 19(1):34-36.
[22] 李玉莉, 胡静姿, 刘惠敏, 等. Bcl-2、Bcl-xL和Bax蛋白在结直肠癌中的表达[J]. 癌变·畸变·突变, 2007, 19(1):53-55.
(责任编辑: 林白霜, 罗 森)
Inhibitory effect of poncirin on viability of gastric cancer cells and underlying mechanism
ZHANG Wei, LI Zhong
(Zhang Zhongjing College of Traditional Chinese Medicine, Nanyang Institute of Technology, Nanyang 473004, China. E-mail: lizhong7011@sina.com)
AIM: To explore the effect of poncirin on the growth of AGS gastric cancer cells and the underlying mechanism.METHODS: The effect of poncirin on AGS cell viability was measure by MTT assay. The cell cycle distribution and cell apoptosis were analyzed by flow cytometry. Nuclear staining with DAPI was used to reflect the morphological change of the AGS cells treated with poncirin. The protein levels of extrinsic apoptosis pathway-related proteins such as FasL, caspase-8, caspase-3 and PARP, and mitochondria-mediated intrinsic apoptosis pathway-associated proteins such as Bak, Bcl-xL, Bax and caspase-9 were determined by Western blot.RESULTS: Poncirin inhibited the viability of AGS gastric cancer cells in a time- and concentration-dependent manner (P<0.05). Poncirin induced accumulation of G1DNA content and significantly increased total apoptosis in the AGS cells. Nuclear staining showed a dose-dependent increase in the number of apoptotic cells after treated with poncirin.The protein level of FasL was upregulated in a dose-dependent manner by treatment with poncirin. Poncirin significantly activated caspase-8 and caspase-3. Moreover, poncirin significantly induced the cleavage of PARP in a dose-dependent manner (P<0.05). In addition, the protein levels of Bcl-xL, Bax and Bak were unchanged after treated with different doses of poncirin. Furthermore, caspase-9 was not activated by poncirin treatment in the AGS cells.CONCLUSION: Poncirin has the anti-cancer effect via extrinsic apoptosis pathway to inhibit the growth of AGS gastric cancer cells, possibly making it a therapeutic agent for human gastric cancer treatment.
Poncirin; Gastric cancer cells; Apoptosis
1000- 4718(2017)09- 1637- 06
2017- 05- 15 [
] 2017- 07- 20
R735.2; R965
A
10.3969/j.issn.1000- 4718.2017.09.017
△通讯作者 Tel: 0377-62071303; E-mail: lizhong7011@sina.com
