Pim-1激酶抑制剂SMI-4a抑制U937细胞增殖并诱导凋亡*
2017-09-22范蕊芳邹丽媛郝秀兰卢佩梅曾军荣蔡东兰刘相富
范蕊芳, 邹丽媛, 郝秀兰, 卢佩梅, 曾军荣, 蔡东兰, 刘相富
(中山大学附属第三医院 1预防保健科, 2产科, 3输血科, 广东 广州 510630)
Pim-1激酶抑制剂SMI-4a抑制U937细胞增殖并诱导凋亡*
范蕊芳1, 邹丽媛1, 郝秀兰2, 卢佩梅1, 曾军荣1, 蔡东兰1, 刘相富3△
(中山大学附属第三医院1预防保健科,2产科,3输血科, 广东 广州 510630)
目的: 研究丝/苏氨酸蛋白激酶Pim-1抑制剂SMI- 4a对人类急性髓系白血病细胞株U937的生长抑制、促凋亡作用及其可能机制。方法: CCK-8法检测不同浓度SMI- 4a作用不同时间对U937细胞的生长抑制率;Annexin V-PI及Hoechst 33342染色法检测SMI- 4a作用前后细胞凋亡情况,集落形成实验检测SMI- 4a对U937细胞集落形成能力的影响;Western blot法检测SMI- 4a对U937细胞核及细胞浆内β-catenin表达变化及细胞内凋亡相关蛋白的表达变化;免疫荧光法检测β-catenin在细胞内的表达变化。结果: CCK-8结果显示SMI- 4a可以抑制U937细胞的活力,并呈时间和剂量依赖性;Annexin V-PI及Hoechst 33342染色结果显示SMI- 4a可以促进U937细胞凋亡;集落形成实验证实SMI- 4a可以抑制U937细胞的集落形成能力;Western blot实验结果显示SMI- 4a 作用于U937细胞48 h后细胞浆内的β-catenin表达增加,细胞核内的β-catenin表达减少,细胞内促凋亡蛋白Bax和PARP表达增强,抑凋亡蛋白Bcl-2表达明显减弱;免疫荧光进一步验证了SMI- 4a 作用后的U937细胞核内的β-catenin表达量明显减少。结论: SMI- 4a诱导U937细胞凋亡是通过上调促凋亡基因的表达、下调凋亡抑制基因的表达来实现的。
Pim-1激酶; SMI- 4a; 急性髓细胞白血病; 细胞凋亡
Pim-1激酶是一种丝/苏氨酸蛋白激酶,其编码基因pim-1最早是作为莫洛尼小鼠白血病病毒的前病毒插入点而被发现的[1]。Pim-1的异常表达可以阻断多种凋亡诱导通路,使得异常细胞得以存活,同时还可以干扰细胞周期的正常调控,诱发染色体分离失败及多倍性出现,最终形成各种恶性肿瘤[2]。Pim-1对正常造血细胞和造血系统恶性肿瘤细胞的增殖和分化均有重要调节作用[3- 4],靶向Pim-1为我们提供了一个治疗血液系统恶性肿瘤的新策略。SMI- 4a为选择性Pim-1小分子抑制剂,研究表明SMI- 4a在体内和体外均能显著抑制Pim-1活性,SMI- 4a既可以通过抑制H3磷酸化进而抑制RNA合成,又可以通过降低4EBP1的磷酸化水平而抑制蛋白质的翻译过程[5]。此外,SMI- 4a可以调节多种信号转导通路,诱导肿瘤细胞的凋亡[6]。本课题主要研究SMI- 4a对人类急性髓系白血病(acute myeloid leukemia,AML)细胞株U937的生长抑制、诱导凋亡作用,检测SMI- 4a对β-catenin在细胞内转位的影响及其下游相关蛋白表达情况,探讨SMI- 4a可能的抗白血病作用机制。
材料和方法
1主要试剂
SMI- 4a和Hoechst 33342购自Sigma;胎牛血清和RPMI-1640培养基购自Hyclone;CCK-8试剂盒购自Dojindo;Annexin V-PI凋亡检测试剂盒购自南京凯基公司;细胞浆与细胞核蛋白提取试剂盒购自碧云天;各种 I 抗购自Cell Signaling Technology;HRP标记的 II 抗购自 Protein Group;Alexa Fluor 594荧光Ⅱ抗购自Invitrogen;甲基纤维素购自R&D;其它生化试剂为进口分装或国产分析纯产品。
2主要方法
2.1细胞培养 U937细胞株为中山大学附属第三医院血液科实验室保存,使用含有10%胎牛血清的RPMI-1640培养液于5% CO2、37 ℃、饱和湿度条件培养箱中培养,取对数生长期细胞进行实验并根据实验需要分组。
2.2CCK-8法检测药物对U937细胞活力的影响 U937细胞培养于96孔板,分别给予不同浓度 (0、5、10、20、40、60和80 μmol/L) 的SMI- 4a作用24和48 h,从急性髓系白血病患者骨髓提取单个核细胞,健康志愿者外周血提取单个核细胞稀释后按照每孔1×104细胞培养于96孔板中,加入上述浓度SMI- 4a作用24 h,检测前每孔加入10 μL CCK-8溶液, 继续孵育4 h,于 450 nm 波长的酶标仪测定吸光度值。
2.3Annexin V-PI法检测细胞凋亡 收集细胞后予PBS洗涤2次,1 000 r/min 离心 5 min,将细胞重悬于500 μL的binding buffer,先后加入5 μL Annexin V-FITC 和5 μL PI,轻轻混匀,避光放置15 min,上流式细胞仪检测细胞凋亡情况,实验重复3次。
2.4细胞凋亡的形态学观察 收集细胞后予PBS洗涤1次,加入Hoechst 33342(10 mg/L)染液500 μL,混匀后置于37 ℃ 水浴锅中孵育15 min,PBS洗涤3次,在有紫外光的荧光显微镜下观察,并随机拍照,计数凋亡细胞的数量,实验重复3次。
2.5甲基纤维素集落形成实验 将空白对照(control)组及药物处理后的U937细胞培养于甲基纤维素中,5% CO2、37 ℃、饱和湿度条件培养箱中培养1周后观察集落形成情况。
2.6Western blot检测细胞相关蛋白的表达 收集细胞后加入细胞裂解液充分裂解细胞,离心取上清即为细胞内总蛋白,考马斯亮蓝法测定蛋白浓度,细胞浆与细胞核蛋白提取试剂盒提取细胞浆与细胞核蛋白,BCA法测定蛋白浓度,等量蛋白上样,8%~12% SDS-PAGE 进行蛋白分离,将蛋白转移至硝酸纤维素膜,TBST洗涤1次,丽春红染色后置于5% 牛血清白蛋白封闭液中封闭1 h,加入相应 I 抗孵育4 ℃ 过夜,TBST洗涤3次后加入 II 抗孵育1 h,于暗室中曝光。β-actin作为胞浆蛋白的内参照,组蛋白H3作为核蛋白的内参照。
2.7免疫荧光法检测细胞核内β-catenin的表达变化 收集细胞后用PBS洗涤1次,离心,PBS重悬调整细胞浓度为1.0×109/L,甩片,4% 多聚甲醛固定,4 ℃ 放置固定40 min,然后加入0.1% Triton X-100破膜,室温下用3% BSA封闭1 h;PBS洗涤后用3% BSA稀释 I 抗(1∶40),4 ℃ 孵育过夜,PBS洗3次后滴加荧光标记的 II 抗,室温避光孵育1 h。把Hoechst (1 000×)用PBS稀释,每片50 μL,避光染色10 min,用PBS洗3次后封片(mounting medium),拍照。
3统计学处理
使用SPSS 17.0 统计软件分析数据,数据均采用均数±标准差(mean±SD)表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,方差齐时,组间多重比较采用LSD-t检验,方差不齐,组间多重比较采用秩和检验,以P<0.05 为差异有统计学意义。
结 果
1SMI-4a对U937细胞活力的抑制作用
CCK-8法检测结果显示,经5、10、20、40、60和80 μmol/L的SMI- 4a作用24和48 h后U937细胞的活力与对照组相比均显著降低(P<0.01),并可见SMI- 4a对U937细胞的生长抑制作用呈时间和剂量依赖性,见图1A。不同浓度的SMI- 4a作用于AML患者原代细胞24 h后细胞活力均显著低于同浓度的SMI- 4作用于正常人外周血单个核细胞24 h后的细胞活力(P<0.05或P<0.01),表明SMI- 4a对AML患者原代细胞活力的抑制作用明显大于对正常人外周血单个核细胞活力的抑制作用,见图1B。
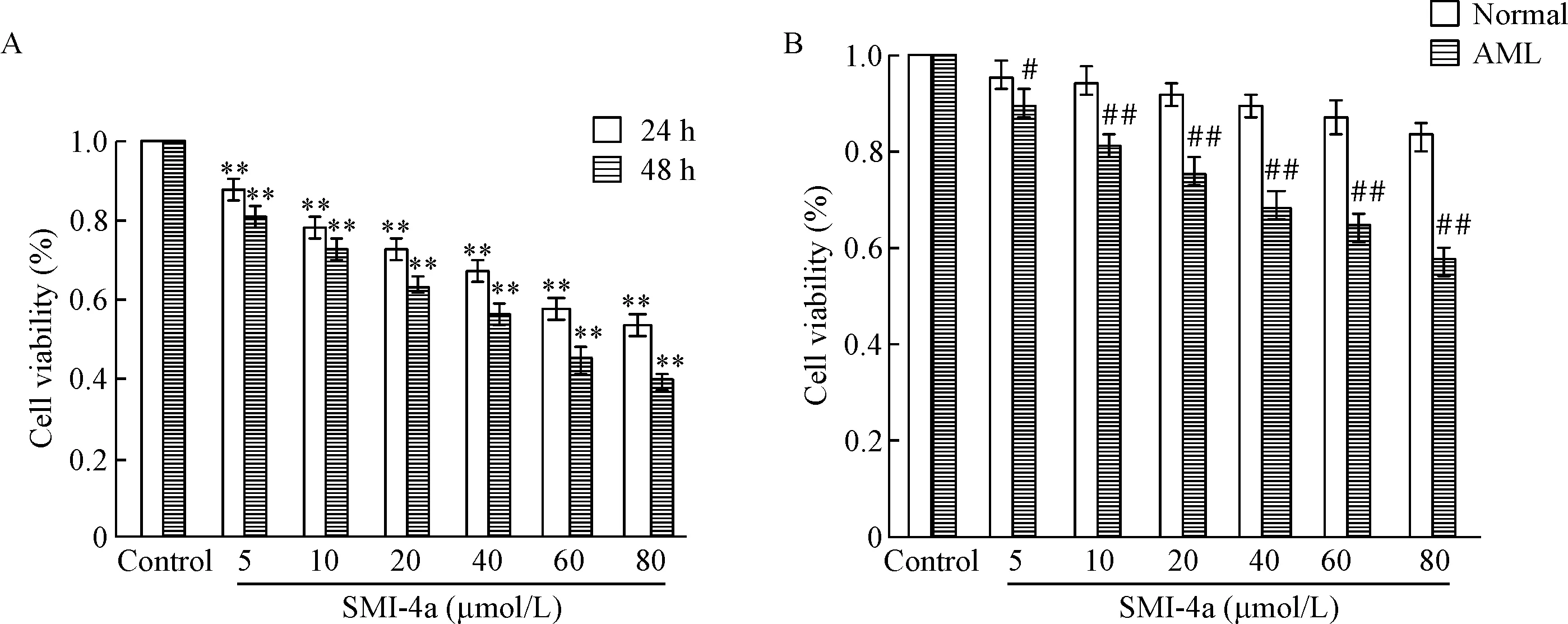
Figure 1. SMI- 4a inhibited the viability of AML cells. A: U937 cells were treated with various concentration of SMI- 4a for 24 h and 48 h; B: mononuclear cells in bone marrow from the patients with AML and peripheral blood mononuclear cells from normal individuals were exposed to different concentrations of SMI- 4a for 24 h. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsnormal group.
图1SMI-4a抑制AML细胞活力
2SMI-4a诱导U937细胞凋亡
Annexin V-PI双染流式细胞术检测结果显示,与对照组相比,20、40和80 μmol/L的SMI- 4a作用于U937细胞24和48 h的凋亡率均显著升高(P<0.05或P<0.01),可见SMI- 4a可以诱导U937细胞凋亡,见图2A。Hoechst 33342染色结果显示,20、40和80 μmol/L的SMI- 4a处理了48 h的U937细胞,可以在显微镜下观察到部分细胞核碎裂,计数100个细胞,凋亡率均显著高于对照组(P<0.01),进一步证实SMI- 4a可以诱导U937细胞凋亡,见图2B。
3SMI-4a抑制U937细胞集落形成
甲基纤维素集落形成实验结果显示,经过7 d培养,20和40 μmol/L SMI- 4a处理过的细胞集落形成率均显著低于对照组(P<0.01),而80 μmol/L SMI- 4a组未见集落形成,提示SMI- 4a可以抑制U937细胞的集落形成能力,见图3。
4SMI-4a对U937细胞内相关蛋白表达的影响
Western blot实验结果显示20、40和80 μmol/L的SMI- 4a作用于U937细胞48 h后,与对照组相比, PARP和Bax蛋白的表达增加,Bcl-2蛋白的表达下降,细胞浆内的β-catenin逐渐增加,细胞核内的β-catenin逐渐减少,说明SMI- 4a可以抑制U937细胞内β-catenin的转位,见图4。免疫荧光实验进一步验证了SMI- 4a处理过的U937细胞核内β-catenin荧光表达量逐渐减少,见图5。
讨 论
急性髓系白血病是一种多基因异常所致的造血干细胞克隆性疾病,其生物学行为主要包括癌基因及抑癌基因的突变、各种生长因子及其受体的异常,这些异常引起其下游信号传导通路的改变从而影响细胞的生长与分化,导致肿瘤的发生[7]。随着新药的不断研发、治疗方案和策略的逐渐优化、支持治疗条件的改善,急性髓系白血病的治疗效果明显提高,但仍有70%左右获得缓解的患者最终复发并演变为难治性白血病,导致治疗失败而死亡[8]。白血病化疗失败最重要的原因是白血病细胞耐药,因此,寻找新的分子靶点,对于提高急性髓系白血病的疗效,改善其预后具有重要的临床意义。
Pim激酶是一种丝/苏氨酸激酶[9]。慢性髓细胞白血病、非霍奇金淋巴瘤和急性髓系白血病患者中Pim激酶的表达接近正常的3倍,在慢性淋巴细胞白血病患者细胞内Pim mRNA的水平接近正常的2倍[10-11];在套细胞淋巴瘤患者中Pim激酶高表达与不良预后有关[12]。在持续表达酪氨酸激酶活性的白血病(TEL/JAK2、BCR/ABL、H4/PDGFβR)中Pim-1和Pim-2激酶的表达水平明显升高,敲除pim-1可以明显抑制这些白血病细胞的生长[4]。
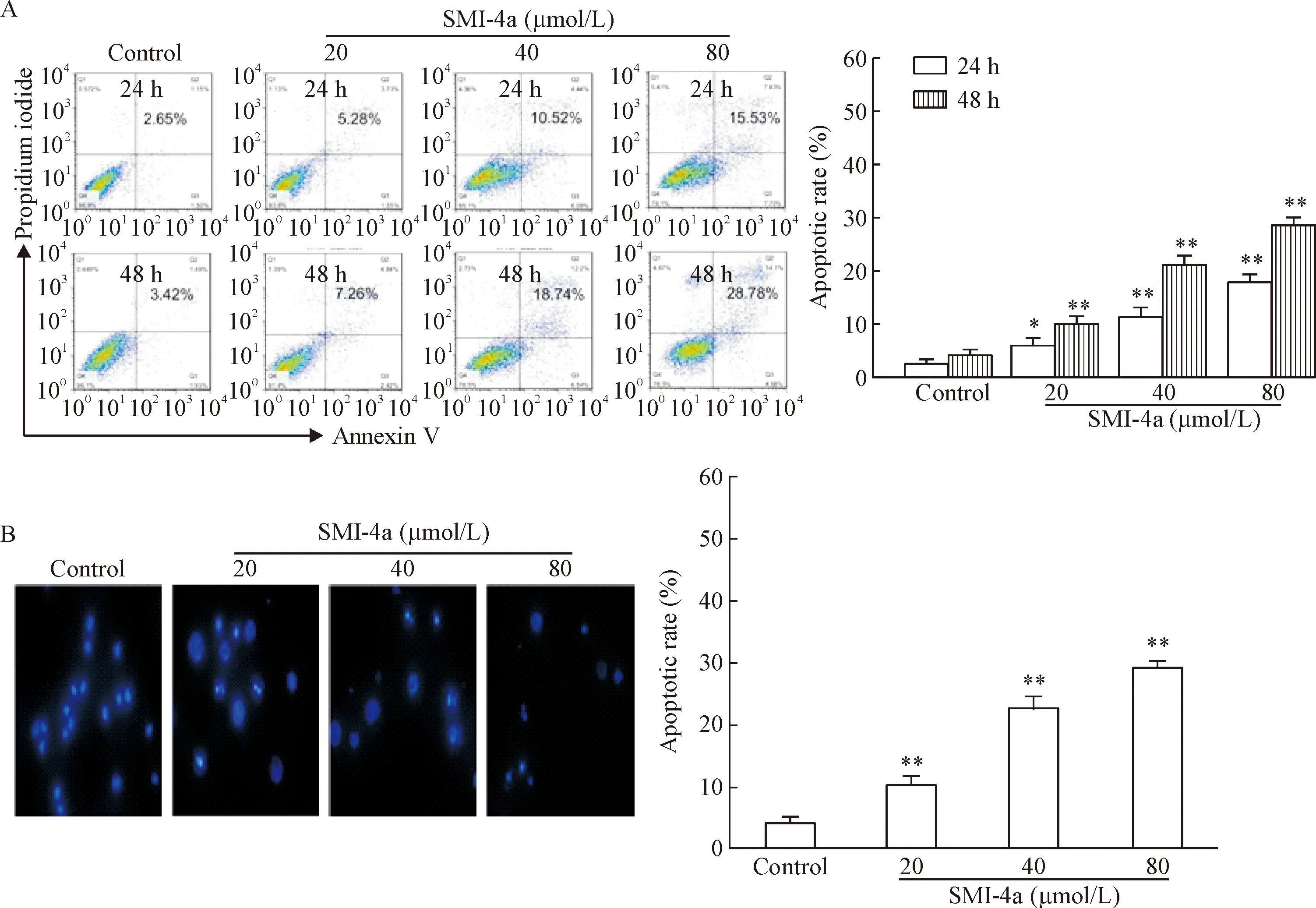
Figure 2. SMI- 4a induced apoptosis in the U937 cells. A: U937 cells treated with SMI- 4a were stained with Annexin Ⅴ-PI and subjected to flow cytometry analysis; B: U937 cells treated SMI- 4a for 48 h were stained with Hoechst 333342 and examined under a fluorescence microscope (×400). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2SMI-4a诱导U937细胞凋亡
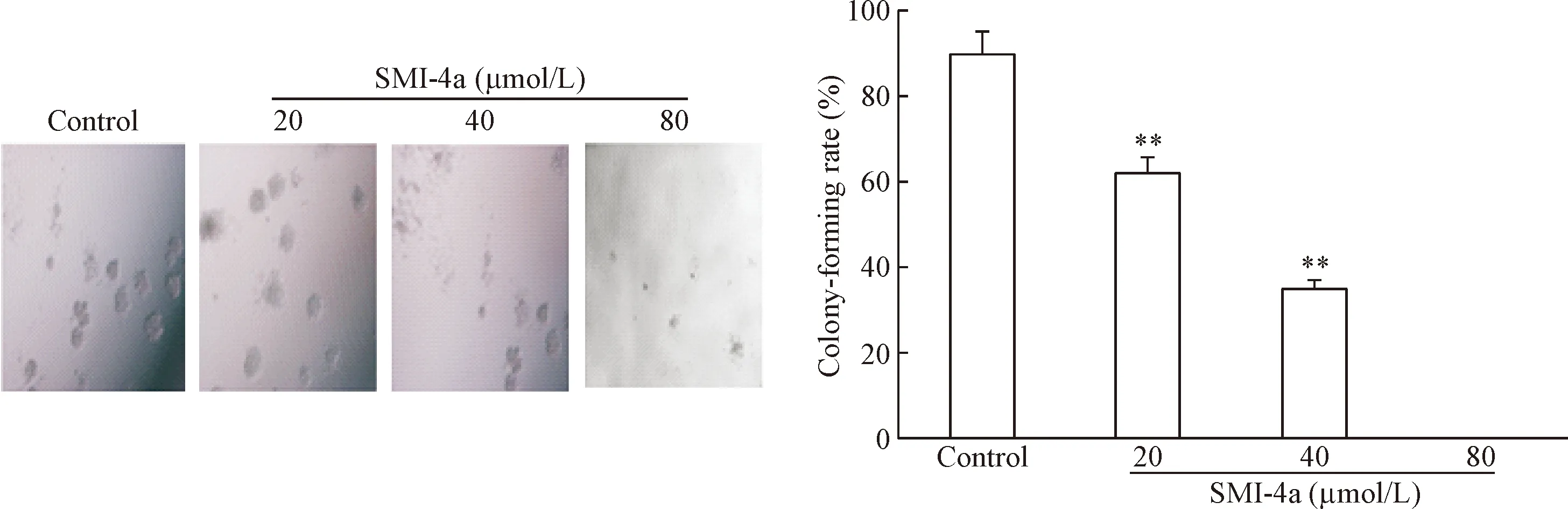
Figure 3. SMI- 4a reduced colony formation capacity of AML cells. U937 cells treated with various concentrations of SMI- 4a were incubated in methylcellulose culture for 1 week and observed under microscope (×200). Mean±SD.n=3.**P<0.01vscontrol group.
图3SMI-4a抑制U937细胞集落形成能力
SMI- 4a是Pim-1激酶的小分子抑制剂,在体内外均可显著抑制Pim-1激酶活性。我们研究表明随着SMI- 4a药物浓度的增加,U937细胞的活力受到不同程度地抑制,这种抑制作用呈时间和剂量依赖性,而对正常人外周血单个核细胞的活力无明显抑制作用。Annexin V-PI和Hoechst检测结果均证实SMI- 4a可以诱导U937细胞凋亡,随着药物浓度增加及作用时间延长,SMI- 4a诱导凋亡作用越来越明显,Wes-tern blot实验结果显示随着SMI- 4a药物浓度的增加,PARP和Bax的蛋白表达量是逐渐增加的,而Bcl-2的表达逐渐减少,考虑SMI- 4a可能是通过线粒体途径诱导细胞凋亡,与文献报道一致[11]。β-catenin的转位对于Wnt/β-catenin这条信号转导通路的激活至关重要,我们检测不同浓度SMI- 4a作用于U937细胞后细胞浆和细胞核内β-catenin表达水平的变化,发现随着SMI- 4a浓度的增加,U937细胞浆内β-catenin表达水平逐渐增加,而细胞核内β-catenin表达水平逐渐降低,免疫荧光检测结果证实SMI- 4a作用后细胞核内β-catenin表达量明显减少,说明SMI- 4a对β-catenin的转位有影响,SMI- 4a是否通过抑制β-catenin转位进而调节凋亡相关基因的表达尚需进一步实验验证。
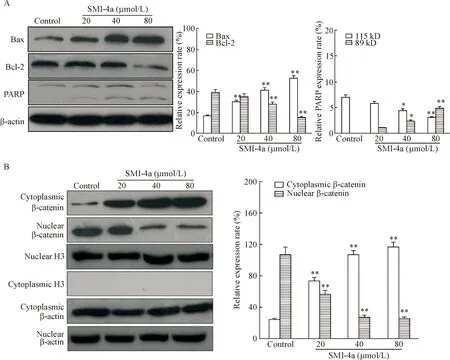
Figure 4. The effects of SMI- 4a on the protein expression in the U937 cells. A: the effects of SMI- 4a on the expression of apoptosis-related proteins; B: the effects of SMI- 4a on the expression of β-catenin in the cytosol and nucleus of U937 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图4SMI-4a对U937细胞内蛋白表达的影响
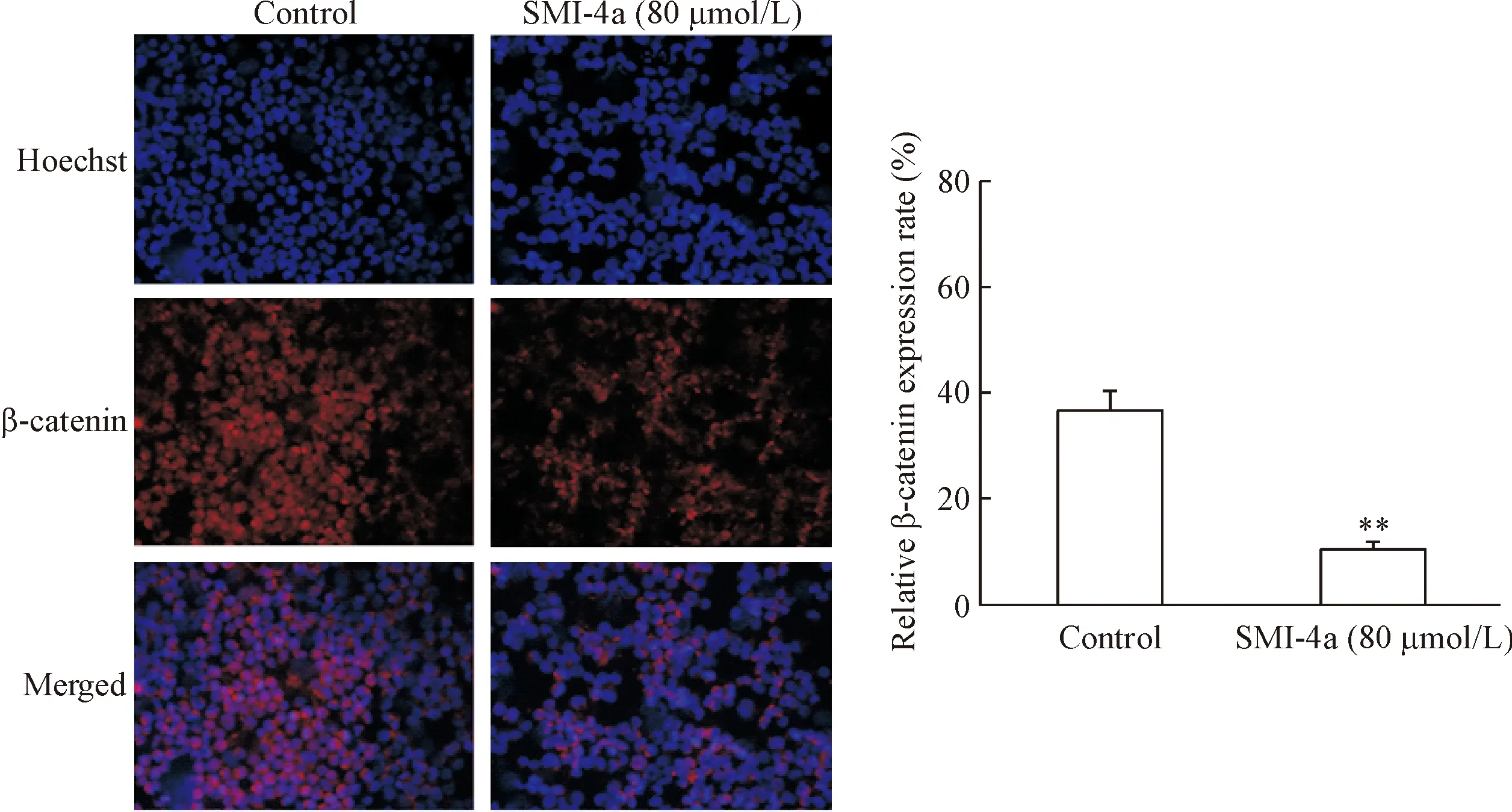
Figure 5. The expression of β-catenin in U937 cells. U937 cells were treated with 80 μmol/L SMI- 4a for 48 h and the expression level of β-catenin was examined by immunofluorescence (×400). Mean±SD.n=3.**P<0.01vscontrol group.
图5SMI-4a对U937细胞核内β-catenin表达的影响
本研究初步证实,SMI- 4a可以抑制U937细胞生长并诱导其凋亡。这将为单用或者联合化疗药物治疗急性髓系白血病提供理论基础,为临床提供新的治疗选择。
[1] Tursynbay Y, Zhang J, Li Z, et al. Pim-1 kinase as can-cer drug target: An update [J]. Biomed Rep, 2016, 4(2):140-146.
[2] Beharrya Z, Mahajanb S, Zemskovac M, et al. The Pim protein kinases regulate energy metabolism and cell growth [J]. Proc Natl Acad Sci USA, 2011, 108(2): 528-533.
[3] Linowes BA, Ligons DL, Nam AS, et al. Pim1 permits generation and survival of CD4+T cells in the absence of γc cytokine receptor signaling[J]. Eur J Immunol, 2013, 43(9):2283-2294.
[4] Adam M, Pogacic V, Bendit M, et al. Targeting PIM kinases impairs survival of hematopoietic cells transformed by kinase inhibitor-sensitive and kinase inhibitor-resistant forms of Fms-like tyrosine kinase 3 and BCR/ABL [J]. Cancer Res, 2006, 66(7):3828-3835.
[5] Yang J, Wang J, Chen K, et al. eIF4B phosphorylation by Pim kinases plays a critical role in cellular transformation byAbloncogenes[J]. Cancer Res, 2013, 73(15):4898- 4908.
[6] Foulks JM, Carpenter KJ, Luo B, et al. A small-molecule inhibitor of PIM kinases as a potential treatment for urothelial carcinomas[J]. Neoplasia, 2014, 16(5):403- 412.
[7] Hospital MA, Green AS, Maciel TT, et al. FLT3 inhibitors: clinical potential in acute myeloid leukemia[J]. Onco Targets Ther, 2017, 10:607-615.
[8] Hackl H, Astanina K, Wieser R. Molecular and genetic alterations associated with therapy resistance and relapse of acute myeloid leukemia[J]. J Hematol Oncol, 2017, 10(1):51.
[9] 孙晓东, 王 燕, 王汉琴, 等. STAT3介导了血小板源性生长因子BB诱导的大鼠血管平滑肌细胞Pim-1表达[J]. 中国病理生理杂志, 2013, 29(5):804-809.
[10] Chen LS, Redkar S, Bearss D, et al. Pim kinase inhibitor, SGI-1776, induces apoptosis in chronic lymphocytic leukemia cells[J]. Blood, 2009, 114(19):4150- 4157.
[11] Lin YW, Beharry ZM, Hill EG, et al. A small molecule inhibitor of Pim protein kinases blocks the growth of precursor T-cell lymphoblastic leukemia/lymphoma[J]. Blood, 2010, 115(4):824-833.
[12] Gómez-Abad C, Pisonero H, Blanco-Aparicio C, et al. PIM2 inhibition as a rational therapeutic approach in B-cell lymphoma [J]. Blood, 2011, 118(20): 5517-5527.
(责任编辑: 陈妙玲, 罗 森)
Pim-1 kinase inhibitor SMI- 4a inhibits proliferation and induces apoptosis in U937 cells
FAN Rui-fang1, ZOU Li-yuan1, HAO Xiu-lan2, LU Pei-mei1, ZENG Jun-rong1, CAI Dong-lan1, LIU Xiang-fu3
(1Prevention Department of Health,2Department of Obstetrics,3Department of Blood Transfusion, The Third Affiliated Hospital, Sun Yat-sen University, Guangzhou 510630, China. E-mail: etoly@163.com)
AIM: To study the growth-inhibiting and proapoptotic effects of Pim-1 kinase inhibitor SMI- 4a on human acute myeloid leukemia cell line U937.METHODS: The effect of SMI- 4a on U937 cell viability was measured by CCK-8 assay. The apoptotic rate was assessed by flow cytometry with Annexin V-PI staining and by fluorescence microscopy with Hoechst 33342 staining. Methylcellulose was used to assess colony formation ability of the cells. The expression of β-catenin in the cell cytosol and nucleus was detected by Western blot, and the expression of apoptosis-related proteins in the U937 cells was also examined. Intracellular distribution of β-catenin was detected by the method of immunofluorescence.RESULTS: SMI- 4a inhibited the viability of U937 cells. Annexin V-PI staining showed that SMI- 4a induced apoptosis in dose- and time-dependent manners. Hoechst 33342 staining also verified the apoptosis. SMI- 4a significantly inhibited the colony formation capacity of the U937 cells. The results of Western blot demonstrated that SMI- 4a upregulated the expression of PARP and Bax, downregulated the expression of Bcl-2 and change the distribution of β-catenin in intracellular compartment. Immunofluorescence observation found that SMI- 4a decreased the expression level of β-catenin in the U937 cells.CONCLUSION: SMI- 4a induces U937 cell apoptosis through regulating the expression of apoptosis-related genes.
Pim-1 kinase; SMI- 4a; Acute myeloid leukemia; Apoptosis
1000- 4718(2017)09- 1625- 06
2017- 03- 07 [
] 2017- 06- 07
广东省科技计划(No. 2011B2080701008)
R733.7; R363
A
10.3969/j.issn.1000- 4718.2017.09.015
△通讯作者 Tel: 020-85252234; E-mail: etoly@163.com
