沉默吲哚胺2,3-双加氧酶2基因对黑色素瘤细胞B16-BL6增殖、迁移和侵袭的影响*
2017-09-22曾小平晏颂欣刘燕玲周慧蓉徐方云王红梅
曾小平, 肖 楚, 晏颂欣, 刘燕玲, 周慧蓉, 徐方云, 潘 意, 王红梅△
(1南昌大学基础医学院, 2江西科技学院, 江西 南昌 330006)
沉默吲哚胺2,3-双加氧酶2基因对黑色素瘤细胞B16-BL6增殖、迁移和侵袭的影响*
曾小平1, 肖 楚1, 晏颂欣1, 刘燕玲2, 周慧蓉1, 徐方云1, 潘 意1, 王红梅1△
(1南昌大学基础医学院,2江西科技学院, 江西 南昌 330006)
目的: 探讨沉默吲哚胺2,3-双加氧酶2(IDO2)基因对小鼠黑色素瘤B16-BL6细胞增殖、迁移及侵袭等生物学行为的影响。方法: IDO2-siRNA转染体外培养的黑色素瘤细胞B16-BL6,应用real-time PCR和Western blot检测IDO2和IDO1基因的表达;平板集落形成实验检测IDO2基因沉默对肿瘤细胞增殖的影响;细胞划痕实验和Transwell小室细胞迁移实验观察IDO2对肿瘤细胞迁移的影响;Transwell小室侵袭实验观察肿瘤细胞侵袭能力。结果: 沉默B16-BL6细胞中IDO2基因能使细胞单集落形成密度降低,划痕迁移变慢, Transwell小室细胞迁移数减少,侵袭细胞数减少。结论: 沉默IDO2可以影响黑色素瘤细胞B16-BL6的增殖、迁移和侵袭能力。
吲哚胺2,3-双加氧酶2; 黑色素瘤; 细胞迁移; 细胞侵袭
近年来的研究发现,肿瘤细胞、免疫细胞如树突状细胞等能产生一种重要的免疫负调节因子——吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO;现又称为IDO1),它可以使肿瘤逃避免疫系统的监控,改变肿瘤侵袭和转移能力,影响树突状细胞疫苗的临床治疗效果[1]。IDO1于1963年首次在兔的肠道中被发现,是色氨酸沿犬尿酸代谢途径的第一步限速酶[2-3]。Mellor等[4]发现IDO1能减少细胞微环境中的色氨酸水平,即引起“色氨酸饥饿”,从而选择性降低抗原依赖的T细胞活性。此外色氨酸的代谢产物如3-羟基氨基苯甲酸、犬尿素和喹啉也能导致T细胞抑制和死亡,IDO1还可以介导调节性T细胞形成从而引起肿瘤免疫逃逸[5]。2007年在人及小鼠体内发现一种新的具有IDO1样活性的酶,被称为吲哚胺2,3-双加氧酶2(indoleamine 2,3-dioxyge-nase 2,IDO2),此酶也可以分解色氨酸,是IDO1的同源蛋白,且结构上与IDO1有43%相似,其基因紧邻IDO1基因的下游,位于人和小鼠的第8号染色体上[6]。由于IDO2分子发现的时间较晚,它的许多生物学特性及免疫抑制的机制还未阐明,但却表现出比IDO1更强的抑制T细胞的抗肿瘤作用。同时IDO2对肿瘤本身生长、转移和侵袭的作用仍不清楚。本研究通过筛选获得高表达IDO2基因的小鼠黑色素瘤细胞B16-BL6,应用RNA干扰技术特异性沉默IDO2后观察B16-BL6细胞生物学特性的变化,探讨IDO2对肿瘤细胞的生长调控作用。
材料和方法
1材料与主要试剂
小鼠黑色素瘤细胞B16-BL6购自American Type Culture Collection (ATCC);RPMI-1640培养基和胎牛血清购自HyClone; 胰蛋白酶购自Gibco;IDO2-siRNA和GL2-siRNA(control siRNA)购自Sigma;qPCR引物由上海拜力生物科技有限公司合成;SYBR Premix Ex Taq I kit购自TaKaRa;Transwell小室购自BD Biosciences;Lipofectamine 2000购自Invitrogen。
2方法
2.1IDO2-siRNA转染B16-BL6细胞 小鼠黑色素瘤B16-BL6细胞常规复苏后,用含10% 胎牛血清的RPMI-1640完全培养液重悬,置于细胞培养箱中37 ℃、5% CO2条件下培养,隔天换液,待细胞长至90%左右融合用0.25%的胰蛋白酶消化传代。取生长良好的细胞均匀铺板于12孔细胞培养板中,待细胞融合度达70%左右时按照Lipofectamine 2000的说明书进行转染。4 h后换成含10%胎牛血清的RPMI-1640完全培养液继续培养。细胞实验分为未处理组、转染GL2-siRNA(control siRNA)的阴性对照组和转染IDO2-siRNA实验组。
2.2Real-time PCR和Western blot检测B16-BL6细胞中siRNA对IDO1和IDO2的沉默效果 收集转染后48 h的细胞,用Trizol试剂盒提取各组总mRNA, M-MLV 逆转录系统反转录成cDNA。SYBR Premix Ex Taq I kit及ABI 7500荧光定量PCR仪进行qPCR扩增和分析。IDO1的上游引物序列为5’- GGGCTTTGCTCTACCACATCCACT-3’,下游引物序列为5’-ACATCGTCATCCCCTCGGTTCC-3’,产物为234 bp;IDO2的上游引物序列为5’-TGCCTGATGGCCTATAACCAGTGT-3’,下游引物序列为5’-TGCAGGATGTGAACCTCTAACGCT-3’,产物为306 bp;GAPDH的上游引物序列为5’-GGGGTGAGGCCGGTGCTGAGTAT-3’, 下游引物序列为5’-CATTGGGGTAGGAACACGGAAGG-3’ 。反应条件为: 95 ℃ 10 min; 95 ℃ 30 s, 60 ℃ 45 s, 72 ℃ 30 s, 40个循环; 72 ℃延伸10 min。每组样本设3个复孔,取其平均Ct值。以未处理组作参照,IDO1和IDO2的相对表达量用2-ΔΔCt表示。组织裂解液RIPA提取转染48 h的细胞总蛋白,BCA法测蛋白浓度,取50 μg样品进行SDS-PAGE,转至硝酸纤维素膜,分别用相应的抗体孵育,ECL系统曝光显影,胶片进行高清度扫描后收集图像,以凝胶图像灰度处理系统分析。
2.3平板集落形成实验 将各组细胞配成细胞悬液,调整浓度为1×107cells/L,取100 μL细胞悬液接种于作好标记的培养皿中(即每个培养皿接种1 000个细胞),补加培养液至5 mL,置于5% CO2、 37 ℃的细胞培养箱中培养;观察各组细胞平板集落形成情况,在第7天将培养皿中的液体吸出,加PBS清洗2次后,加瑞氏染液的I液1 mL,使其覆盖培养皿中所有的细胞,作用1 min后加入等量或稍多的瑞氏染液的II液轻轻摇匀,作用5 min后用自来水冲洗;晾干后拍照保存。
2.4划痕实验 取24孔板,每孔分别接种每组细胞1×105于1 mL细胞培养液中,置细胞培养箱中培养;24 h后吸出培养液,用10 μL的枪头给每组竖直划痕,力道保持平稳;用PBS缓慢清洗3遍,每孔各加1 mL的细胞培养液,于拍照显微镜下观察拍照后放入细胞培养箱中培养24 h;取出观察细胞迁移情况。
2.5Transwell细胞迁移实验 将各组细胞换成无血清培养液培养12 h去除血清的影响;0.25%的胰蛋白酶消化细胞后用PBS洗1遍,并用10 g/L BSA的无血清培养基重悬。分别调整细胞浓度至1×109cells/L;将Transwell小室架在24孔板上,各小室内分别加入100 μL各组细胞悬液;24孔板的下室各加入500 μL含20%胎牛血清的RPMI-1640培养液;常规培养72 h取出小室,吸出培养液,用PBS淋洗;再用棉签小心擦去上室膜细胞;用瑞氏染液固定染色,倒置显微镜下计数迁移至下室膜上的细胞,每个样本随机取5个视野计数,取平均值。
2.6Transwell细胞侵袭实验 将Matrigel放入4 ℃冰箱过夜(12 h),吸取融化状态的Matrigel 10 μL,加70 μL的10 g/L BSA无血清培养基混合,加入Transwell小室的上室包被基底膜,室温风干成果冻状;吸出残余液体,每孔加入50 μL含10 g/L BSA的无血清培养基水化基底膜,置于37 ℃培养箱中孵育30 min后; 细胞换成无血清培养12 h,消化后离心收集细胞沉淀,用PBS洗1遍,然后用10 g/L BSA的无血清培养基重悬。分别调整细胞浓度至1×109cells/L;将Transwell小室架于24孔板上,各小室内分别加入100 μL各组细胞悬液;24孔板的下室各加入500 μL含20%胎牛血清的RPMI-1640培养液,常规培养96 h;取出小室,吸出培养液,用PBS淋洗;再用棉签小心擦去上室膜细胞;瑞氏染液固定染色,倒置显微镜下计数迁移至下室膜上的细胞,每个样本随机取5个视野计数,取平均值。
3统计学处理
以SPSS 17.0进行统计分析,计量数据以均数±标准差(mean±SD)表示,两组间差异比较采用t检验法,多组间差异的比较用单因素方差分析法。以P<0.05 为差异有统计学意义。
结 果
1siRNA对B16-BL6细胞中IDO2的沉默效果
我们的前期实验比较了不同来源的肿瘤细胞系IDO2的表达情况,筛选出高表达IDO2基因的小鼠黑色素瘤B16-BL6细胞(数据未公布),并且挑选出能有效干扰B16-BL6细胞IDO2表达的siRNA进行转染。应用real-time PCR检测转染细胞中IDO1和IDO2的表达,可见转染IDO2-siRNA后B16-BL6细胞IDO2的表达明显降低,而IDO1并没有受影响,用2-ΔΔCt法计算得到IDO2的沉默效率为67%左右。Western blot检测显示细胞IDO2蛋白表达亦显著减少,见图1。
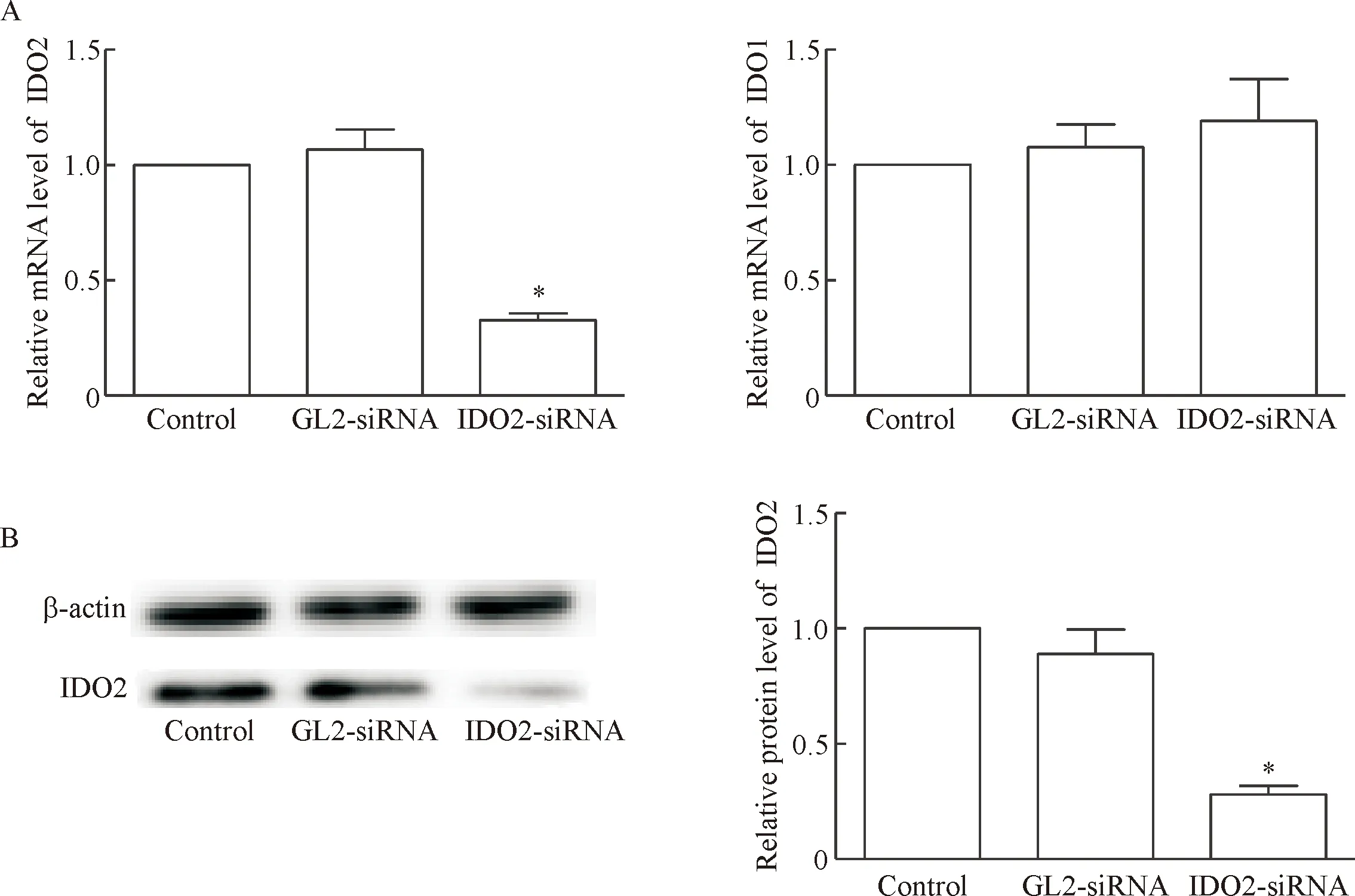
Figure 1. Transfection with IDO2-siRNA decreased IDO2 expression, but the expression of IDO1 in the B16-BL6 cells was not affec-ted. The mRNA expression of IDO2 and IDO1 was detected by real-time PCR (A), and the protein expression of IDO2 was determined by Western blot (B) in the B16-BL6 cells transfected with IDO2-siRNA or GL2-siRNA (control siRNA). Mean±SD.n=4.*P<0.05vsGL2-siRNA group.
图1Real-timePCR和Westernblot检测转染IDO2-siRNA对B16-BL6细胞IDO2和IDO1表达的影响
2细胞平板集落形成实验
通过细胞集落形成实验观察IDO2沉默后细胞的生长情况。经平板集落形成7 d后,各组细胞克隆形成,倒置显微镜拍照,在40倍显微镜下随机取5个视野计算形成的单克隆数,含50个以上细胞形成的集落为一个统计并作图。IDO2-siRNA沉默组较正常对照组及siRNA对照组形成的集落密度和大小都显著减少,各组平均单集落数分别为6.8±0.6、11.8±1.0和10.3±0.7,IDO2沉默组克隆形成数明显减少(P<0.05)。结果提示沉默细胞中的IDO2能抑制B16-BL6细胞的增殖,见图2。
3细胞划痕实验
细胞划痕实验观察经划痕处理后培养24 h细胞迁移情况,计算每组细胞的迁移率=(D0h-D24h)/D0h。正常对照组、siRNA对照组及IDO2-siRNA组细胞的迁移率分别为0.73±0.08、0.70±0.05和0.38±0.04,B16-BL6细胞转染IDO2-siRNA后,与对照组比较细胞迁移率明显下降,差异有统计学意义(P<0.05),见图3。

Figure 2. Transfection with IDO2-siRNA decreased the numbers of colony formation in the B16-BL6 cells (×40). Mean±SD.n=4.*P<0.05vsGL2-siRNA group.
图2细胞的集落形成实验检测转染IDO2siRNA后B16-BL6细胞的集落形成数

Figure 3. The effect ofIDO2 silencing on the migration ability of the B16-BL6 cells detected by the wound healing assay (×100). Mean±SD.n=4.*P<0.05vsGL2-siRNA group.
图3细胞划痕实验检测IDO2基因沉默对B16-BL6细胞迁移能力的影响
4B16-BL6细胞Transwell迁移实验
Transwell迁移实验观察IDO2对B16-BL6细胞迁移能力的改变。正常对照组、siRNA对照组和IDO2沉默组迁移到下室的细胞数分别为90.4±3.7、88.6±5.1和56.2±4.0,差异有统计学意义(P<0.01)。这提示沉默细胞中的IDO2能降低B16-BL6细胞的迁移能力,见图4。
5B16-BL6细胞Transwell侵袭实验
Transwell侵袭实验显示正常对照组、siRNA对照组和IDO2沉默组侵袭到下室的细胞数分别为111.2±10.6、110.8±10.2和44.8±9.6,沉默细胞中的IDO2能降低B16-BL6细胞的侵袭能力,差异有统计学意义(P<0.01),见图5。
讨 论
色氨酸是人体含量最少的必需氨基酸,对维持细胞活化和增殖有重要意义,也是T淋巴细胞保持活性和生存所必需的氨基酸。色氨酸主要是沿犬尿酸通路进行分解,该途径的第一步限速反应为色氨酸氧化生成N-甲酰犬尿酸原,目前发现有3种限速酶能够催化此反应:色氨酸双加氧酶(tryptophan 2,3-dioxygenase,TDO)、IDO1和IDO2。TDO主要存在于肝脏,催化食物来源的色氨酸,受糖皮质激素及左旋色氨酸的诱导[7-8]。IDO1和IDO2是肝脏以外的主要限速酶。尽管IDO2和IDO1一样也是色氨酸代谢的限速酶,但是它们的酶学活性、对底物的亲和力、在哺乳动物和人体内的表达以及免疫学上表现的作用并不完全一致[9];二者表达诱导因素也是不一样,IDO1容易被IFN-γ所诱导,而IDO2却很少被诱导[10]。IDO1和IDO2对T淋巴细胞增殖抑制反应也存在不同的信号通路和不同的免疫调节作用,因而可以认为IDO2与IDO1之间既存在相互联系,又有着不同的作用机制。

Figure 4. The effect ofIDO2 silencing on the migration ability of B16-BL6 cells detected by the Transwell migration assay (×200). Mean±SD.n=4.**P<0.01vsGL2-siRNA group.
图4Transwell小室迁移实验检测IDO2沉默对B16-BL6细胞迁移能力的影响

Figure 5. The effect ofIDO2 silencing on the invasion ability of the B16-BL6 cells detected by the Transwell invasion assay (×200). Mean±SD.n=4.**P<0.01vsGL2-siRNA group.
图5Transwell小室侵袭实验检测IDO2对B16-BL6细胞侵袭能力的影响
IDO2作为免疫负调控因子对T细胞的影响已有部分报导,那么它的表达反过来很可能也影响了肿瘤的某些生长特性。由于IDO2与IDO1结构上存在一定的相似性且有共同的酶学底物,到目前为止还没有一种特异性抑制剂能有效地阻断其酶学活动,因而我们应用RNA干扰技术特异性沉默IDO2、而不影响IDO1表达来研究其对肿瘤生物学活性的影响作用。我们的结果显示沉默IDO2后,黑色素瘤细胞B16-BL6的集落形成数量和大小明显下降,表明其增殖是受抑制的。微环境中色氨酸耗竭以及生成的代谢中间产物可引起细胞增殖受到抑制[11];有研究显示沉默IDO1可以使细胞增殖加快[12]。因而我们推测IDO2对肿瘤细胞的调控可能与IDO1有着不同的机制,并不完全依赖于它的酶活性,或者它的酶活性是在某些条件下才能发挥作用[13]。研究表明肿瘤内虽然有IDO2表达,但通常只有IDO1分解色氨酸,而 IDO2处于失能状态,不影响色氨酸代谢[14]。IDO2是否对肿瘤细胞的侵袭转移能力有影响呢?我们的体外研究结果显示沉默IDO2后,黑色素瘤细胞迁移速度明显减慢,在Transwell侵袭实验中从上室侵袭到下室的细胞也显著减少。研究表明IDO2通过诱导真核细胞转录起始因子2α磷酸化而上调肝脏富含的抑制蛋白的表达,进而调节免疫基因亮氨酸拉链的表达,参与调节细胞增殖和免疫反应,且该过程不能被逆转[15]。应用IDO2抑制剂不仅可以更有效地减小小鼠肿瘤体积,还可以增加肿瘤反应性T细胞的数量,而IDO1抑制剂仅引起荷瘤动物肿瘤体积减小,并且二者发挥不同的免疫调节作用[16],因而IDO2被认为与肿瘤侵袭和远处转移有着更为密切的关系。
[1] Uyttenhove C, Pilotte L, Theate I, et al. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J]. Nat Med, 2003, 9(10):1269-1274.
[2] 岳莉英, 关志明, 裴志强. 内皮源性吲哚胺2,3-双加氧酶抑制周细胞迁移及收缩蛋白表达[J]. 中国病理生理杂志, 2016, 32(2): 256-260.
[3] Yamamoto S, Hayaishi O. Tryptophan pyrrolase of rabbit intestine. D- and L-tryptophan-cleaving enzyme or enzymes[J]. J Biol Chem, 1967, 242(22):5260-5266.
[4] Mellor AL, Munn DH. Tryptophan catabolism and T-cell tolerance: immunosuppression by starvation?[J]. Immunol Today, 1999, 20(10):469-473.
[5] Lee GK, Park HJ, Macleod M, et al. Tryptophan deprivation sensitizes activated T cells to apoptosis prior to cell division[J]. Immunology, 2002, 107(4):452-460.
[6] Schierwater B, de Jong D, Desalle R. Placozoa and the evolution of Metazoa and intrasomatic cell differentiation[J]. Int J Biochem Cell Biol, 2009, 41(2):370-379.
[7] 李娟娟, 李 洋, 杨 青. 人源吲哚胺2,3-双加氧酶-2的表达与纯化[J]. 复旦学报: 医学版, 2016, 43(4):401-408.
[8] 刘燕玲, 王红梅, 闵卫平. 色氨酸2,3-双加氧酶2的生物学特性及其在免疫调节与肿瘤治疗中的作用[J]. 细胞与分子免疫学杂志, 2015, 31(6):856-859.
[9] Merlo LM, Pigott E, DuHadaway JB, et al. IDO2 is a critical mediator of autoantibody production and inflammatory pathogenesis in a mouse model of autoimmune arthritis[J]. J Immunol, 2014, 192(5):2082-2090.
[10] Brooks AK, Lawson MA, Rytych JL, et al. Immunomodulatory factors galectin-9 and interferon-gamma synergize to induce expression of rate-limiting enzymes of the kynurenine pathway in the mouse hippocampus[J]. Front Immunol, 2016, 7:422.
[11] Uyttenhove C, Pilotte L, Théate I, et al. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J]. Nat Med, 2003, 9(10):1269-1274.
[12] Kai S, Goto S, Tahara K, et al. Inhibition of indoleamine 2,3-dioxygenase suppresses NK cell activity and accelerates tumor growth[J]. J Exp Ther Oncol, 2003, 3(6):336-345.
[13] Fatokun AA, Hunt NH, Ball HJ. Indoleamine 2,3-dioxygenase 2 (IDO2) and the kynurenine pathway: characteristics and potential roles in health and disease[J]. Amino Acids, 2013, 45(6):1319-1329.
[14] Löb S, Konigsrainer A, Zieker D, et al. IDO1 and IDO2 are expressed in human tumors: levo- but not dextro-1-methyl tryptophan inhibits tryptophan catabolism[J]. Cancer Immunol Immunother, 2009, 58(1):153-157.
[15] Metz R, Duhadaway JB, Kamasani U, et al. Novel tryptophan catabolic enzyme IDO2 is the preferred biochemical target of the antitumor indoleamine 2,3-dioxygenase inhibitory compound D-1-methyl-tryptophan[J]. Cancer Res, 2007, 67(15):7082-7087.
[16] Hou DY, Muller AJ, Sharma MD, et al. Inhibition of indoleamine 2,3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses[J]. Cancer Res, 2007, 67(2):792-801.
(责任编辑: 林白霜, 罗 森)
Gene silencing of indoleamine 2,3-dioxygenase 2 influences proliferation, migration and invasion of B16-BL6 melanoma cells
ZENG Xiao-ping1, XIAO Chu1, YAN Song-xin1, LIU Yan-ling2, ZHOU Hui-rong1, XU Fang-yun1, PAN Yi1, WANG Hong-mei1
(1Basic Medical College of Nanchang University,2Jiangxi University of Technology, Nanchang 330006, China. E-mail: wanghongmay@hotmail.com)
AIM: To investigate the effects of indoleamine 2, 3-dioxygenase 2 (IDO2) silencing on proliferation, migration and invasion of B16-BL6 melanoma cells.METHODS: IDO2-siRNA was transfected into the B16-BL6 melanoma cellsinvitro. The expression of IDO2 or IDO1 at mRNA and protein levels was detected by real-time PCR and Western blot. Colony formation assay was performed to analyze the proliferation ofIDO2-silencing tumor cells. The migration ability of B16-BL6 cells after silencing ofIDO2 was measured by wound healing assay and Transwell cell migration assay. The invasion ability of the tumor cells was detected by Transwell cell invasion assay.RESULTS: IDO2-siRNA signi-ficantly down-regulated IDO2 expression in B16-BL6 melanoma cells, and did not affect IDO1 expression. Compared with control group, the colony formation ability, the migratory distance measured by wound healing assay, and the migration and the invasion cell numbers detected by Transwell assay all remarkably decreased in theIDO2-silencing cells.CONCLUSION:IDO2 silencing affects the proliferation, migration and invasion abilities of the B16-BL6 melanoma cells.
Indoleamine 2,3-dioxygenase 2; Melanoma; Cell migration; Cell invasion
1000- 4718(2017)09- 1619- 06
2017- 02- 20 [
] 2017- 07- 22
江西省教育厅科学技术研究项目(No. 14090)
R739.5; R363
A
10.3969/j.issn.1000- 4718.2017.09.014
△通讯作者 Tel: 13767004966; E-mail: wanghongmay@hotmail.com
