汉防己甲素对人鼻咽癌CNE1和CNE2细胞株的放疗增敏作用*
2017-09-22常利红陈贤珍吴喜福王志远黄子真黄健聪张革化
王 君, 常利红, 李 霞, 陈贤珍, 吴喜福, 王志远, 黄子真, 黄健聪, 张革化
(中山大学附属第三医院耳鼻咽喉头颈外科,广东 广州 510630)
汉防己甲素对人鼻咽癌CNE1和CNE2细胞株的放疗增敏作用*
王 君, 常利红, 李 霞, 陈贤珍, 吴喜福, 王志远, 黄子真, 黄健聪, 张革化△
(中山大学附属第三医院耳鼻咽喉头颈外科,广东 广州 510630)
目的: 探讨最大非毒性剂量汉防己甲素(tetrandrine,Tet)对人鼻咽癌细胞株CNE1和CNE2的放疗增敏机制。方法: 分别采用最大非毒性剂量Tet (对CNE1细胞为1.5 μmol/L;对CNE2细胞为1.8 μmol/L)、4 Gy放疗和最大非毒性剂量Tet联合放疗处理 CNE1和CNE2细胞;流式细胞术检测各组细胞周期分布,Western blot 检测各组细胞γ-H2AX、cleaved caspase-3、p-CDC25C、CDK1、p-CDK1、cyclin B1、ERK和p-ERK的蛋白水平。结果: 最大非毒性剂量Tet联合放疗后可上调CNE1和CNE2细胞中γ-H2AX的表达。放疗组CNE1和CNE2细胞G2/M期的比例分别为(18.09±0.42)%和(18.48±1.32)%,联合处理组CNE1和CNE2细胞G2/M期的比例降为(15.88±1.04)%和(13.80±0.82)%,与放疗组比较差异有统计学意义(P<0.05)。联合处理可增加放疗所致的cleaved caspase-3的蛋白水平(P<0.05)。不同浓度Tet处理CNE1和CNE2细胞后,p-CDC25C和p-CDK1的蛋白水平随Tet浓度增加而升高(P<0.05),CDK1的表达无明显改变;最大非毒性剂量Tet不影响p-CDC25C、p-CDK1和CDK1的蛋白水平。在CNE1和CNE2细胞中,联合处理可明显降低放疗引起的p-CDC25C和p-CDK1的蛋白水平(P<0.05),上调放疗后cyclin B1的表达,而对总CDK1的表达无明显调节作用;联合处理可显著抑制放疗所致的p-ERK 蛋白水平(P<0.05)。结论: 最大非毒性剂量Tet可以增加放疗引起的CNE1和CNE2细胞的DNA断裂及细胞凋亡,其放疗增敏的机制可能与Tet调控ERK/CDC25C/CDK1/cyclin B1通路、去除放疗导致的G2/M期阻滞有关。
汉防己甲素; 鼻咽癌; G2/M期阻滞; ERK/CDC25C/CDK1/cyclin B1通路 [
鼻咽癌是我国华南地区常见的恶性肿瘤之一,在中国南方地区头颈部恶性肿瘤中占首位,其在中国南方发病率已达(15~40)/10万人次[1],其中,广东省男性发病率达30/10万人次,女性达13/10万人次[2]。由于鼻咽的解剖位置隐蔽、解剖结构复杂且病理特征以未分化型非角化性为主,因此放射治疗一直是鼻咽癌的重要治疗手段。对于I期和 IIA期的鼻咽癌患者,单纯放疗后5年总体生存率可达80%以上[3]。然而由于鼻咽癌早期症状不显著,临床上初诊患者中约有60%已达局部晚期,约5%~8%的患者已伴随远处转移[4]。同时约20%的患者在单纯放疗后仍出现局部恶化[5]。目前,同步放化疗是针对晚期鼻咽癌患者的主要治疗手段,但其在提高5年生存率的同时,也增加了治疗的毒副作用,降低患者的生存质量[6]。因此,寻找有效且安全的放疗增敏剂对于鼻咽癌的治疗具有非常重要的意义。
汉防己甲素(tetrandrine,Tet)又称粉防己碱,是从中草药粉防己的根块中提取的双苄基异喹啉类生物碱,分子式为C33H42N2O6。Tet为天然的非选择性钙离子通道阻滞剂,具有抗高血压、抗炎和抗纤维化等作用,目前已在风湿痛、关节痛、单纯硅肺等疾病中应用于临床[7]。在针对恶性胶质瘤、神经母细胞瘤和食管癌等疾病的研究中发现,Tet可以抑制肿瘤细胞的生长,并且可以增加肿瘤细胞对放疗的敏感性,促进肿瘤细胞的死亡[8-10]。我们前期研究发现,Tet针对人鼻咽癌细胞株CNE1和CNE2的最大非毒性剂量分别为1.5 μmol/L和1.8 μmol/L,并针对最大非毒性剂量Tet联合放疗对CNE1和CNE2细胞增殖的影响进行了研究,发现最大非毒性剂量Tet可以增强放疗对CNE1和CNE2细胞增殖的抑制作用,增加CNE1和CNE2细胞对放疗的敏感性[11]。本研究拟探讨最大非毒性剂量Tet对人鼻咽癌细胞株放疗增敏作用的机制。
材料和方法
1实验材料
1.1细胞株 人鼻咽癌细胞株CNE1和CNE2由中山大学肿瘤医院惠赠。
1.2主要试剂 Tet购自中国浙江海正药业;胰蛋白酶和RPMI-1640培养基购自Invitrogen;胎牛血清购自Gibco;BCA蛋白定量试剂盒、细胞周期试剂盒、细胞和总蛋白提取试剂盒购自中国南京凯基生物科技发展公司;兔抗人γ-H2AX、caspase-3、cleaved caspase-3、ERK和p-ERK抗体购自CST;兔抗人cyclin B1、p-CDK1、p-CDC25C和小鼠抗人CDK1抗体购自Abcam;兔抗人GAPDH抗体、山羊抗兔、山羊抗鼠IgG II抗购自Proteintec Group;Western blot发光试剂盒购自Thermo Fisher Scientific。
2实验方法
2.1细胞培养 人鼻咽癌细胞株CNE1和CNE2在含10%胎牛血清的RPMI-1640培养基中,5% CO2、37 ℃条件下常规培养。取对数生长期的细胞进行实验。
2.2Tet的配制 取0.1775 g Tet溶解于1 mL 1 mol/L的HCl中,加入去离子水至5 mL,调节pH值至6.5,配制成浓度为2 500 μmol/L的溶液,0.22 μm过滤后4 ℃避光保存。使用时加入含10%胎牛血清的RPMI-1640培养基稀释至相应浓度。
2.3放射线照射 细胞培养皿常温下覆盖1.5 cm硅胶补偿膜,采用西门子PRIMUS H型直线加速器的6 MV X线照射细胞,吸收剂量率为250 cGy/min,照射野为25 cm×25 cm,总照射剂量为4 Gy。
2.4流式细胞术检测细胞周期 取对数生长期CNE1和CNE2细胞,分为空白对照组、最大非毒性剂量Tet组、4 Gy放疗组和4 Gy放疗联合最大非毒性剂量Tet(对CNE1细胞为1.5 μmol/L,对CNE2细胞为1.8 μmol/L)组。以每孔3×105细胞接种于6孔板,细胞贴壁后收集细胞并使用PBS漂洗2次,70%乙醇4 ℃固定过夜。碘化丙啶避光染色30 min,使用FACSCalibur流式细胞仪(BD)检测各组细胞周期分布情况。
2.5Western blot实验 取对数生长期CNE1和CNE2细胞,以每孔3×105细胞接种于6孔板,细胞贴壁后分别给予相应浓度Tet或4 Gy处理,放疗联合最大非毒性剂量Tet组在放疗1 h后加入最大非毒性剂量Tet。处理24 h后收集细胞,按照总蛋白提取试剂盒说明提取细胞总蛋白,使用BCA法测定蛋白浓度。取各组蛋白30 μg,经10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)分离后,将蛋白转移至PVDF膜,5%小牛血清白蛋白(BSA)封闭1.5 h, I 抗4 ℃孵育过夜,加入山羊抗兔或山羊抗鼠 II 抗,室温孵育1.5 h。加入化学发光试剂进行放射自显影。使用ImageJ分析软件对结果进行灰度分析。
3统计学处理
设3组平行实验,结果以均数标±准差(mean±SD)表示。采用SPSS 19.0软件进行统计分析,多组数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1最大非毒性剂量Tet联合放疗对CNE1和CNE2细胞中γ-H2AX的影响
Western blot检测4 Gy放疗后及最大非毒性剂量Tet联合放疗处理后γ-H2AX表达情况,在CNE1细胞中,放疗后γ-H2AX表达增加,放疗联合1.5 μmol/L Tet处理组中γ-H2AX表达增加更明显,2组之间差异具有统计学意义(P<0.05),见图1A。同样在CNE2细胞中,放疗组和放疗联合1.8 μmol/L Tet组γ-H2AX表达均增加,且放疗联合Tet组增加幅度更明显(P<0.05),见图1B。这提示最大非毒性剂量Tet可以增强放疗引起的γ-H2AX表达的上调。

Figure 1. The effect of the maximum non-cytotoxic doses of Tet combined with irradiation on the protein level of γ-H2AX. A: the expression of γ-H2AX in the CNE1 cells; B: the expression of γ-H2AX in the CNE2 cells. Mean±SD.n=3.*P<0.05vs4Gy group.
图1不同处理后CNE1和CNE2细胞γ-H2AX的表达情况
2最大非毒性剂量Tet联合放疗对CNE1和CNE2细胞的细胞周期的影响
流式细胞术分析CNE1和CNE2细胞给予放疗或最大非毒性剂量Tet后细胞周期分布的变化情况。CNE1细胞对照组和最大非毒性剂量Tet处理组G2/M期所占比例分别为(7.81±0.16)%和(7.32±0.53)%,两者差异无统计学显著性,放疗组G2/M期细胞所占比例为(18.09±0.42)%,比对照组明显增高(P<0.05),放疗联合Tet组G2/M期细胞比例为(15.88±1.04)%,低于单纯放疗组,差异具有统计学意义(P<0.05),见图2A。
CNE2细胞对照组、最大非毒性剂量Tet处理组、放疗组和放疗联合最大非毒性剂量Tet组G2/M期所占比例分别为(8.69±0.97)%、(8.57±2.13)%、(18.48±1.97)%和(13.80±2.82)%。对照组和最大非毒性Tet处理组之间差异无统计学显著性,放疗组在G2/M期出现明显的阻滞,比例显著高于对照组和Tet组(P<0.05),而放疗联合最大非毒性剂量Tet组G2/M期细胞比例比放疗组降低(P<0.05),见图2B。这提示最大非毒性剂量Tet可以去除放疗引起的G2/M期阻滞。
3最大非毒性剂量Tet联合放疗对CNE1和CNE2细胞cleavedcaspase-3表达的影响
CNE1和CNE2细胞中caspase-3的激活状态(cleaved caspase-3)具有相同的变化趋势。对CNE1细胞及CNE2细胞分别给予1.5 μmol/L和1.8 μmol/LTet处理后,cleaved caspase-3的蛋白水平与对照组的差异无统计学显著性;给予放疗处理后,CNE1和CNE2细胞中的cleaved caspase-3蛋白水平增加;而在放疗联合最大非毒性剂量Tet处理后,cleaved caspase-3的蛋白水平增加更明显(P<0.05),见图3。这提示放疗联合最大非毒性剂量Tet可以增强放疗对caspase-3的激活作用。
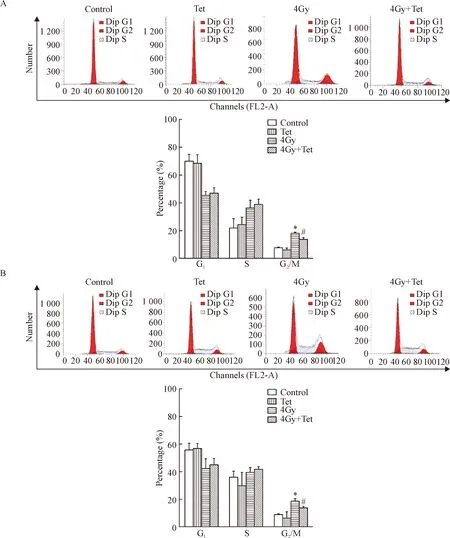
Figure 2. The effect of the maximum non-cytotoxic doses of Tet combined with irradiation on the cell cycle distribution. A: the distribution of cell cycle in CNE1 cells after different treatments; B: the distribution of cell cycle in CNE1 cells after different treatments. Mean±SD.n=3.*P<0.05vscontrol group and Tet group;#P<0.05vs4 Gy group.
图2不同处理对CNE1和CNE2细胞的细胞周期的影响
4最大非毒性剂量Tet联合放疗对CDC25C/CDK1/cyclinB1通路蛋白表达的影响
对CNE1和CNE2细胞给予不同浓度的Tet处理24 h后,Western blot检测p-CDC25C、p-CDK1和CDK1的蛋白水平。在CNE1细胞中,予0.75 μmol/L和1.5 μmol/L Tet处理组的p-CDC25C、p-CDK1和CDK1的蛋白水平与对照组相比差异均无统计学显著性,3.0 μmol/L和6.0 μmol/L Tet处理组的p-CDC25C和p-CDK1蛋白水平与对照组相比有增加(P<0.05),CDK1表达无明显改变,见图4A。在CNE2细胞中,0.9 μmol/L和1.8 μmol/L Tet处理后p-CDC25C和p-CDK1的蛋白水平与对照组相比差异无统计学显著性,3.6 μmol/L和7.2 μmol/L Tet处理后p-CDC25C和p-CDK1的蛋白水平与对照组相比明显增加(P<0.05),而各浓度Tet处理后CDK1的表达差异均无统计学显著性,见图4B。

Figure 3. The effect of the maximum non-cytotoxic doses of Tet combined with irradiation on the protein levels of cleaved caspase-3 and caspase-3 in CNE1 (A) and CNE2 (B) cells. Mean±SD.n=3.*P<0.05vs4Gy group.
图3不同处理后CNE1和CNE2细胞中cleavedcaspase-3和caspase-3的表达
对CNE1和CNE2细胞分别给予放疗和放疗联合最大非毒性剂量Tet处理,处理后24 h提取各组蛋白,Western blot检测各组p-CDC25C、p-CDK1、CDK1和cyclin B1的蛋白水平。CNE1和CNE2细胞中各蛋白水平改变的趋势相同。放疗处理后,p-CDC25C、p-CDK1和CDK1的蛋白水平明显增加,与对照组相比差异有统计学意义(P<0.05),而cyclin B1的表达无明显改变。放疗联合最大非毒性剂量Tet组中p-CDC25C和p-CDK1的蛋白水平较放疗组降低(P<0.05),cyclin B1的表达较放疗组明显增加(P<0.05),而CDK1的表达与放疗组相比差异无统计学显著性,见图4C、D。
5最大非毒性剂量Tet联合放疗对ERK磷酸化的影响
在CNE1细胞中,p-ERK的蛋白水平在对照组和最大非毒性剂量Tet处理组之间的差异无统计学显著性,放疗组的p-ERK蛋白水平显著增加(P<0.05),而放疗联合最大非毒性Tet组的p-ERK蛋白水平较放疗组明显降低,差异具有统计学意义(P<0.05),见图5A。在CNE2细胞中,p-ERK蛋白水平的改变具有同样的趋势,见图5B。
讨 论
放疗是鼻咽癌治疗的重要手段,然而肿瘤组织对放疗的抵抗性会显著影响放疗的治疗效果。目前Tet已被证实对食管癌、神经母细胞瘤等疾病具有放疗增敏的作用,但这些研究使用的Tet剂量仍具有细胞毒性杀伤作用,联合放疗会增加治疗的毒副作用。我们前期研究确定了Tet针对CNE1和CNE2细胞的最大非毒性剂量,并发现该剂量可以增加CNE1和CNE2细胞对放疗的敏感性,增加放疗对细胞增殖的抑制作用,但增敏机制尚未明确。
放疗杀伤肿瘤细胞最主要的生物学效应是DNA双链断裂(double strand breaks,DSBs)[12]。H2AX是组蛋白H2A家族成员之一,其C端存在一段由22个氨基酸残基构成的高度保守同源序列,其中包括139位的丝氨酸残基,在细胞发生DSBs时被磷酸化,称为γ-H2AX。由于γ-H2AX与DSBs关系密切,且没有细胞特异性,因此γ-H2AX被认为是检测DSBs的特异性指标[13]。本研究检测了单纯放疗和放疗联合最大非毒性剂量Tet对γ-H2AX表达的影响,发现最大非毒性剂量Tet可以上调放疗引起的γ-H2AX表达的增加,提示最大非毒性剂量Tet可以促进放疗引起的DSBs。
DNA损伤后,细胞周期监测位点被激活,阻滞细胞周期进程,促使细胞进行DNA修复。若修复失败,细胞携带损伤的DNA进入DNA复制过程,将会导致细胞产生凋亡[14]。细胞周期检测位点包括G1/S位点和G2/M位点,若携带DNA损伤的细胞通过了G1/S位点,则G2/M位点成为DNA修复的最后时期,因此G2/M期是放疗后细胞周期进程的关键位点。关于乳腺癌和结肠癌的研究发现[15-16],去除G2/M期阻滞可增加肿瘤细胞对放疗的敏感性。在本研究中,我们发现CNE1和CNE2细胞中G2/M期细胞所占比例在放疗后明显增加,而放疗联合最大非毒性剂量Tet后,CNE1和CNE2细胞中G2/M期细胞比例下降,提示放疗联合最大非毒性剂量Tet可以降低放疗导致的G2/M期阻滞,可能为最大非毒性Tet放疗增敏的机制之一。

Figure 4. The effect of the maximum non-cytotoxic doses of Tet combined with irradiation on the related protein levels of CDC25C/CDK1/cyclin B1 pathways. A: the related protein levels of CDC25C/CDK1/cyclin B1 pathways in the CNE1 cells after treatment with different doses of Tet; B: the related protein levels of CDC25C/CDK1/cyclin B1 pathways in the CNE2 cells after treatment with different doses of Tet; C: the related protein levels in CNE1 cells after Tet treatment combined with irradiation; D: the related protein levels in CNE2 cells after Tet treatment combined with irradiation. Mean±SD.n=3.*P<0.05vscontrol group (0 μmol/L Tet);#P<0.05vs4Gy group.
图4不同处理后CNE1和CNE2细胞中CDC25C/CDK1/cyclinB1通路蛋白的表达情况
细胞凋亡在肿瘤的发生、发展和治疗中具有重要的意义。Caspase家族为天冬氨酸特异性的半胱氨酸蛋白酶,是细胞凋亡重要的介导因子与执行因子,其中caspase-3处于凋亡级联反应的下游,是凋亡最重要的执行因子之一[17]。正常情况下,caspase-3以无活性的酶原形式存在于细胞质中,当细胞接受凋亡启动信号后,caspase-3被上游因子剪切为cleaved caspase-3从而激活,进而诱导细胞产生凋亡[18]。Caspase-3的活化提示细胞发生不可逆的凋亡[19]。多项研究表明,活化caspase-3可以促进多种瘤细胞的凋亡[20-22]。我们的研究发现,放疗后CNE1和CNE2细胞中cleaved caspase-3的水平增加,最大非毒性剂量Tet联合放疗后,cleaved caspase-3的水平增加更显著,提示最大非毒性剂量Tet可以增强放疗对caspase-3的活化作用,促进细胞的凋亡,从而达到放疗增敏的作用。
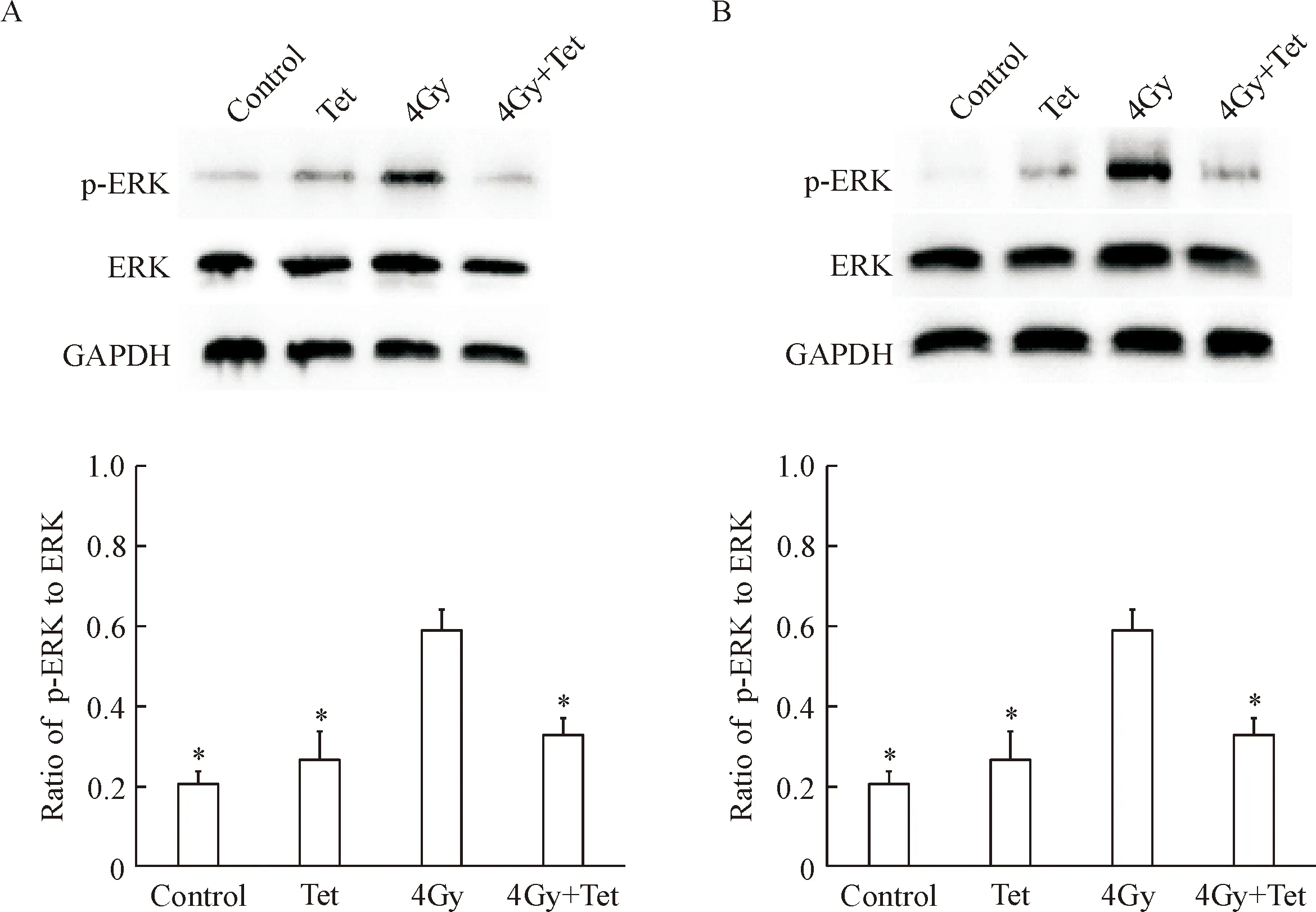
Figure 5. The effect of the maximum non-cytotoxic doses of Tet combined with irradiation on the protein level of p-ERK. A: the protein levels of p-ERK and ERK in the CNE1 cells; B: the protein levels of p-ERK and ERK in the CNE2 cells. Mean±SD.n=3.*P<0.05vs4Gy group.
图5不同处理后CNE1和CNE2细胞中p-ERK和ERK的表达情况
G2/M期进程由CDK1/cyclin B1复合体进行调节。CDK1/cyclin B1复合体的激活需要去磷酸化的CDK1与cyclin B1进行结合,当CDK1的Tyr15位点处于磷酸化状态时,CDK1/cyclin B1复合体处于非激活状态,从而产生G2/M期阻滞[23]。CDC25C可以去除CDK1 Tyr15位点的磷酸化,从而激活CDK1/cyclin B1复合体,促使G2/M期阻滞的去除。细胞周期未启动时,CDC25C处于非活性状态,其Ser216位点被磷酸化,在细胞周期通过G2/M期前,CDC25C Ser216位点发生去磷酸化,去磷酸化的CDC25C进一步激活CDK1/cyclin B1复合体,从而使细胞DNA复制进程通过G2/M期[24]。我们给予CNE1和CNE2不同浓度的Tet处理,发现浓度小于等于最大非毒性剂量的Tet并不影响p-CDC25C、p-CDK1和CDK1的水平,而浓度大于最大非毒性剂量的Tet会上调p-CDC25和p-CDK1的水平,并且上调幅度随浓度增加而增加,但不影响CDK1细胞的表达。提示我们在研究中使用的最大非毒性剂量Tet不影响CNE1和CNE2细胞的G2/M期进程,而大剂量的Tet可以抑制CDC25C/CDK1/cyclin B1通路的激活。与单纯放疗相比较,放疗联合最大非毒性剂量Tet处理后, CNE1和CNE2细胞中p-CDK1的蛋白水平降低,而CDK1无明显改变,cyclin B1表达增加,提示最大非毒性剂量Tet通过增加去磷酸化状态CDK1的比例以及上调cyclin B1的表达促使放疗后CDK1/cyclin B1复合体的激活,而放疗联合最大非毒性剂量Tet后p-CDC25C的蛋白水平降低,提示Tet对CDK1/cyclin B1复合体的激活作用可能与Tet促进CDC25C去磷酸化有关。
ERK为MAPK家族的一员,与肿瘤的发生发展关系密切。ERK可以调节多种信号因子的磷酸化作用,进而调控肿瘤细胞的增殖和凋亡[25]。ERK对G2/M期进程所起的作用仍有争议。Lee等[26]的研究发现棕矢车菊素可以促进ERK的磷酸化,诱导子宫内膜癌细胞G2/M期阻滞。而在人白血病细胞中,ERK的抑制剂可以增强PTX-2引起的G2/M期阻滞[27]。在本研究中,与单纯放疗相比,放疗联合最大非毒性剂量Tet后,p-ERK的蛋白水平显著降低,而ERK的表达无明显变化,提示最大非毒性剂量Tet抑制了ERK的磷酸化,其去除G2/M期阻滞的机制可能与其抑制上游负调控因子ERK的激活有关。
综上所述,最大非毒性剂量Tet可以增加放疗引起的CNE1和CNE2细胞的DNA断裂,并通过调控ERK/CDC25C/CDK1/cyclin B1通路,去除放疗引起的G2/M期阻滞,进而促进细胞的凋亡,从而达到其对人鼻咽癌细胞放疗增敏的目的。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] 中国抗癌协会头颈肿瘤专业委员会, 中国抗癌协会放射肿瘤专业委员会. 头颈部肿瘤综合治疗专家共识[J]. 中华耳鼻咽喉头颈外科杂志, 2010, 45(7):535-541.
[3] Xiao W, Han F, Lu T, et al. Treatment outcomes after radiotherapy alone for patients with early-stage nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2009, 74(4):1070-1076.
[4] Liang Z, Zhu X, Li L, et al. Concurrent chemoradiotherapy followed by adjuvant chemotherapy compared with concurrent chemoradiotherapy alone for the treatment of locally advanced nasopharyngeal carcinoma: a retrospective controlled study[J]. Curr Oncol, 2014, 21(3):e408-e417.
[5] Suarez C, Rodrigo JP, Rinaldo A, et al. Current treatment options for recurrent nasopharyngeal cancer[J]. Eur Arch Otorhinolaryngol, 2010, 267(12):1811-1824.
[6] Yu H, Wang X, Song A, et al. Concurrent chemoradiotherapy versus radiotherapy alone for locoregionally advanced nasopharyngeal carcinoma[J]. Asian Pac J Cancer Prev, 2012, 13(8):3961-3965.
[7] Liu T, Liu X, Li W. Tetrandrine, a Chinese plant-derived alkaloid, is a potential candidate for cancer chemotherapy[J]. Oncotarget, 2016, 7(26):40800-40815.
[8] Chang KH, Chen ML, Chen HC, et al. Enhancement of radiosensitivity in human glioblastoma U138MG cells by tetrandrine[J]. Neoplasma, 1999, 46(3):196-200.
[9] Chen Y, Chen JC, Tseng SH. Effects of tetrandrine plus radiation on neuroblastoma cells[J]. Anticancer Res, 2009, 29(8):3163-3171.
[10] Yu J, Liu F, Sun M, et al. Enhancement of radiosensitivity and the potential mechanism on human esophageal carcinoma cells by tetrandrine[J]. Cancer Biothe Radiopharm, 2011, 26(4):437-442.
[11] 吴喜福, 张革化, 黎景佳, 等. 汉防己甲素对人鼻咽癌细胞株的放射增敏作用及其机制[J]. 中国病理生理杂志, 2012, 28(12):2187-2191.
[12] Tarish FL, Schultz N, Tanoglidi A, et al. Castration radiosensitizes prostate cancer tissue by impairing DNA double-strand break repair[J]. Sci Transl Med, 2015, 7(312):312re31.
[13] Singh I, Ozturk N, Cordero J, et al. High mobility group protein-mediated transcription requires DNA damage mar-ker γ-H2AX[J]. Cell Res, 2015, 25(7):837-850.
[14] Deckbar D, Jeggo PA, Lobrich M. Understanding the li-mitations of radiation-induced cell cycle checkpoints[J]. Crit Rev Biochem Mol Biol, 2011, 46(4):271-283.
[15] Anastasov N, Höfig I, Vasconcellos IG, et al. Radiation resistance due to high expression of miR-21 and G2/M checkpoint arrest in breast cancer cells[J]. Radiat Oncol, 2012, 7:206.
[16] Yong KJ, Milenic DE, Baidoo KE, et al. Sensitization of tumor to212Pb radioimmunotherapy by gemcitabine involves initial abrogation of G2 arrest and blocked DNA damage repair by interference with Rad51[J]. Int J Radiat Oncol Biol Phys, 2013, 85(4):1119-1126.
[17] Shalini S, Dorstyn L, Dawar S, et al. Old, new and emerging functions of caspases[J]. Cell Death Differ, 2015, 22(4):526-539.
[18] Parrish AB, Freel CD, Kornbluth S. Cellular mechanisms controlling caspase activation and function[J]. Cold Spring Harb Perspect Biol, 2013, 5(6): a008672.
[19] Bratton SB, MacFarlane M, Cain K, et al. Protein complexes activate distinct caspase cascades in death receptor and stress induced apoptosis[J]. Exp Cell Res, 2000, 256(1):27-33.
[20] 方 勇, 吴金民, 潘宏铭. Caspase-3抑制剂抑制长春碱诱导的人乳腺癌细胞凋亡及IκΒ-α降解[J]. 中国病理生理杂志, 2009, 25(2):215-219.
[21] 胡明珠, 李 磊, 曹 蕾, 等. PXD101诱导人前列腺癌细胞PC3凋亡的线粒体信号通路[J]. 中国病理生理杂志, 2017, 33(5):793-797.
[22] 邵军良, 韩明芳, 黎运呈. 桂皮酸联合顺铂对人肝癌MHCC97细胞的增殖抑制和凋亡诱导作用[J]. 中国病理生理杂志, 2013, 29(7):1219-1224.
[23] Stolz A, Ertych N, Bastians H. Tumor suppressor CHK2: regulator of DNA damage response and mediator of chromosomal stability[J]. Clin Cancer Res, 2011, 17(3):401-405.
[24] Bartek J, Lukas J. DNA damage checkpoints: from initiation to recovery or adaptation[J]. Curr Opin Cell Biol, 2007, 19(2):238-245.
[25] Samatar AA, Poulikakos PI. Targeting RAS-ERK signalling in cancer: promises and challenges[J]. Nat Rev Drug Discov, 2014, 13(12):928-942.
[26] Lee JG, Kim JH, Ahn JH, et al. Jaceosidin, isolated from dietary mugwort (Artemisiaprinceps), induces G2/M cell cycle arrest by inactivating cdc25C-cdc2 via ATM-Chk1/2 activation[J]. Food Chem Toxicol, 2013, 55:214-221.
[27] Moon DO, Kim MO, Kang SH, et al. Induction of G2/M arrest, endoreduplication, and apoptosis by actin depolymerization agent pextenotoxin-2 in human leukemia cells, involving activation of ERK and JNK[J]. Biochem Pharmacol, 2008, 76(3):312-321.
(责任编辑: 林白霜, 罗 森)
Effect of tetrandrine on radiosensitivity of nasopharyngeal carcinoma cells
WANG Jun, CHANG Li-hong, LI Xia, CHEN Xian-zhen, WU Xi-fu, WANG Zhi-yuan, HUANG Zi-zhen, HUANG Jian-cong, ZHANG Ge-hua
(Department of Otorhinolaryngology Head and Neck Surgery, The Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China. E-mail: gehuazh@hotmail.com)
AIM: To investigate the mechanism of the radiosensitizing effect of maximum non-cytotoxic doses of tetrandrine (Tet) on nasopharyngeal carcinoma cell lines CNE1 and CNE2.METHODS: The cells were treated with ma-ximum non-cytotoxic doses of Tet (for CNE1 cells at 1.5 μmol/L and for CNE2 cells at 1.8 μmol/L), irradiation at 4 Gy, or combination of irradiation and maximum non-cytotoxic doses of Tet. The cell cycle distribution was analyzed by flow cytometry. The protein levels of γ-H2AX, cleaved caspase-3, p-CDC25C, CDK1, p-CDK1, cyclin B1, ERK and p-ERK were determined by Western blot.RESULTS: The expression of γ-H2AX was increased in CNE1 cells and CNE2 cells after combined treatment with irradiation and maximum non-cytotoxic doses of Tet. The percentages of CNE1 cells and CNE2 cells at G2/M phase in irradiation group were (18.09±0.42)% and (18.48±1.32)%, respectively, which were decreased to (15.88±1.04)% and (13.80±0.82)% in combined treatment group, respectively (P<0.05). Combined treatment enhanced the increase in the protein level of cleaved caspase-3 caused by irradiation. The protein levels of p-CDC25C and p-CDK1 were increased in a dose-dependent manner by Tet treatment (P<0.05), while the expression of CDK1 showed no difference among different doses of Tet treatments. The protein levels of p-CDC25C, p-CDK1 and CDK1 showed no difference after the treatment with maximum non-cytotoxic doses of Tet. The combined treatment with irradiation and the maximum non-cytotoxic doses of Tet decreased the protein levels of p-CDC25C and p-CDK1 (P<0.05), increased the expression of cyclin B1, and had no influence on the expression of CDK1 (P<0.05). The combined treatment resulted in an increase in the protein level of p-ERK1 (P<0.05).CONCLUSION: The maximum non-cytotoxic doses of Tet enhance the DNA damage and apoptosis in CNE1 cells and CNE2 cells caused by irradiation, and the mechanism might be associated with ending of G2/M arrest via activation of ERK/CDC25C/CDK1/cyclin B1 pathways.
Tetrandrine; Nasopharyngeal carcinoma; G2/M phase arrest; ERK/CDC25C/CDK1/cyclin B1 pathways
1000- 4718(2017)09- 1611- 08
2017- 01- 26 [
] 2017- 06- 18
广东省自然科学基金资助项目(No. 2014A030313142); 广州市科技计划对外科技合作专项(No. 2013J4500013);广州市天河区科技计划项目医疗卫生专项(No. 2013KW027)
] R762; R965; R730.23
A
10.3969/j.issn.1000- 4718.2017.09.013
△通讯作者 Tel: 020-85253045; E-mail: gehuazh@hotmail.com
