反义锁核酸封闭c-myc第二外显子翻译起始区对肝癌细胞凋亡的影响*
2017-09-22邓益斌肖树荣许桂丹黄赞松
邓益斌, 肖树荣, 许桂丹, 黄赞松
(右江民族医学院附属医院医学检验中心,广西 百色 533000)
反义锁核酸封闭c-myc第二外显子翻译起始区对肝癌细胞凋亡的影响*
邓益斌, 肖树荣, 许桂丹, 黄赞松△
(右江民族医学院附属医院医学检验中心,广西 百色 533000)
目的: 探讨针对c-myc第二外显子翻译起始区的反义锁核酸对肝癌细胞活力和凋亡的影响。方法: 设计合成能特异性封闭c-myc基因第二外显子翻译起始区的反义寡核苷酸、硫代寡核苷酸和锁核酸,分别以阳离子脂质体介导转染HepG2细胞,采用RT-PCR检测细胞内c-Myc的mRNA表达变化;Western blot检测细胞内c-Myc的蛋白表达变化;流式细胞技术检测细胞凋亡情况;MTT法检测反义锁核酸的细胞毒性作用。结果: 转染第5天后,反义锁核酸组c-Myc的mRNA相对表达量为0.335±0.016,明显低于对照组(P<0.05);c-Myc蛋白相对表达量为0.448±0.037,也明显低于对照组(P<0.01);凋亡细胞比例为32%±6%,显著高于对照组(P<0.05)。结论: 针对c-myc第二外显子翻译起始区的反义锁核酸能有效促进肝癌细胞的凋亡。
肝细胞癌;c-myc基因; 反义锁核酸
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,占我国肝癌的90%以上,严重威胁着人类的生命健康,自20世纪90年代起,我国肝癌死亡率上升为肿瘤的第2位。c-myc是细胞原癌基因之一,与肿瘤的发生发展关系密切,位于人类染色体8q24区,由3个外显子和2个内含子组成,其中第1外显子无编码序列,只起调控作用,第2、3外显子共同编码包含439个氨基酸残基的蛋白质,该蛋白主要与Max形成异二聚体后再与DNA核心序列结合,调控基因转录与表达[1-3]。据此推测,针对c-myc第二外显子翻译起始区设计合成反义锁核酸有可能会影响c-Myc的mRNA及蛋白的表达,通过影响肿瘤细胞增殖和凋亡发挥抗肿瘤作用。因此,在前期研究基础上[4-7],我们进一步设计合成能特异性封闭c-myc基因第二外显子翻译起始区的反义锁核酸(antisense locked nucleic acid,anti-LNA),以阳离子脂质体介导转染HepG2细胞,观察其对c-Myc的mRNA及蛋白表达的影响,以期为抗肝癌基因治疗寻找一种新型分子药物。
材料和方法
1细胞系
HepG2肝癌细胞株由中国人民解放军广州军区空军医院刘光泽博士惠赠,常规培养于含G418和10%胎牛血清的DMEM培养基中,37 ℃、5% CO2条件下5~6 d传代1次。
2主要试剂与仪器
DMEM培养基和G418(Gibco);胎牛血清(杭州四季青公司);LipofectamineTM2000(Invitrogen);RNA抽提试剂盒(Sangon);寡聚脱氧胸腺嘧啶核苷酸、禽成髓细胞瘤病毒逆转录酶、RNA酶抑制剂、Taq酶、缓冲液、三磷酸脱氧核苷酸等(TaKaRa);Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物公司);BCA蛋白定量试剂盒、十二烷基硫酸钠(SDS)、硝酸纤维膜、ECL发光液等(Sigma)。实时定量PCR仪(ABI);FACS AriaTM流式细胞分析仪(BD);半干电转系统(Bio-Rad)。
3方法
3.1反义LNA设计与合成 根据反义寡核苷酸作用原理及设计原则,利用RNAstructure 5.0软件设计并筛选出一条总自由能最低的互补于c-myc第2外显子翻译起始区(368~390 nt)的寡核苷酸片段,修饰如下:(1)LNA:5′-TGA△AGCT△ACCGT△ACT△ACGA△C-3′;(2)硫代寡核苷酸:5′-TGA#AGCT#ACCGT#ACT#ACGA#C-3′;(3)未修饰寡核苷酸:5′-TGAAGCTACCGTACTACGAC-3′;(4)无关序列:5′-CGCTATGTAATGCGCTATGG-3′。其中,△代表LNA修饰,#代表硫代修饰。各序列经BLAST排除与人同源后由GeneLink合成修饰并纯化。
3.2实验设计与脂质体转染 实验设对照组和实验组。对照组为空白对照(blank)组。实验组包括未修饰寡核苷酸(oligodeoxynucleotide,ODN)组、硫代寡核苷酸(phosphorothioate oligodeoxynucleotide,S-ODN)组和anti-LNA组。将HepG2细胞按1×108/L接种于16孔培养板,每孔100 μL,共设6个组,每组各设6个复孔,待细胞贴壁后,分别在各组每孔中加入含LNA(或寡核苷酸)的脂质体-DMEM混合液1 mL,培养后第5天收集细胞进行mRNA、蛋白等指标检测。转染按脂质体说明书操作。
3.3c-Myc的mRNA检测 (1)RNA提取:于细胞收集管中加入RNA抽提试剂1 mL,迅速置于冰上,加入0.2 mL氯仿,室温静置15 min,4 ℃ 12 000 r/min离心15 min;取上清液,加入0.5 mL异丙醇,室温静置10 min,4 ℃ 12 000 r/min离心10 min;弃上清液,加入75%焦碳酸二乙酯乙醇溶液1 mL,4 ℃ 7 500 r/min离心5 min;弃上清液室温干燥5 min,溶于焦碳酸二乙酯无菌水中。(2)RNA逆转录:根据目的基因片段碱基序列利用软件设计并评价引物,交由上海英骏生物技术有限公司合成纯化。在微反应管中配制模板RNA和引物(各组均取上下游引物)混合液,总体积为12 μL。65 ℃ 5 min后,冰上迅速冷却。加入2×PCR预反应液8 μL,轻轻混匀,室温静置10 min,移入42 ℃恒温箱中保温60 min后,升至70 ℃保温10 min,移到冰中冷却2 min。(3)cDNA扩增:上述反应管移入PCR扩增仪中(上游引物为5′-TCAACGTTAGCTTCACCAAC-3′,下游引物为5′-TGGGCGAGCTGCTGTCGT-3′,产物长度为245 bp)。反应条件为94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。取PCR扩增产物进行琼脂糖凝胶电泳,并与内参照β-actin(550 bp)电泳条带比较,计算相对灰度比值。
3.4c-Myc蛋白的检测 收集细胞弃上清,用RIPA细胞裂解液[0.01 mol/L Tris-HCl (pH 7.5),0.15 mol/L NaCl,1% Triton X-100,0.1% SDS (pH 7.4),临用前加入PMSF 100 mmol/L]重悬,转入Eppendorf管,冰上静置1 h,4 ℃ 12 000 r/min离心15 min。取上清于新Eppendorf管,提取总蛋白,用BCA蛋白定量试剂盒定量,于-70 ℃保存。取30 μg蛋白质样品与缓冲液[100 mmol/L Tris-HCl (pH 6.8),200 mmol/L DTT,4% SDS,0.2%溴酚蓝,20%甘油]混合煮沸5 min,变性后点样于预先制备好的12% SDS-PAGE电泳胶板上,30~40 mA电泳,当溴酚蓝到达胶板底部时停止电泳。取预处理过的2张3 mm滤纸和1张硝酸纤维膜,按滤纸、凝胶、硝酸纤维膜、滤纸的顺序放入半干电转仪的正极板上,接好负极板后,10~12 V电转30 min。采用ECL发光液试剂盒进行检测,并利用凝胶图像分析系统曝光、拍照和定量分析。
3.5HepG2细胞凋亡的检测 采用Annexin V-FITC/PI双染色流式细胞技术检测HepG2细胞凋亡情况。根据双变量流式细胞仪的散点图来判断结果:左上象限(Q1)为损伤细胞,右上象限(Q2)为坏死细胞,左下象限(Q3)为活细胞,右下象限(Q4)为凋亡细胞。严格按试剂盒说明书和仪器说明书操作。
3.6反义LNA的细胞毒性的检测 采用MTT比色法检测反义LNA对细胞活性的影响。采用含10%胎牛血清培养液配制单细胞悬液,以每孔1×104个细胞接种于96孔板,每孔200 μL,培养5 d后,每孔加MTT溶液(5 g/L,pH 7.4)200 μL,孵育4 h后,终止培养,吸弃培养上清液。每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解。酶联免疫监测仪上于490 nm波长处测定各孔吸光度(A)值。
4统计学处理
用SPSS 19.0统计软件进行数据处理和分析,所有数据采用均数±标准差(mean±SD)表示。各组间比较采用重复测量方差分析的SNK-q检验和Kruskal Wallis H检验,以P<0.05为差异有统计学意义。
结 果
1反义LNA对c-MycmRNA表达的抑制作用
与对照组相比,硫代寡核苷酸组和反义锁核酸组肝细胞中c-Myc的mRNA表达量均明显下调,其中反义锁核酸组下调尤为明显(P<0.05),见图1。
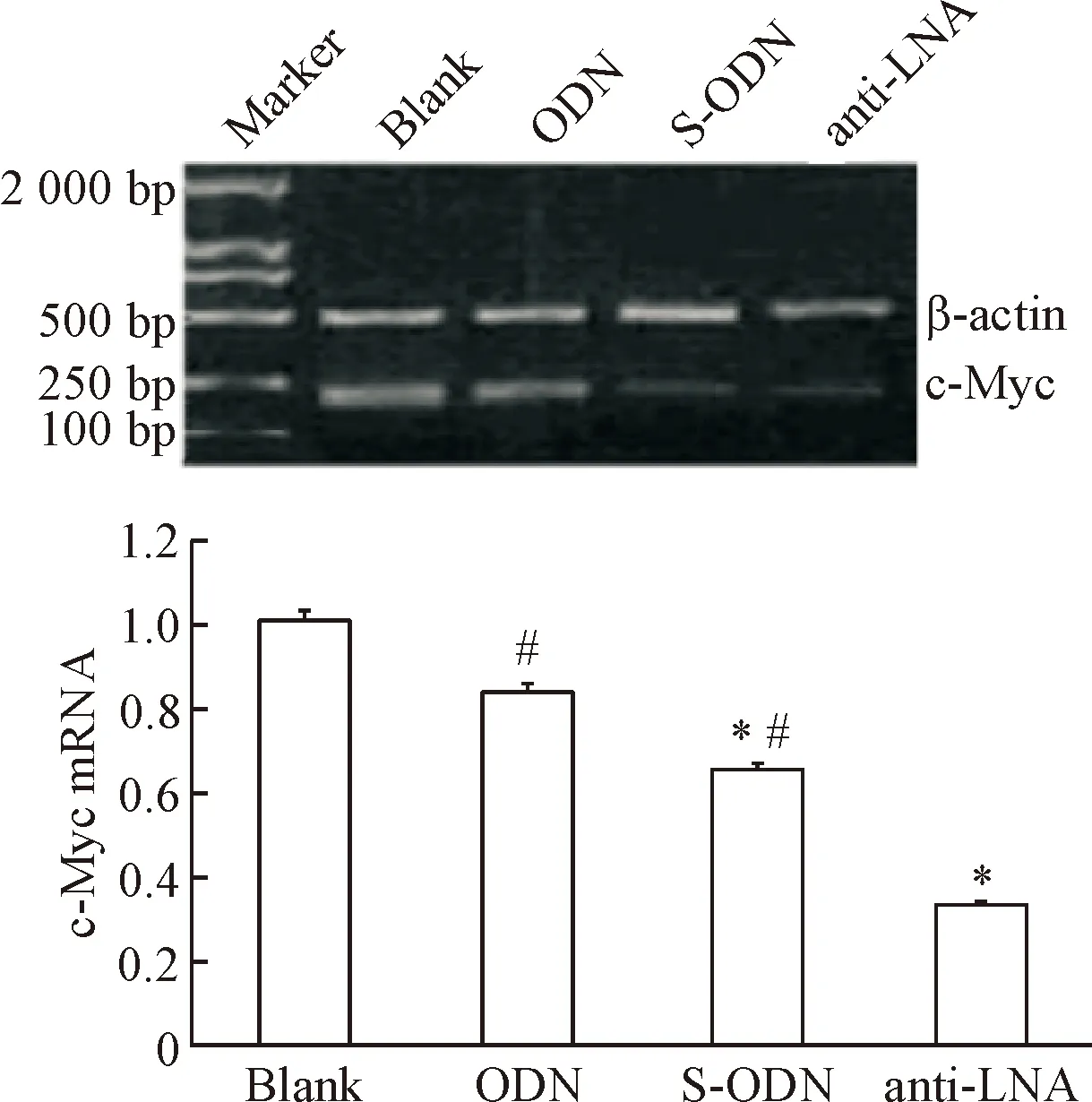
Figure 1. The relative mRNA expression of c-Myc in the HepG2 cells. Mean±SD.n=6.*P<0.05vsblank group;#P<0.05vsanti-LNA group.
图1各组肝癌细胞c-Myc的mRNA相对表达量
2反义LNA对c-Myc蛋白表达的抑制作用
与对照组相比,反义锁核酸组肝细胞中c-Myc蛋白相对表达量明显下降(P<0.01),见图2。
3反义LNA对HepG2细胞凋亡的影响
采用Annexin V-FITC/PI双染色流式细胞技术检测HepG2细胞凋亡情况。结果发现转染第5天后,硫代寡核苷酸组和反义锁核酸组的凋亡细胞比例均显著高于对照组(P<0.05),反义锁核酸组的凋亡细胞比例更高一些,见图3。
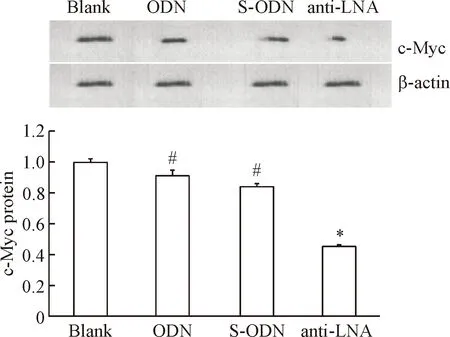
Figure 2. c-Myc protein expression level in HepG2 cells. Mean±SD.n=6.*P<0.05vsblank group;#P<0.05vsAnti-LNA group.
图2各组肝细胞c-Myc蛋白表达水平
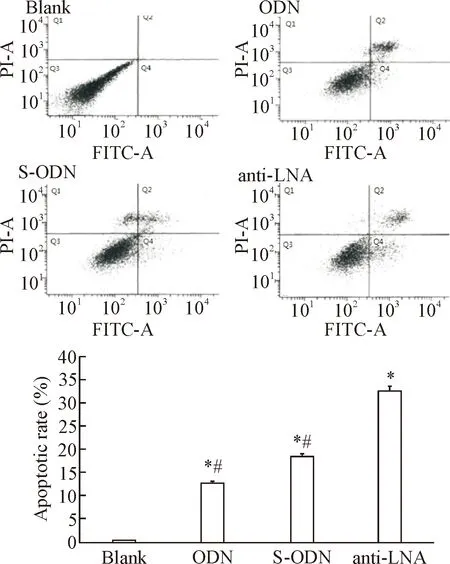
Figure 3. The apoptotic rate of HepG2 cells induced by anti-LNA. Mean±SD.n=6.*P<0.05vsblank group;#P<0.05vsanti-LNA group.
图3各组肝癌细胞的凋亡情况
4反义LNA对细胞的毒性作用
用药5 d后,采用MTT比色法测定各组A值,未修饰寡核苷酸组、硫代寡核苷酸组和反义锁核酸组的A值分别为1.18±0.05、1.16±0.04和1.15±0.05,与空白对照组(1.39±0.04)比较差异均无统计学意义,见图4。

Figure 4. The absorbance values of the HepG2 cells. Mean±SD.n=6.
图4各组肝癌细胞吸光度值
讨 论
目前认为,肿瘤细胞的恶性转化是一个由多细胞信号转导通路异常活化,使多种癌基因或抑癌基因表达异常,进一步促进癌症细胞异常增殖的多环节、多阶段、多步骤的复杂过程,而癌基因突变则是肿瘤细胞增殖的分子基础[8]。常见的癌基因有c-myc(增殖相关基因)、N-ras(转化基因)等,其中c-myc是新近研究发现的与肝细胞癌变密切相关的癌基因,是myc基因家族的重要成员之一,其编码蛋白属于核内转录因子,介导细胞生物信号转导,在细胞凋亡与增殖调控中发挥重要作用[9-11]。因而推测,封闭c-myc第二外显子翻译起始区的基因表达有可能会影响c-Myc mRNA及蛋白的表达,进而可能会影响肿瘤细胞凋亡,从而发挥抗肿瘤作用。
本研究利用计算机辅助药物设计软件设计合成能特异性封闭c-myc基因第二外显子翻译起始区的反义锁核酸片段,以阳离子脂质体介导转染HepG2细胞,利用逆转录聚合酶链反应、Western blot等分子生物学技术检测细胞内c-Myc的mRNA及蛋白表达情况,评估反义锁核酸的抗病毒效果。结果发现,反义锁核酸作用 5 d后,c-Myc的mRNA及蛋白质表达均较对照组明显下降,且细胞凋亡较对照组明显增多。因此认为,针对c-myc基因第二外显子翻译起始区的反义锁核酸可有效干扰c-myc基因的表达,进而促进肝癌细胞凋亡。
[1] Cheng Q, Yuan F, Lu F, et al. CSIG promotes hepatocellular carcinoma proliferation by activating c-Myc expression[J]. Oncotarget, 2015, 6(7):1733-1744.
[2] Pannem RR, Dorn C, Ahlqvist K, et al. CYLD controls c-Myc expression through the JNK-dependent signaling pathway in hepatocellular carcinoma[J]. Carcinogenesis, 2014, 35(2):461-468.
[3] Chauhan A, Paul R, Debnath M, et al. Synthesis of fluorescent binaphthyl amines that bind c-Myc G-quadruplex DNA and repress c-Myc expression[J]. J Med Chem, 2016, 59(15):7275-7281.
[4] 邓益斌, 农乐根, 韦叶生. 针对乙肝病毒前C/C双靶区反义锁核酸在转基因鼠体内抗病毒效果[J]. 生物医学工程学杂志, 2013, 30(4):828-832.
[5] 罗艳红, 邓益斌, 邹佳峻. 反基因锁核酸体外阻断肝癌细胞系乙肝病毒S基因表达[J]. 基础医学与临床, 2014, 14(2):206-210.
[6] Deng YB, Qin HJ, Luo YH, et al. Blocking the expression of hepatitis B virus S gene in hepatocellular carcinoma cell lines with anti gene locked nucleic acidinvitro[J]. Genet Mol Res, 2015, 14(2): 5445-5451.
[7] Deng YB, Qin HJ, Luo YH, et al. Antiviral efficacy of hepatitis B virus S/C gene loci antisense locked nucleic acid on transgenic miceinvivo[J]. Genet Mol Res, 2015, 14(3):10087-10095.
[8] Ho C, Wang C, Mattu S, et al. AKT (v-akt murine thy-moma viral oncogene homolog 1) and N-Ras (neuroblastoma ras viral oncogene homolog) coactivation in the mouse liver promotes rapid carcinogenesis by way of mTOR (mammalian target of rapamycin complex 1), FOXM1 (forkhead box M1)/SKP2,and c-Myc pathways[J]. Hepatology, 2012, 55(3):833-845.
[9] Xiao W, Wang J, Ou C, et al. Mutual interaction between YAP and c-Myc is critical for carcinogenesis in liver can-cer[J]. Biochem Biophys Res Commun, 2013, 439(2):167-172.
[10] Lin F, Ding R, Zhang S, et al. Decrease expression of microRNA-744 promotes cell proliferation by targeting c-Myc in human hepatocellular carcinoma[J]. Cancer Cell Int, 2014, 14:58.
[11] 刘 洁, 沈文静, 卢 瑶, 等. 小干扰RNA沉默hPTTG1基因对卵巢癌细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2011, 27(1):102-107.
(责任编辑: 林白霜, 宋延君)
Effect of antisense locked nucleic acid blocking translation initiation region of c-myc exon 2 on apoptosis of hepatocellular carcinoma cells
DENG Yi-bin, XIAO Shu-rong, XU Gui-dan, HUANG Zan-song
(Center for Medical Laboratory Science, The Affiliated Hospital of Youjiang Medical College for Nationalities, Baise 533000, China. E-mail: 1019846481@qq.com)
AIM: To observe the effect of antisense locked nucleic acid (anti-LNA) blocking the translation initiation region ofc-mycexon 2 on the viability and apoptosis of hepatocellular carcinoma cells.METHODS: The anti-LNA that was complementary to the translation initiation region ofc-mycexon 2 was designed, synthesized, and introduced into the HepG2 cells by cationic liposome-mediated transfection. The mRNA and protein levels of c-Myc in the cells were determined by RT-PCR and Western blot. The change of cell apoptosis was analyzed by flow cytometry, and the toxicity of anti-LNA to the cells was detected by MTT assay.RESULTS: Five days after transfection, the mRNA level of c-Myc in anti-LNA group was 0.335±0.016, and the protein level was 0.448±0.037, significantly lower than those in control group (bothP<0.05). The ratio of apoptotic cells in anti-LNA group was 32%±6%, which was higher than that in control group (P<0.05).CONCLUSION: Antisense locked nucleic acid targeting at the translation initiation region ofc-mycexon 2 shows strong inhibitory effects on the apoptosis of hepatocellular carcinoma cells.
Hepatocellular carcinoma;c-mycgene; Antisense locked nucleic acid
1000- 4718(2017)09- 1602- 04
2016- 09- 12 [
] 2017- 05- 02
国家自然科学基金资助项目(No. 81460123);广西卫生厅立项课题(No. Z2010084);自治区级研究生教育创新计划项目(No. 201601005)
R961; R730.23
A
10.3969/j.issn.1000- 4718.2017.09.011
△通讯作者 Tel: 0776-2846532; E-mail: 1019846481@qq.com
