Rb1延缓人脐静脉内皮细胞早熟性衰老与caveolin-1表达的关系*
2017-09-22刘定辉余舒杰郝宝顺郑振达钱孝贤
刘定辉, 吴 琳, 余舒杰, 周 彬, 王 敏, 刘 勇, 郝宝顺, 郑振达, 钱孝贤, 2△
(中山大学 1附属第三医院心血管内科, 2中西医结合研究所, 广东 广州 510630)
Rb1延缓人脐静脉内皮细胞早熟性衰老与caveolin-1表达的关系*
刘定辉1, 吴 琳1, 余舒杰1, 周 彬1, 王 敏1, 刘 勇1, 郝宝顺1, 郑振达1, 钱孝贤1, 2△
(中山大学1附属第三医院心血管内科,2中西医结合研究所, 广东 广州 510630)
目的: 血管内皮细胞衰老是动脉粥样硬化发生的病理生理机制之一。本研究旨在探讨人参皂苷Rb1延缓人脐静脉内皮细胞(HUVECs)早熟性衰老与窖蛋白1(caveolin-1)表达的关系,为延缓HUVECs衰老提供新的靶点。方法: 建立60 μmol/L过氧化氢(H2O2)诱导的HUVECs早熟性衰老模型,根据细胞形态学的变化、衰老相关β-半乳糖苷酶(SA-β-Gal)染色阳性率和细胞周期评估内皮细胞衰老,采用Western blot和激光共聚焦显微成像的方法检测caveolin-1的变化,观察人参皂苷Rb1对HUVECs衰老的作用及其相关的分子机制。结果: 60 μmol/L H2O2可成功地诱导内皮细胞衰老,早熟性衰老的HUVECs体积变大,SA-β-Gal活性明显增加,细胞发生G1期阻滞,细胞增殖受抑制,caveolin-1表达增多。与H2O2处理组相比,人参皂苷Rb1预处理延缓HUVECs早熟性衰老,SA-β-Gal染色阳性细胞百分比降低,G0/G1期细胞比例下降,caveolin-1表达减少。结论: 人参皂苷Rb1可通过抑制caveolin-1的表达延缓H2O2诱导的HUVECs早熟性衰老。
细胞衰老; 窖蛋白1; 人脐静脉内皮细胞; 人参皂苷Rb1
细胞衰老是生命体中普遍存在的一种压力和损伤反应现象,表现为不可逆的增殖停滞,其可分为两大类:复制性衰老和压力诱导的早熟性衰老。氧化应激可诱导早熟性衰老[1]。其中,内皮细胞衰老呈现出促炎、促血栓形成、促动脉粥样硬化的表型,在增龄相关性血管疾病如动脉粥样硬化的发病中发挥重要作用[2]。因此,深入探讨内皮细胞衰老的机制有助于为增龄相关性血管疾病治疗提供新视角、新靶点。
胞膜窖是细胞质膜内陷形成的一种特异性结构。在大部分细胞,窖蛋白1(caveolin-1)是胞膜窖的主要结构蛋白成分,在调节信号转导中起重要作用[1]。目前文献报道caveolin-1在衰老中发挥重要作用。有研究发现,在氧化应激诱导的成纤维细胞早熟性衰老模型中,caveolin-1通过抑制Sirt1从而促进P53依赖的早熟性衰老并刺激IL-6的分泌[1]。但caveolin-1在内皮细胞衰老中的作用研究尚不多见。
目前有部分报道阿司匹林、他汀、白藜芦醇等对内皮细胞衰老有一定的防治作用[3-5]。人参是我国常见的中草药之一,具有“久服轻身延年”的作用。人参皂苷是人参发挥药理学作用的主要成分,其中人参皂苷Rb1(ginsenoside Rb1,Rb1)是人参皂苷的主要活性单体。有研究发现Rb1可通过抗氧化应激对内皮衰老有一定的作用[6],但Rb1对caveolin-1的调节研究不多见。
本研究以过氧化氢(hydrogen peroxide,H2O2)诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)衰老为研究模型,观察Rb1延缓内皮细胞衰老的作用,并从caveolin-1角度探讨Rb1延缓内皮细胞衰老的机制。
材料和方法
1材料
人参皂苷Rb1购自于中国药品生物制品检定所。30% H2O2购自广州化学试剂厂。M199粉剂、无血清培养基(serum-free medium,SFM)、胎牛血清(fetal bovine serum,FBS)、EDTA胰酶和Ⅰ型胶原酶购自Gibco;内皮细胞生长添加剂(endothelial cell growth supplement,ECGS)购自BD;DMSO和碘化丙啶(propidium iodide,PI)购自Sigma-Aldrich;X-Gal(5-溴-4-氯-3-吲哚-D-半乳糖苷)购自AMESCO;全蛋白提取试剂盒购自南京凯基生物有限公司;BCA蛋白定量试剂盒购自上海生工生物工程技术服务有限公司;预染分子marker购自Fermentas;兔抗caveolin-1多抗购自Cell Signaling Technology;兔抗GAPDH多抗购自Proteintech Group;辣根酶标记羊抗兔IgG购自武汉博士德公司;绿色荧光羊抗兔 II 抗购自Invitrogen。
2HUVECs原代分离及培养
HUVECs原代培养参考Bandin等[7]报道的方法。取健康新生儿脐带,在无菌条件下用PBS反复冲洗直至液体清亮,使用0.1%Ⅰ型胶原酶室温消化20~30 min,收集胶原酶细胞混合液,1 000 r/min离心7 min,弃上清,用预温的完全培养液(60% M199,20% SFM,20% FBS,2 mmol/L谷氨酰胺,60 mg/L ECGS)悬浮细胞,吹打数次后种于培养瓶进行培养。第1~3代用于实验。通过显微镜下观察细胞的形态以及流式检测细胞表面标志物CD31鉴定细胞类型。
3实验方法
3.1内皮细胞衰老模型的建立以及细胞处理 第1~2代脐静脉内皮细胞消化计数后,以1×104cells/mm2种入不同的培养板或培养皿。待培养24 h后,换用含2%血清的M199培养基饥饿细胞至少8 h,然后加入H2O2进行刺激处理,刺激1 h后置换成正常完全培养基,培养24 h后进行后续实验。通过衰老相关β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal)染色和细胞周期的检测判断模型成功与否。
在探讨人参皂苷Rb1逆转内皮细胞早衰及其机制时,细胞分组为:空白对照组(正常完全培养基培养)、模型组(60 μmol/L H2O2作用细胞1 h)及10 μmol/L、20 μmol/L和40 μmol/L Rb1干预组(10、20和40 μmol/L Rb1作用30 min后加入60 μmol/L H2O2刺激1 h)。
3.2SA-β-Gal染色 SA-β-Gal染色参考Dimri等[8]的方法进行。染色18 h后在倒置显微镜下以物镜(×10)观察细胞染色情况,进行相关计数和拍照,连续计数400个细胞,统计其中的蓝染细胞数目(即SA-β-Gal染色阳性细胞),蓝染细胞/400个细胞为染色百分比,该百分比作为衰老程度的评价标准。
3.3细胞周期测定 各组细胞消化后于低温离心机300×g离心 5 min,PBS清洗2次,缓慢加入70%冰乙醇,轻柔吹散混匀细胞,于4 ℃固定过夜;次日300×g离心5 min弃去乙醇,冷PBS清洗细胞2次,加入终浓度为50 mg/L PI染液,4 ℃避光反应60 min,随后流式细胞术检测分析各组的细胞周期时相。
3.4Western blot实验 细胞蛋白提取方法按照南京凯基生物有限公司全蛋白提取试剂盒说明书执行。随后按照上海生工生物工程技术服务有限公司BCA蛋白定量试剂盒说明书测定蛋白量。经BCA定量后,10 μg样品蛋白进行SDS-PAGE分离,然后转移到PVDF膜上。用5%脱脂奶粉溶液室温封闭1 h后,加入抗caveolin-1(1∶10 000)抗体,4 ℃摇床过夜孵育12 h以上。 I 抗孵育结束后,弃去 I 抗,TBST洗膜 5 min×3次,加入羊抗兔 II 抗(1∶40 000),室温孵育1 h,TBST洗3次后使用化学发光法曝光显影。最后用Quantity One软件扫描条带,分析图像。
3.5激光共聚焦成像观察 将第1~2代细胞消化计数,种于含有玻璃盖片的6孔板中,培养24 h后,用含2%胎牛血清的M199培养基同步化细胞,同步化次日加入相应处理因素,处理好的细胞再培育24 h,随后弃去培养基,PBS洗涤2次后使用4%多聚甲醛固定细胞15 min,用预冷的TBST轻柔洗涤细胞2次,再用含0.25% Triton X-100的TBST孵育细胞7 min进行打孔,随后使用碧云天封闭液封闭60 min,先后加入 I 抗、II 抗和Hoechst染色液进行不同时间孵育,封片避光过夜。最后在正置荧光显微镜下观察,进行激光扫描共聚焦观察。
4统计学处理
用SPSS 16.0 软件进行统计分析。计量资料用均数±标准差(mean±SD)表示。多组数据间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1HUVECs培养形态学观察及鉴定
HUVECs单层生长,早期呈小多角形,胞浆丰富,核清晰,细胞融合后呈典型铺路石样排列(图1)。CD31(血小板内皮细胞黏附分子1)被广泛应用于鉴定内皮细胞,本实验的流式细胞术分析结果显示,第1代和第2代人脐静脉内皮细胞的CD31阳性率分别为99.9%和99.6%,符合内皮细胞特性(图2)。
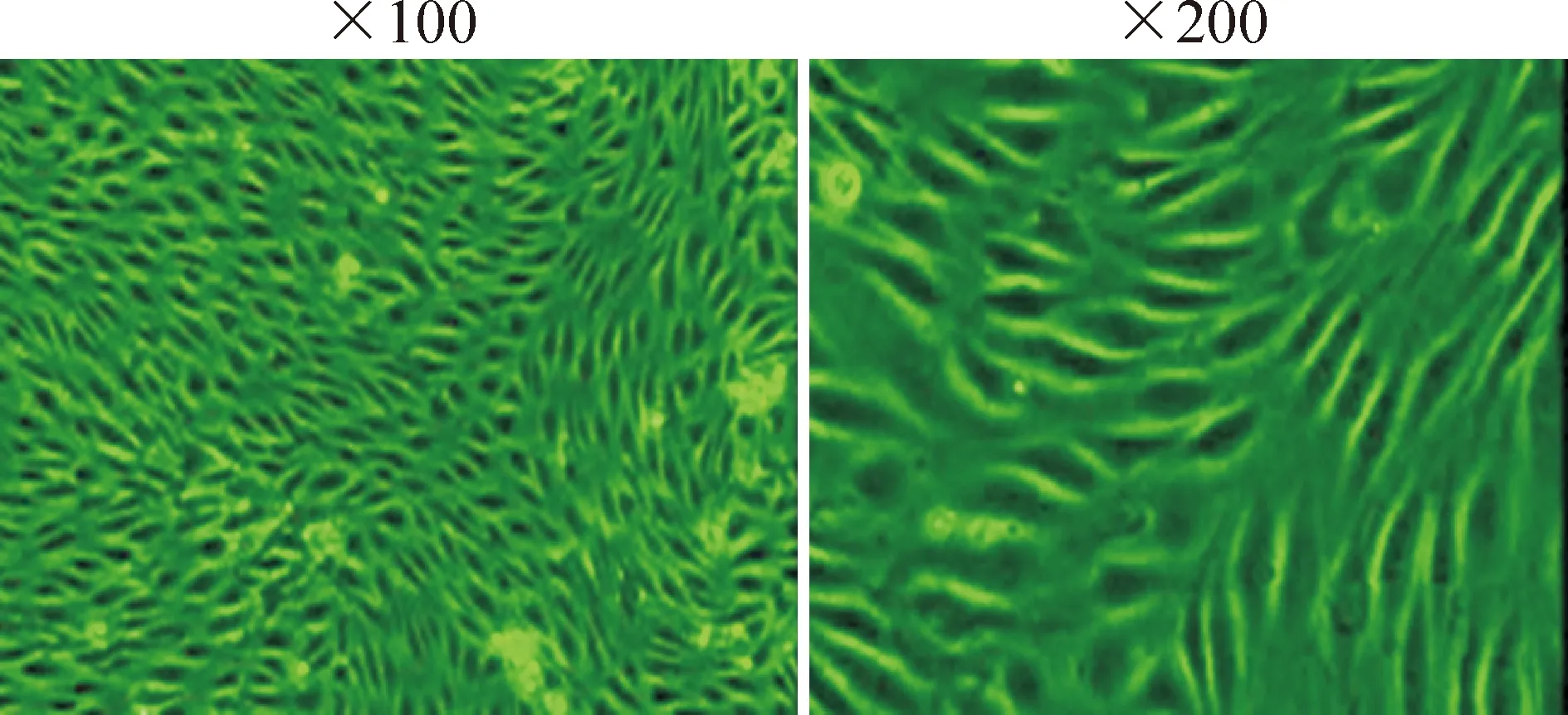
Figure 1. Normal appearance of HUVECs.
图1人脐静脉内皮细胞显微镜下形态

Figure 2. The identification of HUVECs via CD31 with flow cytometry. A: the cells at passage 1 (left: negative control; right: positive rate of CD31 on the surface of cells); B: the cells at passage 2 (left: negative control; right: positive rate of CD31 on the surface of cells).
图2流式细胞术检测细胞表面CD31鉴定内皮细胞
2Rb1对H2O2诱导的早熟性衰老HUVECsSA-β-Gal染色的影响
本课题组既往的研究显示40~100 μmol/L H2O2可以有效地诱导HUVECs衰老,且未引起明显凋亡,基于后续实验对细胞数目的要求,我们选用60 μmol/L H2O2刺激HUVECs建立衰老模型[6, 9]。从图3中我们可以看到,60 μmol/L H2O2刺激组与对照组相比,细胞形态失去铺路石样排列外观,细胞体积变大、呈扁平状,SA-β-Gal染色阳性细胞数明显升高(P<0.01)。Rb1 (10、20和40 μmol/L)作用于H2O2诱导的早熟性衰老HUVECs,与H2O2组相比,SA-β-Gal染色阳性细胞数明显降低(P<0.01),以20 μmol/L Rb1组效果最佳,见图3。
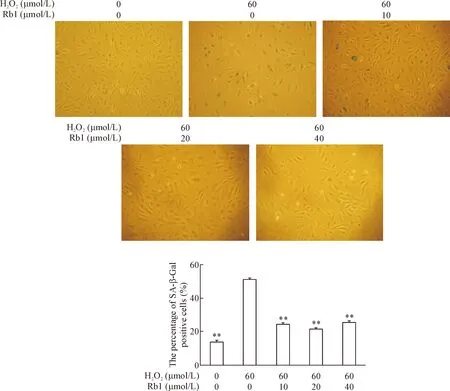
Figure 3. The effect of Rb1 pretreatment on H2O2-induced senescence in the HUVECs detected by SA-β-Gal staining (×100). Senescent cells were identified as blue-stained cells. Mean±SD.n=5.**P<0.01vsH2O2group.
图3不同浓度Rb1预处理对于各组细胞衰老染色的影响
3Rb1对H2O2诱导的早熟性衰老HUVECs细胞周期的影响
H2O2诱导的早熟性衰老模型组细胞G0/G1期比例明显高于对照组(P<0.05),S期细胞明显低于对照组(P<0.05);10 μmol/L Rb1作用于HUVECs,与衰老模型组相比,G0/G1期比例降低(P<0.05),S期细胞比例增多,但差异无统计学显著性;20和40 μmol/L Rb1作用于HUVECs,与衰老模型组相比,G0/G1期比例降低(P<0.05),S期细胞比例增多(P<0.05);20 μmol/L Rb1组与40 μmol/L Rb1组各期细胞比例的差异无统计学显著性,见图4。
4Rb1对H2O2诱导的早熟性衰老HUVECscaveolin-1蛋白的影响
为了评估Rb1抗内皮细胞衰老是否与caveolin-1有关,我们分别使用Western blot和激光共聚焦技术对caveolin-1蛋白表达进行了检测。Western blot结果显示,与对照组相比,60 μmol/L H2O2组的caveolin-1蛋白表达明显增多,Rb1(10、20和40 μmol/L)预处理后,caveolin-1表达减少。其中,以20 μmol/L Rb1组的效果最佳(P<0.05),见图5。

Figure 4. The effect of Rb1 pretreatment on cell cycle in the HUVECs. The cell cycle was detected by flow cytometry with PI staining. Mean±SD.n=3.*P<0.05vsH2O2.
图4不同浓度Rb1预处理对于各组细胞周期的影响
同时,我们采用激光共聚焦技术对caveolin-1的蛋白表达进行了检测。如图6所示,与对照组相比,60 μmol/L H2O2组内皮细胞胞浆体积明显增大,形态扁平,caveolin-1荧光强度变强,其在胞膜和胞浆分布均增多,说明caveolin-1蛋白表达明显增多;20 μmol/L Rb1预处理后,胞浆体积有所减小,caveolin-1荧光强度变暗,胞膜和胞浆分布均减少,说明其表达减少。

Figure 5. The effect of Rb1 on the protein expression of caveolin-1 in the HUVECs. The protein level of caveolin-1 was evaluated by Western blot with caveolin-1 antibody. GAPDH served as loading control. Mean±SD.n=3.*P<0.05vsH2O2.
图5Rb1对HUVECscaveolin-1蛋白的影响
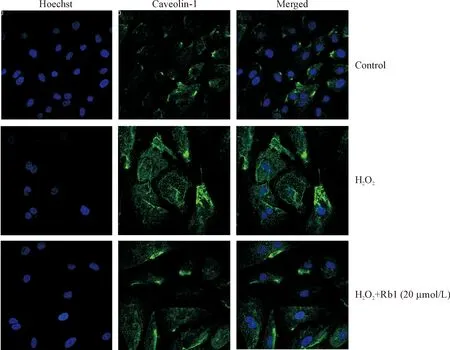
Figure 6. The effect of Rb1 on the expression of caveolin-1 in the HUVECs evaluated by confocal laser-scanning microscopy (×400).
图6激光扫描共聚焦显微镜观察H2O2处理及人参皂苷Rb1预处理后HUVECscaveolin-1的表达
讨 论
本课题研究发现,60 μmol/L H2O2能够有效地诱导原代人脐静脉内皮细胞的衰老,而人参皂苷Rb1可通过抑制caveolin-1的表达发挥延缓H2O2诱导的人脐静脉内皮细胞早熟性衰老的作用。

胞膜窖是细胞质膜内陷形成的囊状结构。在大部分细胞类型包括内皮细胞,caveolin-1是胞膜窖的重要功能蛋白。Caveolin-1具有特殊的脚手架区(caveolin scaffolding domain,CSD),该区可介导ca-veolin-1与许多信号分子之间的直接作用,成为多条信号通路的枢纽中心,影响信号转导、细胞代谢、胆固醇平衡、自噬、肿瘤增殖或抑制等过程,近年来,其在细胞衰老方面的作用日益被关注[15]。Feng等[16]的研究发现caveolin-1与高糖诱导的人肾小球系膜细胞衰老有关,阻断caveolin-1能显著地减少细胞衰老,其可能与P53途径有关。Volonte等[1]的研究表明caveolin-1能结合Sirt1,从而抑制Sirt1的活性,促进成纤维细胞的衰老以及IL-6的分泌。Rippe等[17]在研究microRNA变化与内皮细胞衰老的关系时发现,caveolin-1抑制miR-133a,抑制eNOS的活性,在衰老人动脉内皮细胞中,caveolin-1表达增多。Powter 等[18]的研究发现胞膜窖可调控内皮细胞一种新的抗炎衰老表型,在H2O2诱导或过表达ARHGAP18/SENEX诱导的衰老内皮细胞中,胞膜窖和caveolin-1表达明显增多。与既往在不同细胞模型中的研究结果类似,我们的研究发现在氧化应激诱导的人脐静脉内皮细胞衰老模型中,caveolin-1表达明显增多,说明caveolin-1表达与内皮细胞衰老密切相关。
人参首见于《神农本草经》,具有“补五脏、安精神、定魂魄、止惊悸、除邪气、明目开心益智,久服轻身延年”等作用,其作为补气药在中国使用已超过2 000余年。人参皂苷Rb1是人参发挥药理作用的主要成分之一[19]。近年来,已有部分研究证实,人参皂苷Rb1在心血管及神经系统中具有保护作用[20-24]。Lan等[23]的研究证实人参皂苷Rb1可通过激活PI3K/Akt途径、抑制PKC从而改善同型半胱氨酸引起的内皮细胞损伤。Xu 等[24]的研究发现人参皂苷Rb1可上调NO水平、刺激ghrelin表达,保护同型半胱氨酸损伤的内皮细胞。我们的研究发现人参皂苷Rb1可改善内皮细胞衰老,目前人参皂苷Rb1抗内皮细胞衰老的研究并不多见。我们课题组既往的研究发现H2O2刺激的衰老内皮细胞ROS水平明显增加,MDA水平增高,SOD1活性明显下降,细胞内SOD1 mRNA及蛋白水平明显减少,eNOS表达和NO含量明显下降,以上作用均能被人参皂苷Rb1有效地逆转[6, 9]。本研究中发现,在加入不同浓度人参皂苷Rb1预处理后,H2O2诱导的内皮细胞衰老能被有效地遏制,大且扁平、多形核的细胞数目减少,SA-β-Gal染色阳性细胞数明显减少,G0/G1期细胞比例降低,S期细胞比例增多,caveolin-1表达减少,说明人参皂苷Rb1具有抗衰老作用,其抗衰老作用可能与Rb1调节caveolin-1的表达相关。并且在大多数情况下,以20 μmol/L Rb1预处理的抗衰老效果最佳,提示在我们的研究中人参皂苷Rb1逆转H2O2诱导的内皮细胞衰老并不是剂量依赖的。本研究从caveolin-1角度进行探讨,发现人参皂苷Rb1抗衰老可能与Rb1调节caveolin-1的表达相关。我们的研究进一步丰富了人参皂苷Rb1抗内皮细胞衰老的机制。
本研究结果表明人参皂苷单体Rb1可能通过抑制caveolin-1的表达发挥延缓H2O2诱导的人脐静脉内皮细胞早熟性衰老的作用。本课题探索了人参皂苷Rb1防治内皮细胞衰老的可行性及部分机制,但仍需在体外及体内实验进一步深入探讨其上游及下游机制。
[1] Volonte D, Zou H, Bartholomew JN, et al. Oxidative stress-induced inhibition of Sirt1 by caveolin-1 promotes p53-dependent premature senescence and stimulates the secretion of interleukin 6 (IL-6)[J]. J Biol Chem, 2015, 290(7): 4202-4214.
[2] Nazari-Shafti TZ, Cooke JP. Telomerase therapy to reverse cardiovascular senescence[J]. Methodist Debakey Cardiovasc J, 2015, 11(3): 172-175.
[3] Yi TN, Zhao HY, Zhang JS, et al. Effect of aspirin on high glucose-induced senescence of endothelial cells[J]. Chin Med J (Engl), 2009, 122(24): 3055-3061.
[4] Lei J, Gu X, Ye Z, et al. Antiaging effects of simvastatin on vascular endothelial cells[J]. Clin Appl Thromb He-most, 2014, 20(2): 212-218.
[5] Kao CL, Chen LK, Chang YL, et al. Resveratrol protects human endothelium from H2O2-induced oxidative stress and senescence via SirT1 activation[J]. J Atherosclerosis Thrombosis, 2010, 17(9): 970-979.
[6] Liu DH, Chen YM, Liu Y, et al. Rb1 protects endothe-lial cells from hydrogen peroxide-induced cell senescence by modulating redox status[J]. Biol Pharm Bull, 2011, 34(7): 1072-1077.
[7] Baudin B, Bruneel A, Bosselut N, et al. A protocol for isolation and culture of human umbilical vein endothelial cells[J]. Nat Protoc, 2007, 2(3): 481-485.
[8] Dimri GP, Lee X, Basile G, et al. A biomarker that identifies senescent human cells in culture and in aging skininvivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367.
[9] Liu DH, Chen YM, Liu Y, et al. Ginsenoside Rb1 reverses H2O2-induced senescence in human umbilical endothelial cells: involvement of eNOS pathway[J]. J Cardiovasc Pharmacol, 2012, 59(3): 222-230.
[10] Barton M, Husmann M, Meyer MR. Accelerated vascular aging as a paradigm for hypertensive vascular disease: prevention and therapy[J]. Can J Cardiol, 2016, 32(5): 680-686.e684.
[11] El Assar M, Angulo J, Rodriguez-Manas L. Oxidative stress and vascular inflammation in aging[J]. Free Radic Biol Med, 2013, 65: 380-401.
[12] Oeseburg H, Iusuf D, van der Harst P, et al. Bradykinin protects against oxidative stress-induced endothelial cell senescence[J]. Hypertension, 2009, 53(2): 417-422.
[13] Conti V, Corbi G, Simeon V, et al. Aging-related changes in oxidative stress response of human endothelial cells[J]. Aging Clin Exp Res, 2015, 27(4): 547-553.
[14] Zhou Y, Dong Y, Xu QG, et al. Mussel oligopeptides protect human fibroblasts from hydrogen peroxide (H2O2)-induced premature senescence[J]. Arch Gerontol Geriatr, 2014, 58(2): 293-299.
[15] Zou H, Stoppani E, Volonte D, et al. Caveolin-1, cellular senescence and age-related diseases[J]. Mech Ageing Dev, 2011, 132(11-12): 533-542.
[16] Feng X, Gao W, Li Y. Caveolin-1 is involved in high glucose accelerated human glomerular mesangial cell senescence[J]. Korean J Intern Med, 2016, Apr 6. [Epub ahead of print]
[17] Rippe C, Blimline M, Magerko KA, et al. MicroRNA changes in human arterial endothelial cells with senescence: relation to apoptosis, eNOS and inflammation[J]. Exp Gerontol, 2012, 47(1): 45-51.
[18] Powter EE, Coleman PR, Tran MH, et al. Caveolae control the anti-inflammatory phenotype of senescent endothelial cells[J]. Aging Cell, 2015, 14(1): 102-111.
[19] Cheng Y, Shen LH, Zhang JT. Anti-amnestic and anti-aging effects of ginsenoside Rg1 and Rb1 and its mechanism of action[J]. Acta Pharmacol Sin, 2005, 26(2): 143-149.
[20] 谢 薇, 夏凌辉, 方 峻, 等. 人参皂苷Rb1对白消安诱导人脐静脉内皮细胞表达PAI-1、TF和TGF-β1的影响[J]. 中国病理生理杂志, 2008, 24(9):1856-1858.
[21] 朱陵群, 范吉平, 黄啟福, 等. 人参皂苷Rb1对大鼠胎鼠海马神经细胞凋亡的影响[J]. 中国病理生理杂志, 2001, 17(12):1229-1231.
[22] Wang S, Li M, Guo Y, et al.Effects of Panax notoginseng ginsenoside Rb1 on abnormal hippocampal microenvironment in rats[J]. J Ethnopharmacol, 2017, 202:138-146.
[23] Lan TH, Xu ZW, Wang Z, et al. Ginsenoside Rb1 prevents homocysteine-induced endothelial dysfunction via PI3K/Akt activation and PKC inhibition[J]. Biochem Pharmacol, 2011, 82(2): 148-155.
[24] Xu Z, Lan T, Wu W, et al. The effects of ginsenoside Rb1 on endothelial damage and ghrelin expression induced by hyperhomocysteine[J]. J Vasc Surg, 2011, 53(1): 156-164.
(责任编辑: 陈妙玲, 罗 森)
Rb1 protects human umbilical vein endothelial cells from hydrogen peroxide-induced senescence: involvement of caveolin-1
LIU Ding-hui1, WU Lin1, YU Shu-jie1, ZHOU Bin1, WANG Min1, LIU Yong1, HAO Bao-shun1, ZHENG Zhen-da1, QIAN Xiao-xian1, 2
(1Department of Cardiology, The Third Affiliated Hospital,2Institute of Integrated Traditional Chinese and Western Medicine, Sun Yat-sen University, Guangzhou 510630, China. E-mail: xiaoxianq@qq.com)
AIM: Endothelial cell senescence has been proposed to be involved in endothelial dysfunction and atherogenesis. This study aims to investigate the effects of ginsenoside Rb1, a major constituent of ginseng, on hydrogen peroxide (H2O2)-induced endothelial cell senescence, and to explore the expression and production of caveolin-1 in H2O2-induced premature senescence.METHODS: The senescence of primary human umbilical vein endothelial cells (HUVECs) was induced by H2O2as judged by morphology inspection, senescence-associated β-galactosidase (SA-β-Gal) staining and cell cycle detection. The protein expression of caveolin-1 was determined by Western blot and confocal laser-scanning microscopy.RESULTS: Treatment of the HUVECs with H2O2at 60 μmol/L induced premature senescence, as judged by enlarged, flattened cell morphology, increased SA-β-Gal activity and sustained growth arrest. H2O2effectively increased caveolin-1 level. Pretreatment of the HUVECs with Rb1 was found to reverse endothelial cell senescence, as witnessed by a significant decrease in senescent cell numbers and a decreased percentage of G0/G1phase cells. Furthermore, Rb1 administration reversed the H2O2-increased protein level of caveolin-1.CONCLUSION: Ginsenoside Rb1 antagonizes H2O2-induced endothelial cell senescence through caveolin-1 modulation.
Cell senescence; Caveolin-1; Human umbilical vein endothelial cells; Ginsenoside Rb1
1000- 4718(2017)09- 1544- 07
2017- 02- 06 [
] 2017- 03- 22
国家自然科学基金资助项目(No. 81370447); 广东省自然科学基金博士启动项目(No. 2015A030310048)
R363.2
A
10.3969/j.issn.1000- 4718.2017.09.002
△通讯作者 Tel: 0738-85252168; E-mail: xiaoxianq@qq.com
