共济失调毛细血管扩张症1例病例报告
2017-09-22朱冠忠王春林方燕兰朱建芳
朱冠忠 梁 黎 王春林 方燕兰 朱建芳
·病案报告·
共济失调毛细血管扩张症1例病例报告
朱冠忠 梁 黎 王春林 方燕兰 朱建芳
1 病例资料
患儿,女,10岁2个月,因“步态不稳4年、反复咳嗽2年”于2014年11月24日收治入浙江大学医学院附属第一医院(我院)儿科。
患儿于2010年下半年在家中无明显诱因出现步态不稳、平衡感差,渐现讲话含糊不清,学习成绩仍保持中等水平,无头晕、头痛、呕吐和抽搐,无视物模糊等。近2年反复阵发性连声咳嗽,非犬吠样,咳毕无鸡鸣样回声,有时伴喉头痰鸣,无喘息、气促和发绀,偶有发热,病后体重不增。先后在多家综合性医院神经科和中医科就诊,查尿有机酸和血酰基肉碱谱未见明显异常;头颅MRI示两侧小脑半球及小脑蚓部脑沟增宽;脊髓小脑共济失调(SCA)3/1型相关基因检测显示CAG重复数处于正常范围;诊断“小脑萎缩、营养不良”,多次给予“抗感染、止咳”或“穴位注射IVIG、理疗、中药”等综合治疗。咳嗽缓解、体温恢复正常,但步态不稳、话语含糊不清未改善。患儿系G2P1(第1胎社会因素人工流产),足月剖宫产,出生体重2.95 kg,无窒息抢救史。否认家族遗传病史、传染病接触史和生食蝲蛄、鱼蟹史。
体格检查:神志清楚,反应好,精神稍差,血压95/55 mmHg,身高121 cm(-2.6 SD),体重18 kg(-2.1 SD),略有气促,消瘦貌,腹壁皮下脂肪厚度0.2 cm;双眼结膜充血(图1A);双肺呼吸音粗,满布粗大湿啰音;心音中等强度,心律齐,未及器质性杂音;腹平软,肝、脾肋下未及;四肢活动欠灵敏,肌力、肌张力正常;指鼻试验阳性,双手快速轮换试验阳性,直线行走试验阳性。
实验室检查:血常规WBC 11.6×109·L-1,N 0.78,L 0.09,M 0.10,E 0.02;Hb 127 g·L-1,PLT 247×109·L-1。AFP 223.8 (0~20.0)ng·mL-1,血清血吸虫及肺吸虫抗体阴性,肝、肾功能正常。免疫球蛋白测定:IgG 5.6(8.0~18)g·L-1,IgA 1 820(900~4 500)mg·L-1,IgM 1 011(600~2 800)mg·L-1, IgE<20.0 mg·L-1;C3 1.15 (0.58~1.60)g·L-1,C4 0.22(0.07~0.49)g·L-1。X线胸片:两肺支气管炎征象(图1B)。视频脑电图:双侧额区尖样慢波活动;左侧额极、额、额中线区、前颞区尖波、尖慢复合波发放;睡眠期偶见右侧额、中央、前颞区尖波发放。头颅MRI:两侧小脑半球及小脑蚓部脑沟增宽,小脑萎缩(图1C)。
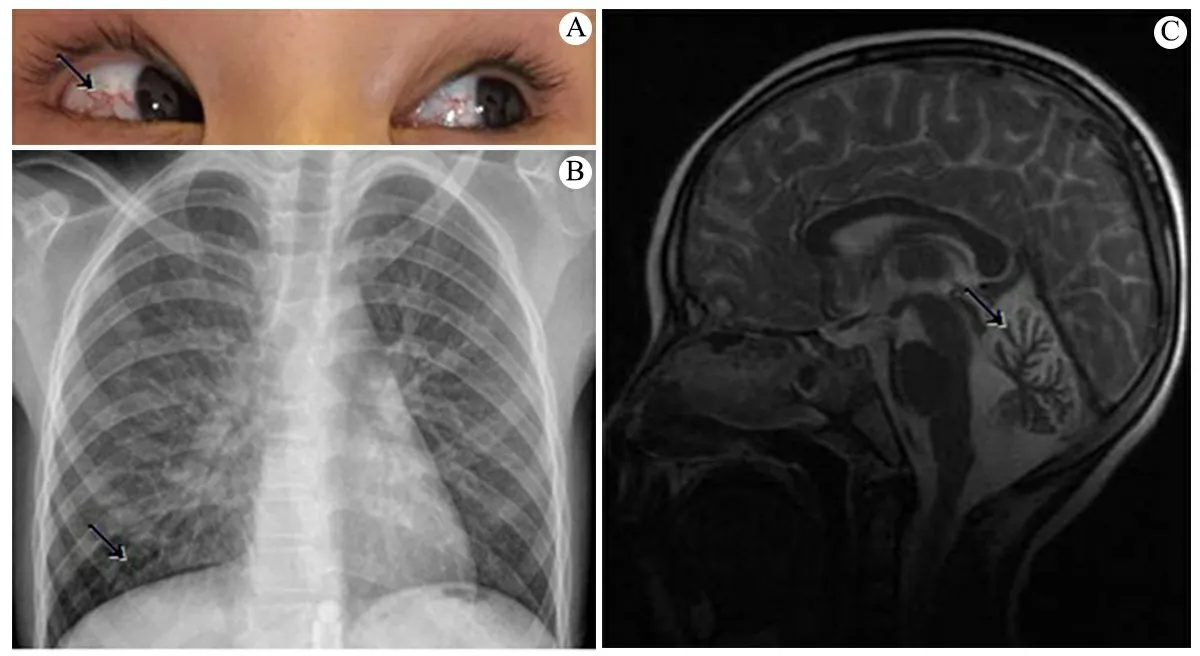
图1 患儿眼、肺和脑影像学所见图
注 A:眼结膜毛细血管扩张;B:X线胸片示支气管炎;C:头颅MRI示小脑萎缩
经我院儿科、神经科、眼科、影像科和感染科多学科讨论,根据患儿步态不稳、眼结膜毛细血管扩张和反复呼吸道感染等症状、体征和病史,临床诊断为共济失调毛细血管扩张症(AT),急性支气管炎。
因既往诊断与基础疾病存在较大程度的不符,为探求疾病的原因,经我院伦理委员会备案,在征得了患儿及其家属知情同意后,并行Sanger验证对患儿及其父母进行ATM全基因外显子及其剪切位点测序。患儿34号外显子检测到来自父亲的ATM基因突变c.5170G>T,55号外显子检测到来自母亲的ATM基因突变, c.8053_8067del TCATTTAAAGCAGAA(图2)。
治疗:住院期间,予头孢呋辛、输注人免疫球蛋白和雾化吸入等,于入我院第3 d气促缓解,咳嗽逐渐好转,10 d后出院。
近期随访,患儿步态不稳、语言含糊情况无好转,呼吸道感染次数有所减少。
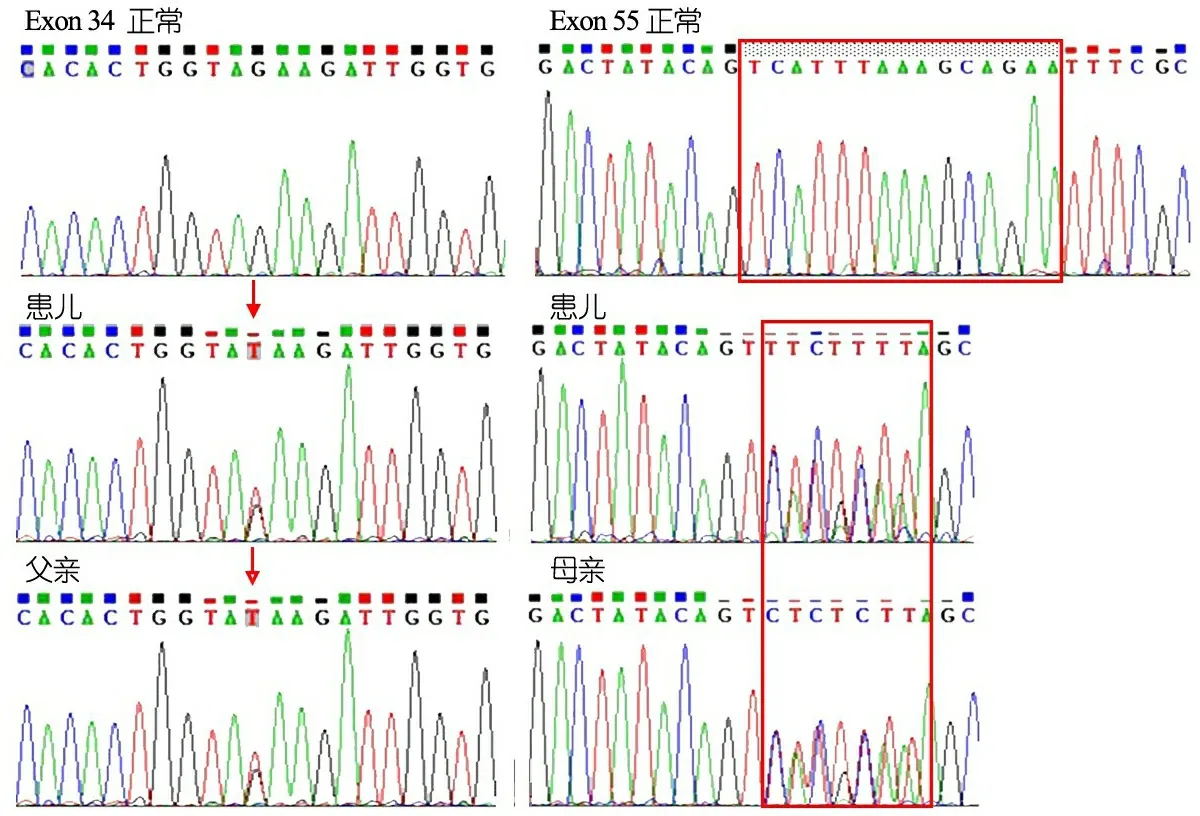
图2 共济失调毛细血管扩张症患儿的ATM基因测序
注 左图显示患儿Exon34突变c.5170G>T,来自患儿父亲;右图显示患儿Exon55突变c.8053_8067delTCATTTAAAGCAGAA,来自母亲
2 讨论
AT又称Louis-Bar综合征,是一种累及多系统的常染色体隐性遗传疾病,人群发病率1/40 000~1/200 000。该病主要累及神经系统、免疫系统和皮肤,患儿多于10岁之前出现症状,临床表现为进行性小脑共济失调,眼结膜毛细血管扩张,反复呼吸道感染,免疫缺陷,放射敏感,易患恶性肿瘤,病程晚期患儿多死于感染或肿瘤[1-3]。AT临床诊断首先需重视症状与体征,本文患儿体征中的眼结膜充血(眼结膜毛细血管扩张)在入我院前一直未被重视,是导致延误诊断的主要原因。临床中比较常见的遗传性共济失调为SCA3型与1型,本文患儿在外院检测SCA 3/1型相关基因提示CAG重复数处于正常范围,据此排除了遗传性共济失调,犯了基因诊断的选择性错误。
AT为单基因遗传病,其致病基因于1988年被Gatti等首先报道定位于11q22.3[4]。1995年以色列遗传学家Shiloh确定该疾病致病基因为ATM[5]。该基因全长约 150 kb,cDNA 12 kb,共有66个外显子,第4外显子为第1个编码外显子,开放阅读框有9 168个核苷酸,编码1个有3 056个氨基酸残基、相对分子质量为350 000的高分子量蛋白激酶(ATM),该激酶属于磷酸肌醇3激酶相关蛋白激酶(PIKK)的家族成员[6, 7]。ATM是一种稳态蛋白激酶,在各种细胞信号通路中具有极其广泛的作用,与DNA损伤修复密切相关[8-12]。在正常细胞中ATM蛋白为无活性二聚体/四聚体,可以被快速激活并招募至DNA双链断裂位点,并随后激活DNA修复机制[8, 12]。由于AT患者缺失ATM功能,因此无法检测并修复自身DNA的损害。至此逐渐认识到AT是由ATM基因突变所致。
现在已知的AT发病机理为:ATM作为DNA损伤信号传导通路中重要的感应和调节基因,其编码的ATM蛋白在激活状态下磷酸化下游蛋白,通过调控细胞凋亡、DNA损伤修复和细胞周期关卡等维持基因组稳定性[13]。由于AT患儿ATM基因突变引起ATM蛋白功能缺失,使得受损DNA修复过程受阻,从而导致基因组不稳定、染色体断裂及染色体重排。同时此过程中可能形成或激活癌基因增加了AT患者发生白血病、淋巴瘤和乳腺癌等恶性肿瘤的风险。病理机制可以解释AT患者临床症状的多系统表现,包括皮肤毛细血管扩张、放射敏感、免疫缺陷和易患肿瘤倾向。然而,ATM基因在神经元细胞的发育以及对神经元保护中的功能并不如其在其他类型细胞中的作用那么清楚。研究显示,线粒体功能缺陷、活性氧积累、先天性免疫反应、细胞凋亡调节或特异性修复途径缺陷均可能有助于引发神经元细胞死亡[14-16]。参与协调运动的小脑神经细胞易受到ATM蛋白缺失的影响,因此,保护神经元功能需要有效的DNA修复,只是其发挥相应功能的具体细节不明确。尽管ATM基因突变引起AT的机制尚不完全清楚,但基因测序为AT的诊断提供了可靠有效的方法, 在很大程度上解决了临床诊断困难的问题。
迄今,国际上已发现 400 余个ATM基因突变位点,突变位点遍布基因全长,无突变热点。突变类型中,绝大多数为复合性杂合突变,突变形式有错义突变、无义突变、剪切位点突变、小片段插入突变、小片段缺失突变、大片段缺失和同义突变等;国内仅1篇文献报道中的2例患儿有基因诊断[17],共检测到3种突变,分别为11号外显子的1346G>C的错义突变、6号外显子610G>T的无义突变和47号外显子6679C>T的错义突变。本文报告的患儿存在2种ATM基因新突变,提示患儿为复合杂合突变。在Hapmap和dbaSNP数据库中未检索到2种新突变的相应频率。应用MutationTaster和Polyphen进行蛋白功能预测,结果提示具有致病性。致病原因为基因突变引起氨基酸序列及剪接位点发生改变,从而影响蛋白质功能,推测由此导致AT的发生。
迄今该病尚无有效的方法。基因治疗似乎是较有前景的手段,但就目前而言,大分子的基因片段通过血脑屏障存在较大困难[6],提高免疫力及预防感染是治疗的关键。
[1] Perlman SL, Boder DE, Sedgewick RP, et al. Ataxia-telangiectasia. Handb Clin Neurol, 2012,103:307-332 .
[2] Lavin MF. Ataxia-telangiectasia: from a rare disorder to a paradigm for cell signalling and cancer. Nat Rev Mol Cell Biol, 2008,9(10):759-769
[3] Taylor AM, Lam Z, Last JI, et al. Ataxia telangiectasia: more variation at clinical and cellular levels. Clin Genet, 2015,87(3):199-208 .
[4] Gatti RA, Berkel I, Boder E, et al. Localization of an ataxia-telangiectasia gene to chromosome 11q22-23. Nature, 1988,336(6199):577-580 .
[5] Shiloh Y. Ataxia-telangiectasia: closer to unraveling the mystery. Eur J Hum Genet, 1995,3(2):116-138 .
[6] Chaudhary MW, Al-Baradie RS. Ataxia-telangiectasia: future prospects. Appl Clin Genet, 2014,7:159-167 .
[7] Baretic D, Williams RL. PIKKs—the solenoid nest where partners and kinases meet. Curr Opin Struct Biol, 2014,29:134-142 .
[8] Shiloh Y, Ziv Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nat Rev Mol Cell Biol, 2013,14(4):197-210 .
[9] Shiloh Y. ATM: expanding roles as a chief guardian of genome stability. Exp Cell Res, 2014,329(1):154-161 .
[10] Shiloh Y, Lederman HM. Ataxia-telangiectasia (A-T): An emerging dimension of premature ageing. Ageing Res Rev, 2017,33:76-88 .
[11] Guleria A, Chandna S. ATM kinase: Much more than a DNA damage responsive protein. DNA Repair (Amst), 2016,39:1-20 .
[12] Awasthi P, Foiani M, Kumar A. ATM and ATR signaling at a glance. J Cell Sci, 2016,129(6):1285 .
[13] Yang C, Hao J, Kong D, et al. ATM-mediated Mad1 Serine 214 phosphorylation regulates Mad1 dimerization and the spindle assembly checkpoint. Carcinogenesis, 2014,35(9):2007-2013 .
[14] Coufal NG, Garcia-Perez JL, Peng GE, et al. Ataxia telangiectasia mutated (ATM) modulates long interspersed element-1 (L1) retrotransposition in human neural stem cells. Proc Natl Acad Sci U S A, 2011,108(51):20382-20387 .
[15] Valentin-Vega YA, Kastan MB. A new role for ATM: regulating mitochondrial function and mitophagy. Autophagy, 2012,8(5):840-841 .
[16] McKinnon PJ. ATM and the molecular pathogenesis of ataxia telangiectasia. Annu Rev Pathol, 2012,7:303-321 .
[17] 江泓, 唐北沙, 胡正茂, 等. 共济失调毛细血管扩张症两例患者临床与ATM基因突变研究. 中华医学杂志, 2005,85(16):1117-1120
2017-07-15
2017-08-11)
(本文编辑:张崇凡,孙晋枫)
浙江大学医学院附属第一医院儿科 浙江杭州,310003
王春林,E-mail:hzwangcl@zju.edu.cn
10.3969/j.issn.1673-5501.2017.04.014
