β-酮硫解酶缺乏致非糖尿病性酮症酸中毒救治1例并文献复习
2017-09-22刘成军
白 科 周 昉 刘成军 许 峰
·论著·
β-酮硫解酶缺乏致非糖尿病性酮症酸中毒救治1例并文献复习
白 科 周 昉 刘成军 许 峰
目的 探讨β-酮硫解酶缺乏致非糖尿病性酮症酸中毒(NDKA)的救治方法。方法 报告1例β-酮硫解酶缺乏症患儿的3次NDKA发作,收集其临床症状、辅助检查结果和酸中毒抢救方案。文献复习儿童NDKA的救治策略。结果 患儿男,5月23 d,因“腹泻3 d,抽搐3 h” 于2013年5月31日入重庆医科大学附属儿童医院,血串联质谱3-羟基丁酰肉碱增高(58.71 μmol·L-1)、尿气相质谱示3-羟基丁酸显著增高(2 591.6 μmol·L-1),3-羟基丙酸(20.3 μmol·L-1)和乙酰甘氨酸(34.9 μmol·L-1)增高;基因测序,T2基因突变( c.456C>T),确诊β-酮硫解酶缺乏症。患儿于5、8和26月龄出现3次NDKA发作,均伴消化道症状、深大呼吸、轻度脱水及意识改变;3次入院时pH分别为7.15、7.09和7.03,HCO3-(mmol·L-1)分别为3.8、<3和4.8,尿酮体均3+,血糖(mmol·L-1)为4.3、5.1和4.7;首次NDKA发作时行连续性血液透析滤过(CHDF)酸中毒纠正不理想,入院81 h改胰岛素,89 h时酸中毒完全纠正;3次NDKA发作治疗中,5%NaHCO3剂量(mL·kg-1)分别为24、2.5和3 、胰岛素剂量(U·kg-1·h-1)分别为0.079、0.078和0.081 ,入院至酸中毒纠正时间(h)为89、60和21 。结论 β-酮硫解酶缺乏症NDKA发作治疗,CHDF疗效欠佳,NaHCO3的使用应谨慎,胰岛素疗效确切。
β-酮硫解酶缺乏症; 酮症酸中毒; 儿童
1 病例资料
患儿男,5个月23 d,以“腹泻3 d,抽搐3 h”为主诉,于2013年5月31日入重庆医科大学附属儿童医院(我院)重症监护室。
入院前3 d开始腹泻,无呕吐;入院前3 h气促,面色苍白,呻吟,神志不清,频繁抽搐;无发热,咳嗽;纳差、小便少。
患儿系G4P2,39+6孕周剖宫产,无窒息抢救史,出生体重3 900 g。既往有2次上呼吸道感染病史。父母否认近亲结婚,否认遗传疾病史。家族成员无类似病史。
体格检查:呼吸65·min-1,心率176·min-1,血压96/69 mmHg,SaO298%,体重8 kg。嗜睡,轻度脱水貌,深大呼吸。双肺音粗,无罗音;心音稍低顿,律齐;腹软,肝、脾未及肿大;四肢肌张力稍低,肢端稍凉,病理征阴性。
实验室检查:血气分析pH 7.15,PCO211 mmHg、HCO3-3.8 mmol·L-1,阴离子间隙(AG) 30.1,尿酮体3+,血糖4.3 mmol·L-1。肝肾功能、心肌酶和脑脊液生化检查指标均在正常值范围。2013年6月6日,血串联质谱结果显示3-羟基丁酰肉碱58.71 (0~0.60)μmol·L-1,尿气相质谱结果显示3-羟基丁酸2 591.6(0~3.7)μmol·L-1,3-羟基丙酸20.3(0~1.1)μmol·L-1,乙酰甘氨酸34.9(0~0.1)μmol·L-1。
影像学检查: X线胸片示双肺纹理增多。头颅MRI(图1A)示,DWI见双侧豆状核对称性片状高信号影,其他序列信号改变不明显,其余脑实质未见明显异常信号影。脑电图示镇静状态下背景呈弥漫性1.5~3.5 Hzδ活动。
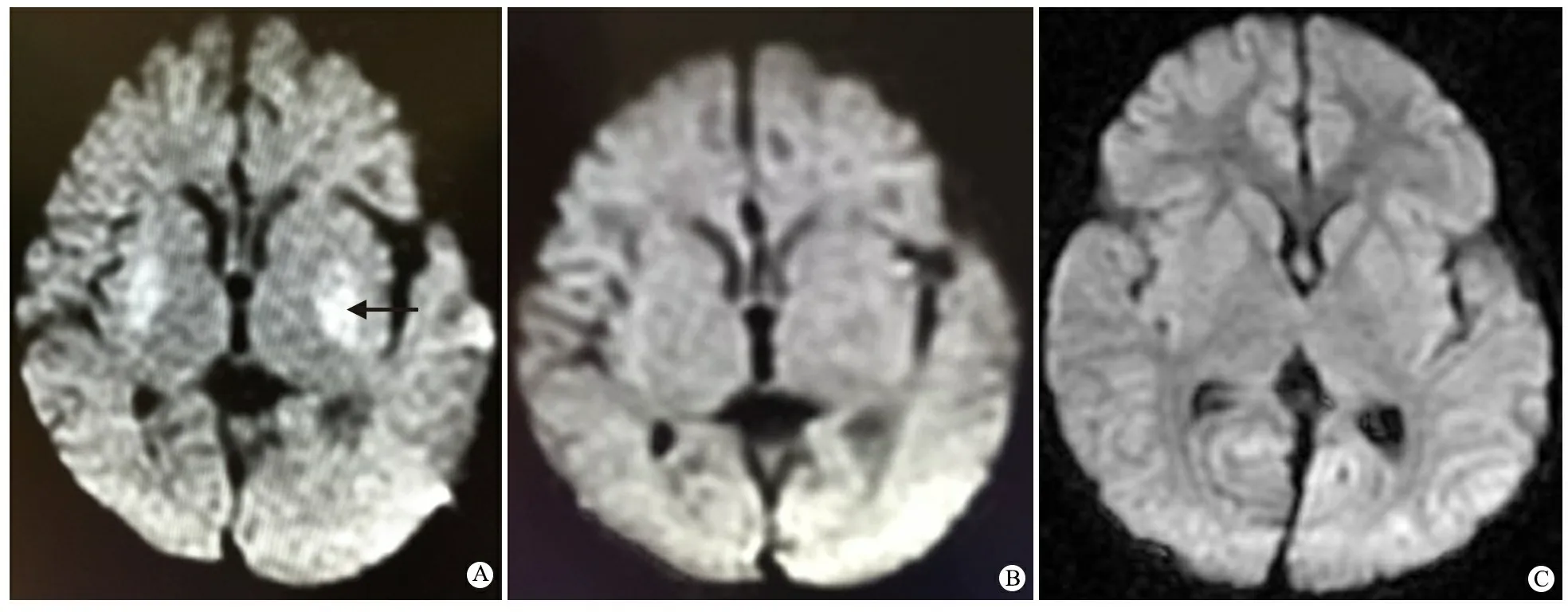
图1 患儿头颅MRI检查DWI图像
注 A:2013年6月5日,箭头所指双侧豆状核对称性异常信号;B:2013年7月28日,未见明显异常;C:2017年8月17日,未见明显异常
基因测序: 患儿反复出现非糖尿病性酮症酸中毒(NDKA),串联质谱分析显示异亮氨酸及酮体分解障碍,故在患儿父母知情同意下行β-酮硫解酶(T2)基因测序,外显子5第46位碱基C突变为T( c.456C>T),相关结果见文献 .
[1]。
诊断:入院时深大呼吸、血气分析提示高AG型代谢性酸中毒且血糖不高,诊断NDKA;血、尿代谢筛查结果提示酮体分解障碍;根据T2基因测序结果明确诊断β-酮硫解酶缺乏症(βKTD)。
治疗:给予5%NaHCO3(24 mL·kg-1)和持续血液透析滤过(CHDF),酸中毒纠正不理想,予胰岛素(4~6 g葡萄糖/1 U胰岛素),监测血钾并适时补钾,酸中毒完全纠正,治疗经过见图2。第5 d患儿生命体征稳定后出ICU。第12 d患儿无酸碱失衡等内环境紊乱,神清,反应可,四肢肌张力未见异常,病理征未引出,出院,嘱低蛋白饮食、避免饥饿等。出院后1月余复查头颅MRI,未见异常(图1B)。
2013年8月17日(8个月9天,体重8 kg)因“呕吐、腹泻、发热1天”第2次入我院,于2015年2月24日(2岁2个月,体重12 kg)因“暴食后,呕吐、气促半天”第3次入我院,均有嗜睡,AG值分别为34.4和27.5,血糖分别为5.1和4.7 mmol·L-1,血钾分别为4.6和5 mmol·L-1,血乳酸分别为1和1.2 mmol·L-1,血氨分别为105和36 mmol·L-1,给予胰岛素后酸中毒纠正,治疗经过详见图2。
随访:随访至2017年8月17日(4岁8月),体重15 kg,无惊厥发作,头颅MRI未见异常(图1C),血串联质谱及尿气相质谱未见异常,韦克斯勒氏测验结果轻度低下(语言IQ 62,操作IQ 78,总IQ 66)。
3 讨论
βKTD又称线粒体乙酰乙酰基辅酶A硫解酶缺乏症,是异亮氨酸代谢障碍的常染色体隐性遗传病[2]。T2在异亮氨酸分解第6步中使2-甲基-乙酰乙酰基辅酶A分解为乙酰辅酶A和丙酰辅酶A,T2也在酮体分解和脂肪酸氧化过程中起重要作用[3]。T2 缺乏导致上游产物堆积,临床以血和尿液中酮体增加、酸中毒和有机酸尿(尿液中2-甲基乙酰乙酸、3-羟基丁酸和甲基巴豆酰甘氨酸异常增高)等为主要特征[1],通过纤维母细胞、淋巴细胞β-酮硫解酶活性测定或基因检测而确诊[4]。本文患儿表现为NDKA,血串联质谱结果显示3-羟基丁酰肉碱升高,尿气相质谱结果显示3-羟基丁酸升高,基因测序提示T2基因突变c.456C>T,确诊βKTD。自1974 年Hillman等[5]首次报告βKTD以来,全世界报道βKTD病例百余例,βKTD发病率<1/10万[6]。该病临床表现变异较大,最常见生长发育障碍、间歇发作酮症酸中毒、低血糖、拒乳和呕吐等非特异性临床表现[7],可在上呼吸道、胃肠道感染或蛋白摄入过多后发生昏迷,严重者可致智力障碍、神经系统发育落后甚至死亡。βKTD急性发作期常表现为酮症酸中毒但不伴血糖升高,暂命名为NDKA,其救治是βKTD急性期抢救成功及决定预后的关键,迄今国内外尚少见关于βKTD患儿NDKA发作救治的详细报道。患儿3次NDKA发作情况,诱因均为胃肠炎,临床表现均有纳差、深大呼吸和轻度脱水,神经系统表现第1次入院为浅昏迷、惊厥,余2次为嗜睡;3次入院时尿酮均3+。
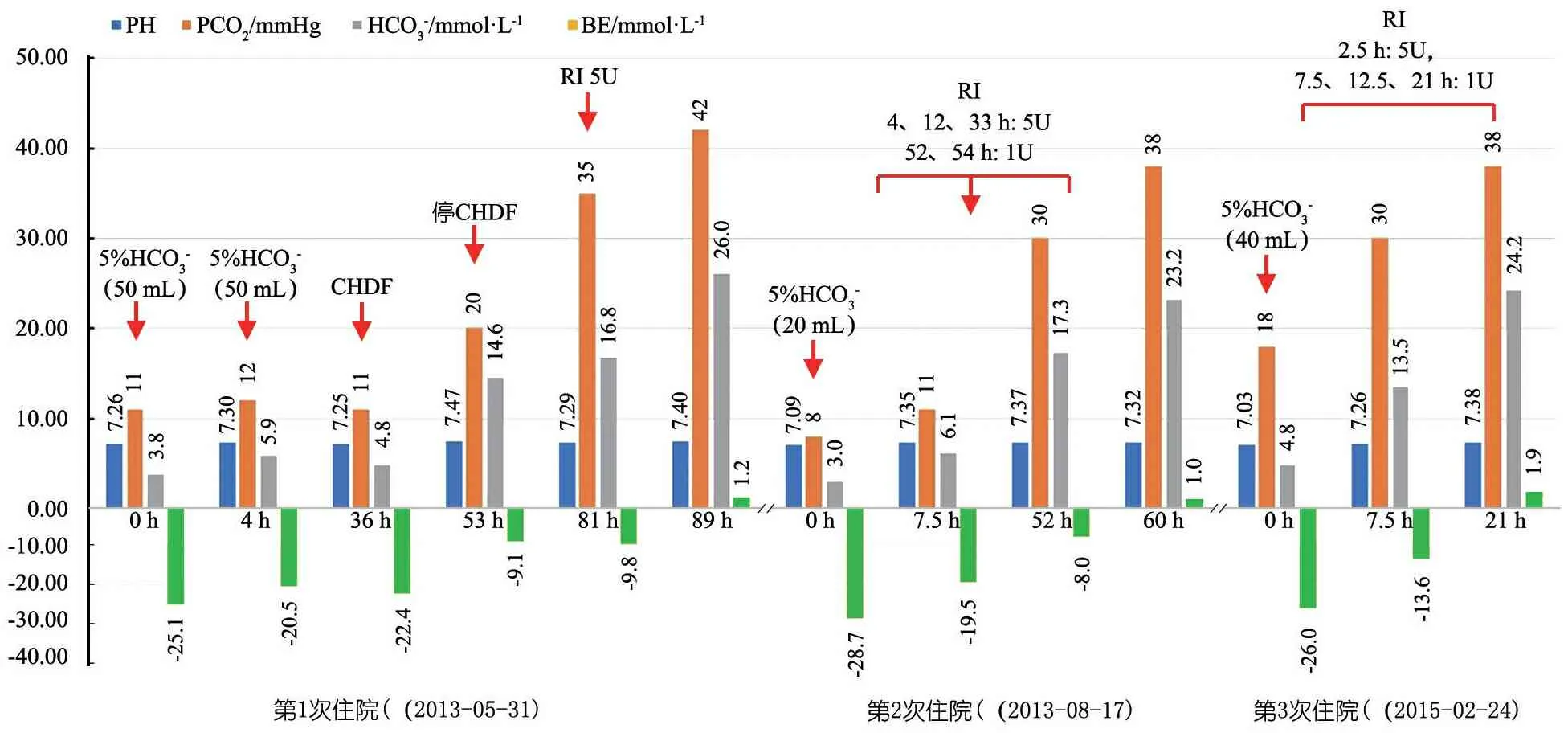
图2 患儿3次住院重要检查及治疗经过图
注 CHDF:持续血液透析滤过;RI:胰岛素
3.1 关于胰岛素的应用 肝内的游离脂肪酸是酮体的主要来源。胰岛素能抑制脂肪分解为游离脂肪酸、抑制酮体生成,从而纠正酮血症。本文患儿第1次NDKA发作时,予大剂量NaHCO3和CHDF,酸中毒纠正均不理想,至入院81 h予胰岛素,89 h时酸中毒得以完全纠正,尿酮体转阴;第2、3次NDKA发作时,分别于入院4 h和2.5 h起多次予胰岛素,入院60 h和21 h时酸中毒完全纠正,尿酮体转阴。后2次NDKA发作均未行CRRT治疗,仅小剂量应用NaHCO3,酸中毒完全纠正且时间缩短,提示胰岛素对βKTD患儿NDKA的治疗有效。但遗憾的是,患儿3次发作时均未行血胰岛素检测,该患儿的基础胰岛素水平如何不得而知。需要注意的是:①胰岛素的使用可以导致低血糖,且该类患儿血糖大多正常甚至偏低,更易出现低血糖,故予以4~6 g葡萄糖/1 U胰岛素比例,并加强血糖监测,调整葡萄糖与胰岛素比例,维持血糖正常高值,患儿3次住院治疗过程中均未出现严重低血糖或高血糖发生;②胰岛素可致钾离子向细胞内转移,从而导致低血钾的发生,故应加强监测,适时补钾。
3.2 关于早期补糖 T2缺乏时,异亮氨酸代谢障碍,2-甲基-乙酰乙酰基辅酶A堆积,使酮体生成增加,本例患儿第3次入院因暴食后发病,可能与异亮氨酸饮食摄入过多有关。同时,T2缺乏患儿在疾病状态下食纳减少,肝脏内糖原逐渐降低甚至耗竭,机体所需的能源由体内储存的脂肪取代之。脂肪分解代谢增强时往往伴随氧化不全,容易产生过多中间产物即酮体,进一步加剧酮体的生成。酮体生成增加,导致AG上升及HCO3-成比例减少,甚至出现酮症酸中毒临床表现。由此可见,对于βKTD患儿的NDKA发作,早期供糖、限制异亮氨酸和脂肪饮食摄入十分重要。文献报道[8],予低蛋白饮食(1.5 g·kg-1·d-1)、高碳水化合物维持血糖正常高值、补充肉碱(50 mg-1·d-1),有助于改善急性期NDKA症状。
3.3 关于碱性液体的应用 目前尚无证据表明使用NaHCO3对糖尿病酮症酸中毒(DKA)有任何明确的益处[9-12]。相反,有证据[12-15]表明,碳酸氢盐的使用可加重中枢神经系统酸中毒和组织缺氧,加重低钾血症,改变钙离子浓度,增加血浆渗透浓度等,因此,NaHCO3在DKA的患儿应用应谨慎。酮症酸中毒时,碳酸氢根离子减少是因酮体增加导致AG上升,因而βKTD患儿NDKA机制与DKA一致,其根本都在于酮体增加,故似乎βKTD患儿亦应慎重使用NaHCO3。但目前βKTD患儿病例数量有限,尚无关于βKTD患儿NaHCO3剂量与酸中毒纠正疗效相关的文献。许多学者[16-17]认为,严重酸中毒(pH<7.1)时应积极应用NaHCO3。本文患儿βKTD第1次NDKA发作,予大剂量NaHCO3(24 mL·kg-1),酸中毒纠正不理想,后2次NDKA发作时仅少量应用NaHCO3(2.5、3 mL·kg-1),而应用胰岛素后,酸中毒纠正均理想,提示NaHCO3的应用对酮症酸中毒的纠正疗效欠佳。但严重代谢性酸中毒可致心律失常、心肌收缩力减弱及心血管系统对儿茶酚胺敏感性降低等[18,19]。在DKA的研究中建议,仅当pH<6.9、循环系统功能不稳定时,可以考虑适量使用NaHCO3[20],通常予5%NaHCO31~2 mL·kg-1,稀释后在l h以上时间内缓慢输入,必要时重复。
3.4 关于连续性肾脏替代治疗(CRRT) 酮体(乙酰乙酸、β-羟基丁酸及丙酮)为小分子物质,其所致严重酸中毒理论上均可考虑予CRRT治疗,以减轻酮症酸中毒临床症状。有学者[6, 17]认为CRRT在酮症酸中毒的救治有效,但却几乎没必要。本文患儿首次发病时行CHDF治疗,酸中毒仅部分纠正,停CHDF、予胰岛素后酸中毒完全纠正,提示CHDF治疗βKTD所致NDKA疗效欠佳。考虑因CRRT治疗仅能降低血中酮体的浓度,而不能从根源上减少酮体的生成,随着CRRT治疗的结束,酮体浓度再次上升,使得临床表现反跳。
鉴于本文βKTD患儿每次发病均以血糖不高的酮症酸中毒为主要表现,血、尿代谢筛查需要约1周时间方能提示酮体分解障碍,患儿就诊2月基因测序结果出来后才得以确诊βKTD,为了便于患儿的早期诊治,将其诊断为NDKA,直到明确病因。
综上所述,NDKA是βKTD急性期的严重并发症,快速、安全有效地纠正酮症酸中毒是βKTD急性期抢救的关键。早期补糖/进食碳水化合物、限制异亮氨基酸及脂肪摄入可减少βKTD患儿酮体的产生及酮症的持续;虽病例资料有限,但胰岛素对βKTD患儿NDKA的救治似乎确切有效;CRRT对βKTD患儿酮症酸中毒的纠正疗效欠佳;NaHCO3在βKTD患儿酮症酸中毒时更应慎用。
[1] 李莉,朱岷,毛会音,等.T2基因突变致3-酮硫解酶缺乏症.重庆医科大学学报,2014,38(5),683-686 .
[2] Daum RS,Lamm PH,Mamer OA,et al. A 'new' isorder of isoleucine catabolism.Lancet, 1971,2(7737):1289-1290 .
[3] Catanzano F, Ombrone D, Di Stefano C, et al.The first case of mitochondrial acetoacetyl-CoA thiolase deficiency identified by expanded newborn metabolic screening in Italy: the importance of an integrated diagnostic approach. J Inherit Metab Dis, 2010,33(Suppl 3):S91-94 .
[4] Cook P, Walker V. Investigation of the child with an acute metabolic disorder. J Clin Pathol, 2011,64(3):181-191 .
[5] Hillman RE, Keating JP. Beta-ketothiolase deficiency as a cause of the "ketotic hyperglycinemia syndrome". Pediatrics,1974,53(2):221-225 .
[6] Abdelkreem E, Otsuka H, Sasai H, et al. Beta-ketothiolase deficiency: resolving challenges in diagnosis. J Inborn Errors Metab Screen, 2016, 4: 1-9 .
[7] Arica V, Arica SG, Dag H, et al. Beta-ketothiolase deficiency brought with lethargy: case report. Hum Exp Toxicol. 2011,30(10):1724-1727 .
[8] Akella RR, Aoyama Y, Mori C, et al. Metabolic encephalopathy in beta-ketothiolase deficiency:The first report from India. Brain Dev, 2014, 36(6):537-540 .
[9] Morris LR, Murphy MB, Kitabchi AE.Bicarbonate therapy in severe diabetic ketoacidosis.Ann Intern Med,1986,105(6):836-840 .
[10] Okuda Y, Adrogue HJ, Field JB, et aL Counterproductive effects of sodium bicarbonate in diabetic ketoacidosis.J Clin Endocrinol Metab, 1996, 81(1):314-320 .
[11] Green SM, Rothrock SG, Ho JD, et al. Failure of adjunctive bicarbonate to improve outcome in severe pediatric diabetic ketoacidosis.Ann Emerg Med,1998,31(1):41-48 .
[12] Assal JP, Aoki TT, Manzano FM, et al. Metabolic effects of sodium bicarbonate in management of diabetic ketoacidosis.Diabetes, 1974, 23(5):405-411 .
[13] Ohman JL Jr, Marliss EB, Aoki TT, et al. The cerebrospinal fluid in diabetic ketoacidosis.N Engl J Med, 1971, 284(6):283-290 .
[14] Soler NG, Bennett MA, Dixon K,et al.Potassium balance during treatment of diabetic ketoacidosis with special reference to the use of bicarbonate. Lancet, 1972, 2(7779):665-667 .
[15] Lever E, Jaspan JB.Sodium bicarbonate therapy in severe diabetic ketnacidesis.Am J Med,1983,75(2):263-268 .
[16] Morris AAM. Disorders of Ketogenesis and Ketolysis// Saudubray JM, Berghe GVD, Walter JH. Inborn Metabolic Diseases. Berlin Heidelberg:Springer-Verlag,2012:217-222 .
[17] Sass JO, Grünert SC. Disorders of Ketone Body Metabolism// Blau N, Duran M, Gibson KM, et al. Physician’s Guide to the Diagnosis, Treatment, and Follow-Up of Inherited Metabolic Diseases. Berlin Heidelberg:Springer-Verlag,2014:361-371 .
[18] Sun GH,Song J. Progress in Research on the Relationship Between Acute cardiovascular disease and Acid-Base Imbalance. Modem Instruments & Medical Treatment.2014:20(3):29-31 .
[19] Kim HJ, Son YK, An WS. Effect of Sodium Bicarbonate Administration on Mortality in Patients with Lactic Acidosis: A Retrospective Analysis. PLoS One,2013,8(6):e65283 .
[20] Narins RG, Cohen JJ.Bicarbonate therapy for organic acidosis:the case for its continued use.Ann Intern Med,1987,106(4):615-618
Rescue non-diabetic ketoacidosis caused by β-ketothiolase deficiency in one child and literature review
BAIKe,ZHOUFang,LIUCheng-jun,XUFeng
(Children'sHospitalofChongqingMedicalUniversity,Chongqing400014,China)
BAI Ke, E-mail: baike0052032@sina.com
ObjectiveTo study the rescue methods of non-diabetic ketoacidosis caused by β-ketothiolase deficiency. MethodsOne case of β-ketothiolase deficiency who suffered three episodes of non-diabetic ketoacidosis was reported. Clinical symptoms, auxiliary examination results and rescue methods of acidosis were retrospectively reviewed. The treatment strategies of non-diabetic ketoacidosis rescuing were summarized and literatures were reviewd. ResultsA 5 23/30 months old boy was admitted to the Children's Hospital of Chongqing Medical University on May 31,2013,because of "diarrhea 3 days, spasm 3 hours".The blood series mass spectrometry indicated that the 3-hydroxybutyl carnitine was increased (58.71 μmol·L-1); the urine gas phase mass spectra showed a significant increase (2 591.6 μmol·L-1), with the 3-hydroxypropyl acid (20.3 μmol·L-1), and acetyl glycine increased (34.9 μmol·L-1) and theT2 gene mutation was presented asT2 gene mutation, which confirmed the deficiency of beta-ketone thiolysis in the first hospitalization. He suffered three episodes of non-diabetic ketoacidosis respectively at the age of 5, 8 and 26 months .All three episodes were accompanied by gastrointestinal symptoms, deep breathing, mild dehydration and altered consciousness. The pH, HCO3-, urine acetone bodies and blood sugar were (7.15, 7.09, 7.03), (3.8, < 3, 4.8) mmol·L-1, (3+, 3+, 3+), (4.3, 5.1, 4.7) mmol·L-1respectively.The boy was treated with continuous hemodiafiltration in the first hospitalization, which lasted 17 hours, with ketoacidosis corrected partly. The ketoacidosis was corrected completely until 8 hours after using insulin, which was used 81 hours after admission.The time of correction of acidosis, the dosage of 5% sodium bicarbonateand and insulin dosage were (89, 60, 21) h, (24, 2.5, 3) mL·kg-1, (0.079, 0.078, 0.081) U·kg-1·h-1respectively. ConclusionFor NDKA treatment, insulin is effective, CRRT is not effective, and the use of sodium bicarbonate should be prudent.
β-ketothiolase deficiency; Ketoacidosis; Children
2017-06-26
2017-08-16)
(本文编辑:张崇凡,孙晋枫)
重庆医科大学附属儿童医院 重庆,400014
白科,E-mail: baike0052032@sina.com
10.3969/j.issn.1673-5501.2017.04.013
