体素内不相干运动弥散加权成像对儿童腹部良恶性肿瘤诊断价值
2017-09-22徐燕清马阳阳乔中伟
徐燕清 王 莉 龚 英 马阳阳 周 剑 乔中伟
·论著·
体素内不相干运动弥散加权成像对儿童腹部良恶性肿瘤诊断价值
徐燕清1王 莉2龚 英1马阳阳3周 剑1乔中伟1
目的 运用体素内不相干运动(IVIM)弥散加权(DW)MRI的方法,探讨IVIM双指数参数鉴别儿童腹部良恶性肿瘤的价值。方法 以儿童腹部肿瘤手术病理为金标准,术前1周内行IVIM DW-MRI检查为待测标准,对怀疑腹部肿瘤、不能完全确诊为良性肿瘤者行常规MRI(T1W、T2W和增强T1W)和DW序列。根据病理分为恶性组、良实性组、交界性组和良囊性组。选取b值范围0~800 s·mm-2,通过软件计算得到ADC值,使用肿瘤轮廓法勾画肿瘤的感兴趣区(ROI),计算D、D*和f值。结果 85例腹部肿瘤患儿(98个肿瘤)进入本文分析。男43例;平均年龄4.4岁;恶性组(52例,62块),交界性组(7例,7块),良实性组(21例,24块),良囊性组(5例,5块);ROI平均值12.9(1.3~26.1)cm2。ADC、D和D* 均体现在恶性组最低,交界性组、良实性组和良囊性组依次升高,差异均有统计学意义;ADC、D和D* 在恶性与非恶性肿瘤(实性+囊性)差异均有统计学意义;鉴别恶性和良实性肿瘤Cutoff(×10-6mm2·s-1)分别为1 367、1 056和1 605,ADC鉴别的特异度高(85.5%),D值鉴别的灵敏度高(83.3%),鉴别恶性和实性肿瘤(良实性+交界性)、恶性和非恶性肿瘤(良实性+交界性+良囊性)Cutoff(×10-6mm2·s-1)分别为1 173、1 014和1 634;鉴别恶性和实性肿瘤(良实性+交界性)ADC和D值特异度较好(87.1%和83.9%),鉴别恶性和非恶性肿瘤(良实性+交界性+良囊性),ADC、D和D*值特异度均良好(88.9%、86.1%和80.6%)。结论 IVIM DW-MRI中的ADC和D值对鉴别儿童腹部良恶性肿瘤有较好的诊断价值。
磁共振成像; 弥散加权; 体素内不相干运动; 腹部肿瘤; 手术病理; 儿童
儿童腹部肿瘤影像学检测和诊断手段主要包括B超、CT和MRI。目前B超主要用于肿瘤的初筛和超声引导下的手术穿刺活检术,CT检查的电离辐射使其在儿童中的应用受到限制。随着成像技术的改进,既往多用于神经系统的MRI检查,正在更多地用于腹部肿瘤检查,特别是基于分子水平的弥散加权成像(DW)手段,可以显示病变组织内小分子物质的热运动情况。体素内不相干运动(IVIM)DW是基于双指数模型,计算组织的真正弥散和灌注相关性弥散的方法,可以计算D(组织真正的弥散系数),D*(与灌注相关的组织弥散)和灌注分数(f)[1, 2]。本文旨在运用IVIM DW-MRI的方法,探讨IVIM双指数参数诊断儿童腹部肿瘤的价值。
1 方法
1.1 研究设计 以诊断准确性研究作为设计方案。以儿童腹部肿瘤手术病理为金标准,以术前IVIM DW-MRI为待测标准,评估不同性质腹部肿瘤的诊断价值。
1.2 诊断金标准 以手术病理为儿童腹部肿瘤诊断金标准,根据病理分为恶性组、良实性组、交界性组和良囊性组。
1.3 腹部肿瘤MRI检查 ①怀疑腹部肿瘤,不能完全确诊为良性肿瘤;②4岁以下患儿行DW-MRI检查使用10%水合氯醛镇静。
1.4 IVIM DW-MRI判读及参数标准 ①常规MRI(T1W、T2W、CE-T1W)和DW序列。②通过软件计算得到ADC值,ADC= [In(SIb/SI0)]/b,其中SI0代表b=0时的信号强度,SIb代表不同b值时的信号强度。③本研究选取b值范围0~800 s·mm-2,选取方法为6~8个b值(b值1:0、50、200、400、600和800 s·mm-2,b值2:0、50、100、200、400、600、800 s·mm-2,b值3:0、50、100、150、200、400、600和800 s·mm-2)。小b值(0~200 s·mm-2)ADC反映肿瘤血流灌注(D*),高b值(>200 s·mm-2)ADC(D)反映肿瘤的弥散受限程度,既往研究证明与肿瘤细胞的排列紧密程度有关。④肿瘤信号的测量:使用肿瘤轮廓法勾画肿瘤的感兴趣区(ROI),根据肿瘤大小设置,选取轴面肿瘤最大层面,尽可能全面地包括肿瘤实质部分而避免包括肿瘤边缘部分,再复制到DW各b值及ADC图;测量肿瘤实质成分时,尽量避开肿瘤坏死区;可疑肿瘤坏死区表现:在肿瘤中,T2W高信号,T1W增强无强化的区域。D、D*和f值计算公式:根据IVIM理论[1],SIb/SI0= (1-f) × exp (-b ×D) + f × exp(-b ×D*)。其中,SIb是不同b值下的图像信号强度,SI0是b=0 时的信号强度。
1.5 病例纳入和排除标准 ①临床考虑占位性病变,影像学(B超和/或CT)不能确定为良性,行MRI检查;②经手术并取得病理诊断结果;③排除术前行放疗、化疗者。
1.6 偏倚因素的控制 IVIM DW-MRI检测至手术均在1周内完成;均由2名具有5年以上腹部MRI经验的高年主治医师分别独立阅片和行ROI测量。
1.7 统计学分析 采用SPSS 22.0软件包对数据进行统计分析。对于连续性定量资料,首先采用S-W正态性分析比较其是否服从正态分布。对于不服从正态分布资料,采用中位数和四分位数间距描述其分布,采用Kruskal-Wallis H检验比较组间差异,采用卡方检验或Fisher确切概率法比较组间分类资料差异。根据病理分组的组间两两比较采用所有成对比较法,采用ROC曲线分析IVIM DW-MRI检测的ADC、D和D*值在鉴别恶性和良实性肿瘤、恶性和实性肿瘤(良实性+交界性)、恶性和非恶性(良实性+交界性+良囊性)肿瘤的价值。本文所有检验均为双侧检验,结果以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2012年7月28日至2013年10月30日符合本文纳入排除标准的85例腹部肿瘤患儿(98个肿瘤)进入本文分析。男43例;年龄2天至14岁,平均年龄4.4岁;恶性组(52例,62块):神经母细胞瘤19例(23块),肝母细胞瘤7例(9块),神经节神经母细胞瘤5例(6块),肾母细胞瘤5例(5块),淋巴瘤4例(4块),未成熟畸胎瘤2例(3块),盆腔胚胎性横纹肌肉瘤2例(2块)、肾透明细胞肉瘤1例(2块)、肾横纹肌样瘤1例(2块),骶前纤维肉瘤、肾上腺皮质癌、肾癌、睾丸内胚窦癌、骶尾部生殖细胞瘤、中胚层肾瘤各1例(1块);交界性组(7例,7块):胰腺囊实性瘤4例(4块),肾上腺皮质肿瘤2例(2块),纤维瘤病1例(1块);良实性组(21例,24块):成熟畸胎瘤6例(7块),节细胞神经瘤3例(4块),炎性肌母细胞瘤4例(4块),椎体结核1例(2块),肝脏局灶结节增生、肾上腺皮质增生、肾腺瘤、脾脏硬化性血管瘤伴结节性转化、脾血管瘤、隔离肺和Castleman病各1例(1块);良囊性组(5例,5块):卵巢囊肿和淋巴管瘤各2例(2块),胆总管囊肿1例(1块)。ROI平均值12.9(1.3~26.1)cm2。表1显示85例腹部肿瘤患儿的一般信息。图1显示,以左侧肾母细胞瘤为例常规MRI和DW-MRI图像。
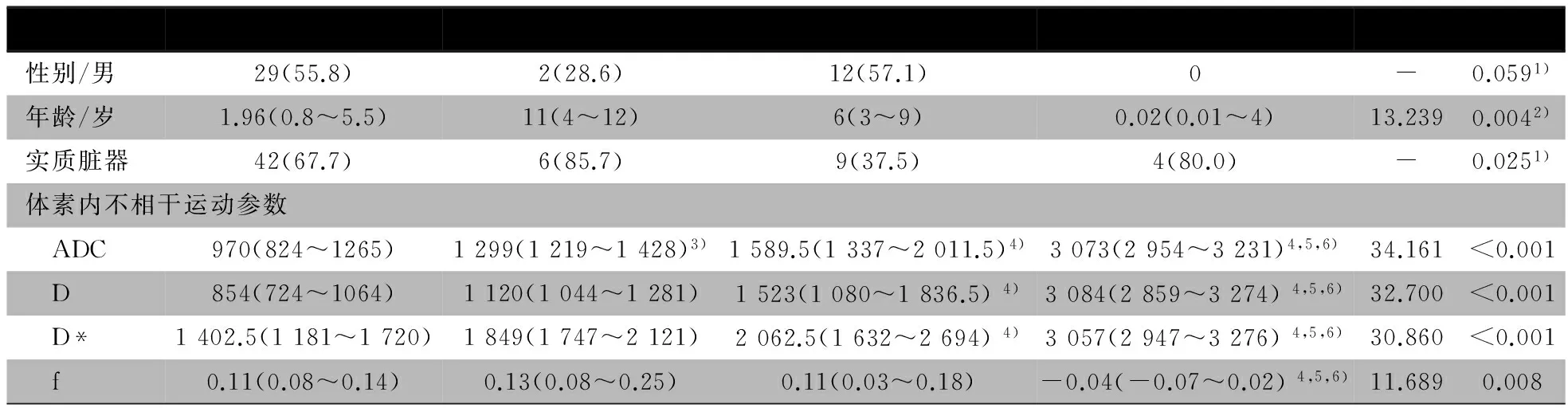
表1 85例腹部肿瘤患儿的一般特征和体素内不相干运动参数
注 1):采用Fisher确切概率法比较组间差异;2):采用kruskal-Wallis H检验比较组间差异;3):与恶性组比较P<0.05;4):与恶性组比较,P<0.01);5):与良实性组比较P<0.05;6):与交界性组比较P<0.05

图1 左侧肾母细胞瘤常规MRI及DW-MRI图像
注 左侧腹膜后见一巨大球形肿块,约118.9 mm×122.0 mm×148.3 mm,A:T1WI以低信号为主,中央呈片状高信号;B:T2WI稍高信号为主,夹杂片状、条索状高信号;C:CE-T1WI肿块实质部分明显强化,中央见大片低信号未强化区;D和E:DW b=400和b=800 s·mm-2肿瘤以高信号为主,其内夹杂点状低信号;F:ADC map,肿瘤以低信号为主,中央夹杂点状、片状高信号
2.2 不同性质肿瘤在IVIM不同参数中的两两比较 表1显示, ADC、D和D*均体现在恶性组最低,交界性组、良实性组和良囊性组依次升高,ADC、D和D*值差异均有统计学意义;ADC、D和D*在恶性组与非恶性(良实性+交界性+良囊性)差异均有统计学意义,仅在ADC值恶性组与交界性组差异有统计学意义,ADC、D和D*值在良实性组与良囊性组差异均有统计学意义,ADC、D、D*和f值在良囊性组和交界性组差异有统计学意义。
2.3 IVIM不同参数对恶性组与其他不同组别的诊断价值 图2和表2显示,①f值在恶性组和良实性组鉴别,恶性与实性(良实性+交界性)鉴别,恶性与非恶性(良实性+交界性+良囊性)的鉴别AUC均<0.6,P>0.05;②鉴别恶性和良实性ADC、D和D*值AUC差别不大(0.800、0.794和0.789),Cutoff分别为1 367、1 056和1 605,ADC的特异度更高(85.5%),D的灵敏度更高(83.3%);③鉴别恶性和实性(良实性+交界性)、恶性和非恶性(良实性+交界性+良囊性)ADC、D和D*值AUC差别不大(0.779~0.828),且ADC、D和D*值鉴别的灵敏度均<75%(69.4%~72.6%),Cutoff分别为1 173、1 014和1 634;鉴别恶性和实性(良实性+交界性)ADC和D值特异度较好(87.1%和83.9%),鉴别恶性和非恶性(良实性+交界性+良囊性),ADC、D和D*值特异度均良好(88.9%、86.1%和80.6%)。
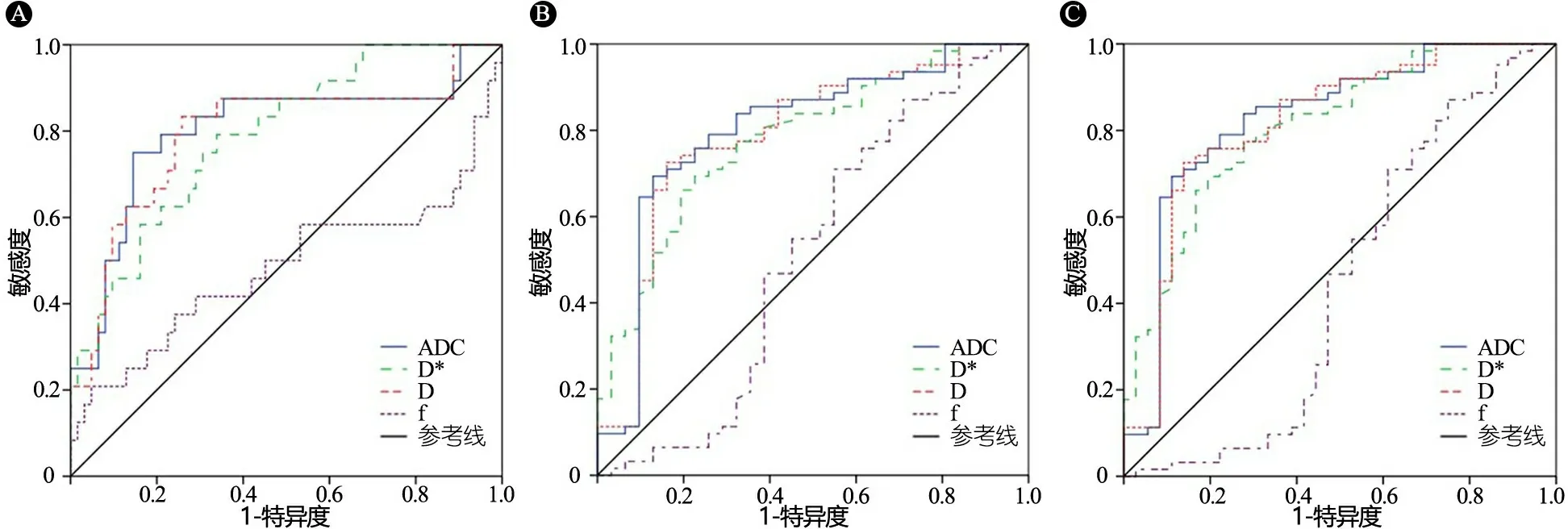
图2 体素内不相干运动(IVIM)不同参数对恶性组与其他不同组别的诊断价值
注 A:鉴别恶性和良实性肿瘤;B:鉴别恶性和良实性+交界性肿瘤;C:鉴别恶性和良实性+交界性+良囊性肿瘤

表2 体素内不相干运动(IVIM)参数对恶性组与其他组别的鉴别诊断
3 讨论
IVIM DW-MRI是基于双指数模型,计算组织的真正弥散和灌注相关性弥散的方法,可以计算D,D*和灌注分数f值[1,2]。D是指组织真正的弥散系数,D*是与灌注相关的组织弥散。活体生物组织的弥散包括水分子的弥散运动和血液的微循环(灌注)相关弥散。成人腹部器官和肿瘤的研究发现,腹部实体器官和实体肿瘤的ADC值显著高于相应的D值,表明 ADC值中存在着较大的灌注因素[3-8]。只有当弥散仅表现为该组织的分子运动,即仅有D时,ADC才与D值相等。
本文儿童肿瘤发病的年龄在不同组间差异有统计学意义,是受不同肿瘤性质中包含疾病的好发年龄所影响。良囊性组5例中3例为先天性肿瘤(淋巴管瘤2例,胆总管囊肿1例),出生后即可发病,因此诊断年龄最低;恶性组发病平均年龄2.0岁,恶性组52例腹部肿瘤患儿中,婴幼儿发病的肿瘤占71.2%(37例),包括神经母细胞瘤18例,肾母细胞瘤、肝母细胞瘤各5例,节细胞神经母细胞瘤、淋巴瘤、盆腔胚胎性横纹肌肉瘤、肾上腺皮质癌、肾透明细胞肉瘤、睾丸内胚窦癌、骶尾部生殖细胞瘤、中胚层肾瘤、未成熟畸胎瘤各1例;交界性组7例腹部肿瘤患儿,胰腺囊实性瘤、肾上腺皮质肿瘤和纤维瘤病均好发于学龄儿童,因此本文呈现交界性腹部肿瘤发病年龄最大(平均11岁)。
本文ADC、D和D*值在不同性质肿瘤间显示,恶性组最低,交界性组、良实性组、良囊性组依次升高。本文在b值测量范围(0~800 s·mm-2)内,ADC在鉴别恶性与非恶性(良实性+交界性+良囊性)差异有统计学意义,Kocaoglu等[9]以 b值0~800 s·mm-2的DW测量了31个儿童腹部肿瘤(16个良性肿瘤,15个恶性肿瘤),其良、恶性肿瘤的ADC值分别为(2.28±1.00)和(0.84±1.7)×10-3mm2·s-1。其研究中恶性肿瘤的ADC值与本研究接近;良性肿瘤的ADC值与本文比较,介于良实性肿瘤与良囊性肿瘤之间,考虑为其良性肿瘤包含了良实性和良囊性肿瘤的缘故。Gawande等[10]使用2个b值(0和500 s·mm-2,1.5T)和3个b值
(0、500和800 s·mm-2,3T)的DW测量了73个儿童腹部肿瘤(39个良性和34个恶性),恶、良性实性肿瘤的ADC值分别为1.07和1.6×10-3mm2·s-1,良、恶性实性肿瘤之间差异有统计学意义,与本文结果相似。文中有两组b值,作者证实在不同场强(1.5T和3T)下,得到的腹部肿瘤ADC值差异无统计学意义。既往儿童肿瘤ADC的研究[11,12], 也得到相似结果,即在0~800 s·mm-2的b值范围内,1.5T或3T MRI行DW检查,可以得到相似的腹部肿瘤ADC值。
检索文献未见儿童腹部肿瘤D和D*值的相关数据报告。本文D*值(×10-6s·mm-2)在恶性组、交界性组、良实性组和良囊性组分别为1 402.5、1 849、2 062.5和3 057 ,D值(×10-6s·mm-2)在恶性组、交界性组、良实性组和良囊性组分别为854、1 120、1 523和3 084,为儿童腹部肿瘤的临床与研究提供了参考。本文结果显示,鉴别恶性和良实性肿瘤D值的灵敏度更高(83.3%),鉴别恶性和实性肿瘤(良实+交界性),D值与ADC一样显示较好的特异度(83.9%和87.1%),鉴别恶性和非恶性(良实性+交界性+良囊性),ADC、D和D*值一样显示良好的特异度(88.9%、86.1%和80.6%)。总体而言,D*、D值在鉴别恶性和实性肿瘤(良实性+交界性)、鉴别恶性和非恶性(良实性+交界性+良囊性)敏感度均不佳。
近年来,IVIM在腹部器官、特别是肝脏的研究成为热点[4,6,8,13-21]。Rheinheimer等[22]研究结果认为,IVIM成像可以增强肾脏肿瘤的诊断准确性,D值是鉴别肿瘤和正常组织的最佳参数,而f值有潜力用于肾脏组织学亚型的区分。Chandarana[23]等通过对IVIM DW与动态增强MR和组织病理学的对照研究,提出参数D和f能够区分肾脏肿瘤亚型,而灌注分数f不需要外源性造影剂就可以评价肾脏血管。Freiman等[24]等在儿童克隆恩病的IVIM研究中发现,IVIM模型得到的数据,要优于ADC模型(P=0.0088),强化区域的f值显著降低,D*值显著升高,而D值在强化组和非强化组两组间中无显著差异。Kim等[25]通过儿童尿路感染的IVIM研究发现,f和D*值在“反流组”要明显高于“非反流”组,f/d值在预测膀胱输尿管反流方面显示了最佳诊断效果。在本文中,恶性组、交界性组、良实性组间,f值差异无统计学意义,考虑f值反映的是组织血流灌注,而恶性组、交界性组和良实性组各组中,都包含富血供和乏血供肿瘤,不同组内各肿瘤的f值高低不等,造成各组f值差异无统计学意义。良囊性组的f值特别低,考虑良囊性组基本为乏血供肿瘤,几乎没有强化,故良囊性组的f值接近0。同一类肿瘤中的不同亚型,或是肿瘤放化疗前后,可能存在不同的血流灌注情况和强化方式,此时使用f值来区分肿瘤不同亚型[8,17,26]、不同分级[15]以及对放化疗效果的评价[4,19-21]、或观察肿瘤或脏器的血管灌注情况[26],都可见于文献报道,而未见于f值在观察肿瘤性质上有意义。
本研究选取3组b值,范围在0~800 s·mm-2。3组的中200~800 s·mm-2范围的b值设定是一样的,考虑>200 s·mm-2的b值反映的是组织真正的弥散特性,不会影响D值。<200 s·mm-2范围(0、50、100、150和200 s·mm-2)3组b值设定有较大不同,考虑<200 s·mm-2的范围内,所有的ADC值均是通过相同的单指数公式(ADC= [In(SIb/SI0)]/b)拟合得到的,故所得ADC值相同。根据这个公式,b值越多,则拟合曲线稳定性越好,但曲线并不受到单个b值的偏倚影响。本文在儿童腹部肿瘤方面的b值选择,是一次有价值的尝试和探索。
本研究的不足与局限性:临床中用超声等影像学检查可以基本确定良性病或确定手术治疗方案不困难时,可不行MR检查,只有在超声探查到肿瘤或可疑肿瘤时、在确定后续的手术方式及其他治疗方案(是否进行术前及术后的放/化疗)有困难时,才行MR检查。作为鉴别良恶性腹部肿瘤的诊断准确性研究,交界性组和良囊性组的病例数较少略显不足。
综上所述,IVIM双指数模型参数(ADC、D、D*和f值)能准确反映肿瘤组织中水分子的扩散及血流灌注,为良、恶性肿瘤的鉴别及不同肿瘤的诊断提供新的思路和方法。
[1]Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1986, 168(2): 497-505 .
[2]Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. 1986, Radiology, 161(2): 401-407 .
[3]Yamada I, Aung W, Himeno Y, et al. Diffusion coefficients in abdominal organs and hepatic lesions: evaluation with intravoxel incoherent motion echo-planar MR imaging. Radiology, 1999, 210(3): 617-623 .
[4]Orton MR, Messiou C, Collins D, et al. Diffusion-weighted MR imaging of metastatic abdominal and pelvic tumours is sensitive to early changes induced by a VEGF inhibitor using alternative diffusion attenuation models. Eur Radiology, 2016, 26(5): 1412-1419 .
[5]Wurnig MC, Donati OF, Ulbrich E, et al. Systematic analysis of the intravoxel incoherent motion threshold separating perfusion and diffusion effects: Proposal of a standardized algorithm. Magn Reson Med, 2015,74(5):1414-1422 .
[6]França M, Martí-BonmatíL, Alberich-Bayarri, et al. Evaluation of fibrosis and inflammation in diffuse liver diseases using intravoxel incoherent motion diffusion-weighted MR imagin. Abdom Radiol (NY), 2017,42(2):468-477 .
[7]Luciani A, Vignaud A, Cavet M, et al. Liver cirrhosis: intravoxel incoherent motion MR imaging—pilot study. Radiology, 2008, 249(3):891-899 .
[8]Yoon JH, Lee JM, Yu MH, et al. Evaluation of hepatic focal lesions using diffusion-weighted MR imaging: comparison of apparent diffusion coefficient and intravoxel incoherent motion-derived parameters. J Magn Reson Imaging, 2014, 39(2):276-285 .
[9]Kocaoglu M, Bulakbasi N, Sanal HT, et al. Pediatric abdominal masses: diagnostic accuracy of diffusion weighted MRI. Magn Reson Imaging, 2010, 28(5):629-636 .
[10]Gawande RS, Gonzalez G, Messing S, et al. Role of diffusion-weighted imaging in differentiating benign and malignant pediatric abdominal tumors. Pediatr Radiol, 2013, 43(7):836-845 .
[11]Gahr N, Darge K, Hahn G, et al. Differentiation of neuroblastoma and ganglioneuroblastoma/ganglioneuroma. Eur J Radiol, 2011, 79(3):443-446 .
[12]徐燕清,王莉,乔中伟.儿童腹部肿瘤磁共振弥散加权成像研究进展.中国临床医生杂志, 2016, 44(9): 4-6 .
[13]Barbieri S, Brönnimann M, Boxler S, et al. Differentiation of prostate cancer lesions with high and with low Gleason score by diffusion-weighted MRI. Eur Radiol, 2017, 27(4):1547-1555 .
[14]Kang KM, Lee JM, Yoon JH, et al. Intravoxel incoherent motion diffusion-weighted MR imaging for characterization of focal pancreatic lesions. Radiology. 2014, 270(2): 444-453 .
[15]Woo S, Lee JM, Yoon JH, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma: correlation with enhancement degree and histologic grade. Radiology, 2014, 270(3):758-767 .
[16]Chiaradia M, Baranes L, Van Nhieu JT, et al. Intravoxel incoherent motion (IVIM) MR imaging of colorectal liver metastases: are we only looking at tumor necrosis? J Magn Reson Imaging, 2014, 39(2):317-325 .
[17]Gaing B, Sigmund EE, Huang WC, et al. Subtype differentiation of renal tumors using voxel-based histogram analysis of intravoxel incoherent motion parameters. Invest Radiol, 2015, 50(3):144-152 .
[18]Lee JT, Liau J, Murphy P, et al. Cross-sectional investigation of correlation between hepatic steatosis and IVIM perfusion on MR imaging. Magn Reson Imaging, 2012, 30(4):572-578 .
[19]Granata V, Fusco R, Catalano O, et al. Early assessment of colorectal cancer patients with liver metastases treated with antiangiogenic drugs: the role of intravoxel incoherent motion in diffusion-weighted imaging. PLoS One, 2015, 10(11):e0142876 .
[20]Nougaret S, Vargas HA, Lakhman Y, et al. Intravoxel Incoherent Motion-derived Histogram Metrics for Assessment of Response after Combined Chemotherapy and Radiation Therapy in Rectal Cancer: Initial Experience and Comparison between Single-Section and Volumetric Analyses. Radiology, 2016, 280(2):446-454 .
[21]Yoon MA, Hong SJ, Lee CH, et al. Intravoxel incoherent motion (IVIM) analysis of vertebral bone marrow changes after radiation exposure from diagnostic imaging and interventional procedures. Acta Radiol, 2017, 58(10):1260-1268 .
[22]Rheinheimer S, Stieltjes B, Schneider F, et al. Investigation of renal lesions by diffusion-weighted magnetic resonance imaging applying intravoxel incoherent motion-derived parameters-initial experience. Eur J Radiol, 2012, 81(3):e310-316 .
[23]Chandarana H, Kang SK, Wong S, et al. Diffusion-weighted intravoxel incoherent motion imaging of renal tumors with histopathologic correlation. Invest Radiol, 2012, 47(12):688-696 .
[24]Freiman M, Perez-Rossello JM, Callahan MJ et al. Characterization of fast and slow diffusion from diffusion-weighted MRI of pediatric Crohn's disease. J Magn Reson Imaging, 2013, 37(1):156-163 .
[25]Kim JW, Lee CH, Yoo KH, et al. Intravoxel incoherent motion magnetic resonance imaging to predict vesicoureteral reflux in children with urinary tract infection. Eur Radiol, 2016, 26(6):1670-1677 .
[26]van Baalen S, Leemans A, Dik P, et al. Intravoxel incoherent motion modeling in the kidneys: Comparison of mono-, bi-, and triexponential fit. J Magn Reson Imaging, 2017, 46(1):228-239
Value of intravoxel incoherent motion diffusion-weighted magnetic resonance imaging in differentiating benign and malignant pediatric abdominal tumors
XUYan-qing1,WANGLi2,GONGYing1,MAYang-yang3,ZHOUJian1,QIAOzhong-wei1
(1DepartmentofRadiology,Children'sHospitalofFudanUniversity,Shanghai201102,China; 2DepartmentofRadiology,NingboFirstHospitalofZhejiangProvince,Ninbo315000,China; 3DepartmentofPathology,Children'sHospitalofFudanUniversity,Shanghai201102,China)
QIAO zhong-wei, E-mail: qiaozhwei@163.com
ObjectiveTo investigate the value of IVIM double exponential parameters in differentiating the benign and malignant pediatric abdominal tumors by use of the method of IVIM DW-MRI. MethodsTaking the pathology of pediatric abdominal tumor operation specimens as the golden standard, patients were assigned to malignant group, benign solid group, borderline group and benign cystic group, and the IVIM DW-MRI detection was performed as the standard to be detected within one week before the operation, and routine MRI (T1W, T2W, CE-T1W) and DWI sequence examination were performed for the suspected abdominal tumor, which could not be confirmed as the benign tumor. Then the b value range of 0~800 s·mm-2was chosen, and the ADC value was obtained by the software calculation, and the tumor size was delineated by use of ROI tumor profile method, and the D, D* and f values were calculated.Results85 cases of children with abdominal tumor (98 masses) were included in the analysis of this study and there were 43 cases of male patients with the average age of 4.4 years old; malignant group (52 cases, 62 masses), borderline group (7 cases, 7 masses), benign solid group (21 cases, 24 masses), benign cystic group (5 cases, 5 masses); and the average value of ROI was 12.9(1.3~26.1)cm2. And for ADC, D and D* values, they showed the lowest in the malignant group and increased successively in the borderline group, benign solid group and benign cystic group, which had statistically significant difference; the differences of ADC, D and D* values between the malignant group and non-malignant (benign solid, borderline and benign cystic) groups had statistical significance; the cutoff identifying malignant and benign solid tumors was 1 367, 1 056 and 1 605 ×10-6mm2·s-1, respectively, and the identifying specificity for ADC was higher (85.5%), and the identifying sensitivity for D value was higher (83.3%), and the cutoff identifying malignant and solid tumors (benign solid plus borderline), malignant and non-malignant (benign solid plus borderline plus benign cystic) was 1 173, 1 014 and 1 634×10-6mm2·s-1, respectively; the specificity for ADC and D values identifying malignant and solid tumors (benign solid plus borderline) was better (87.1% and 83.9%), and the specificity for ADC, D and D* values identifying malignant and non-malignant (benign solid plus borderline plus benign cystic) was all better (88.9%,86.1% and 80.6%). Conclusion The ADC and D values in the IVIM DW-MRI had good diagnostic value in identifying pediatric abdominal benign and malignant tumors.
Magnetic resonance imaging; Diffusion-weighted imaging; Intravoxel incoherent motion; Abdominal tumor; Pathology of operation; Children
2017-08-04
2017-08-21)
(本文编辑:张崇凡,孙晋枫)
上海市科学技术委员会西医引导项目:134119a4100;上海申康医院发展中心临床辅助科室能力(影像医学)建设项目:SHDC22015031
1 复旦大学附属儿科医院放射科 上海,201102;2 浙江省宁波市第一医院放射科 浙江宁波,315000;3 复旦大学附属儿科医院病理科 上海,201102
乔中伟,E-mail:qiaozhwei@163.com
10.3969/j.issn.1673-5501.2017.04.003
