腹腔镜下动脉优先、钩突优先入路:一种提高胰头癌动脉周围廓清率的简易安全方法
2017-09-21高文涛李海峰奚春华
高文涛,李海峰,奚春华,苗 毅
(南京医科大学第一附属医院,江苏 南京,210029)
·专家论坛·
腹腔镜下动脉优先、钩突优先入路:一种提高胰头癌动脉周围廓清率的简易安全方法
高文涛,李海峰,奚春华,苗 毅
(南京医科大学第一附属医院,江苏 南京,210029)
胰腺癌胰十二指肠切除术(pancreaticoduodenectomy,PD)术后局部复发率高达30%~60%,反映了清扫不足的现状,其常见复发部位集中于肠系膜上动脉(superior mesenteric artery,SMA)、腹腔干(celiac artery,CA)中轴线周围。CA、SMA由于位置深在、解剖关系复杂,在开放手术、腹腔镜手术中都是清扫的要点与难点。实现SMA、CA与门静脉(portal vein,PV)/肠系膜上静脉(superior mesenteric vein,SMV)所构成的主动脉前方三角区域(头侧三角),以及SMA沿主干延伸至钩突远端的扇形区域(足侧三角)内神经、结缔组织及钩突的完整切除,是减少局部复发的关键。我们在此描述灵活利用腹腔镜侧后方视角,完成钩突优先、动脉优先入路胰十二指肠切除术的新方法,旨在改善关键结构的入路与暴露,实现CA-SMA为轴全长胰腺钩突系膜的完整切除,降低局部复发率。
胰头导管腺癌的生物学行为恶劣,发现时肿瘤直径<3 cm的患者,仅有15%有机会手术切除;约55%的患者因远处转移、30%的患者属于局部进展期无法行根治性手术。由于R0切除显著提高远期生存[1],因此对于这15%的可切除的患者,应力争根治性切除。在NCCN指南中,PD要求将SMV、PV完全从钩突游离,SMA右侧180度清扫至动脉外膜(adventitial)。但回顾性分析表明,胰腺癌术后局部复发率高达30%~62%[2-4],如此高的局部复发率既反映了胰腺癌生物行为差,也反映了目前清扫方式、范围的不足。
胰头癌术后复发部位主要位于SMA、CA、腹主动脉周围[5-7](图1)。胰腺的解剖特点是血管穿行,SMA、CA解剖部位深在,暴露困难,加之胰腺癌往往局部浸润血管、神经丛,客观上造成了PD术中两处清扫困难区域(图1),即SMA、CA、与PV/SMV所构成的主动脉前方三角区域(头侧三角),以及SMA沿主干延伸至钩突远端的扇形区域(足侧三角),其内神经、结缔组织、钩突的完整切除,是减少局部复发的关键(图1)。
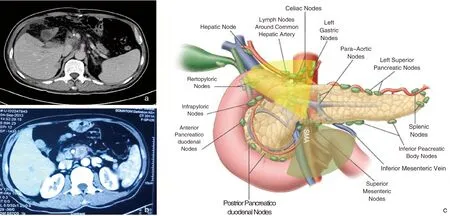
图1 胰头癌PD后局部复发(a:CA、肝总动脉附近复发(头侧三角);b:SMA远端左侧复发(足侧三角);c:胰腺癌清扫困难区域:以SMA根部为中心的头侧三角与足侧三角)。
(1)SMA、CA与PV/SMV所构成的主动脉前方三角区域(头侧三角):SMA从腹主动脉发出后有2~3 cm无任何分支,称之为“外科干”。此处与其他解剖结构交织少,因此通过扩大的Kocker切口,从右后侧或左后侧入路暴露、游离SMA根部较容易。但此入路难以再向其头侧完全暴露SMA、CA根部。同时腹主动脉表面、CA、SMA根部有腹腔神经节、粗大的神经纤维走行,形成致密的血管神经鞘,胰颈、钩突部癌容易沿神经浸润至CA、SMA根部。因此处解剖部位深在、暴露困难、组织致密、缺乏良好的解剖层次,是PD的清扫死角之一。(2)SMA沿主干延伸至钩突远端的扇形区域(足侧三角):自SMA动脉外科干延伸至跨越钩突/十二指肠水平部处,先后于左后方发出及第一空肠支共干的胰十二指肠下动脉(inferior pancreaticoduodenal artery,IPDA),远端相继发出结肠中动脉,第2、第3空肠支;其后方则走行汇入SMV的空肠静脉干及分支,胰腺钩突也往往自SMA后方延伸至其左侧,前方为肠系膜、SMV干及分叉处;此处SMA穿行于重要解剖结构间,无法直接显露;并发出多个分支,与相应静脉支交织,而钩突癌往往自SMA后方浸润至其左侧,侵犯其分支、静脉分支,是PD更难清扫的死角。因此在NCCN指南中,肿瘤侵犯SMA左侧或第一空肠支均定义为“不可切除”。此两处死角都具有解剖深在、暴露困难的特点,但又具有不同的解剖特点,暴露与解剖径路有所不同。
动脉优先入路、后方入路[8]、钩突优先入路旨在改善SMA的暴露、早期可切除性评估,并便于完成SMA周围神经、淋巴结缔组织的剥离。根据显露SMA的径路,动脉优先入路包括6种径路(图2),最常用的为经Treitz韧带左侧入路、利用扩大Kocker切口的右后侧入路、SMV内侧入路等[9-10]。钩突优先入路理念与动脉优先相似,强调了SMA、钩突的优先分离[11],自钩突开始向头侧切除,最后切断胰颈。但经典的动脉优先、钩突优先入路,钩突的分离仍在离断空肠后通过向右上旋转牵拉钩突,在SMA右侧完成。由于SMV位于SMA右侧,此方法必须先将SMV翻转后才能显露SMA与钩突间的解剖关系。
常规腹腔镜胰十二指肠切除术采用脐部单一视角,与SMA同轴且距离近,对于足侧三角的暴露尤其困难;但腹腔镜具有视角灵活的特点与优势,腹腔镜胰十二指肠切除术应采用适合腔镜特点的手术入路。因此,我们将开放手术中动脉优先、钩突优先的理念,与腹腔镜的多视角优势相结合,针对胰头癌两处清扫死角发展出了新的腹腔镜手术入路流程。
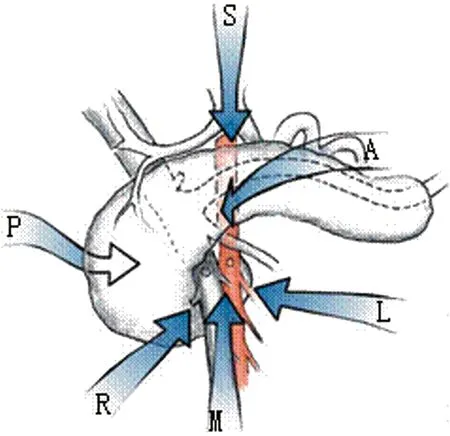
图2 动脉优先入路中显露SMA的6种途径。“L”代表经Treitz韧带途径的左侧动脉入路。(引自:Sanjay P,Takaori K,Govil S,et al.Br J Surg,2012 Aug;99(8):1027-1035.)
1 技术流程
总体切除流程可根据三个视角切换分为四步[12],以1例钩突癌病例为例(图3)。(1)经脐孔Trocar进镜与足侧视角:SMV与胰腺探查、十二指肠离断、肝十二指肠韧带前方组织清扫(图4)。(2)平脐左侧腹Trocar进镜、左侧后方视角,经Treitz韧带途径动脉优先、钩突优先的手术入路,实现CA、SMA起始部左侧、SMA干的长程显露、IPDA离断,并于肠系膜根部左侧实现沿SMA干的远端钩突完全切除。①充分暴露左结肠下区、肠系膜根部左侧。②切开Treitz韧带,将十二指肠水平部、胰头后方自腹主动脉前方分离至腔静脉前方(类似于从左侧进行的Kocker切口)。③于左肾静脉上方暴露SMA根部,完成SMA起始部的游离与悬吊(图5a)。继续向头侧分离,则为CA起始部,可根据需要进行CA根部左侧的清扫。④自根部开始剥离SMA,离断IPDA,以SMA轴左侧缘为切除线,实现远端钩突系膜的完全切除(图5d)。此例患者一并切除了肿瘤侵犯的第1空肠支(IPDA共干)及第2、第3空肠支,保留了结肠中动脉(图5b、图5c)。(3)经平脐右侧腹Trocar进镜、利用右后侧视角及钩突优先入路:将切除的十二指肠、钩突自系膜根部后方旋转牵拉至右侧,可见钩突远端已在前述左侧入路实现了完全切除(图6a)。右侧入路重点分离SMA、CA起始部,肝十二指肠韧带后方淋巴结缔组织(或称为近端钩突系膜),完成胰头钩突系膜的完全分离(图6b、图6c)。右后侧视角下分离方式为后入路,将SMA、CA周围、肝十二指肠韧带后方淋巴结缔组织整体自后向前上旋转、牵拉,自动脉剥离后会显露SMV、PV后方,随后切断通往钩突的静脉分支,即完成胰腺钩突完全切除。(4)经脐部Trocar进镜足侧视角,切断胰颈、肝总管,完成切除。
2 讨 论
目前胰头癌的不可切除标准存有争议,清扫侧重的范围不能一概而论,NCCN指南过于笼统。笔者体会,胰头恶性肿瘤根据位置可分为三类:(1)胰头近壶腹部;(2)胰头颈部,易浸润CA、肝动脉;(3)胰腺钩突部,易浸润SMA,甚至沿SMA后方浸润至肠系膜根部左侧。此三类肿瘤位置、侵犯范围有差异,不论可切除性评价、切除时清扫的重点区域也应有不同(图7)。见表1。
根据我们胰腺中心的临床实践,我们认为可切除性的动脉侵犯标准应以深度、而非周径为判断标准。此外,即使较小的肿瘤,由于位置原因,如胰颈部肿瘤侵犯、甚至包绕CA,胰腺钩突肿瘤侵犯SMA超过180度,甚至侵犯至左侧的并不少见,右侧180度只是切除技术的屏障,而非肿瘤侵犯的物理屏障。然而现状是肿瘤的解剖学而非生物学,决定了其不可切除性。“不可切除性”应分为“技术性不可切除”与“生物性不可切除”,前者的界定受术者技术水平、医疗条件等影响,不能仅以影像学的临界值一概而论。尤其近20年来外科技术得到很大进步、胰腺疾病专业化、胰腺中心的涌现,突破了原有技术性不可切除的屏障,相应的切除范围、清扫重点范围也应有所侧重与扩大。两处清扫困难区域:SMA、CA与PV/SMV所构成的主动脉前方三角区域(头侧三角),及SMA沿主干延伸至钩突远端的扇形区域(足侧三角),其内神经、结缔组织、钩突的完整切除是突破原有切除界限、减少局部复发的关键。
随着手术指征的扩大,腔镜手术应达到开放手术相同的切除规范,同时采用适合腔镜特点的手术入路。我们采用的腹腔镜下经Treitz韧带途径动脉优先、钩突优先的手术方式,充分利用腹腔镜视角优势,体现了“暴露优先”的理念,通过提供关键解剖结构良好的视野与暴露,以消除胰头癌PD清扫死角,提高胰头癌动脉周围廓清率。
左侧钩突优先入路充分体现了腔镜手术的视角优势,优点包括:(1)暴露优良,符合正常解剖。SMA解剖上位于SMV左后侧,同时钩突往往在SMA后方延伸至SMA左侧,左侧入路能避免SMV的遮挡,稍微逆时针牵拉十二指肠即可在一个视野显露SMA干、IPDA、SMV空肠支后方、胰腺钩突远端、十二指肠的相互解剖关系(图8)。(2)利于预先判断肿瘤动脉侵犯情况、评估可切除性。(3)钩突的主要血管分支IPDA自SMA左后方发出,此视角能在直视下暴露钩突主要的血管分支IPDA、胰十二指肠下静脉(inferior pancreaticoduodenal vein,IPDV)起始部,并辨认是否侵犯空肠支;优先离断IPDA,阻断胰头动脉血供,减少淤血及切除过程中的出血(图8);(4)可实现自SMA根部开始,直至跨越钩突远端、十二指肠水平部全长的根部、远端钩突系膜的完全剥离。切除线位于SMA左侧,保证实现SMA全长右侧至少180度的切除线;尤其对于钩突癌能实现更干净的切缘。(5)相当比例患者可实现从左侧视角即完成远端钩突的完全切除[12]。(6)可在显露SMA起始部后继续向上分离,显露CA起始部左侧右后侧视角钩突优先入路。其他优点还包括:(1)利于早期发现并保护SMA发出的异位肝右动脉;(2)对于需要SMV、PV静脉切除的患者,必须先分离钩突、SMA;侧后方入路提供良好的SMA分离途径;(3)助手提供完全暴露,术者可直视下双手操作,控制出血,提高安全性。见表2。
此手术方式亦有缺点,由于需要切换视角,术者、助手需要两次改变站位,CA、SMA动脉的分离会显著延长手术时间;此外,取决于钩突的相对解剖位置,部分患者通过旋转牵拉SMV,在SMA右侧即能实现钩突系膜的良好暴露,或肿瘤位于近壶腹部,CA根部、SMA远端转移、侵犯可能性低者,则Treitz韧带途径入路优势不大;但对于靠近胰颈部、钩突的肿瘤,必须实现CA、SMA为轴钩突系膜的完全切除时,Treitz韧带途径钩突优先、动脉优先入路,能改善关键解剖结构暴露,保证钩突全长切除线,有助于手术的安全性、提高手术质量、降低局部复发率。
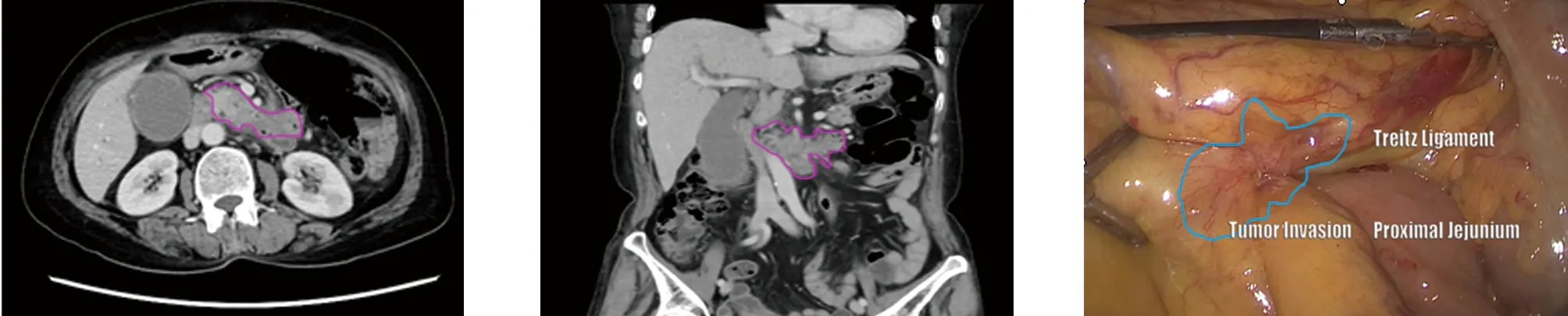
图3 CT可见钩突癌侵犯SMA干远端(跨越十二指肠水平部处)的后方至左侧;侵犯1、2空肠支。探查可见肠系膜根部左侧、Treitz韧带处肿瘤侵犯呈“癌脐”样改变;在NCCN指南中,肿瘤侵犯SMA左侧或第一空肠支均定义为“不可切除”。此处的钩突癌根治性切除必须实现足侧三角的彻底清扫。
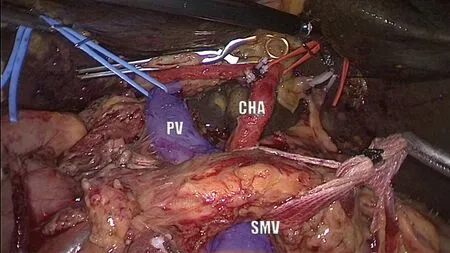
图4 肝十二指肠韧带前方组织的剥离:脐孔进镜,足侧视角,肝十二指肠韧带前方淋巴组织en bloc向后剥离。
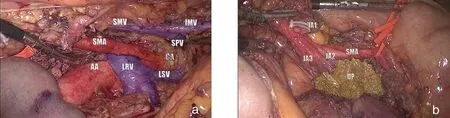

图5 左后侧视角,Treitz韧带途径、动脉优先、钩突优先入路。a:左侧Trocar进镜,切开Treitz韧带,将十二指肠和胰头后方从腹主动脉前方分离直至腔静脉前方(类似于从左侧进行的Kocker切口)。左肾静脉上方显露、分离SMA根部。b:沿SMA向远端游离,可见肿瘤侵犯第1、2、3空肠支(JA,jejunm artery)。c:空肠支离断后,进入无瘤解剖界面。d:远端钩突已完全分离;图在一个视野中,能充分暴露并完成SMA从起始部至跨越钩突、十二指肠水平部的长干游离,IPDA已优先离断;SMV左后方亦显露,IPDV已离断。
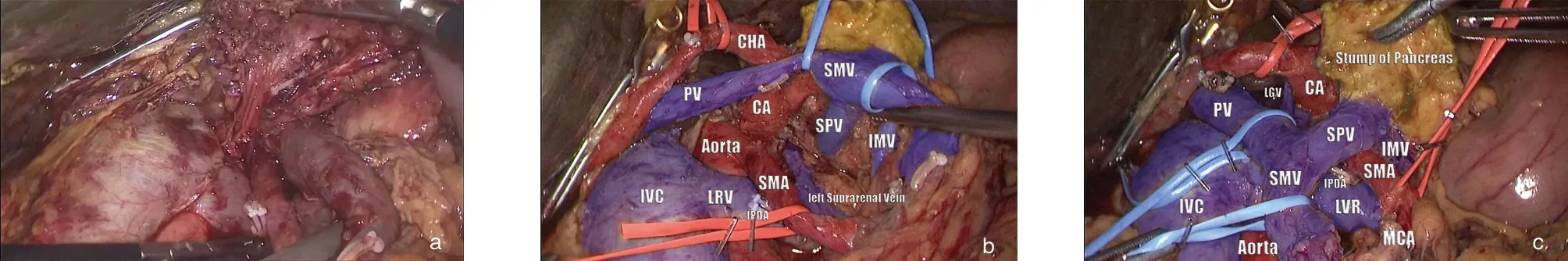
图6 右后侧视角,完成SMA、CA起始部夹角处、肝十二指肠韧带后方组织的完全清除。a:将切除的十二指肠和钩突自系膜根部后方旋转牵拉至右侧后,可见钩突远端已经在前述左侧入路实现了完全切除;b、c:右侧入路重点分离SMA、CA起始部、肝十二指肠韧带后方淋巴结缔组织(或称为近端钩突系膜),完成胰头钩突系膜的完全分离。图中可见腹主动脉前方、围绕SMA、CA,围绕SMV/PV、SPV结缔组织均完全切除(因此能清楚从后方显示胰颈后方和脾静脉干SPV),头侧三角、足侧三角均实现了完全切除,胃左静脉(LGV)保留。
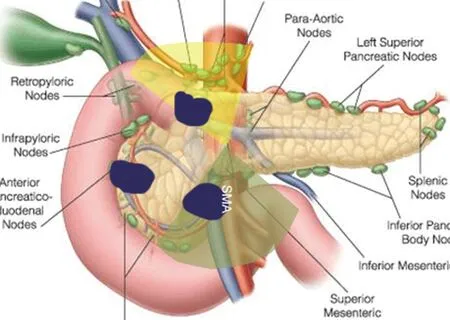
图7 胰头恶性肿瘤根据位置可分为三类,侵犯的范围有差异,无论是可切除性评价、切除是清扫的重点也应不同:胰头颈部癌清扫重点为头侧三角:胰腺钩突部癌清扫重点需兼顾足侧三角。
表1 胰头肿瘤位置及可切除性、清扫重点的比较

胰头肿瘤位置易侵犯的范围可切除性评价清扫重点区域胰头近壶腹部同NCCN指南常规胰头颈部易浸润CA、肝动脉放宽对CA、肝动脉侵犯的规定头侧三角胰腺钩突部易浸润SMA,甚至沿SMA后方浸润至肠系膜根部左侧 放宽对SMA侵犯的规定足侧三角
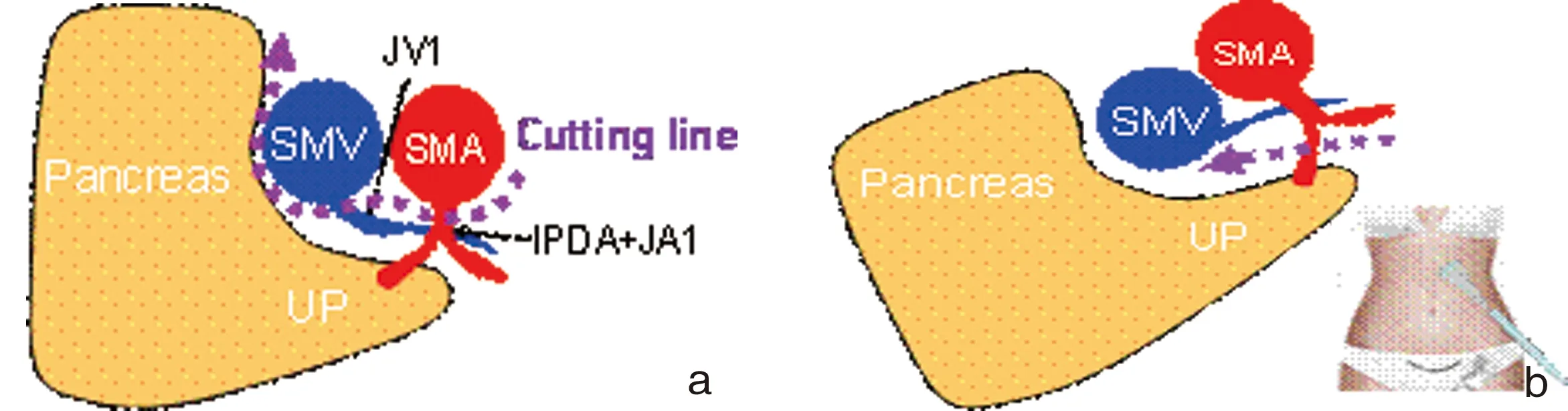
图8 钩突的主要血管分支和第一空肠支共干的IPDA、IPDV,发出位置为SMA、SMV的后方,常规从SMA右侧分离钩突时难以清楚显露IPDA发出根部;b:通过向左侧牵拉钩突,在SMA左侧能直接显露IPDA根部(图片引自:Yuichi Nagakawa, Tokyo Medical University)
表2 肠系膜根部左侧、右侧钩突切除的优缺点比较
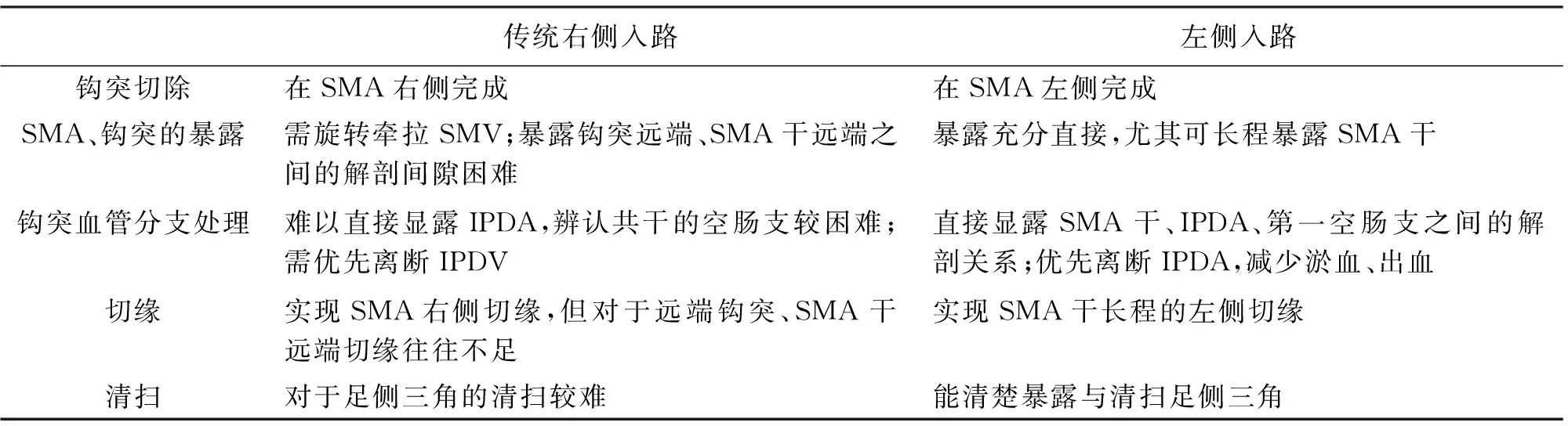
传统右侧入路左侧入路钩突切除在SMA右侧完成在SMA左侧完成SMA、钩突的暴露需旋转牵拉SMV;暴露钩突远端、SMA干远端之间的解剖间隙困难暴露充分直接,尤其可长程暴露SMA干钩突血管分支处理难以直接显露IPDA,辨认共干的空肠支较困难;需优先离断IPDV直接显露SMA干、IPDA、第一空肠支之间的解剖关系;优先离断IPDA,减少淤血、出血切缘实现SMA右侧切缘,但对于远端钩突、SMA干远端切缘往往不足实现SMA干长程的左侧切缘清扫对于足侧三角的清扫较难能清楚暴露与清扫足侧三角
[1] Yamamoto T,Yagi S,Kinoshita H,et al.Long-term survival after resection of pancreatic cancer:a single-center retrospective analysis[J].World J Gastroenterol,2015,21(1):262-268.
[2] Neoptolemos JP,Stocken DD,Friess H,et al.A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer[J].N Engl J Med,2004,350(12):1200-1210.
[3] Neoptolemos JP,Palmer DH,Ghaneh P,et al.Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4):a multicentre,open-label,randomised,phase 3 trial[J].Lancet,2017,389(10073):1011-1024.
[4] Van Laethem JL,Hammel P,Mornex F,et al.Adjuvant gemcitabine alone versus gemcitabine-based chemoradiotherapy after curative resection for pancreatic cancer:a randomized EORTC-40013-22012/FFCD-9203/GERCOR phase II study[J].J Clin Oncol,2010,28(29):4450-4456.
[5] Hishinuma S,Ogata Y,Tomikawa M,et al.Patterns of recurrence after curative resection of pancreatic cancer,based on autopsy findings[J].J Gastrointest Surg,2006,10(4):511-518.
[6] Yu W,Hu W,Shui Y,et al.Pancreatic cancer adjuvant radiotherapy target volume design:based on the postoperative local recurrence spatial location[J].Radiat Oncol,2016,11(1):138.
[7] Hishinuma S,Ogata Y,Tomikawa M,et al.Patterns of recurrence after curative resection of pancreatic cancer,based on autopsy findings[J].J Gastrointest Surg,2006,10(4):511-518.
[8] Ogiso S,Conrad C,Araki K,et al.Posterior approach for laparoscopic pancreaticoduodenectomy to prevent replaced hepatic artery injury[J].Ann Surg Oncol,2013,20(9):3120.
[9] Zimmitti G,Manzoni A,Addeo P,et al.Laparoscopic pancreatoduodenectomy with superior mesenteric artery-first approach and pancreatogastrostomy assisted by mini-laparotomy[J].Surg Endosc,2016,30(4):1670-1671.
[10] Weitz J,Rahbari N,Koch M,et al.The "artery first" approach for resection of pancreatic head cancer[J].J Am Coll Surg,2010,210(2):e1-4.
[11] Pędziwiatr M,Pisarska,Maczak P,et al.Laparoscopic uncinate process first pancreatoduodenectomy-feasibility study of a modified 'artery first' approach to pancreatic head cancer[J].Langenbecks Arch Surg,2017 Jul 11.[Epub ahead of print]
[12] 高文涛,奚春华,涂敏,等.腹腔镜下Treitz韧带途径钩突优先、动脉优先入路胰十二指肠切除术的临床应用[J].中华外科杂志,2017,55(5):359-363.
1009-6612(2017)08-0568-06
10.13499/j.cnki.fqjwkzz.2017.08.568
2017-08-10)
