无患子花色素理化性质研究
2017-09-21,,,,,,*
, ,, ,,,*
(1.浙江树人大学生物与环境工程学院,浙江杭州 310015; 2.杭州民生药业有限公司质检中心,浙江杭州 311199;3.瑞安市人民医院制剂室,浙江瑞安 325200)
无患子花色素理化性质研究
钱天元1,孙亭1,李成平1,叶露2,单海峰3,饶桂维1,*
(1.浙江树人大学生物与环境工程学院,浙江杭州 310015; 2.杭州民生药业有限公司质检中心,浙江杭州 311199;3.瑞安市人民医院制剂室,浙江瑞安 325200)
以无患子花为原料,提取无患子花色素并研究了其理化性质。实验结果证明水对无患子花色素的提取能力最强,在253 nm处存在最大吸收峰;无患子花色素适合中性溶液保存;光照会促进无患子花色素的分解;无患子花色素在60 ℃温度下具有较好的稳定性;K+、Ca2+的存在对无患子花色素的稳定性有较大影响;食品添加剂中葡萄糖、蔗糖和维生素C(VC)会破坏无患子花色素的稳定性;此外,无患子花色素具有一定抗氧化还原的能力。这一结果可为以无患子花为原料的食品开发提供有益提示和理论基础。
无患子花,理化性质,色素
无患子又名黄目树、鬼见愁,原产中国长江流域以南各地以及中南半岛各地、印度和日本[1]。其果皮含有皂素,可代肥皂,木材可做箱板和木梳等[2-4]。根、嫩枝叶、种子:苦、微辛,寒。清热祛痰,消积杀虫,具有极高的应用价值,因其种子药用广泛而越来越受人们关注[5-6]。同时,其果皮是一种天然的非离子型表面活性剂,有优秀的起泡性和洗涤能力,其中皂苷的含量可达42.73%可以替代传统的石化产品原料的洗涤剂。可以预见,无患子可以成为一种新型经济林树种。但对无患子花的研究较少。本实验研究了无患子花色素的最佳提取工艺及其理化性质,并初步探讨了无患子花色素的抗氧化性及还原性。随着人民生活水平的提高,对自然、健康的食品的追求,采用天然色素替代人工色素已成为食品工业的发展趋势,而寻找来源方便、成本低,无毒的天然色素是当前的研究热点。无患子作为园林绿化树,在我国广泛种植,其花期短而集中,有利于收集,材料成本低、来源广泛,但目前都作为园林废弃物,未得到合理使用。本实验则是首次对无患子花进行全面的理化性质研究,以期为无患子花的综合利用提供依据。
1 材料与方法
1.1材料与仪器
无患子花 产地为杭州,在40 ℃和8 h条件下烘箱烘干,粉碎过筛网。
葡萄糖、柠檬酸和维生素C为食品级试剂;Zn2+、K+、Na+、Ca2+和Ni3+标准溶液(国家钢铁材料测试中心钢铁研究总院);乙醇、甲醇、正丁醇、石油醚和丙酮均为分析纯。
DGG-9140A型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;KQ-300GVDV型三频恒温数控超声波清洗器 昆山市超声仪器有限公司;DF-101B集热式磁力加热搅拌器 金坛市国旺实验仪器厂;GL-20G-Ⅱ台式高速冷冻离心机 上海安亭科学仪器厂;UPWS超纯水器 杭州永洁达净化科技有限公司;L65紫外可见分光光度计 上海精科。
1.2实验方法
1.2.1 无患子花的最大吸收波长选择 精确称取5.000 g无患子花粉碎物,先以超纯水为提取溶剂,按固液比1∶15 (g∶mL)于室温下对无患子花粉末中的有效成分进行提取[7-10]。4 h后将提取液离心分离(10000 r/min)10 min,取上清液于10000 r/min下再次高速离心10 min。再取上清液在紫外可见分光光度计下进行紫外吸收波长扫描,扫描波长范围为200~600 nm。读取不同溶剂提取物的最大吸收波长和最大吸收峰值。选择峰值最大者为无患子花粉末的最佳提取溶剂。
1.2.2 无患子花的提取溶剂选择 分别采用乙醇、甲醇、石油醚、正丁醇和丙酮各100 mL为提取溶剂,并将提取液于其最大吸收波长处进行吸光度值测定并比较。
1.2.3 无患子花色素的理化性质
1.2.3.1 无患子花色素的酸碱稳定性研究 用pH2~pH8的柠檬酸-磷酸氢二钠缓冲液和pH9.1~pH10.8的碳酸钠-碳酸氢钠缓冲溶液配制不同的无患子花粉末水提取物溶液,并将提取液于其最大吸收波长处进行吸光度值测定,以判断不同pH环境对于无患子花色素稳定性的影响[11-12]。
1.2.3.2 无患子花色素的光稳定性研究 取无患子花粉末水提取物溶液,分别在最佳pH情况下,采取避光及室内光和室外光条件下进行保存[7]。按时间1、2、4 d分别测定其吸收值。
1.2.3.3 无患子花色素的热稳定性研究 最佳pH条件下,于不同温度下加热1~3 h,冷却至室温,对无患子花粉末水提取物溶液稀释100倍后测定其紫外吸收值[13-15]。
1.2.3.4 不同金属离子的影响 取条件相同的无患子花粉末水提取物,最佳pH条件下,分别加入1 mL 0.01 mol/L的Zn2+、K+、Na+、Ca2+和Ni3+标准溶液,待溶液体系稳定后,于最大紫外吸收波长处,测定紫外吸收值[16-17]。
1.2.3.5 食品添加剂的影响 取无患子花粉末水提取物,分别添加0.05%的VC、柠檬酸、酒石酸、20%的蔗糖和葡萄糖各1 mL,调节pH至最佳条件,待体系反应稳定后,于1、8、24 h时段测定其吸光度并记录[18-19]。
1.2.3.6 抗氧化性研究 过氧化氢氧化实验:取无患子花粉末水提取物,分别添加0.2%、0.4%、0.6%、0.8%和1.0%的过氧化氢。待体系反应稳定后,测定其吸光度[20-21]。
DPPH·清除率测定:取4 mL无患子花粉末水提取物溶液,加入4 mL浓度为0.0002 mol/L的DPPH·溶液,摇匀,室温下避光反应30 min,以无水乙醇作对照,于517 nm波长处测定吸光A。对照组以无水乙醇代替DPPH·溶液,与待测液混合,于517 nm波长处测定吸光度B,空白组以上述DPPH·溶液与无水乙醇混合后于517 nm波长处的吸光度C[22-25]。按下式计算清除。
式(1)
式(1)中:A为样品组吸光度;B为对照组吸光度;C为空白组吸光度。
羟基自由基清除率测定:取2 mL无患子花粉末水提取物溶液,置于10 mL离心管中,分别加入1 mL 9 mmol/L的硫酸亚铁溶液,2 mL 9 mmol/L的水杨酸-乙醇溶液,混匀,加入1 mL 0.01%的过氧化氢溶液,于510 nm处测定吸光度A。对照组以超纯水代替过氧化氢溶液,于510 nm处测定吸光度B,空白组以超纯水代替待测液,于510 nm处测定吸光度C[26]。按下式计算清除率。
式(2)
超氧阴离子清除率的测定:采用邻苯三酚自氧化法,取5 mL 50 mmol/L磷酸氢二钠-磷酸二氢钠溶液(pH8),置于25 ℃水浴中保温20 min,加入2 mL无患子花粉末水提取物溶液,再加入1 mL 5 mmol/L的邻苯三酚溶液,混匀,25 ℃水浴中反应5 min,最后加入1 mL 10 mol/L盐酸终止反应,在320 nm处测定吸光度,对照组以超纯水代替邻苯三酚溶液,空白组以蒸馏水代替待测液[26]。按下式计算清除率。
式(3)
1.3数据处理
本文所有实验进行三次平行实验,数据值为平均值,数据分析采用Excel2003软件进行分析。
2 结果与分析
2.1无患子花的最大吸收波长选择
使用超纯水作为提取溶剂对无患子花的有效成分进行提取,然后进行紫外分光光度计全波长扫描寻找有效点见图1。
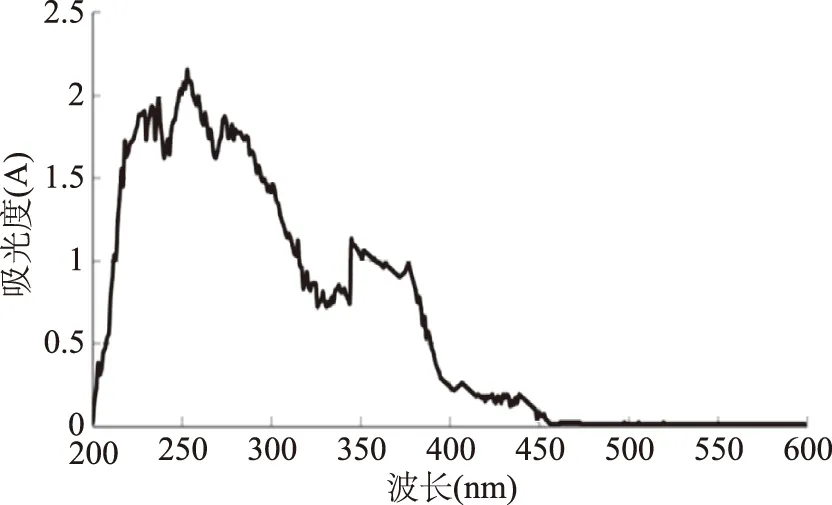
图1 无患子花水提取液全波长扫描Fig.1 Full wavelength scanning of extracst of flower of Sapindus mukurossi by water

表2 无患子花在不同pH条件下的显色结果Table 2 Color rendering results of flower of Sapindus mukurossiin different pH value
由图1可知,无患子花水提取溶液在253 nm处存在极高的吸收值。
2.2无患子花的提取溶剂选择
结果表明:无患子花色素易溶于水、醇类等极性溶剂,难溶于正丁醇、石油醚等非极性溶剂,不溶于丙酮。无患子花有机溶液提取物液体在紫外区253 nm都具有非常强烈的吸收值。在253 nm处,不同溶剂的吸光度见表1。不同浓度乙醇对无患子花色素的提取实验见图2,由图2可见,纯水溶液对于无患子花色素的提取能力最大,可能是由于无患子花色素是具有强极性的,根据相似相溶的原理,在水和乙醇中的溶解性更强,故选择水为提取试剂。

表1 不同有机溶剂无患子花色素提取液在253 nm处的吸光度Table 1 The absorbance of different solvents in the extracst of flower of Sapindus mukurossi in 253 nm

图2 不同浓度乙醇无患子花色素提取液在253 nm处的吸光度Fig.2 The absorbance of flower of Sapindus mukurossi extracts from different ethanol concentrations at 253 nm
2.3理化性质分析
2.3.1 不同pH溶液中的显色情况 不同pH对无患子花色素的紫外-可见光吸收的影响见表2。
实验发现当pH<6时,无患子花溶液颜色透明,呈浅黄色,当pH≥6时,颜色由浅黄色向淡黄色变深,变色较明显。当pH>9时溶液呈现深黄色,变色明显,且无法测出紫外吸收波长,可能是受到pH影响无患子花色素在强碱性条件下被分解所以吸收值无法检测到。
2.3.2 光稳定性 在pH为中性时,无患子花水提取物的吸光度随存放时间的延长而逐渐下降,下降幅度较明显。说明无患子花水提取物成分不稳定。在室内光照或室外光照条件下,无患子花水提取物的吸光度值比避光条件下降低的快。说明光对无患子花色素分解有催化作用。
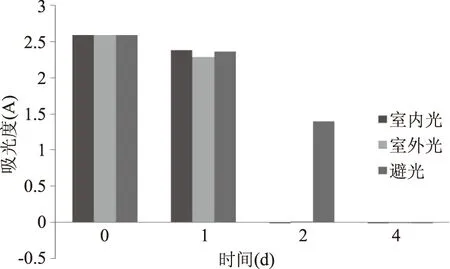
图3 光照对无患子花水提取液的稳定影响Fig.3 Effect of light on stability of flower of Sapindus mukurossiin water solution
2.3.3 温度的影响 在pH为中性条件下,当温度达到70 ℃以上时,溶液颜色并无明显变化,仍为淡黄色,但是吸光度值出现了明显变化见图4,说明高温不利于无患子花水提取物的稳定。

图4 温度对无患子花水提取液的稳定影响Fig.4 Effect of temperature on the stability of flower of Sapindus mukurossiin water solution
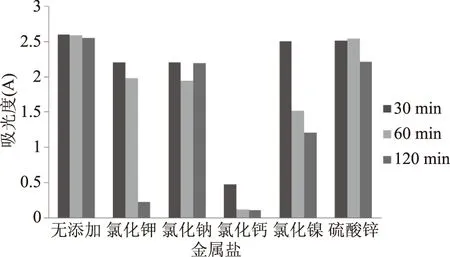
图5 不同金属离子对无患子花水提取液的稳定影响Fig.5 Effect of different metal ions on the stability of flower of Sapindus mukurossi water solution
2.3.4 金属离子的影响 金属离子对无患子花提取物稳定性的影响如图5所示。加入Na+,Zn2+后对无患子花色素影响很小,色素溶液仍呈现淡黄色。不过加入K+和Ni3+后,色素溶液都出现了变化,吸光度值明显随时间呈下降趋势。另加入Ca2+后短时间内颜色褪去且最后测得吸光度值下降明显。因此加入无患子花色素的物品应避免与Ca2+接触,减少与K+和Ni3+接触。
2.3.5 不同食品添加剂的影响 由于添加物自身极性和酸碱性等的影响,使这些添加物加入后溶质的吸收峰的波长、强度发生了十分明显的变化。添加VC后,在静置的24 h内,溶液紫外吸收值基本保持不变,具有较好的稳定性。但添加葡萄糖和蔗糖,色素直接分解残存少量。在添加酒石酸和柠檬酸后,色素吸光度随时间减少。
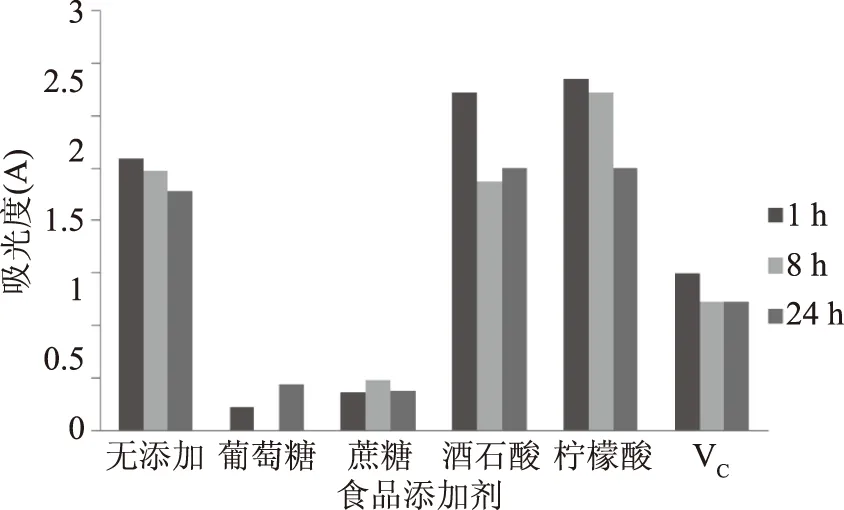
图6 不同食品添加剂对无患子花水提取液的稳定影响Fig.6 Effect of different food additives on the stability of flower of Sapindus mukurossi water solution
2.3.6 抗氧化能力的实验 由图7看出不管过氧化氢的浓度大小,无患子花色素的吸光度均明显下降。说明无患子花水提取液的耐氧化性比较差。
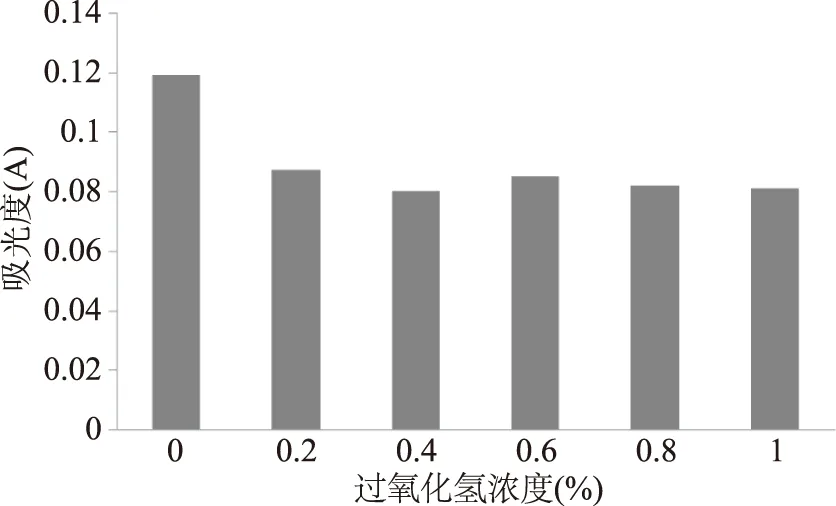
图7 不同浓度过氧化氢对无患子花水提取液的影响Fig.7 Effect of different concentrations of hydrogen peroxide to flower of Sapindus mukurossi water solution
如图8所示,无患子花水提取溶液对于DPPH和羟基自由基具有一定的清除能力,但对于超氧阴离子的清除能力较差。
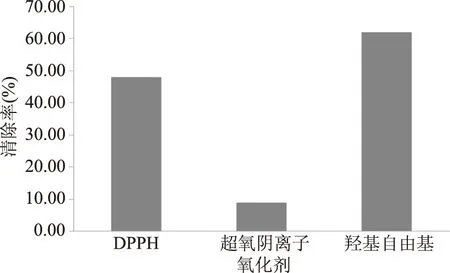
图8 无患子花水提取液对DPPH,羟基自由基,超氧阴离子清除能力Fig.8 Flower of Sapindus mukurossi watersolution on DPPH,hydroxyl radical,superoxide anion scavenging ability
3 结论
通过不同溶剂对无患子花中的色素进行提取,发现无患子花色素易溶于极性溶剂,难溶于非极性溶剂。其中,对于无患子花色素的提取能力最大的溶剂是水。
无患子花色素在253 nm处存在极高的吸收值。在酸性条件下为浅黄色,随着pH增加颜色加深。在碱性条件下颜色变为深黄但无紫外吸收,说明碱性环境中无患子花色素稳定性比不上酸性条件。但提取液pH不能过低,当pH≤6时,吸光度下降。通过实验pH为6~8时提取较为适宜。且在pH为7时,溶液提取效果好及提取液稳定性好。
无患子花色素其成分稳定性较差。光照超过1 d吸光度有明显下降;透光时,常温下无患子花色素具有较好的热稳定性。pH为中性的无患子花提取液在30~60 ℃放置,随着时间的延长,其稳定性有所下降,但整体变化不大,但在70、80 ℃放置,随着时间的延长,其稳定性迅速下降。无患子花对金属Ca2+非常敏感,对K+、Ni3+较敏感,应避免与这些金属离子接触。
通过不同浓度的过氧化氢溶液的添加以及无患子花提取液对DPPH·,超氧阴离子,羟基自由基的清除,综合比较发现无患子花色素的抗氧化能力一般,应避免与强氧化物接触,存放应注意防氧化。
[1]中国植物志编辑委员会.中国植物志:47卷[M].北京:科学出版社,1998.
[2]马丽珍.无患子皂苷提取工艺的优化[J].日用化学工业,2015,45(3):149-151.
[3]杨鹤群,韩春蕊,赵丹青,等.无患子皂素的表面活性及复配增效性能[J].化工进展,2015,34(12):4343-4347.
[4]金秋,奚立民,张昕欣,等.无患子皂苷的抗菌活性研究[J].科技通报,2014,30(3):35-38.
[5]王秋成,陈奇,马骏,等.无患子果皮提取物清洗矿物油污的可行性研究[J].浙江工业大学学报,2015,43(3):241-245.
[6]周露,谢文申,罗雁婕.川滇无患子提取物用于农药的生物活性研究[J].植物保护,2010,36(5):162-164.
[7]王晓晴,王榆元,钟敏,等.康仙花色素的提取及其理化性质的研究[J].林产化学与工业,2013,33(4):62-65.
[8]周幸知,曹婷婷,吴嘉玺.天然色素的研究进展概述[J].农技服务,2015,32(9):10-13.
[9]石翠芳,孙智达,谢笔钧.沙枣果肉原花青素的提取、纯化及抗氧化性能的研究[J].农业工程学报,2006,22(3):159-161.
[10]张晓玲,杨桥,吴文惠,等.食品黑色素毛细管电泳分析新方法的建立[J].食品科学,2008,29(6):372-375.
[11]易建华,朱振宝,董文宾.核桃蛋白酶解产物抗氧化性的研究[J].食品工业科技,2007,28(4):84-87.
[12]唐红枫,穆婷,张雨婷,等.玫瑰色素的提取工艺优化及其应用[J].中国调味品,2011,36(12):111-117.
[13]李进,祝长青,原惠,等.黑果枸杞色素最优提取工艺条件研究[J].新疆师范大学学报:自然科学版,2005,24(1):62-69.
[14]吴帅,王成忠,吴秋.大孔树脂纯化毛梾色素的研究[J].中国调味品,2016,41(9):135-140.
[15]李进,苏小红,原惠,等.小蜡色素稳定性研究[J].食品科学,2008,29(9):106-110.
[16]白立敏,辛秀兰,江波,等. 树莓红色素的提取及稳定性研究[J].食品工业科技,2007,28(12):179-195.
[17]孙茜,张雨婷,穆婷,等.玫瑰色素提取工艺条件优化研究[J].化学与生物工程,2011,28(8):11-13.
[18]崔福顺,金清,李铉军,等.兴安杜鹃花色素提取及理化性质研究[J].食品与机械,2011,27(4):61-64.
[19]海妮·巴音达,阿不都拉·阿巴斯.响应面实验优化紫薯皮色素提取工艺及其稳定性分析[J].食品科学,2016,37(1):56-61.
[20]南海娟,莫海珍,颜振敏,等.槲树叶黄酮的抗氧化特性研究[J].中国食品添加剂,2013,(2):1006-2513.
[21]蒋益花,蒋新龙,蔡成岗,等.草酸辅色黑米花色苷热降解及抗氧化特性研究[J].中国粮油学报,2015,30(7):91-96.
[22]王雅,李家寅,赵春萌,等. 沙枣黄酮提取工艺、抗氧化及抑菌活性研究[J].食品工业科技,2013,34(4):273-276.
[23]谢宇奇,莫春凤,奚文权. 枫香树叶黑色素粗产品清除DPPH自由基活性研究[J].粮油食品科技,2016,24(5):83-86.
[24]郑立辉,王鹏君,李伟,等.白芷精油成分分析及清除DPPH自由基活性[J].食品科技,2014,35(15):180-184.
[25]姚文红,李飞阳,王娟. 女贞花总黄酮提取及清除DPPH自由基作用的研究[J].食品研究与开发,2016,37(14):42-45.
[26]郑朝华,陈建秋.西洋参总黄酮的提取及其对羟基自由基清除的作用[J].安徽农业科学,2012,40(32):15903-15904.
StudyonthephysicochemicalpropertiesofpigmentfromflowerofSapindusmukurossi
QIANTian-yuan1,SUNTing1,LICheng-ping1,YELu2,SHANHai-feng3,RAOGui-wei1,*
(1.College of Biology and Environmental Engineering,ZhejiangShuren University,Hangzhou,310015,China;2.Hang Zhou Minsheng Pharmaceutical Co.,Ltd,Hangzhou,311199,China;3.Department of Pharmacy,The People’s Hospital of Ruian,Ruian,325200,China)
With the flower ofSapindusmukurossias raw material,the extraction conditions and physicochemical properties of flower pigments were studied. Experimental results proved that water had a strong ability of extracting effective. The pigment of flower got the maximum absorption peak in 253 nm. Experiment showed that the pigment was more stable under neutral conditions and light can promote the decomposition of the pigment and below 60 ℃ also good for storage. K+and Ca2+had great influences on color and stability of the pigment. Glucose,sucrose and vitamin C(VC)could damage the stability of the pigment. The extraction from the flower ofSapindusmukurossishowes a certain antioxidant activity.All the results will provide theoretical basis for the food development based on the pigment from the flower ofSapindusmukurossi.
flower ofSapindusmukurossi;physicochemical properties;pigment
2017-01-13
钱天元(1996-),男,本科,研究方向:食品检测,E-mail:52247328@qq.com。
*通讯作者:饶桂维(1979-),男,硕士,实验师,研究方向:食品检测,E-mail:xiankelaifeng@163.com。
浙江省教育厅研究项目(Y201432429);浙江树人大学中青年学术团队资助项目(20154503)。
TS255.1
:B
:1002-0306(2017)17-0212-05
10.13386/j.issn1002-0306.2017.17.040
