丁香乙酸乙酯相抑制LDL中赖氨酸、色氨酸氧化修饰的研究
2017-09-21,,,,,,4,,,3,4,*
,,,, ,,4,,,3,4,*
(1.九江学院药学与生命科学学院,江西九江 332000;2.九江安德和生物科技有限公司,江西九江 332000;3.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013;4.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045)
丁香乙酸乙酯相抑制LDL中赖氨酸、色氨酸氧化修饰的研究
万严1,2,杨琼玉1,2,曲文娟1,3,谢丽琴1,郝澍1,2,沈勇根1,4,张良慧1,2,江慎华1,2,3,4,*
(1.九江学院药学与生命科学学院,江西九江 332000;2.九江安德和生物科技有限公司,江西九江 332000;3.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013;4.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045)
低密度脂蛋白(LDL)所含的色氨酸(Trp)、赖氨酸(Lys)发生氧化修饰是导致动脉粥样硬化(AS)形成的重要因素。为反映丁香乙酸乙酯相(EAFC)对LDL氧化过程中Trp、Lys修饰的抑制作用,本文首先对LDL氧化评价孵育体系中氧化剂CuSO4及底物LDL浓度进行优化;进而以荧光为主要指标对这种抑制效果进行了评价。结果表明,选定CuSO4浓度1.25、25 μmol/L与LDL浓度500 μg/mL为配比做后续实验。20 μg/mL EAFC能抑制Trp降解导致的荧光淬灭,抑制作用显著高于1 μg/mL阳性对照(2,6-二叔丁基对甲基苯酚,BHT)(p<0.01)。3 μg/mL EAFC能抑制高反应活性醛修饰Lys,10 μg/mL EAFC能显著抑制Lys与4-HNE共价结合(p<0.01)。15 μg/mL EAFC能有效抑制Lys与MDA交联,抑制效果强于1 μg/mL BHT。15 μg/mL EAFC能显著抑制脂褐素形成(p<0.01)。本文为后期解析EAFC抑制LDL氧化修饰作用方式、抑制氧化LDL与清道夫受体之间识别等作用机理提供参考。
丁香,ApoB-100,低密度脂蛋白,色氨酸,赖氨酸
低密度脂蛋白(Low density lipoprotein,LDL)是由脂质和载脂蛋白B-100(Apolipoprotein B-100,ApoB-100)组成的球状分子,是血液中胆固醇主要载体[1-2]。LDL由74%~79%脂质和21%~26%蛋白组成[2]。LDL极易被氧化修饰产生醛类如4-羟基壬稀酸(4-hydroxynonenal,4-HNE)和丙二醛,(Malondialdehyde,MDA)等,这些产物能氧化修饰LDL的蛋白质(ApoB-100)中相应氨基酸残基[3-5]。ApoB-100(4536个氨基酸残基,分子量为513 kDa)是LDL主要的蛋白质成分,为LDL识别受体的配基。每个ApoB-100分子含有357个赖氨酸(Lysine,Lys)残基及37个色氨酸(Tryptophan,Trp)残基[2,6]。因Trp具有高荧光量子产率,为蛋白质主要的内在荧光团。LDL氧化修饰导致Trp荧光发生淬灭[7]。同时,LDL脂质过氧化产物容易氧化Lys经一系列生化反应最终导致动脉粥样硬化(Atherosclerosis,AS)产生[5,8]。ApoB-100氧化修饰对促进ox-LDL形成及AS具有重要影响。因此,研究天然产物以及功能食品在减轻醛类对LDL中ApoB-100氧化修饰备受关注[9]。
丁香为桃金娘科植物丁香(EugeniacaryophyllataThunb.)的干燥花蕾,为国家公布的药食两用植物,是非常有价值的香料及东亚传统药物,具有很多药理功效[10-13]。
由于在ApoB-100氧化修饰过程中,Trp在Ex295/Em330处的荧光发生淬灭。活性醛与Lys发生衍生化,Lys衍化程度越高其荧光光谱变化越明显[14]。同时,荧光光谱具有高灵敏度、选择性和多功能性等优势[15],被广泛运用于蛋白荧光特性的表征[16]。
实验室前期研究结果表明,丁香在87种药食两用原料中总多酚含量及FRAP值最高、抗氧化能力最强[17]。丁香乙酸乙酯相在其非油类成分中抑制LDL氧化能力最强[18]。Chen等[19]还发现丁香甲醇粗提物能够有效抑制蛋白氧化修饰作用。Yang 等[14]通过荧光光谱技术发现丁香有效部位能有效抑制LDL氧化过程中共轭二烯(CD)产生、胆固醇降解及Lys游离氨基活性降解。江慎华等[2]发现丁香乙酸乙酯相能有效抑制LDL弱氧化过程中硫代巴比妥酸反应物(TBARS)生产、CD产生、及Lys游离氨基活性降解。但是,丁香乙酸乙酯相在氧化修饰过程中对LDL所含ApoB-100中Lys、Trp氧化修饰的抑制效果尚不清楚。
因此,本文以荧光定量及扫描为指标,评价EAFC抑制LDL氧化修饰过程中Trp降解、Lys修饰的效果,以期为解析EAFC抑制LDL氧化修饰作用方式、抑制ox-LDL与清道夫受体之间识别等作用机理提供参考。
1 材料与方法
1.1材料与仪器
丁香 江西黄庆仁栈华氏大药房,批号:1511008,生产日期:2015年11月20号,由江西樟树天齐堂中药饮片有限公司分装,产自广西。材料买回后高速粉碎、过40目筛后置冰箱中备用。LDL依据江慎华等[2]方法自中分离得到。
肝素钠、柠檬酸钠、磷酸二氢钾、磷酸氢二钠 上海阿拉丁试剂有限公司;其余试剂均为国产分析纯或优级纯。
日立F-4500荧光分光光度计 日本岛津公司;UNIC7200可见分光光度计 尤尼柯(上海)公司;PB-10 pH计 Sartorius仪器设备有限公司;CT15RT型高速冷冻离心机 上海天美生化仪器设备工程有限公司;DFY-C高速粉碎机 温岭林大机械公司;RE-52型旋转蒸发仪 上海亚荣生化仪器厂;LJL10冷冻干燥机 巩义市予华仪器有限公司;透析袋(SP132544) 上海源叶生物科技有限公司。
1.2实验方法
1.2.1 生物活性追踪法提取EAFC 采用江慎华等[2]方法,称取200 g丁香干粉,甲醇提取,料液比1∶10 (g/mL)、60 ℃、180 r/min水浴振荡提取40 min,重复以上操作再次提取,合并两次提取液、运用旋转蒸发仪浓缩。取1/10溶液浓缩获得丁香粗提物。剩余溶液旋转蒸发仪浓缩后加入浓缩液3倍体积蒸馏水超声辅助混悬后,向该混悬液液中依次加入石油醚、乙酸乙酯和正丁醇充分萃取(每次溶剂用量200 mL,每种溶剂萃取10次),各萃取相及剩余水相分别浓缩后置于-68 ℃超低温冰箱预冻过夜后,置冷冻干燥机中冻干,72 h后获干粉,分装、密封后置真空干燥器中保存备用。
1.2.2 LDL提取 采用江慎华等[2]方法。在磁力搅拌作用下,将血浆(300 mL)与沉淀液(0.064 mol/L柠檬酸钠,50000 U/L肝素钠,5 mol/L盐酸调pH至5.04)按1∶10体积比混匀。37 ℃水浴静置15 min后,4 ℃、3000 r/min离心10 min,弃上清。收集沉淀后加入1500 mL洗涤液(0.064 mol/L柠檬酸钠5 mol/L盐酸调pH至5.11)洗涤沉淀。离心(10 min 4 ℃ 3000 r/min)弃上清、收集沉淀,用少量磷酸盐缓冲液(PBS)(160 g/L NaCl、2.7 mmol/L KCl、8.1 mmol/L Na2HPO4、1.5 mmol/L KH2PO4)溶解LDL并于4 ℃透析24 h,每6 h更换一次PBS。以牛血清白蛋白为标准品、按Lowry法[20]测定LDL中蛋白质含量,以该蛋白含量定量LDL浓度,4 ℃避光保存,一周内用完。标准曲线回归方式为:y(OD)=0.013x(μg/mL)+0.0503,R2=0.9903。

图1 生物活性追踪法制备EAFCFig.1 The preparation scheme of EAFC based on bioassay guided method
1.2.3 确定LDL氧化孵育体系中CuSO4及LDL适宜添加量 用PBS将透析后的LDL蛋白浓度稀释为250、500、1000 μg/mL,分别加入不同浓度氧化剂CuSO4(1.25、2.5、5、10、25、50 μmol/L),37 ℃孵育24 h后,加1% EDTA-Na2终止氧化反应,分别测定脂褐素含量、4-HNE对ApoB-100修饰作用释放的荧光和Trp荧光强度。以及固定LDL浓度为500 μg/mL,分别加入1.25、2.5、5、10、25、50 μmol/L CuSO4对MDA-Lys和高反应活性醛类修饰Lys及Trp荧光光谱进行扫描。
1.2.4 EAFC对ox-LDL中Trp降解的抑制 设置促氧对照组(4.9 mL LDL+50 μL CuSO4+50 μL甲醇)、空白对照组(4.9 mL LDL+50 μL去离子水+50 μL甲醇)、2,6-二叔丁基对甲基苯酚(2,6-Di-tert-butyl-4-methylphenol,BHT)阳性对照组和不同浓度的EAFC(4.9 mL LDL+50 μL CuSO4+50 μL BHT或EAFC)。LDL的终浓度为500 μg/mL,CuSO4终浓度为1.25、25 μmol/L。37 ℃水浴孵育14 h后进行如下测定。
采用Ferretti 等[21]方法稍加修改,定量测定Ex295nm/Em330 nm处Trp荧光强度以评价各样液抑制ApoB-100中Trp降解的效果。
采用De 等[8]方法稍加修改,固定Ex280 nm,在300~450 nm发射波长内对各样品进行荧光扫描。
1.2.5 EAFC对脂质过氧化产物修饰ApoB-100的抑制效果
1.2.5.1 EAFC抑制4-HNE与ApoB-100中Lys的ε-氨基共价结合 采用Itakura 等[22]方法稍加修改。按照1.2.4方法孵育14 h,测定Ex360 nm/Em430 nm处荧光强度,评价LDL氧化过程中4-HNE与ApoB-100中Lys的ε-氨基相互作用形成的荧光强度以及不同样液的抑制效果。
1.2.5.2 EAFC抑制MDA与ApoB-100中Lys的ε-氨基相互作用 采用Yang等[14]方法,按照1.2.4方法孵育18 h,固定Ex390 nm、在400~550 nm范围内扫描发射波长,测定LDL氧化过程中MDA与ApoB-100中赖氨酸ε-氨基相互作用形成的荧光强度及不同样液的抑制效果。
1.2.5.3 EAFC抑制高反应活性醛类对Lys修饰效果 采用Yang 等[14]方法,按照1.2.4方法孵育18 h,固定Ex350 nm、在发射波长400~550 nm内对各样品进行荧 光扫描。
1.2.5.4 EAFC抑制LDL氧化过程中脂褐素产生 采用Sutherland 等[23]方法稍加修改。按照1.2.4方法孵育14 h,在5 nm狭缝条件下测定Ex350 nm/Em460 nm处荧光强度,测定EAFC对LDL氧化过程中脂褐素产生的抑制效果。
1.2.6 数据处理 采用DPS软件进行统计分析。
2 结果与分析
2.1确定LDL氧化孵育体系中CuSO4及LDL适宜添加量
Cu2+诱导氧化时,LDL中不饱和脂肪酸氧化形成大量脂质过氧化产物[24]。已经证实,在LDL氧化过程中产生的脂质过氧化产物能诱导LDL结构和功能改变[21]。由于不同的LDL以及CuSO4添加量对LDL氧化中各评价体系的结果具有影响[18]。因此,本实验首先对氧化孵育体系中LDL及CuSO4添加量进行优化,实验结果如图2、图3所示。
2.1.1 确定Trp荧光淬灭、4-HNE与Lys共价结合、脂褐素孵育体系中CuSO4及LDL适宜添加量 ApoB-100是LDL主要的蛋白质成分,在受体介导的内吞作用中作为配基识别LDL受体[6]。ApoB-100分子含有的37个Trp是LDL主要的内在荧光团[2],随LDL氧化其荧光会发生淬灭[7],该荧光淬灭越多表示LDL蛋白质氧化越严重[25]。为确定Trp荧光孵育体系中LDL和CuSO4的适宜添加量,采用1.2.3中方法测定,结果如图2a所示。当LDL为500 μg/mL时,CuSO4浓度在0~25 μmol/L范围内,荧光强度随浓度增强而减弱,在25~50 μmol/L范围内时,荧光强度随浓度增强而有所增强。当LDL浓度为250或1000 μg/mL时,CuSO4浓度在0~50 μmol/L范围内Trp荧光强度均未出现明显拐点。该结果表明,Trp荧光淬灭的评价体系中LDL和CuSO4适宜浓度分别为500 μg/mL和25 μmol/L。
4-HNE是重要的脂质过氧化产物,其与蛋白质形成的加成物影响蛋白质的结构和功能[26]。通过检测Ex360 nm/Em430 nm的荧光,可以检测LDL氧化中4-HNE与Lys结合[20]。脂褐质为氧化和交联的蛋白质、脂类以及少量碳水化合物组成的复杂混合物[27]。该混合物由醛式的脂质过氧化产物和蛋白质反应生成,在衰老细胞、血浆、ox-LDL以及AS损伤中均有分布,其在血浆中的浓度是体内脂质过氧化标志[23]。为确定4-HNE与Lys共价结合、脂褐素孵育体系中LDL和CuSO4的适宜添加量,采用1.2.3节方法测定结果如图2b、图2c所示。当LDL浓度为500 μg/mL时,CuSO4浓度在0~25 μmol/L范围内,荧光强度随CuSO4浓度增加而增强,而CuSO4浓度在25~50 μmol/L荧光强度随Cu2+浓度增加而减弱。而LDL浓度在250、1000 μg/mL时,CuSO4在0~50 μmol/L浓度范围内氧化程度均未出现明显拐点。因此,4-HNE与Lys共价结合、脂褐素评价体系中LDL和CuSO4适宜浓度为500 μg/mL和25 μmol/L。

图2 不同LDL和CuSO4条件下LDL氧化产生的荧光强度Fig.2 The fluorescence intensity of LDL oxidation under different CuSO4 and LDL conditions注:(a)Trp激发荧光;(b)4-HNE与Lys共价结合;(c)脂褐素。
2.1.2 Trp荧光光谱、MDA-Lys、高反应活性醛类修饰Lys孵育体系中CuSO4适宜添加量 天然ApoB-100中Trp荧光光谱在332 nm附近有最大吸收[25],随着LDL氧化,最大吸收逐渐降低[2]。为进一步验证2.1.1反应体系中LDL浓度及CuSO4添加量,本文进一步扫描Trp荧光光谱,结果如图3a所示。当CuSO4在0~50 μmol/L之间时,荧光扫描峰值随着CuSO4浓度升高而降低。加入25、50 μmol/L CuSO4后Trp荧光光谱几乎重叠。扫描光谱图荧光强度及走势越低,表明LDL氧化越严重,添加丁香样品后更容易反映其抑制效果。图3a结果在该孵育体系中CuSO4浓度为25 μmol/L比较适宜,验证了上述图2a测定结果。
LDL氧化过程中还会产生另一种高反应活性醛(MDA),MDA能与Lys交联形成MDA-Lys[28-29]。脂质氧化产物-各种醛类修饰Lys的ε-氨基,形成Ex350 nm/Em420 nm处有强荧光吸收的物质,导致蛋白质无法正确折叠乃至降解[6,22]。荧光强度越高,代表LDL氧化修饰越严重,添加丁香样品后更容易反映其抑制氧化修饰效果。因此,分别固定Ex390 nm,Ex350 nm扫描发射波长反映Lys光谱变化,确定MDA-Lys和高反应活性醛类修饰Lys孵育体系中CuSO4的最适浓度。结果如图3b、图3c所示。当CuSO4为1.25 μmol/L时,MDA-Lys荧光光谱峰值明显降低,高反应活性醛类对Lys修饰的光谱峰值明显升高,随着CuSO4浓度进一步升高,光谱峰值变化不大。结果表明MDA-Lys和高反应活性醛类修饰Lys的荧光光谱孵育体系中CuSO4的最适浓度为1.25 μmol/L。

图3 在不同CuSO4浓度条件下500 μg/μLLDL氧化形成的荧光强度Fig.3 The fluorescence intensity of 500 μg/μL LDL oxidation at different CuSO4 concentrations注:(a)Trp荧光光谱;(b)MDA-Lys;(c)高反应活性醛类修饰Lys。
2.2 EAFC对LDL氧化过程中Trp降解的抑制作用
2.2.1 EAFC对LDL氧化过程中Trp降解导致荧光淬灭的定量测定 由上述2.1确定混合孵育体系中LDL和CuSO4最适浓度后,采用1.2.4方法测定EAFC对LDL氧化过程中Trp降解抑制作用的结果如图4所示。与促氧相比,添加15、20 μg/mL EAFC后Trp荧光强度显著增强(p<0.01),浓度越高、抑制效果越好,并且20 μg/mL EAFC的抑制效果强于阳性对照(1 μg/mL)(p<0.01)。表明EAFC能有效抑制Trp降解。

图4 EAFC对LDL氧化过程中Trp荧光淬灭的抑制效果Fig.4 Inhibition efficiency of EAFC on Trp fluorescence quenching 注:不同字母表示差异极显著,p<0.01,图6,图9同。
2.2.2 EAFC对LDL氧化过程中Trp降解导致荧光淬灭的扫描分析 2.2.1中结果表明EAFC能有效抑制Trp荧光淬灭,在此基础上根据1.2.4方法通过荧光扫描评价各样品对LDL氧化过程中Trp荧光光谱变化的抑制效果,结果如图5所示。与促氧相比,添加1 μg/mL EAFC后其荧光光谱最大吸收增强,且随EAFC浓度升高其最大吸收峰逐渐增强。20 μg/mL EAFC的抑制效果强于1 μg/mL BHT。该结果与图4定量测定结果相互佐证,进一步证明EAFC能够有效抑制氧化LDL中Trp降解。EAFC对Trp降解的抑制作用可能是通过抑制Cu2+与ApoB-100结合,从而避免蛋白质的氨基酸残基被修饰[30]。Ferretti 等[21]研究发现植物甾醇也能抑制LDL氧化过程中Trp降解。

图5 EAFC对LDL氧化过程中Trp产生荧光光谱变化的影响Fig.5 The influence of EAFC on Trp fluorescence spectroscopy
2.3 EAFC抑制LDL氧化过程中脂质过氧化产物对ApoB-100中Lys的修饰作用
LDL氧化过程中,不仅ApoB-100的Trp会降解,Lys也会受醛类修饰[31]。由2.2结果可知EAFC能有效抑制ApoB-100中Trp降解,本节进一步分析EAFC对脂质过氧化产物修饰ApoB-100中Lys的抑制效果。
2.3.1 EAFC抑制LDL氧化过程中4-HNE与ApoB-100中Lys共价结合效果 LDL经脂质过氧化反应形成的4-HNE是一种能与Lys共价结合的醛类[20]。采用1.2.5.1节方法测定EAFC对4-HNE与Lys共价结合的抑制作用,结果如图6所示。与空白相比,促氧荧光强度显著增强(p<0.01)。添加10 μg/mL EAFC后荧光强度较促氧显著减弱(p<0.01),且随着EAFC浓度提高,荧光强度逐渐减弱。表明EAFC能有效抑制4-HNE对ApoB-100中Lys的修饰作用,但EAFC的抑制效果显著低于10 μg/mL BHT。Keller等[32]研究发现仙人掌多酚和黄酮能够抑制4-HNE的毒性。EAFC抑制4-HNE与Lys共价结合,也可能是由其所含的多酚和黄酮起作用。

图6 EAFC对4-HNE与Lys的ε-氨基相互作用的抑制效果Fig.6 Inhibition efficiency of EAFC on covalent binding of 4-HNE to the lysine ε-amino group
2.3.2 EAFC抑制LDL氧化过程中MDA与Lys结合作用 由2.3.1分析可知EAFC能有效抑制4-HNE与Lys共价结合(图6)。LDL脂质过氧化产生的代表性醛类除了4-HNE外,还包含MDA[27]。因此,采用1.2.5.2节方法测定EAFC对MDA与Lys结合的抑制作用结果如图7所示。与空白相比,促氧组荧光光谱最高。添加5 μg/mL EAFC后,荧光光谱及强度较促氧降低。当EAFC升高到15 μg/mL后,荧光光谱进一步降低,其荧光强度及扫描谱线甚至趋近于空白组,并强于1 μg/mL BHT,表明EAFC也能有效抑制MDA与Lys结合。实验室前期研究基础已表明EAFC能有效抑制LDL氧化过程中形成MDA[33]。因此,EAFC可能是通过抑制MDA产生、降低其含量而达到减少MDA与ApoB-100中Lys交联。

图7 EAFC对MDA与Lys交联作用的抑制效果Fig.7 Inhibition efficiency of EAFC on covalent binding of MDA to the Lys
2.3.3 EAFC抑制LDL氧化过程中高反应活性醛类对Lys修饰作用 LDL脂质过氧化中除了会产生2.3.1和2.3.2中的4-HNE和MDA,还包含许多其他的高反应活性醛类[34]。因此,通过1.2.5.3方法测定分析EAFC抑制高反应活性醛类对Lys修饰的效果,结果如图8所示。与空白相比,促氧的荧光光谱峰值明显升高。添加3 μg/mL和5 μg/mL EAFC后其荧光光谱峰值逐渐降低。以上结果表明EAFC能减缓LDL氧化过程中高反应活性醛类对ApoB-100中Lys的修饰作用。Picard等[35]研究发现氨基胍能延缓高反应活性醛类对Lys的修饰作用。
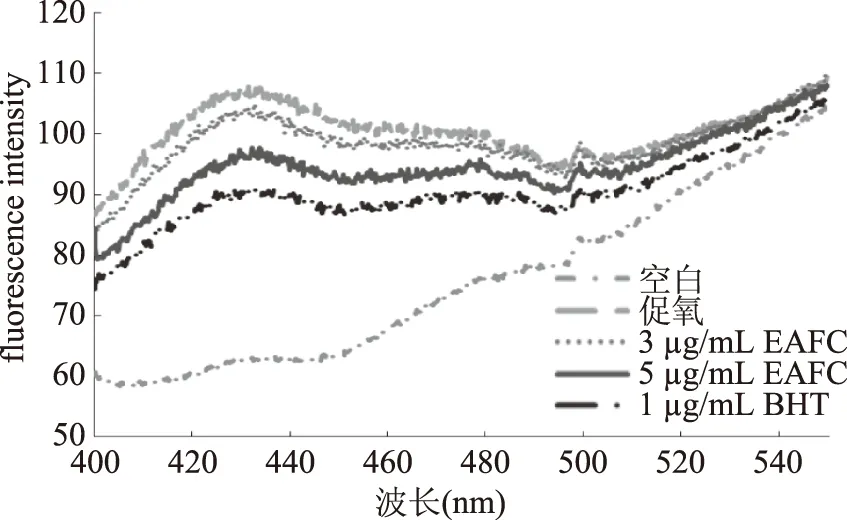
图8 EAFC对高反应活性醛类修饰Lys的荧光光谱的影响Fig.8 Effect of EAFC on fluorescence spectra of lysine by reactive aldehydes modification
2.4 EAFC抑制LDL氧化过程中脂褐素的形成
LDL在氧化过程中,除了ApoB-100中Trp会降解以及醛类会对Lys修饰外,ox-LDL产生的脂质过氧化产物还能与ApoB-100反应生成脂褐素[36]。为此,采用1.2.5.4方法通过测定脂褐素荧光变化反映EAFC对脂质过氧化产物与ApoB-100反应的抑制效果,结果如图9所示。与促氧相比,添加15 μg/mL EAFC样液后,其荧光强度显著降低(p<0.01)。随着EAFC浓度增加,荧光强度逐渐减弱。这些结果表明,EAFC也能有效抑制ox-LDL中脂褐素生成。王丽丽发现紫丁香叶提取物能抑制脂褐素形成[37]。LDL氧化修饰导致ApoB-100周围极性发生改变使其更容易与脂质过氧化产物发生反应。EAFC可能是通过保护ApoB-100,使其极性不发生变化,从而使其不易于与脂质氧化产物结合[30]。

图9 EAFC对LDL氧化过程中脂褐素形成的抑制效果Fig.9 Inhibition efficiency of ethyl acetate extract of clove on lipofuscin generated
3 结论
EAFC能抑制Trp的降解,延缓LDL氧化过程中ApoB-100的修饰,其抑制效果高于1 μg/mL BHT。
10 μg/mL EAFC能抑制4-HNE对Lys的修饰,当EAFC浓度增加为15 μg/mL不仅能抑制脂褐素形成,对于Lys与MDA发生交联的抑制效果强于1 μg/mL BHT(p<0.01),所以EAFC能抑制高反应活性醛类对Lys修饰,延缓清道夫受体对ox-LDL的识别与吞噬。
EAFC抑制醛类对Lys修饰可能是通过抑制Trp的降解,从而减少脂质过氧化反应的启动,进而减少醛类对Lys的修饰。
[1]Prassl R,Laggner P. Molecular structure of low density lipoprotein:current status and future challenges[J]. European Biophysics Journal,2009,38(2):145-158.
[2]江慎华,万严,杨琼玉,等. 丁香有效部位对低密度脂蛋白弱氧化修饰的抑制效果[J]. 农业机械学报,2016,47(6):242-249.
[3]Lankin V Z,Tikhaze A K,Kapel’Ko V I,et al. Mechanisms of oxidative modification of low density lipoproteins under conditions of oxidative and carbonyl stress[J]. Biochemistry Biokhimiia,2007,72(10):1081-1090.
[4]Baohai S,Subramaniam P,Ioanna P,et al. Modifying apolipoprotein A-I by malondialdehyde,but not by an array of other reactive carbonyls,blocks cholesterol efflux by the ABCA1 pathway[J]. 2010,285(24):18473-18484.
[5]Stocker R,Jr K J. Role of oxidative modifications in atherosclerosis[J]. Physiological Reviews,2004,84(4):1381-1478.
[6]Kim G,Lee H,Oh H,et al. Solution state structure of P1,the mimetic peptide derived from Igm antigen ApoB-100 by NMR[J].2016,20(3):95-101.
[7]Sato A,Aoki J,Ebina K. Synthetic biotinylated peptide compound,BP21,specifically recognizes lysophosphatidylcholine micelles[J]. Chemical Biology & Drug Design,2012,80(3):417-425.
[8]De L P R,Barcelos R P,De Bem A F,et al. Oximes as inhibitors of low density lipoprotein oxidation[J]. Life Sciences,2008,83(25-26):878.
[9]Rahman M A,Abdullah N,Aminudin N. Antioxidative effects and inhibition of human low density lipoprotein oxidationinvitroof polyphenolic compounds in flammulina velutipes(golden needle mushroom)[J]. Oxidative Medicine & Cellular Longevity,2015,2015(10):1-10.
[10]江慎华,赵锦,刘常金,等. 采用超声-微波协同技术提取丁香总多酚工艺优化及其高效原因分析[J]. 食品工业科技,2014,35(24):243-247.
[11]Ryu B,Kim H M,Woo J H,et al. A new acetophenone glycoside from the flower buds ofSyzygiumaromaticum(cloves)[J]. Fitoterapia,2016,115:46-51.
[12]闫训友,杜洪利,朱爱红,等. 丁香提取物对鲜切鸭梨保鲜效应的研究[J]. 食品工业科技,2016,37(4):347-350,355.
[13]Jin S,Cho K H. Water extracts of cinnamon and clove exhibits potent inhibition of protein glycation and anti-atherosclerotic activityinvitroandinvivohypolipidemic activity in zebrafish[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2011,49(7):1521-1529.
[14]Yang Q Y,Wan Y,Jiang S H,et al. The antioxidant inhibition of clove effective fraction on lipid and protein and spectra variation of LDL.[J]. Spectroscopy and Spectral Analysis,2017,1(37):312-320.
[15]Chen Z,Liu Q,Wang S,et al. Study on hemorrhagin III purified from the venom of Agkistrodon acutus,by three-dimensional fluorescence spectrometry[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy,1999,55(9):1909-1914.
[16]Kumaran R,Ramamurthy P. Photophysical studies on the interaction of amides with Bovine Serum Albumin(BSA)in aqueous solution:Fluorescence quenching and protein unfolding[J]. Journal of Luminescence,2014,148(7):277-284.
[17]杜余辉,蔡志鹏,江慎华,等. 丁香有效部位清除超氧阴离子及对LDL糖基化抑制作用[J]. 食品工业科技,2016,37(15):80-85.
[18]江慎华,肖敏,江春霞,等. 生物活性追踪法对丁香抗低密度脂蛋白氧化修饰的研究[J]. 现代食品科技,2013(9):2063-2067.
[19]Chen H,Diao J,Li Y,et al. The effectiveness of clove extracts in the inhibition of hydroxyl radical oxidation-induced structural and rheological changes in porcine myofibrillar protein[J]. Meat Science,2015,111(2):60-66.
[20]董学艳,姜铁民,刘继超,等. 高通量快速检测母乳总蛋白、乳清蛋白和酪蛋白含量方法的比较研究[J]. 食品工业科技,2016,37(5):308-310.
[21]Ferretti G,Bacchetti T,Masciangelo S,et al. Effect of phytosterols on copper lipid peroxidation of human low-density lipoproteins[J]. Nutrition,2010,26(3):296-304.
[22]Itakura K,Oya T. Detection of lipofuscin-like fluorophore in oxidized human low-density lipoprotein. 4-hydroxy-2-nonenal as a potential source of fluorescent chromophore.[J]. Febs Letters,2000,473(2):249-253.1.4.5.
[23]Sutherland W H,Williams M J,Jong S A D. Plasma protein lipofuscin-like fluorophores in men with coronary artery disease treated with statins[J]. Archives of Medical Research,2007,38(7):757-763.
[24]Yu L H,Liu G T,Sun Y M,et al. Antioxidative effect of schisanhenol on human low density lipoprotein and its quantum chemical calculation[J]. Acta Pharmacologica Sinica,2004,25(8):1038-44.
[25]Portella R D L,Barcelos R P,Rosa E J F D,et al. Guaraná(Paullinia cupana,Kunth)effects on LDL oxidation in elderly people:aninvitro,andinvivo,study[J]. Lipids in Health & Disease,2012,12(1):12.
[26]Castro J P,Jung T,Grune T,et al. 4-Hydroxynonenal(HNE)modified proteins in metabolic diseases[J]. Free Radical Biology & Medicine,2016.
[27]Nowotny K,Jung T,Grune T,et al. Accumulation of modified proteins and aggregate formation in aging[J]. Experimental Gerontology,2014,57(9):122-131.
[28]Huang G S,Wang Z P,Wang S C,et al. Intracellular generation of MDA-LYS epitope in foam cells[J]. Life Sciences,1999,65(3):285-296.
[29]Uchida K,Sakai K,Itakura K,et al. Protein Modification by lipid peroxidation products:formation of malondialdehyde-derived N′-(2-Propenal)lysine in proteins[J]. Archives of Biochemistry & Biophysics,1997,346(1):45-52.
[30]Barcelos R P,Portella R L,Da R E,et al. Thiosemicarbazone derivate protects from AAPH and Cu2+-induced LDL oxidation[J]. Life Sciences,2011,89(1-2):20.
[31]Vanderyse L,Devreese A M,Baert J,et al. Structural and functional properties of apolipoprotein B in chemically modified low density lipoproteins[J]. Atherosclerosis,1992,97(2-3):187.
[32]Keller J. Antiatherogenic and antitumoral properties of Opuntia cladodes:inhibition of low density lipoprotein oxidation by vascular cells,and protection against the cytotoxicity of lipid oxidation product 4-hydroxynonenal in a colorectal cancer cellular model[J]. Journal of Physiology and Biochemistry,2015,71(3):577-587.
[33]刘仁绿,肖敏,江卫青,等. 诃子粗提物及不同极性部位抑制低密度脂蛋白氧化修饰的研究[J]. 食品工业科技,2013,34(16):100-104.
[34]Esterbauer H,Jürgens G,Quehenberger O,et al. Autoxidation of human low density lipoprotein:loss of polyunsaturated fatty acids and vitamin E and generation of aldehydes[J]. Journal of Lipid Research,1987,28(5):495.
[35]Picard S,Parthasarathy S,Fruebis J,et al. Aminoguanidine inhibits oxidative modification of low density lipoprotein protein and the subsequent increase in uptake by macrophage scavenger receptors[J]. Proceedings of the National Academy of Sciences,1992,89(15):6876-6880.
[36]Candide C,Reyftmann J P,Santus R,et al. Modification of ε-amino group of lysines,cholesterol oxidation and oxidized lipid-apoprotein cross-link formation by porphyrin-photosensitized oxidation of human low density lipoproteins[J]. Photochemistry & Photobiology,1988,48(2):137.
[37]王丽丽,赵新淮. 紫丁香叶提取物对低密度脂蛋白氧化修饰的抑制作用[J]. 东北农业大学学报,2007,38(5):641-644.
InhibitioneffectofethylacetatefractionofcloveonTrpandLysmodificationduringLDLoxidation
WANYan1,2,YANGQiong-yu1,2,QUWen-juan1,3,XIELi-qin1,HAOShu1,2,SHENYong-gen1,4,ZHANGLiang-hui1,2,JIANGShen-hua1,2,3,4,*
(1.School of Pharmacy and Life Science,Jiujiang University,Jiujiang 332000,China;2.Jiujiang Andehe Biotechnology Corporation Ltd,Jiujiang 332000,China;3.School of Food and Biological Engineering,Jiangsu University,Jiangsu Provincal Key Lab of Physical Processing of Agricultural Products,Zhenjiang,212013,China;4.College of Food Science and Engineering,Jiangxi Agricultural University,Jiangxi Key Laboratory of Natural Products and Functional Foods,Nanchang 330045,China)
Oxidative modification of Tryptophan(Trp)and Lysine(Lys)in apoB-100 of LDL is the important factor resulting in atherosclerosis(AS). In order to investigate the possible inhibition effect of Ethyl acetate fraction of clove(EAFC)on Trp and Lys oxidative modification during LDL oxidation,the concentrations of CuSO4and LDL were firstly optimized,and then this inhibition effects of EAFC against oxidation were evaluated by using fluorescence as the main index in this paper. The results indicated that the concentrations of CuSO4and LDL were 1.25,25 μmol/L and 500 μg/mL respectively in subsequent experiments. Fluorescence quenching can be inhibited by 20 μg/mL EAFC,and this inhibition effect was significantly higher than that of the 1 μg/mL butylated hydroxytoluene(positive control,BHT)(p<0.01). Likewise,3 μg/mL EAFC can inhibit the modification of Lys residues by highly reactive aldehydes. 10 μg/mL EAFC can dramatically inhibit covalent binding of 4-HNE with the Lys residues(p<0.01). The modification of Lys residues resulting from MDA was inhibited by EAFC(15 μg/mL)which was significant than that of 1 μg/mL BHT. Meanwhile,15 μg/mL EAFC showed a significant inhibition on formation of lipofuscin(p<0.01). This study provides references for further analyzing the inhibition way of EAFC and the mechanism that EAFC inhibits the recognition between ox-LDL and scavenger receptors.
clove;apolipoproteinb-100;low density lipoprotein;tryptophan;lysine
2017-03-06
万严(1993-),女,硕士,研究方向:天然产物研究与开发,E-mail:wanyanbio@163.com。
*通讯作者:江慎华(1973-),男,博士,教授,研究方向:天然产物研究与开发,E-mail:jiangshenhua66@163.com。
国家自然科学基金(31360371,31560308,31301423);江西省科技支撑计划(20151BBF60026);江西省教育厅项目(GJJ161081);江苏省农产品物理加工重点实验室开放课题(JAPP2010-5);江西省天然产物与功能食品重点实验室开放基金、九江学院人才启动基金、九江学院教改课题(2015-04)。
TS201.4
:A
:1002-0306(2017)17-0010-08
10.13386/j.issn1002-0306.2017.17.003
