不同处理条件对马铃薯糖蛋白Patatin构象的影响研究
2017-09-21,,,
,,,
(1.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨150000;2.黑龙江出入境检验检疫局技术中心,黑龙江 哈尔滨 150001;3.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨150000;4.东北农业大学食品学院,黑龙江 哈尔滨150030)
不同处理条件对马铃薯糖蛋白Patatin构象的影响研究
孙莹1,魏冬旭2,姚春艳3,江连洲4
(1.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨150000;2.黑龙江出入境检验检疫局技术中心,黑龙江 哈尔滨 150001;3.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨150000;4.东北农业大学食品学院,黑龙江 哈尔滨150030)
运用荧光和圆二色光谱手段研究了不同物理和化学条件处理后,马铃薯糖蛋白Patatin二级和三级结构的变化。结果表明:当pH4~5时,Patatin的二级结构以α-螺旋为主。当pH6~9时,Patatin的二级结构以β-折叠为主;随着pH增加,荧光强度下降,最大发射波长蓝移,并且pH对Patatin结构的影响是可逆的;在温度为20~60 ℃时,Patatin的二级结构以β-折叠结构为主,当温度达到80 ℃时,Patatin的二级结构以无规则卷曲结构为主;随着温度升高,荧光强度下降,最大发射波长红移;当Patatin处于不同浓度的DTT环境时荧光强度下降,当Patatin处于不同浓度的尿素环境时荧光强度增加,出现红移。在变性剂存在条件下,无规则卷曲结构逐渐取代β-折叠结构成为含量最多的构型。
Patatin,空间构象,荧光光谱,圆二色光谱
Patatin占马铃薯块茎中可溶性蛋白的40%左右[1-2],是一种具有多种生理功能的天然糖蛋白,如抗氧化和抗肿瘤增殖活性,所以引起了研究者的广泛兴趣[3-5]。在一定环境下,蛋白质会因为带电基团的定位及基团间的静电作用,发生构象变化,从而使其功能性质发生变化。Kelly[6]等研究表明尿素和盐酸胍可以引起蛋白质折叠展开。然而不同处理条件对马铃薯糖蛋白Patatin结构的影响还不十分清楚。
荧光光谱技术是观测蛋白质构象变化动力学过程的一种重要工具[7-8]。蛋白质的内源荧光主要是由Trp和Tyr残基所发射[9]。荧光强度和最大吸收波长的改变反应了色氨酸残基的变化程度和所处的微环境的变化。蛋白质变性的过程就是其内部的疏水性氨基酸逐渐向外暴露的过程,所以可以借助于疏水性较强的色氨酸或酪氨酸残基的微环境变化来预测蛋白质表面疏水性的变化以对其变性过程进行动态研究[10-11]。蛋白质是链状生物大分子,通过氨基酸分子构成,天然状态的蛋白质分子通常不以长链分子的状态存在,而是长链分子折叠后形成的具有一定规律的三维结构。蛋白质主链的构象代表蛋白质的二级结构,有四种空间结构,分为α-螺旋,β-折叠,β-转角和无规卷曲[12-13]。蛋白质的圆二色性是由其酰胺键(肽键)的相互作用引起的,可在190~250 nm的紫外区段来测量蛋白质的圆二色谱。不同的蛋白质二级结构,引起不同的酰胺键的相互作用,产生不同的圆二色光谱特征[13]。目前由于圆二色谱具有信息量大,干扰小,结果更直观等特点,已经成为测定生物大分子结构的有力手段。
本研究利用荧光光谱和圆二色谱分析马铃薯糖蛋白Patatin在不同pH、温度、尿素和DDT诱导下二级和三级结构的变化,旨在准确地表征蛋白质构象,为今后研究马铃薯蛋白质结构和功能的关系奠定一定的理论基础。
1 材料与方法
1.1材料与仪器
马铃薯汁水 内蒙古华欧淀粉厂;Con A-Sepharose 4B和Q-Sepharose Fast Flow 美国GE Healthcare公司;盐酸胍、尿素和DDT Sigma公司,其他所用化学药品为分析纯。
AKTA层析系统 美国GE公司;Jasco-810圆二色光谱仪日本 JASCO公司;F-4500型荧光分光光度计 日本日立公司。
1.2实验方法
1.2.1 糖蛋白Patatin的制备 以马铃薯汁水为原料,采用MWCO 200 kDa超滤膜进行过滤。将超滤截留液干燥后得到的马铃薯浓缩蛋白粉进行色谱分离。称取三份200 mg超滤浓缩蛋白粉分别用pH7的5 mL 20 mmol/L磷酸盐缓冲液溶解。10000 r/min离心30 min后取上清液上离子交换Q-Sepharose Fast Flow(1.6 cm×25 cm)柱,用20 mmol/L磷酸盐缓冲液(溶解样品时的pH)平衡,收集离子交换穿透峰,再用平衡液冲洗5个柱体积,然后用含1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)B液洗脱。100% B液直接洗脱。收集离子交换洗脱峰。将离子交换洗脱峰浓缩后,上Con A-Sepharose 4B(2.6 cm× 20 cm)柱。用含1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)平衡,用1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)平衡5个柱体积后,改用含0~100 mmol/Lα-甲基-D-葡萄糖苷和1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)C液洗脱。流速为1.5 mL/min。在280 nm下检测吸光度。收集亲和层析洗脱峰,5000 Da超滤离心管离心10 min,干燥后存于-20 ℃冰箱中备用[14]。
1.2.2 荧光光谱测定 参照Rahma等[15]人方法,略作修改。采用F-4500型荧光分光光度计测定Patatin的三级结构变化。激发波长为295 nm,发射光检测范围为300~400 nm,扫描速度为1200 nm/min,激发和发射狭缝均为5 nm,扫描5次。数据分析软件采用FL Solutions 2.0。
1.2.3 圆二色光谱测定 参照李雪琴等[16]人方法,稍作修改。采用远紫外区域圆二色光谱研究不同pH对蛋白二级结构的影响。配制一定浓度的蛋白溶液,室温下将样品放置1 h。采用Jasco-810圆二色光谱仪在190~250 nm之间扫描,分辨率1 nm,空白为样品所处的缓冲液,实验值为5次扫描的均值。蛋白二级结构组成估算软件为Jasco。
1.2.4 不同pH对Patatin构象的影响 将Patatin分别用pH4、pH5、pH6、pH7、pH8和pH9的0.1 mol/L Tris-HCl缓冲液溶解,用相应的缓冲液调节pH到精确的值,保证蛋白质的浓度为1 mg/mL,取样测定不同pH对荧光光谱和圆二色光谱的影响。然后从不同pH的样品体系中取样,小心调节pH为7.0,进行荧光光谱检测。
1.2.5 不同温度对Patatin构象的影响 将Patatin用pH7.0,0.1 mol/L Tris-HCl缓冲液溶解在离心管中,保证蛋白质的浓度为1 mg/mL,然后将离心管分别在20、40、60、80、100 ℃水浴中加热30 min后迅速放入冰浴中冷却。取样测定不同温度对荧光光谱和圆二色光谱的影响。
1.2.6 不同变性剂对Patatin构象的影响 将Patatin分别用0、2、4、6、8 mol/L尿素(pH7.0,1 mol/L Tris-HCl)和0、2、4、6、8 mmol/L DTT(pH7.0,1 mol/L Tris-HCl)溶液溶解,静置2 h后取样测定尿素和DTT对Patatin荧光光谱的影响。并用6 mol/L尿素和2 mmol/L DTT溶解Patatin,静置2 h后,取样用于圆二色谱的检测。
1.3数据处理
每个实验重复三次,实验结果用平均数±SD表示。采用SPSS 12.0数据统计软件对实验数据进行处理,采用Origin8.0作图。
2 结果与分析
2.1不同pH对Patatin构象的影响
由图1可知,在pH4和pH5的酸性环境下,Trp荧光强度最高,且在pH4 和pH5时的荧光图谱差别很小。随着pH的升高,Trp的荧光强度逐渐减弱,在pH9时,几乎看不到明显的峰型。实验测得Trp的最大发射波长为355 nm,说明在pH4~9范围内Patatin中的Trp残基较大程度上位于疏水的环境中。当pH再次调为7.0时,不同pH环境中Trp的荧光强度近似一致(图1)。说明pH引起的侧链氨基酸残基微环境的变化可能是可逆的,但是pH本身也会造成荧光强度的变化[17]。
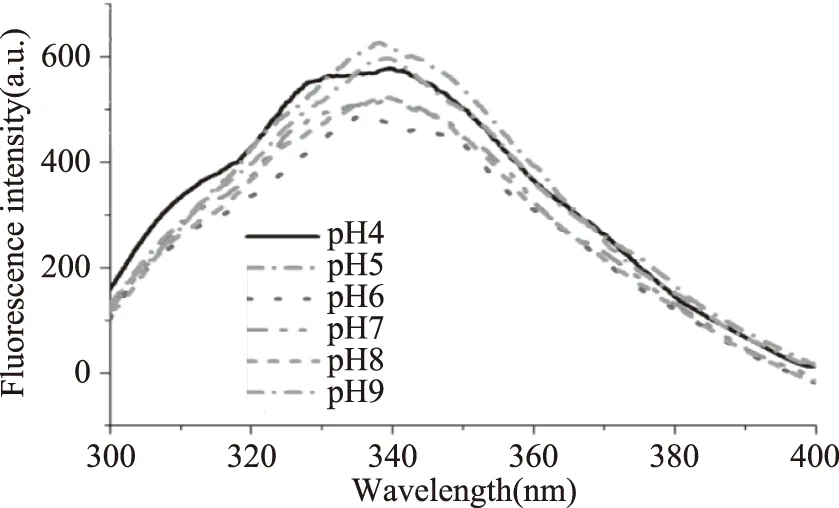
图1 不同pH条件下Patatin溶液pH调整为7时的荧光光谱Fig.1 Fluorescence spectra of Patatin recorded at pH adjusted to pH7
pH对Patatin二级结构含量的影响如图2所示。当pH<6时,β-折叠结构的含量随着pH的增加而迅速增加,在pH6时达到最大;当pH>7时,再提高pH对β-折叠结构的含量影响不大;α-螺旋结构的含量随着pH的升高逐渐下降;无规则卷曲结构含量逐渐增加;β-转角在pH7时最低,在pH7两侧轻微增加;在pH4和pH5条件下,α-螺旋和β-折叠结构含量相近,为主要的二级结构类型;在pH6~9范围内,Patatin的二级结构以β-折叠为主,α-螺旋、β-转角和无规则卷曲结构次之。蛋白质分子中α-螺旋和β-折叠的稳定性主要取决于分子内部的氢键。溶液pH的变化造成蛋白分子的内部氢键发生改变,致使二级结构发生改变[18-19]。结合荧光光谱分析结果可知,在pH4和pH5条件下的Patatin结构相似;pH6~9条件下的Patatin结构相似。

图2 不同pH对Patatin二级结构含量的影响Fig.2 Effect of pH on secondary structure content of Patatin
2.2不同温度对Patatin构象的影响
图3是不同温度对Patatin荧光光谱的影响。由图可知,温度在20 ℃和40 ℃时,Trp荧光强度变化很小,两者的峰型相同,最大发射峰波长相近。在60 ℃时,Trp的荧光强度与20 ℃和40 ℃时相差不大,但是最大发射波长发生了轻微红移。在80 ℃和100 ℃高温条件下,Trp荧光强度显著下降,并且发生显著红移。温度升高,分子间的碰撞加剧,分子内的振动增强,蛋白质分子中不同部位的弱键逐渐被破坏,Trp残基向极性环境转移程度增加。温度升高导致蛋白质分子的空间结构逐步松散,产生红移[20]。在不同温度下蛋白质分子处于不同的变性态能量发生转移,另外,在高温下分子聚集,Patatin构象发生一定程度的变化,导致荧光猝灭[21]。因此,Patatin内源荧光强度都是随着温度升高逐步降低的。
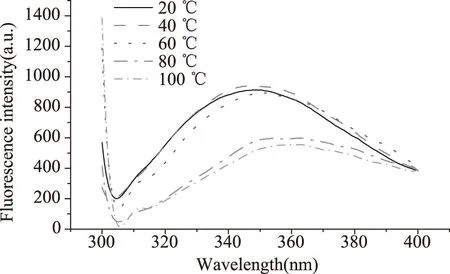
图3 不同加热温度条件下Patatin荧光光谱Fig.3 Fluorescence spectra of Patatin recorded at different temperature
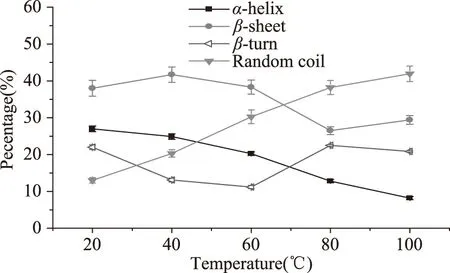
图4 不同温度对Patatin二级结构的影响Fig.4 Effect of temperature on secondary structure content of Patatin
当Patatin所处体系的温度低于40 ℃时,α-螺旋、β-折叠、β-转角以及无规则卷曲的含量比例变化不大,说明在此范围内Patatin的结构变化不显著。当温度继续升高时,α-螺旋含量迅速下降,无规则卷曲含量迅速增加。当温度达到80 ℃时,无规则卷曲结构占主导地位。田素燕[22]采用远紫外圆二色谱法研究了细胞红蛋白的环境温度对细胞红蛋白二级结构的影响,温度达到368 K,它仍保持有20%的α-螺旋结构,说明该蛋白具有较高的热稳定性。本研究中,Patatin在80 ℃时(353 K)时α-螺旋含量仍然保持在10%以上,在高温下Patatin仍然具有一定量的二级结构,说明Patatin也是一种高热稳定性蛋白。
2.3不同变性剂对Patatin构象的影响
Patatin经过0、2、4、6、8 mol/L尿素处理后,荧光光谱的变化如图5所示,在激发波长295 nm条件下,未经过变性剂处理的Patatin最大发射波长为341 nm,经过2、4、6、8 mol/L尿素处理后,Patatin最大发射波长发生红移,分别红移了1、4、5、7 nm。荧光强度从527.6增加为683.9、657.9、805.2和819.2。
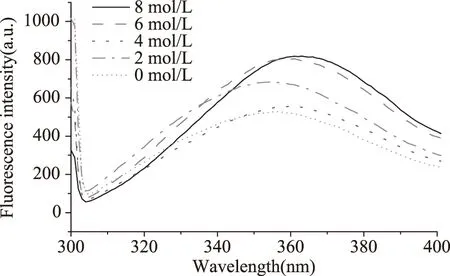
图5 尿素对Patatin荧光光谱的影响Fig.5 Effect of urea on fluorescence spectra of Patatin
尿素能够破坏Patatin分子中的氢键,尿素常被用于蛋白质的解离和亚基的分离,在8 mol/L尿素作用下,大多数蛋白质由折叠态变成完全伸展的状态,尿素通过破坏氢键而使蛋白质从有序变为无序,发生去折叠现象。随着浓度的增加,荧光强度增加,说明尿素不仅破坏了疏水相互作用,还能促进使Patatin分子中的色氨酸残基部分暴露在极性环境中,处于蛋白质分子的表面或者部分位于蛋白质分子表面,从而引起荧光强度和最大发射波长的改变,使Patatin构象发生变化,从而使荧光强度增加。
DTT处理对Patatin其荧光光谱的影响如图6所示。在激发波长295 nm时,不同浓度的DTT并没有引起最大发射波长的改变,但随着DTT浓度的增加,荧光强度下降。当DTT浓度为2、4、6、8 mmol/L时,荧光强度与未经过DTT处理的溶液相比,分别下降23.1%,40.7%,45.2%和49.5%。蛋白质内部的二硫键的数量影响蛋白质的稳定性,DTT主要作用于蛋白质的二硫键,使整个蛋白质分子结构变成一种松散的状态,色氨酸残基移动向其分子表面,使其构象发生变化,蛋白质的结构从有序变为无序,色氨酸残基暴露在极性环境中,从而引起荧光强度的下降[23-24]。

图6 DTT对Patatin荧光光谱的影响Fig.6 Effect of DTT on fluorescence spectra of patatin
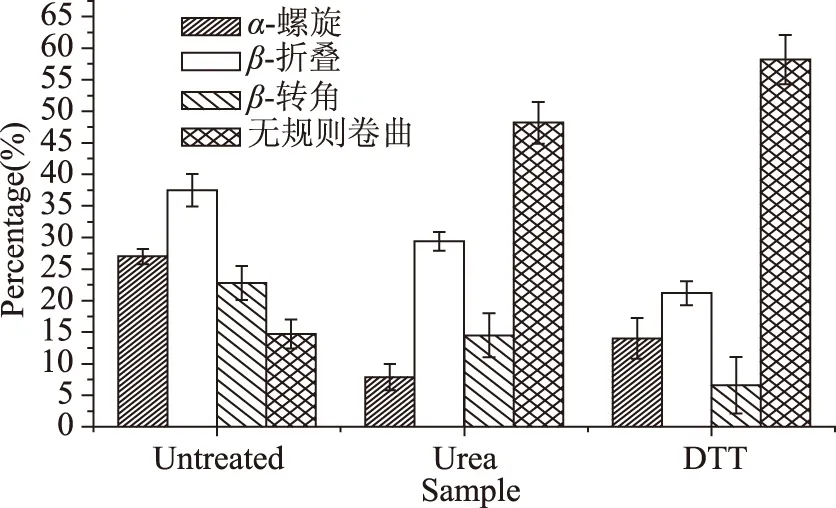
图7 变性剂对Patatin二级结构的影响Fig.7 Effect of DTT and urea on secondary structure content of Patatin
考察变性剂对二级结构含量的影响时,选择6 mol/L尿素和2 mmol/L DTT处理Patatin,并与未经过变性剂处理的Patatin相比较。由图7可知,Patatin经6 mol/L尿素和2 mmol/L DTT 处理后α-螺旋、β-折叠和β-转角结构含量大幅度下降,无规则卷曲结构含量增加,无规则卷曲含量接近50%,表明经过6 mol/L尿素和2 mmol/L DTT处理后Patatin几乎完全失去二级结构,蛋白质结构变得更加松散无序,蛋白质发生变性。α-螺旋、β-折叠和β-转角稳定性主要取决于分子内部氢键,当蛋白质经过变性剂处理后由于它们能与水分子或者蛋白质分子中游离氨基和羧基形成氢键,造成分子内部氢键发生改变,从而对蛋白质二级结构造成巨大破坏[13,22,25]。
3 结论
采用荧光分光光谱和圆二色光谱两种测试手段,检测了马铃薯糖蛋白Patatin在不同外界条件处理下的二级和三级结构,研究表明:pH会对糖蛋白Patatin的结构产生影响,但影响是可逆的,在pH4和pH5条件下,α-螺旋和β-折叠结构含量相近,为主要的二级结构类型;在pH6~9范围内,Patatin的二级结构以β-折叠为主;随着温度的升高,蛋白质分子中不同部位的弱键逐渐被破坏,当温度达到80 ℃时,主要为无规则卷曲结构;在变性剂尿素和DDT的处理下,Patatin的二级结构已经发生显著变化,特别是尿素对二级结构的影响更加明显。
[1]Racusen D,Foote M. A major soluble glycoprotein of potato tubers[J]. Journal of Food Biochemistry,1980,4(1):43-52.
[2]Pikkard CS,Brusca JS,Hannapel D J,et al. The tow classes of genes for the major potato tuber protein,patatin,are differentially expressed in tubers and roots[J]. Nucleic Acids Research,1987,15(5):1979-1994.
[3]Andrews D L,Beames B,Summers M,et al. Characterization of the lipid acyl hydrolase activity of the major potato(Solanumtuberosum)tuber protein,patatin,by cloning and abundant expression in a baculovirusvector[J]. Biochemical Journal,1988,252(1):199-206.
[4]Ton NC,Daleo G,Oliva C. An acidicβ-1,3 glucanase from potato tubers appears to be patatin[J]. Plant Physiology and Biochemistry,2001,39(10):849-854.
[5]liu YW,Han CH,Lee MH,et al. Patatin,the tuber storage protein of potato(SolanumtuberosumL.),exhibits antioxidant activityinvitro[J]. Journal of Agricultural and Food Chemistry,2003,51(15):4389-4393.
[6]Keil M,SancheZ,Serrano J,Schell J,et al. Primary structure of a proteinase inhibitor II gene from potato(Solanumtuberosum)[J]. Nucleic Acids Research,1986,14(14):5641-5650.
[7]陈惠黎. 生物大分子的结构和功能[M].上海:上海医科大学出版社,1999.
[8]Kristiansen E,Zachariassen KE. The mechanism by which fish antifreeze proteins cause thermal hysteresis[J]. Cryobiology,2005,51(3):262-280.
[9]刘媛,谢孟峡,康娟. 三七总皂甙对牛血清白蛋白溶液构象的影响[J]. 化学学报,2003,61(8):1305-1310.
[10]李沉纹,周佳敏,尹宗宁. 荧光光谱法研究过氧化氢酶溶液稳定性[J]. 中国生化药物杂志,2009,30(4):243-247.
[11]Greenfield N J. Using circular dichroism spectra to estimate protein secondary structure[J]. Nature Protocols,2007,1(6):2876-2890.
[12]夏其昌,曾嵘. 蛋白质化学与蛋白质组学[M]. 北京:科学出版社,2004.
[13]文鹏程,余丹丹,汪昕昕,等. 不同处理条件对乳铁蛋白构象的影响研究[J]. 光谱学与光谱分析,2012,32(1):162-165.
[14]SunY,JiangLZ,Wei DX. Partial characterization,invitroantioxidant and antiproliferative activities of patatin purified from potato fruit juice[J].Food&Function,2013,4:1502-1511.
[15]Rahma E,Rao MN. Characterization of sunflower proteins[J].Journal of Food Science,1979,44(2):579-582.
[16]李雪琴,苗笑亮,裘爱泳. 蚕豆分离蛋白的制备及其功能性质研究[J]. 粮食与饲料工业,2003,5:41-43.
[17]Pots AM,Jongh HH,Gruppen H,et al. Heat-induced conformational changes of patatin,the major potato tuber protein[J]. European Journal of Biochemistry,1998,252(1):66-72.
[18]朱科学,周惠明,郭晓娜. 植物来源糖蛋白的结构与功能[J]. 食品与发酵工业,2002,28(12):57-61.
[19]杨芳,梁毅. 脲和盐酸胍诱导溶菌酶去折叠的荧光相图法研究[J]. 化学学报,2003,61(6):803-807.
[20]Sargent PJ,Farnaud S,Evans RW. Structure/function overview of proteins involved in iron storage and transport[J]. Current Medicinal Chemistry,2005,12(23):2683-93.
[21]Lambert C,Leonard N,De Bolle X,Depiereux E ESyPred3D:Prediction of proteins 3D structures[J]. Bioinformatics,2002,18:1250-1256.
[22]田素燕,李连之,高磊,等. 圆二色光谱法研究环境因素对细胞红蛋白二级结构的影响[J]. 分析化学,2009,37(8):1097-1101.
[23]Valueva TA,Revina T A,Mosolov VV,et al. Primary structure of potato kunitz-type serine proteinase inhibitor[J]. Biological Chemistry,2000,381(12):1215-1221.
[24]Perez-Iratxeta C,Andrade-Navarro MA. Estimation of protein secondary structure from circular dichroism spectra[J]. BMC Strucal Biology,2008,8:25.
[25]Kelly SM,Price NC. The use of circular dichroism in the investigation of protein structure and function[J].Current Protein and Peptide Science,2000,1:349-384.
EffectofdifferenttreatmentconditionsontheconformationchangesofPatatin
SUNYing1,WEIDong-xu2,YAOChun-yan3,JIANGLian-zhou4
(1.College of Tourism and Culinary Science,Harbin University of Commerce,Harbin 150000,China;2.Technical Centre of Heilongjiang Entry-exit Inspection and Quarantine,Harbin 150001,China;3.College of Economics,Harbin University of Commerce,Harbin 150000,China;4.Food College of the Northeast Agriculture University,Harbin 150000,China)
In this study,the tertiary and secondary structures of Patatin under different physico-chemical treatments were investigated by fluorescence and circular dichrosim. Patatin was rich inα-helix at pH4~5,but theα-helix was gradually instead by theβ-sheet at pH6~9. With the increasing pH,the strength of fluorescence became apparently lower. A blue shift in the maximum emission wavelength was observed,and the effect of pH on struction was reversible. Patatin was rich inβ-sheet from 20 ℃ to 60 ℃. When the temperature reached to 80 ℃,the random coil content reached to maximum. With the increasing temperature,the fluorescence intensity decreased signifcantly. A red shift in the maximum emission wavelength was observed and the fluorescence intensity decreased in Patatin treated by DTT but increased by urea. A red shift in the maximum emission wavelength was observed,and theβ-sheet gradually instead by the random coil under the condition of DTT and urea.
Patatin;structure characteristic;fluorescence;circular dichrosim
2016-12-27
孙莹(1982-),女,博士,讲师,研究方向:植物蛋白质的功能性,E-mail:sunying625@163.com。
黑龙江省自然科学基金项目(C2015067);哈尔滨商业大学青年创新人才项目(2016QN060)。
TS201.1
:A
:1002-0306(2017)17-0080-05
10.13386/j.issn1002-0306.2017.17.016
