菠萝蜜果皮活性成分的纯化与结构鉴定
2017-09-21,,,
,,,
(中国热带农业科学院农产品加工研究所,广东湛江 524001)
菠萝蜜果皮活性成分的纯化与结构鉴定
彭芍丹,李积华,黄晓兵,林丽静*
(中国热带农业科学院农产品加工研究所,广东湛江 524001)
为了进一步研究菠萝蜜果皮中的活性成分,采用柱层析分离方法对菠萝蜜果皮乙醇提取物进行分离纯化,利用硅胶柱、薄层层析和凝胶柱等分离手段,从菠萝蜜醇提物的乙酸乙酯萃取部位中分离纯化并鉴定了2种化合物,经过1H-NMR和13C-NMR核磁共振波谱仪检测后结构已确定,分别为环木菠萝烯酮(cycloartenone)和环桉树醇(cycloeucalenol)。通过本实验的分离纯化工艺,为全面研究菠萝蜜的植物化学数据提供理论依据。
菠萝蜜果皮,活性成分,单体,结构鉴定
菠萝蜜(ArtocarpusheterophyllusLam.),又称波罗蜜、苞萝、木菠萝、树菠萝、大树菠萝等,是桑科菠萝蜜亚科菠萝蜜属常绿乔木,是世界著名的热带水果。自一千多年前从印度引入我国后,被广泛的种植于我国的广东省、广西省、云南省、海南省、福建省和台湾省等地区,作为“全身都是宝”的热带珍果。菠萝蜜不仅能作为鲜果供人们食用,其树种更是集药用和木材于一身的优秀树种,但是它的利用却受到了很大的局限性。不同菠萝蜜品种差异极大,品质低下的部分树种病害严重,再加上果实本身保鲜期极短,我国在其生产上的技术又不够成熟和完善,在产业规模上就不足以支撑菠萝蜜加工的发展,在市场上也满足不了人们对产品数量和质量上的要求。除了菠萝蜜果干一例较为成功的产品外,没有其他对菠萝蜜加工利用的好技术和方法,导致菠萝蜜在我国也只能成为小众水果,北方地区根本不能享用到菠萝蜜果实的香甜。而国内外对于菠萝蜜的研究报道也不多,因此这方面的研究利用还是很值得开展的。
多项研究表明,菠萝蜜果实具有很强的抗氧化活性[1],Jagtap通过DPPH、FRAP和DMPD三种方法对成熟菠萝蜜果肉的丙酮、甲醇、乙醇和水的提取物进行抗氧化活性评价,均证明菠萝蜜果肉具有很强的清除自由基活性,其中黄酮和多酚是菠萝蜜果肉的抗氧化物质;Saxena A等用DPPH自由基清除法对气调保藏菠萝蜜果肉的甲醇提取物进行抗氧化活性分析,发现经过预处理的果肉具有较好的抗氧化稳定性,其对DPPH自由基的清除率与其中抗坏血酸和多酚含量呈正相关[2-3]。Soong等用ABTS法和FRAP法研究了脱脂后菠萝蜜种子和果肉的乙醇提取物的抗氧化活性,发现种子的抗氧化活性高于果肉,而且干制后样品的抗氧化活性约为新鲜样品的3倍,酚类化合物约贡献了70%的抗氧化活性[4],烘干后成熟果实的乙醇提取物对DPPH自由基清除活性的IC50为410 μg/mL[5]。对于占整个果实约1/2的菠萝蜜果皮的抗氧化活性则未见报道,而且已有研究证明了其果皮中黄酮类化合物含量丰富,黄酮类与抗氧化活性有密切的关系,本文作者已在前期实验的基础上得出菠萝蜜果皮醇提物乙酸乙酯部位具有较强抗氧化活性,因此本研究是在前期研究的基础上对乙酸乙酯活性部位的进一步纯化,这对菠萝蜜的综合利用有重要意义。
1 材料与方法
1.1材料与仪器
菠萝蜜 采于湛江徐闻县龙塘镇(九成熟)。
无水乙醇,95%乙醇,盐酸,甲醇,丙酮,乙酸乙酯,氯仿,石油醚 分析纯,国药集团化学试剂;实验用水 二次蒸馏水;100~200,200~300目柱层析硅胶、预制薄层层析板 青岛海洋化工厂;Sephadex LH-20柱层析凝胶 Pharmacia公司;5%硫酸乙醇显色剂、碘显色剂 国药集团。
超高压液相-高分辨飞行时间质谱Triple TOFTM 5600+/UPLC-Triple TOF MS/MS 美国AB Sciex公司;AV-600型核磁共振波谱仪 美国Bruker公司;HH-4恒温水浴锅 国华电器有限公司;752N紫外可见分光光度计、FA2104N天平 上海精密科学仪器有限公司;真空冷冻干燥机 北京若比邻公司;LR4002旋转蒸发仪 德国Heidolph公司;DFT-150高速万能粉粹机 上海鼎广有限公司;MS 3 digital振荡器 德国IKA公司;冰箱 海尔集团有限公司。
1.2实验方法
1.2.1 乙酸乙酯部分的分离 即乙酸乙酯部分得到条件为菠萝蜜果皮在80%乙醇、温度65 ℃,料液比1∶3条件下提取三次得到的粗提物,再用石油醚、乙酸乙酯、水一次萃取后得到的乙酸乙酯部浓缩浸膏[6-7]。
取乙酸乙酯部分(184 g),使用100~200目硅胶拌样后进行常压硅胶柱层析(硅胶100~200目),氯仿-甲醇系统(20∶1~10∶1~8∶1~4∶1~0∶1)梯度洗脱,得到8个流分,依次命名为Fr.1、Fr.2、Fr.3、Fr.4、Fr.5、Fr.6、Fr.7、Fr.8。
Fr.3分离:取Fr.3部分,进行Sephadex LH-20凝胶柱层析(流动相为氯仿∶甲醇1∶1),得到4个部分。其中第1份有白色状物质析出,重结晶得到白色固体物质BLM-1(75 mg)。
Fr.8分离:取Fr.8部分,使用100~200目硅胶拌样后进行常压硅胶柱层析(硅胶200~300目),氯仿-甲醇系统(1∶0~20∶1~10∶1~4∶1~0∶1)梯度洗脱,得到5个部分。其中第5个部分有白色固体析出,经过反复硅胶纯化后得到白色无定形固体BLM-2(约100 mg)。
Fr.1、Fr.2、Fr.4、Fr.5、Fr.6、Fr.7等流分未纯化出相应单体物质。另外,Fr.8中还分离出白色细小晶体BLM-3(约200 mg),故本研究以Fr.3和Fr.8作为研究对象。具体分离过程见下图1。

图1 乙酸乙酯部分离纯化流程图Fig.1 The flow chart of extraction and purification from the fraction of ethyl acetate
1.2.2 化合物结构鉴定 采用核磁共振1H-NMR和13C-NMR,超高压液相-飞行时间质谱等现代技术对化合物进行结构分析和解析,结合相关文献报道最终鉴定各化合物结构。具体方法如下。
显色反应:乙酸酐-浓硫酸反应(Liebermann-Burchard反应)。取乙醇提取液1~2 mL,挥去乙醇,残渣溶解或悬浮于乙酸酐中,滴加1滴浓硫酸,如呈紫红色,并且在溶液上层逐渐变绿,证明含有甾体、三萜类或皂甙。
色谱条件:色谱柱:ZORBAX Eclipse Plus C18(100 mm(2.1 mm,1.8 μm);流动相:乙腈(A)和水(B);流速0.3 mL/min;柱温40 ℃;进样量2 μL;梯度洗脱程序:0.0~2.0 min,10%~95% A;2.0~15.0 min,95% A。
质谱条件:通过全扫描获得一级谱图,并通过数据采集模式获得二级谱图。电喷雾离子源(ESI)负离子模式;质量扫描范围100~1000 m/z;离子源雾化气:55 Psi;辅助加热气:55 Psi;气帘气:40Psi;辅助加热温度:550 ℃;喷雾电压:-4500 V;去簇电压:-80 V;碰撞能:一级-5 V,二级-35 eV;扩展碰撞能量:15 eV。
核磁鉴定:采用Bruker AV-600核磁共振仪,1H-NMR和13C-NMR的观察频率频率为600 MHz,溶剂为CDCl3。
2 结果与讨论
2.1化合物BLM-1:环木菠萝烯酮(cycloartenone)的结构
白色固体粉末(氯仿),分子式C30H48O,分子量为424.70。通过Liebermann-Burchard反应结果为阳性,为甾类或三萜类化合物。在1H-NMR(CDCl3,600 MHz)谱中,δ5.10(1H,t,J=6.3 Hz,H-24)为1个双键碳上质子信号,δ:1.70(3H,s,27-CH3)、1.82(3H,s,26-CH3)、1.25(3H,s,28-CH3)、1.11(3H,s,18-CH3)、0.92(3H,s,21-CH3)、1.05(3H,d,J=5.7 Hz,30-CH3)、1.25(3H,s,29-CH3)为7个甲基质子信号;0.59(1H,d,J=4.2 Hz,H-19a)、0.08(1H,d,J=4.2 Hz,H-19b)为1对环阿屯烷类型三萜的特征亚甲基质子信号。
13C-NMR(151 MHz,CDCl3)谱共给出30个碳信号:35.58(C-1)、37.48(C-2)、216.63(C-3)、50.24(C-4)、48.44(C-5)、22.18(C-6)、25.97(C-7)、47.89(C-8)、20.77(C-9)、25.87(C-10)、26.74(C-11)、33.42(C-12)、45.33(C-13)、48.73(C-14)、35.87(C-15)、28.14(C-16)、52.29(C-17)、17.64(C-18)、32.79(C-19)、29.56(C-20)、19.29(C-21)、36.32(C-22)、27.73(C-23)、124.21(C-24)、130.94(C-25)、24.93(C-26)、18.22(C-27)、29.56(C-28)、28.14.(C-29)、18.08(C-30)以上数据对比文献[8-11]中环阿尔廷醇波谱学数据,除了3-C位变成了羰基,少了一个连氧碳上质子信号,其他部分都一致,故鉴定化合物BLM-1为环木菠萝烯酮(cycloartenone),有报道菠萝蜜树的叶子和茎中存在该化合物[12],但本研究是首次从菠萝蜜果皮中纯化得到。
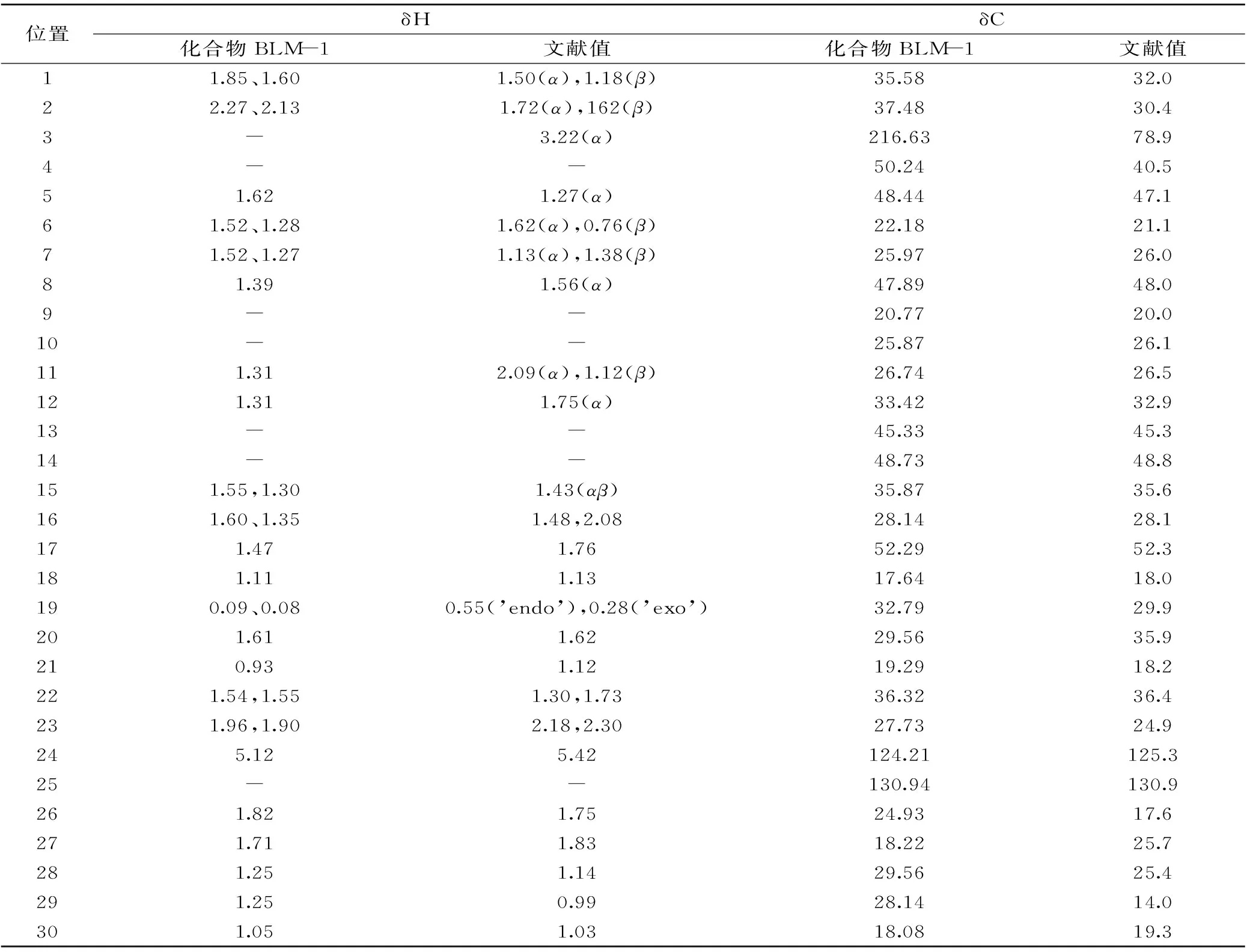
表1 化合物BLM-1的1H-NMR和13C-NMR数据Table 1 1H-NMR and 13C-NMR of compound BLM-1
综上所述分析,结合1H-NMR和13C-NMR谱中数据见表1,鉴定化合物BLM-1为环木菠萝烯酮(cycloartenone),化学结构式见图1。
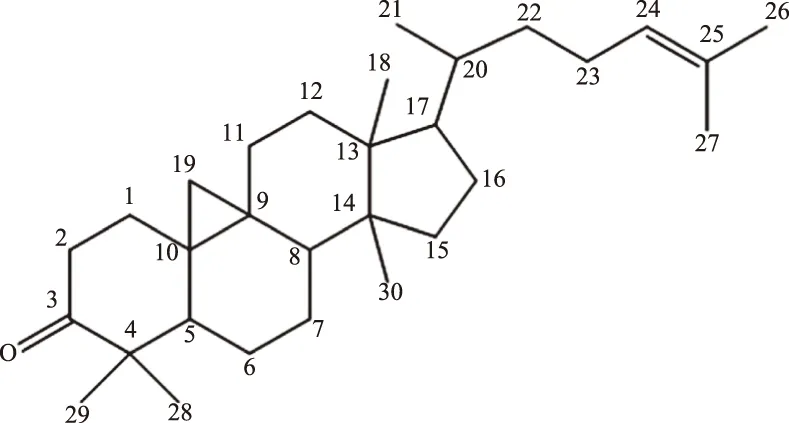
图2 化合物BLM-1的结构式Fig.2 Thestuctures of compound BLM-1
2.2化合物BLM-2:环桉树醇(cycloeucalenol)的结构
白色细小针状晶(氯仿),分子式C30H50O,分子量426.72。通过Liebermann-Burchard反应结果为阳性,示为甾类或三萜类化合物。在1H-NMR(CDCl3,600 MHz)谱中,δ4.73(1H,t,J=6.3 Hz,H-24)为1个双键碳上质子信号,δ0.17、δ0.38处是环丙基的两个质子信号,δ1.08-1.39处是亚甲基的质子信号,δ0.91-1.60处是甲基的质子信号,δ3.20-3.28处是羟基附近的次甲基的质子信号。
13C-NMR(151 MHz,CDCl3)谱共给出30个碳信号:31.32(C-1)、37.81(C-2)、76.80(C-3)、43.33(C-4)、44.59(C-5)、24.67(C-6)、27.25(C-7)、46.88(C-8)、21.87(C-9)、29.71(C-10)、26.97(C-11)、35.34(C-12)、45.35(C-13)、48.90(C-14)、32.88(C-15)、25.17(C-16)、52.21(C-17)、17.79(C-18)、29.52(C-19)、19.13(C-20)、36.13(C-21)、35.01(C-22)、30.80(C-23)、156.92(C-24)、34.81(C-25)、23.55(C-26)、22.00(C-27)、105.93(C-28)、18.34.(C-29)、14.40(C-30)以上数据对比文献[13-17]中环阿屯醇波谱学数据,除了24-C和25-C位变成了双键,其他部分都一致,故鉴定化合物BLM-2为环桉树醇(cycloeucalenol),有报道菠萝蜜树的叶子和茎中存在该化合物,但本研究是首次从菠萝蜜果皮中纯化得到。
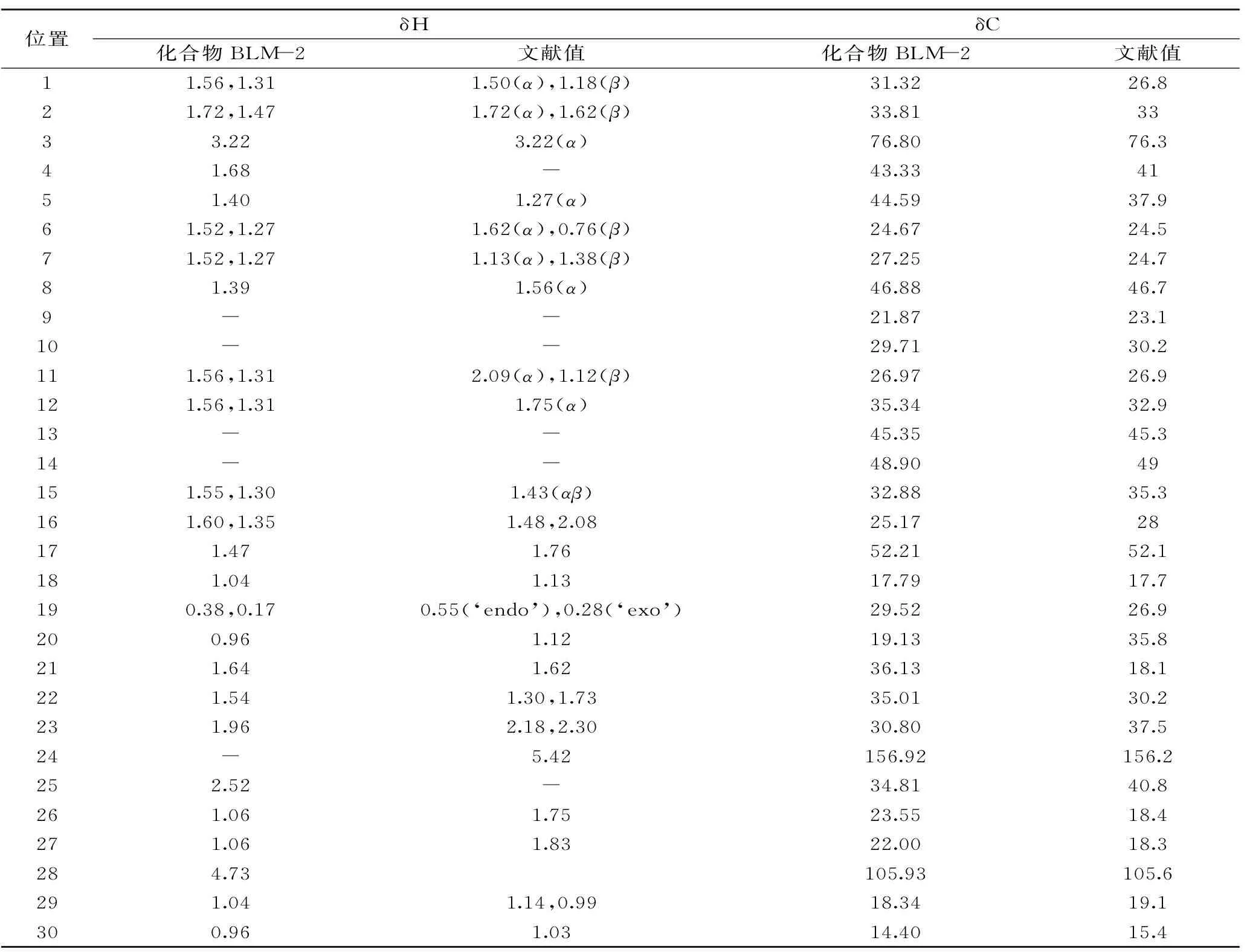
表2 化合物BLM-2的1H-NMR和13C-NMR数据Table 2 1H-NMR and 13C-NMR of compound BLM-2
综上所述分析,结合1H-NMR和13C-NMR谱中数据见表2,鉴定化合物BLM-2为环桉树醇(cycloeucalenol),化学结构式见图2。
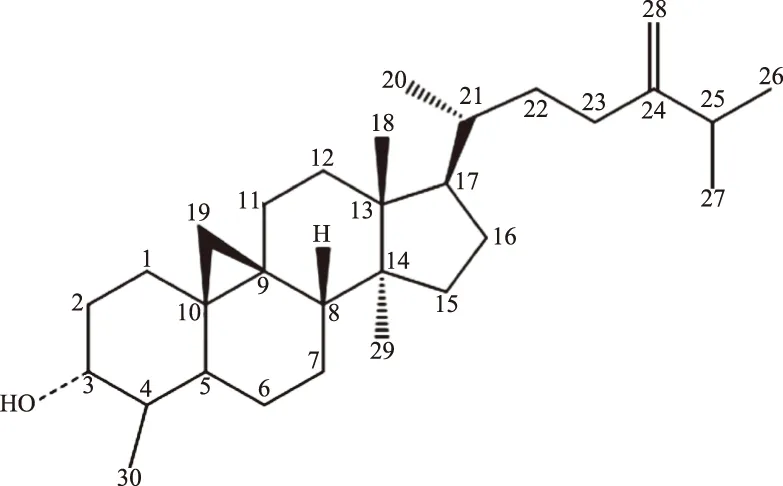
图3 化合物BLM-2的结构式Fig.3 The stuctures of compound BLM-2
3 结论
本研究采用柱层析分离方法对菠萝蜜果皮乙醇提取物进行分离纯化,利用硅胶柱、薄层层析和凝胶柱等分离手段,从乙酸乙酯部纯化鉴定出BLM-1和BLM-2两种化合物,经过质谱、1H-NMR和13C-NMR核磁共振波谱仪检测后结构已确定,分别为环木菠萝烯酮(cycloartenone)和环桉树醇(cycloeucalenol),均为三萜类的化合物,由于时间关系未能对化合物进行进一步的活性鉴定,据多处文献报道,此类化合物都共同具有溶血、抗癌、抗炎、杀菌、杀软体动物、抗生育、增强免疫力等活性[18]。如,Titov等[5]对一些四环和五环三萜对七种人癌细胞的抗癌活性的构效进行了研究,发现3β,16α-二羟基-齐墩果-12烯在体外对HE6-1-A等6种癌细胞有抑制活性。用菌种Saccharomycescarlsbergensiss在体外进行实验,研究了49种五环三萜类化合物的抗真菌活性,结果表明C-27或28位有游离羧基的齐墩果酸和常春藤皂苷元的皂苷具有较强的抗真菌活性[19-20]。以上两种化合物均有报道存在于菠萝蜜树的叶子和茎中,但果皮中尚未有报道。本研究对菠萝蜜的进一步研究有理论意义。
[1]Isabelle M,Lee B L,Lim M T,et al. Antioxidant activity and profiles of common fruits in Singapore[J]. Food Chemistry,2010,123(1):77-84.
[2]Saxena A,Bawa A S,Raju P S. Phytochemical changes in fresh-cut jackfruit(ArtocarpusheterophyllusL.)bulbs during modified atmosphere storage[J]. Food Chemistry,2009a,115(4):1443-1449.
[3]Saxena A,Bawa A,Raju P. Phytochemical changes in fresh-cut jackfruit(ArtocarpusheterophyllusL.)bulbs during modified atmosphere storage[J]. Food chemistry,2009b,115(4):1443-1449.
[4]Soong Y-Y,Barlow P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry,2004,88(3):411-417.
[5]Titov S. Antioxidant activities of some local Bangladeshi fruits(Artocarpusheterophyllus,Annonasquamosa,Terminaliabellirica,Syzygiumsamarangense,AverrhoacarambolaandOleaeuropa)[J]. 生物工程学报,2007,23(2):257-261.
[6]彭芍丹,李积华,唐永富,等.菠萝蜜不同部位抗氧化性的研究.热带作物学报,2013,34(9):1737-1741.
[7]彭芍丹,李积华,黄晓兵,等.菠萝蜜果皮不同萃取部位抗氧化活性的研究.食品工业科技. 2014,35(20):82-85.
[8]Khan M,Omoloso A,Kihara M. Antibacterial activity of Artocarpus heterophyllus[J]. Fitoterapia,2003,74(5):501-505.
[9]Karthy E,Ranjitha P,Mohankumar A. Antimicrobial potential of plant seed extracts against multidrug resistant methicillin resistant Staphylococcus aureus(MDR-MRSA)[J]. International Journal of Biology,2009,1(1):34-40.
[10]Trindade M B,Lopes J L,Soares-Costa A,et al. Structural characterization of novel chitin-binding lectins from the genus Artocarpus and their antifungal activity[J]. Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2006,1764(1):146-152.
[11]Ratnasooriya W,Jayakody J. Artocarpus heterophyllus seeds inhibits sexual competence but not fertility of male rats[J]. Indian journal of experimental biology,2002,40(3):304-308.
[12]Prakash O,Kumar R,Mishra A,et al. Artocarpus heterophyllus(Jackfruit):an overview[J]. Pharmacognosy Reviews,2009,3(6):353-358.
[13]Arung E T,Shimizu K,Kondo R. Inhibitory effect of isoprenoid-substituted flavonoids isolated from Artocarpus heterophyllus on melanin biosynthesis[J]. Planta medica,2006a,72(9):847-850.
[14]Arung E T,Shimizu K,Tanaka H,et al. 3-Prenyl luteolin,a new prenylated flavone with melanin biosynthesis inhibitory activity from wood of Artocarpus heterophyllus[J]. Fitoterapia,2010a,81(6):640-643.
[15]Arung E T,Wicaksono B D,Handoko Y A,et al. Cytotoxic effect of artocarpin on T47D cells[J]. Journal of natural medicines,2010b,64(4):423-429.
[16]Arung E T,Shimizu K,Kondo R. Inhibitory effect of artocarpanone from Artocarpus heterophyllus on melanin biosynthesis[J]. Biological and Pharmaceutical Bulletin,2006b,29(9):1966-1969.
[17]Sato M,Fujiwara S,Tsuchiya H,et al. Flavones with antibacterial activity against cariogenic bacteria[J]. Journal of ethnopharmacology,1996,54(2):171-176.
[18]乔凤云,陈欣,余柳青. 抗氧化因子与天然抗氧化剂研究综述[J]. 科技通报,2006,22(3):332-336.
[19]Fernando M,Thabrew M,Karunanayake E. Hypoglycaemic activity of some medicinal plants in Sri-Lanka[J]. General Pharmacology:The Vascular System,1990,21(5):779-782.
[20]Fernando M,Wickramasinghe S,Thabrew M,et al. Effect of Artocarpus heterophyllus and Asteracanthus longifolia on glucose tolerance in normal human subjects and in maturity-onset diabetic patients[J]. Journal of ethnopharmacology,1991,31(3):277-282.
Separation,purificationandstructuralanalysisofactivecompoundfromjackfruitpeel
PENGShao-dan,LIJi-hua,HUANGXiao-bing,LINLi-jing*
(Agricultural Products Processing Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524001,China)
To further explore the active ingredients of jackfruit peel,cycloartenone and cycloeucalenol were isolated from the fraction of ethyl acetate by using modern isolation techniques such as silica gel,thin-Layer chromatography and sephadex LH-20,and had been elucidated from1H-NMR and13C-NMR spectral data. This research will be useful for the further study of effective material basic of jackfruit,especially the characteristic composition of terpenoids.
jackfruit peel;active ingredients;monomer;structural identification
2017-02-20
彭芍丹(1989-),女,硕士研究生,研究方向:天然产物化学,E-mail:282387502@qq.com。
*通讯作者:林丽静(1978-),男,博士,研究方向:天然产物化学,E-mail:49031788@qq.com。
公益性行业(农业)科研专项(201303077-4);中国热带农业科学院基本科研业务费专项资金(1630122017T21)。
TS255.1
:A
:1002-0306(2017)17-0005-05
10.13386/j.issn1002-0306.2017.17.002
