低聚半乳糖对植物乳杆菌生长及部分代谢的影响
2017-09-21,,
, ,
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
低聚半乳糖对植物乳杆菌生长及部分代谢的影响
孙思睿,张晟,孟祥晨*
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
以一株能产细菌素的植物乳杆菌KLDS1.0391为研究对象,将MRS培养基中的葡萄糖用等量的低聚半乳糖替代,采用体外发酵方式,研究37 ℃培养36 h过程中活菌数、pH和滴定酸度的变化,同时分别测定培养28 h和24 h时有机酸和细菌素的产量。结果表明:随培养时间的延长,培养物的pH先迅速下降,至12 h后下降速度逐步平稳,以低聚半乳糖作为碳源时促生长作用显著高于葡萄糖(p<0.05),且菌体衰退较为缓慢。而且该菌株代谢低聚半乳糖时所产生的有机酸及抑菌活性均更高,其中有机酸主要为乳酸、乙酸和丙酸。
植物乳杆菌,增殖,有机酸,细菌素
植物乳杆菌属于乳杆菌属,大都从植物中分离获得,有广泛用途。植物乳杆菌KLDS1.0391是一株分离自内蒙古天然发酵乳制品——焦克的乳酸菌,经鉴定后,保藏于国家工业微生物菌种保藏中心(CGMCC No.3151)。该菌对模拟消化道环境具有较好的耐受性,也有良好的益生特性[1],能代谢合成细菌素,该细菌素耐酸耐热性能良好,对G+和G-细菌的生长均具有较强的抑制作用[2]。低聚半乳糖(Galactooligosaccharides,GOS)由半乳糖与葡萄糖主要经β-1,6糖苷键连接而成,是一种益生元,在上消化道不能被消化吸收,可作为持续碳源[3],在下消化道促进乳杆菌和双歧杆菌增殖,维持菌群平衡,改善肠道环境[4]。
目前关于植物乳杆菌利用低聚糖的研究,主要是将低聚糖作为全部或部分碳源,进而分析其促生长作用及相关益生特性。向培养基中添加一定量的水苏糖可促进植物乳杆菌RB1的增殖作用[5];很多时候,与相同浓度的葡萄糖相比,适量添加低聚糖对储藏期内或者极酸性胃液环境下的菌体能起到很好的保护作用[6]。除此之外,植物乳杆菌C88与人参多糖的联合可显著调节抗氧化活性和免疫调节活性[7],而植物乳杆菌Sc52和牛蒡低聚果糖的联合则能明显地改善和治疗Ⅱ型糖尿病[8]。
对于能产生细菌素的乳酸菌,低聚糖不仅可以促进其生长,还可以影响细菌素的合成量。已经发现:碳源、氮源组成以及磷酸盐浓度等[9]都显著影响乳酸链球菌素nisin的合成,菊糖刺激副干酪乳杆菌CMGB16分泌细菌素[10],也有实验表明:低聚糖可以有效地调节微生物的生长,同时刺激细菌素的产生[11],但是低聚糖、菌株的个体差异性会导致产生不同的效果,而且尚不清楚具体机制。
低聚半乳糖是目前唯一一种能够被八大有益菌利用的低聚糖,前期在比较不同低聚糖对植物乳杆菌代谢影响时,发现:低聚半乳糖对植物乳杆菌促生长作用最强,但是还不清楚植物乳杆菌KLDS1.0391对低聚半乳糖的代谢特点以及低聚半乳糖如何影响该菌细菌素合成。因此,本研究将以植物乳杆菌KLDS1.0391为研究对象,进一步研究其对低聚半乳糖的代谢特点。
1 材料与方法
1.1材料与仪器
植物乳杆菌(Lactobacillusplantarum)KLDS1.0391 东北农业大学教育部乳品科学重点实验室分离保藏;枯草芽孢杆菌(Bacillussubtilis)ATCC6633 购自中国药品生物制品检定所;MRS培养基:配制方法参照文献[12];改良MRS培养基(modified MRS,mMRS):将MRS培养基中的葡萄糖用等量的低聚半乳糖代替,其余成分均相同;营养肉汤培养基:蛋白胨10 g,牛肉膏5 g,氯化钠10 g,蒸馏水1 L。pH调至7.4;标准酸(乳酸、乙酸、丙酸)色谱纯 Sigma公司;浓硫酸 天津化学试剂一厂;低聚半乳糖 上海源叶生物(S11138-100 g,BR,98%);过氧化氢酶 Sigma公司。
高效液相色谱仪Waters2695 Waters公司;色谱柱HPX-87H,BIO-RAD;微孔滤膜0.22 μm MILLIPORE公司;KQ-800GKDV超声波水浴仪 昆山市超声仪器有限公司;LGJ-1冷冻干燥机 上海医用分析仪器厂;GL-21高速冷冻离心机 上海市离心机械研究所;Delta320pH计 瑞士梅特勒托利多有限公司;HVE-8D全自动高压蒸汽灭菌锅 日本HIRAYAMA公司。
1.2实验方法
1.2.1 菌株的活化与培养 将于-80 ℃冰箱中保藏的植物乳杆菌KLDS1.0391和枯草芽孢杆菌ATCC6633分别在MRS培养基和营养肉汤培养基中活化传代3次后,置于37 ℃恒温箱中培养16 h,以备后续实验使用。
1.2.2 活菌数的测定 采用平板菌落计数法[13],选取适宜的稀释梯度,计算其不同生长时期的活菌数。
1.2.3 pH及滴定酸度测定 分别采用pH计直接测定pH和氢氧化钠滴定法测量滴定酸度。
1.2.4 有机酸含量测定 通过高效液相色谱法测定培养物中乳酸、乙酸和丙酸的含量。
色谱条件:流动相5 mmol/L硫酸,在使用前进行超声处理30 min,参数设定为流速0.5 mL/min,柱温55 ℃,进样量20 μL。取发酵液经离心过滤膜后注射于样品瓶中待测。
标准曲线的绘制:精确配制不同浓度梯度的标准样品,经HPLC确定出各标准品的保留时间,并绘制标准曲线。
1.2.5 抑菌活性的测定 先将培养至一定时间的菌液离心得到无细胞发酵上清液,随即用6 mmol/L氢氧化钠溶液将pH调至6.5来排除有机酸的干扰,并向上清液中添加已配制好的过氧化氢酶乙酸钠溶液,于37 ℃水浴锅中水浴2 h以排除过氧化氢的干扰。处理后的上清液过滤膜后冷冻干燥,用无菌水将冻干样品复溶,采用双层平板打孔法测定抑菌活性[14]。
1.2.6 低聚半乳糖对植物乳杆菌生长的影响 将植物乳杆菌以2%的接种量分别接种到MRS和mMRS培养基中,在37 ℃下培养36 h,并每隔4 h取样一次,进行菌落计数,绘制出该菌株的生长曲线,同时计算对数生长期的生长速率。
1.2.7 植物乳杆菌代谢低聚半乳糖产生有机酸分析 根据滴定酸度曲线,取培养至28 h的酸度恒定时的上清液经一系列处理后进行HPLC分析,测定主要有机酸的种类及产量。标准样品的标准曲线以标准样品的浓度为横坐标,峰面积值为纵坐标[15]。
1.2.8 植物乳杆菌代谢低聚半乳糖产细菌素分析 通过课题组的前期研究[16],当培养至24 h左右细菌素的产量基本趋于稳定,因此在本实验中选择该时间点来比较该菌株在两种培养基中抑菌活性的强弱。
1.3数据分析
每个实验均独立重复3次,实验结果用“平均值±标准差”表示,采用SPSS 17.0对结果进行显著性差异分析。
2 结果与分析
2.1植物乳杆菌KLDS1.0391在含低聚半乳糖MRS培养基中的生长
植物乳杆菌KLDS1.0391分别以低聚半乳糖和葡萄糖作为碳源时,培养36 h的生长情况见图1。

图1 植物乳杆菌在两种含糖培养基中生长情况Fig.1 The growth of Lactobacillus plantarum in two sugar-containing medium
从图中可以看出,植物乳杆菌KLDS1.0391在MRS培养基中生长时,无明显迟滞期,0~4 h生长速度较快,并于培养12 h时活菌数最高,达1.64×109CFU/mL,随后数量逐渐减少,其在对数期的生长速率为0.6245 h-1。而在含低聚半乳糖的mMRS培养基中,虽然有较为明显的适应期,但进入对数期后生长速率较MRS培养基快,为0.7271 h-1,并在培养20 h时活菌数最高为5.5×109CFU/mL。此外,在mMRS中衰亡期开始时间晚于对照组,且其衰亡速度与MRS培养基相比也较为缓慢。至培养结束时,在MRS培养基和mMRS培养基中的活菌数分别为:3.4×108CFU/mL和1.42×109CFU/mL。此结果说明:低聚半乳糖对植物乳杆菌KLDS1.0391不仅有明显的促增殖作用,且在含低聚半乳糖培养基中生长的菌体衰亡更为缓慢。
2.2植物乳杆菌在含低聚半乳糖培养基中生长时pH及滴定酸度的变化
植物乳杆菌分别在MRS和mMRS培养基中培养36 h过程中的产酸情况见图2。
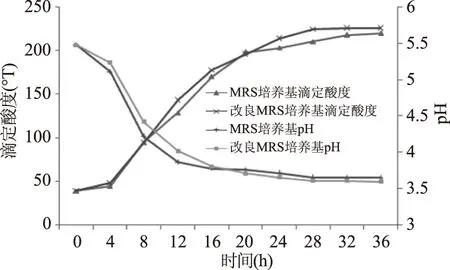
图2 植物乳杆菌在两种含糖培养基中的产酸情况Fig.2 The acid production of Lactobacillus plantarum in two sugar-containing medium
MRS和mMRS培养基初始pH为5.48,接菌培养后,随着培养时间的延长,pH迅速降低,滴定酸度快速升高,并于培养16 h后产酸变化速度逐渐变缓,在培养至28 h时产酸量趋近稳定,此时pH分别为3.66和3.61,滴定酸度为210.276 °T和224.136 °T。在整个培养期间,两实验组滴定酸度及pH变化无显著差异(p>0.05)。
2.3植物乳杆菌在不同培养基中生长时产生的主要有机酸
植物乳杆菌分别在MRS和mMRS培养基中培养至稳定期28 h,取培养上清液,处理后采用高效液相色谱法测定乳酸、乙酸和丙酸的量,结果见表1。
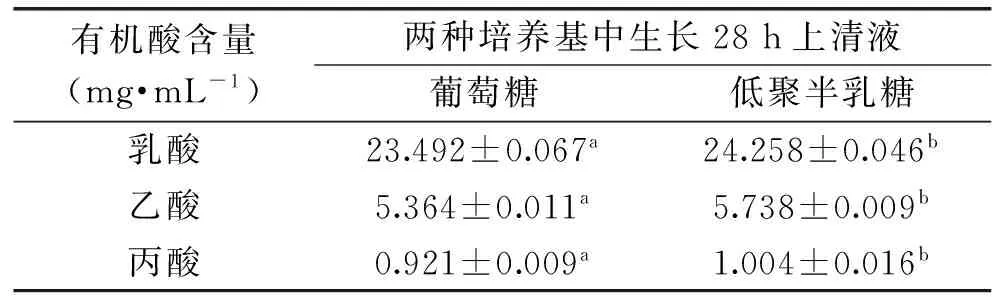
表1 植物乳杆菌代谢两种糖产生主要有机酸的量Table 1 The contents of organic acids produced by Lactobacillus plantarum in two sugar-containing medium
注:同行数据字母不同表示差异显著(p<0.05)。
实验发现:植物乳杆菌代谢低聚半乳糖后,所产生的乳酸、乙酸和丙酸均显著高于代谢葡萄糖时所产生的量,且代谢产生有机酸中乳酸量最高,其次是乙酸和丙酸。
2.4低聚半乳糖对植物乳杆菌KLDS1.0391抑菌活性的影响
植物乳杆菌KLDS1.0391在mMRS和MRS培养基中生长24 h后,所产细菌素的抑菌圈分别为(11.41±0.03) mm和(10.38±0.02) mm(p<0.05),说明该菌株在含低聚半乳糖培养基中生长时,更利于其细菌素的合成。
3 讨论
无论是体外还是体内实验,都证实低聚糖对乳杆菌具有良好的促增殖作用,且相比之下,低聚半乳糖的效果最优[17],本实验也证实了低聚半乳糖对植物乳杆菌KLDS1.0391有促增殖作用,同时延缓其衰亡速度。
乳酸菌是一类可以发酵碳水化合物从而产生大量乳酸的革兰氏阳性细菌,其代谢产生的有机酸主要为乳酸,其次是各种短链脂肪酸,主要包括甲酸、乙酸、丙酸和丁酸。本研究发现植物乳杆菌KLDS1.0391在利用低聚半乳糖后所产生的乳酸、乙酸和丙酸的量都有所提高。不同种属在不同的发酵时间以及低聚糖添加量不同的情况下,产生有机酸的种类和比例差异较大。例如向干酪乳杆菌的培养基中添加0.5%低聚果糖(F)、1.5%低聚果糖(F)、3%低聚果糖(F)和0.5%葡萄糖(G),在培养的任意时间段,乳酸产量均是低聚果糖培养基高于葡萄糖培养基;而就乙酸而言,不同时间段四种培养基中乙酸产量多少的排列顺序各不同,并不是低聚果糖培养基始终高于葡萄糖培养基,例如当培养至8 h时,乙酸产量依次为1.5% F、0.5% F<0.5% G<3% F[18]。
本实验中的植物乳杆菌KLDS1.0391是一株能产细菌素的菌株,我们研究发现:该菌株能够利用低聚半乳糖促进细菌素的合成,但具体机制不清。报道中也有一些乳酸菌不能有效的利用某些低聚糖,这样它在生长过程中就会遭受到其自身诱导合成细菌素的胁迫[19]。Reminta[20]等人在研究中选用三种低聚糖分别与不同菌株联合培养,发现菌株LL2在以葡萄糖作为碳源时菌体密度虽为α环状糊精为碳源时的二倍,但是其抑菌活性明显低于环状糊精,且8 h后效价下降明显,这表明促生长作用强并不一定能促进细菌素的合成。而Muoz等人[21]的研究结果表明某些乳酸杆菌在含低聚果糖的培养基中生长时活菌数以及细菌素的产量均高于在葡萄糖培养基中。细菌素的产生与乳酸菌的生长呈现出一定相关性[22],但是不同乳酸菌的生长曲线以及代谢产生细菌素的规律也会略有差异,这可能是由于菌株不同所产生的个体差异,且研究中所利用的底物低聚糖也不同,因而会造成不同的变化规律。而在本实验中,低聚半乳糖不仅对植物乳杆菌KLDS1.0391有促生长作用,同时还会促进其细菌素的合成。下一步我们将会深入挖掘其中所涉及的机制。
4 结论
低聚半乳糖对植物乳杆菌KLDS1.0391具有显著的促生长作用,并且能够有效延缓该菌株在生长后期的衰亡。植物乳杆菌KLDS1.0391在代谢低聚半乳糖时产生的有机酸量以及抑菌活性均显著高于葡萄糖,其中所涉及的机理仍有待于进一步研究。
[1]李雪.LactobacillusplantarumKLDS1. 0391 和 KLDS1. 0706 益生潜能的体外评价[D]. 哈尔滨:东北农业大学,2015.
[2]Gong H S,Meng X C,Wang H. Plantaricin MG active against Gram-negative bacteria produced by Lactobacillus plantarum KLDS1. 0391 isolated from “Jiaoke”,a traditional fermented cream from China[J]. Food control,2010,21(1):89-96.
[3]Goderska K,Nowak J,Czarnecki Z. Comparision of growth of Lactobacillus acidophilus and Bifidobacterium Bifidum species in media suplemented with selected saccharides including prebiotics[J]. Acta Scientiarum Polonorum Technologia Alimentaria,2008,7(2):5-20.
[4]Bouhnik Y,Raskine L,Simoneau G,et al. The capacity of nondigestible carbohydrates to stimulate fecal bifidobacteria in healthy humans:a double-blind,randomized,placebo-controlled,parallel-group,dose-response relation study[J]. The American Journal of Clinical Nutrition,2004,80(6):1658-1664.
[5]魏艳,曾小群,潘道东,等.水苏糖对植物乳杆菌的增菌效果研究[J].中国食品学报,2013(12):103-108.
[6]杨郁,李静雅,刘小涛,等.低聚糖对植物乳杆菌XC-10的影响研究[J]. 现代农业科技,2016(4):287-288.
[7]王晓慧. 人参多糖联合植物乳杆菌抗氧化及免疫调节活性研究[D]. 长春:吉林农业大学,2015.
[8]栾畅,王宏伟,何忠梅,等. 植物乳杆菌Sc52联合牛蒡低聚果糖对Ⅱ型糖尿病模型小鼠的治疗作用[J]. 食品科学,2015,36(21):214-220.
[9]Todorov S D,Dicks L M T. Bacteriocin production by Lactobacillus pentosus ST712BZ isolated from boza[J]. Brazilian Journal of Microbiology,2007,38(1):166-172.
[10]Vamanu E,Vamanu A. The influence of prebiotics on bacteriocin synthesis using the strain Lactobacillus paracasei CMGB16[J]. African Journal of Microbiology Research,2010,4(7):534-537.
[11]Patel S,Goyal A. The current trends and future perspectives of prebiotics research:a review[J]. 3 Biotech,2012,2(2):115-125.
[12]李景良,宋达峰,顾青. 植物乳杆菌ZJ316生产细菌素[J]. 微生物学报,2008,48(6):818-823.
[13]马宇骥,张岩,李键,等. 茶多酚对乳酸菌发酵及酸奶品质的影响[J]. 黑龙江畜牧兽医,2016,11:26.
[14]Nieto-Lozano J C,Reguera-Useros J I,Peláez-Martínez M C,et al. Effect of a bacteriocin produced by Pediococcus acidilactici against Listeria monocytogenes and Clostridium perfringens on Spanish raw meat[J]. Meat Science,2006,72(1):57-61.
[15]Xie R,Tu M,Wu Y,et al. Improvement in HPLC separation of acetic acid and levulinic acid in the profiling of biomass hydrolysate[J]. Bioresource Technology,2011,102(7):4938-4942.
[16]贡汉生. 植物乳杆菌KLDS1.0391所产细菌素的分离纯化与部分特性[D].哈尔滨:东北农业大学,2009.
[17]黄婧,辛修锋. 不同功能性低聚糖的益生元功效比较[J].中国食品添加剂,2009(S1):30-33.
[18]张晓峰,李婉,李文杰,等. 低聚果糖对干酪乳杆菌生长和代谢的影响[J]. 食品工业科技,2015,36(3):363-366.
[21]Munoz M,Mosquera A,Almeciga-Diaz C J,et al. Fructooligosaccharides metabolism and effect on bacteriocin production in Lactobacillus strains isolated from ensiled corn and molasses[J]. Anaerobe,2012,18(3):321-330.
[22]刘书亮,张艾青,田刚,等.植物乳杆菌P158的生长曲线及其细菌素的特性[J].核农学报,2009,23(6):1021-1025.
InfluenceofgalactooligosaccharidesonthegrowthandmetabolismofLactobacillusplantarum
SUNSi-rui,ZHANGSheng,MENGXiang-chen*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultrual University,Harbin 150030,China)
InLactobacillusplantarumKLDS1.0391 which can produce the bacteriocins,the effect of galactooligosaccharides(GOS)which substituted for glucose in MRS media were studiedinvitrofermentation. The titratable acidity,pH value and amounts of viable bacteria were determined during fermentation of 36 h at 37 ℃ in both of MRS and mMRS(GOS substituted for glucose). The contents of organic acids and bacteriocins were also determined at the cultivation of 28 h and 24 h respectively. The results showed that the pH value decreased rapidly with the cultivation and then changed sloely after cultivation of 12 h,and the growth-stimulating effect of galactooligosaccharides(GOS)was significantly higher than that of glucose(p<0.05),meanwhile the decline was slower. Moreover,the concentrations of organic acids and antimicrobial activity of the bacteriocins in mMRS were higher than that in MRS,and the main organic acids were lactate,acetate and propionate.
Lactobacillusplantarum;proliferation;organic acids;bacteriocins
2017-02-21
孙思睿(1994-),女,硕士研究生,研究方向:食品微生物,E-mail:siruiSun@126.com。
*通讯作者:孟祥晨(1970-),女,博士,教授,研究方向:乳品科学及食品微生物,E-mail:xchmeng@163.com。
国家自然科学基金项目(3167101455)。
TS201.3
:A
:1002-0306(2017)17-0095-04
10.13386/j.issn1002-0306.2017.17.019
