Tween80-乳酸乙酯复合溶液 强化植物吸收土壤中的DDT
2017-09-21陈薇薇张文卿
郭 平,陈 涛,陈薇薇,杨 平,张文卿
(1.吉林大学环境与资源学院,吉林大学地下水资源与环境教育部重点实验室, 水资源与水环境吉林省重点实验室,吉林 长春 130021; 2.国网吉林省电力有限公司电力科学研究院,吉林 长春 130021)
Tween80-乳酸乙酯复合溶液 强化植物吸收土壤中的DDT
郭 平1,陈 涛2,陈薇薇1,杨 平1,张文卿1
(1.吉林大学环境与资源学院,吉林大学地下水资源与环境教育部重点实验室, 水资源与水环境吉林省重点实验室,吉林 长春 130021; 2.国网吉林省电力有限公司电力科学研究院,吉林 长春 130021)
采用盆栽实验方法,研究了Tween80-乳酸乙酯复合溶液对黑麦草(LoliumperenneL.)吸收、转化污染土壤中DDT的作用,同时考察了黑麦草生物量、叶绿素含量和根系活力的动态变化规律.结果表明:Tween80-乳酸乙酯复合溶液能够通过提高DDT的溶解度有效促进黑麦草对DDT的吸收、富集并促进其转化为DDE和DDD;黑麦草地下部分的富集能力显著高于地上部分,Tween80-乳酸乙酯复合溶液作用下黑麦草地上部分和地下部分中DDTs的含量占原施药量的0.42%和1.2%,比植物单独修复分别提高了21.7%和17.9%;三种植物抗性生理生化指标在修复过程中呈现出不同的动态变化规律,整体看来DDT胁迫是降低黑麦草生物量等指标的主要因素,而Tween80-乳酸乙酯复合溶液对有机污染环境中的黑麦草生长水平和抗逆性程度具有一定的调控作用.
DDT;植物修复;Tween80-乳酸乙酯复合溶液;生物量;叶绿素含量;根系活力
DDT(双对氯苯基三氯乙烷)作为有机氯农药的典型代表,曾被用于控制农业害虫和疟疾疾病,在全世界范围内广泛使用,尽管已经禁用多年,但由于其化学稳定性和疏水性极强,导致DDT及其降解产物持久存在于土壤环境中.[1]多年来,这些农药残留物因具有高脂溶性和生物蓄积性、低生物可利用性和降解性以及“三致”效应,对环境生态系统、农产品安全和人类健康产生了严重危害.[2-3]因此,治理和修复DDT污染土壤一直是环境领域的研究热点之一.
植物修复技术是DDT污染土壤修复的主要方式之一,它是利用植物降解、代谢、转化及其根际微生态功能的修复技术,[4]具有无二次污染、安全、无毒、廉价等优点[5].植物根系的吸收、固定、代谢被认为是植物修复土壤有机污染的途径之一[6-7].然而,由于DDT能够被土壤强烈吸附,从土壤固相向土壤溶液的缓慢释放严重限制了其植物可利用程度和植物修复速度,因此采取强化措施提高植物修复效率就成了植物修复DDT污染土壤的关键.[8]化学与生物修复联用技术是目前最具发展潜力的有机污染土壤修复方式之一,现在普遍采用表面活性剂等物质将污染物洗脱至土壤溶液,并通过微生物降解或植物吸收达到去除目的.[9-10]高彦征等[9]以水培体系模拟研究了非离子表面活性剂Tween80对黑麦草吸收菲和芘的影响,结果表明低浓度Tween80可促进黑麦草根和茎叶吸收菲和芘,而高浓度则产生抑制作用;谢文明等[11]采用盆栽方法研究了两种化学表面活性剂对土壤中DDT植物修复作用的影响,结果表明表面活性剂可以促进南瓜对DDT的富集,并可显著加速土壤中DDT的消解;Wu等[8]通过盆栽的方法研究了丛枝菌根菌和非离子表面活性剂TX-100对紫花苜蓿吸收和降解DDT的影响,结果表明联合使用丛枝菌根菌和TX-100能够促进紫花苜蓿地下部分和地上部分对DDT的吸收作用.由此可见,利用表面活性剂强化植物修复能力能够有效提高有机污染土壤的植物修复效率,并具有较大的发展潜力.然而,以往的研究主要集中在表面活性剂提高植物对土壤中有机污染物的降解作用,或仅利用单一的表面活性剂强化植物修复效率等方面,而利用易降解的化学表面活性剂与其他表面活性物质复配强化植物修复能力的相关研究,以及通过植物生物量、叶绿素含量和根系活力等植物抗性指标来评价表面活性剂,植物修复过程中植物的生理变化等研究目前尚鲜见报道.
基于此,本研究以p,p′-DDT为有机氯农药DDT的代表物(文中无特殊说明均使用DDT表示),采用国内外应用广泛、对有机污染物具有较好修复效果的黑麦草为修复材料,利用受环境因素影响小、易生物降解的非离子表面活性剂Tween80[12]与可生物降解的“绿色”有机溶剂乳酸乙酯[13-14]按一定比例复配的混合洗脱液(预实验表明二者以一定比例复配,不仅对DDT可以产生显著的协同增溶、洗脱作用,而且能够减少表面活性剂的使用量,具有安全、高效、低成本等优点),采用盆栽实验的方法,进行了Tween80-乳酸乙酯复合溶液强化植物修复DDT污染土壤的研究.探讨了复合增效溶液存在条件下黑麦草对DDT的吸收、转化作用,黑麦草茎叶和根对DDT及其降解产物的动态富集规律,同时观察了黑麦草生物量、叶绿色含量和根系活力在修复过程中的变化情况,旨在揭示Tween80-乳酸乙酯复合溶液对黑麦草吸收、转化土壤中DDT的作用与机理,并考查Tween80-乳酸乙酯复合溶液存在条件下黑麦草在有机污染胁迫环境中的生长水平和抗逆性程度.
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂
3种DDT单体p,p′-DDT;p,p′-DDD和p,p′-DDE(文中无特殊说明均使用DDE和DDD表示)标准品,纯度≥98.0%,德国Dr.Ehrenstorfer公司;Tween80(C64H124O62),分析纯,天津市光复精细化工研究所;乳酸乙酯(C5H10O3),分析纯,国药集团化学试剂有限公司;丙酮(C3H6O),色谱纯,美国Tedia公司;正己烷(C6H14),色谱纯,美国Tedia有限公司;乙酸乙酯(C4H8O2),色谱纯,德国Merck公司;尿素(CO(NH2)2),分析纯,沈阳化学试剂厂;磷酸二氢钙(Ca(H2PO4)2· H2O),分析纯,北京化工厂;硫酸钾(K2SO4),分析纯,北京化工厂;实验用水均为去离子水.
1.1.2 仪器
气相色谱仪:GC-2010,配置电子捕获检测器(ECD),日本岛津制作所;总有机碳分析仪:TOC-VCPH,日本岛津制作所;冷冻干燥机:FD5-3T,美国SIM公司;固相萃取仪:ASE-12,天津奥特赛恩斯仪器有限公司;真空泵:AP-02B,天津奥特赛恩斯仪器有限公司;氮吹浓缩装置:MTN-2800D,天津奥特赛恩斯仪器有限公司;旋转蒸发仪:52AA,上海亚荣生化仪器厂;C18小柱:封端,天津博纳艾杰尔科技有限公司;SPE净化柱:弗罗里硅土柱,天津博纳艾杰尔科技有限公司;生化培养箱:SPX-250B-Z,上海博迅实业有限公司.
1.2 供试土壤
供试土壤采自吉林省长春市市郊农田表层土壤(0~20 cm),按照土壤农业化学分析标准方法进行土壤样品采集、预处理和理化性质分析[15].经处理后的土壤样品过0.25 mm细筛,混合均匀后储存于玻璃广口瓶中备用.
土壤的基本理化性质:pH=6.81(m(土)/V(水)=1∶2.5),氧化还原电位(Eh)为442 mV,阳离子交换量(CEC)为28.67 cmol/kg,有机质含量(OM)为35.08 g/kg;砂粒(粒径0.02~2 mm)、粉粒(粒径0.002~0.02 mm)、黏粒(粒径小于0.002 mm)的质量分数分别为76.71%,14.18%和9.11%.
1.3 供试植物
采用国内外有机污染环境修复实验中应用较广泛,而且适合在北方生长的黑麦草(LoliumperenneL.)作为研究对象,品种为“曼哈顿4号”,由长春市农科院提供.
1.4 盆栽实验
先用丙酮将DDT标准样品溶解,喷洒到少量土壤中并混合均匀;待丙酮挥发后,将添加DDT的土壤与盆栽土壤充分混合(质量比为1∶9),最终获得DDT质量分数为2.38 mg/kg的污染土壤用于盆栽实验.称取800 g土壤装入正方形的瓷花盆中(10 cm×10 cm×10 cm),并将CO(NH2)2,Ca(H2PO4)2· H2O和K2SO4以溶液的形式作为肥料添加到土壤中,以补充N、P、K这3种植物生长所必需的主要矿物质元素,标准分别为35,25和30 mg/kg.每隔两周补充一次营养液.加去离子水调节土壤含水率达到田间最大持水量的60%,置于光照培养箱中,在与植物生长环境一致的条件下平衡1周后待用.
黑麦草种子经消毒、浸种后,于培养箱中进行催芽、露白,选取颗粒饱满、大小一致的草种均匀播撒在花盆内.盆栽实验期间,按照常规的栽培措施管理,播种2周后间苗至5株,自此每隔8 d用含有250 mg/L Tween80和100 mg/L乳酸乙酯复配而成的溶液定期浇灌.盆栽周期为90 d,实验期间向每盆土壤中浇9次复合增效溶液,体积总计1 440 mL,Tween80和乳酸乙酯在土壤中的累积浓度分别为450 mg/kg和180 mg/kg.保持黑麦草在(25±1)℃(白天,光照强度15 000 lx,相对湿度80%)/(18±1)℃(黑夜,无光照,相对湿度80%)和适合含水量的条件下生长.每隔2 d随机轮换花盆的位置,以保证各处理生长条件一致.
实验设计3种处理:只在DDT污染土壤中种植黑麦草的处理(T1);种植黑麦草,定期添加一定量Tween80-乳酸乙酯复合溶液的污染土壤处理(T2);种植黑麦草,不添加Tween80-乳酸乙酯复合溶液的干净土壤样品作为空白对照(CK).每个处理3次重复.
分别于盆栽实验开始后的30,60和90 d收获植物样品.将黑麦草地下部分(根系)和地上部分(茎和叶)反复冲洗干净后迅速分开,经冻干后低温保存待分析.测定指标包括:黑麦草地上部分和地下部分中DDT及其代谢产物的含量、黑麦草生物量、叶绿素含量和根系活力.
1.5 样品测定、分析
采用超声波萃取-气相色谱法测定土壤和植物样品中DDT,DDD和DDE的含量[12].
气相色谱操作条件:SHIMADZU (GC-2010)配ECD检测器,DB-608毛细管柱(30 m×0.25 mm×0.25 μm);载气为高纯氮气,流速为9.4 mL/min;进样口温度250℃,检测器温度280℃,柱升温程序为起始温度100℃,以20℃/min升温至210℃,再以10℃/min升温至250℃,保持10 min;不分流进样,进样量为1 μL,外标法定量.
DDT,DDE和DDD在植物地上部分中的平均回收率为82.7%~108.2%,相对标准偏差为1.8%~6.4%.DDT,DDE和DDD的检出限分别为0.21,0.15 和0.23 μg/kg;植物地下部分的检出限分别为0.25,0.19和0.30 μg/kg,平均回收率为91.2%~107.3%,标准偏差在2.6%~7.3%之间,均符合残留分析的要求.
黑麦草冻干后分别记录地上部分和地下部分的干物质量;黑麦草的叶绿素含量和根系活力分别采用分光光度法及TTC法进行测定[16].
2 结果与讨论
2.1 DDT及其降解产物在黑麦草中的积累规律
DDE和DDD都是DDT的主要代谢产物,DDT在好氧条件下可被土壤微生物脱氯转化为DDE,在厌氧微生物的作用下则可以降解为DDD.[17]Reid等[18]的研究指出,DDT降解的厌氧过程比好氧过程更容易发生,由于DDE基本无活性,因此常被认为是DDT的最终降解产物,DDD继续降解为其他DDT衍生物的过程也非常困难.[19]
在DDT污染土壤的修复过程中,不仅在黑麦草体内检测到了DDT,而且还检测到其主要降解产物DDE和DDD,说明加入到土壤中的DDT发生了降解反应,而且黑麦草对DDT及其降解产物均具有一定的吸收作用.黑麦草地上部分和地下部分中DDT及其降解产物以及DDTs(DDT及其代谢产物)含量的动态变化情况见表1和表2.
由表1和表2可知,DDT在黑麦草地上部分和地下部分的含量均随着时间的增加而逐渐增大,虽然在修复过程中黑麦草根不断累积DDT的代谢产物,但DDT始终是主要的吸收对象.T2处理中黑麦
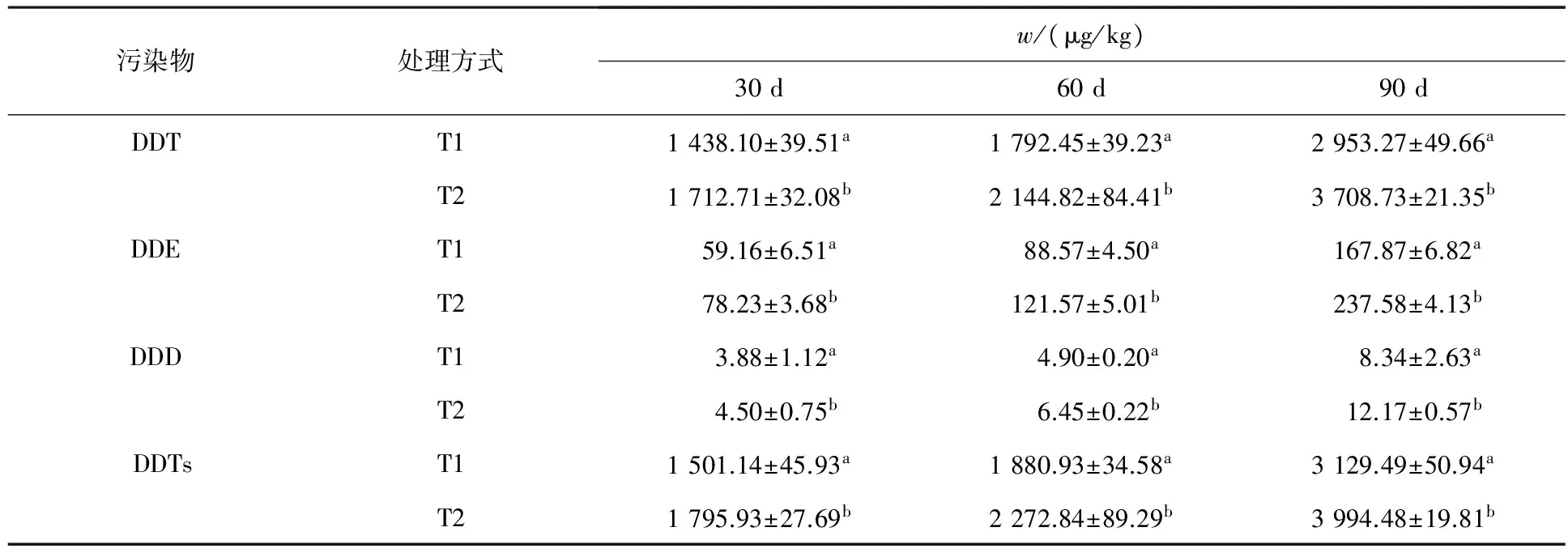
表1 DDT及其降解产物在黑麦草地上部分的含量
注:n=3,小写字母表示一列数据之间的差异显著性,下同.
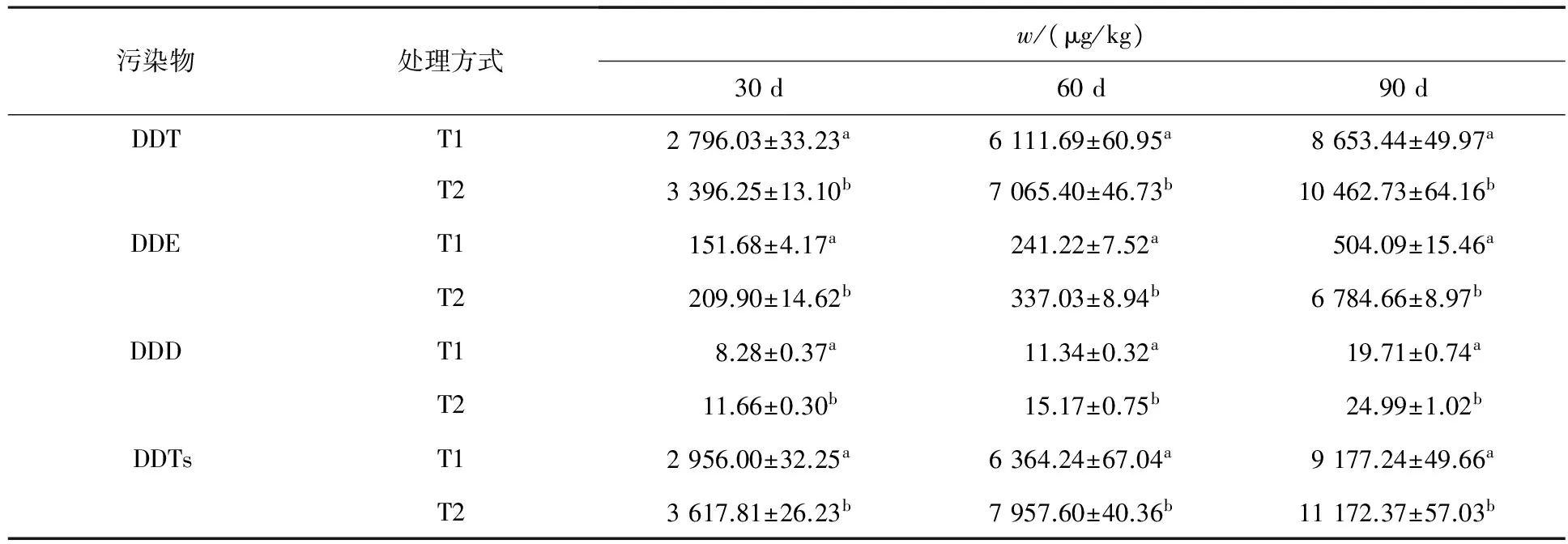
表2 DDT及其降解产物在黑麦草地下部分的含量
草地上部分和地下部分DDT的含量均高于T1,同一时间内不同处理方式下植物地上部分污染物含量均存在显著差异.30,60和90 d时,T2处理中黑麦草地上部分DDT含量分别比T1提高了16.0%,16.4%和20.4%;T2处理中黑麦草地下部分DDT的含量比T1分别提高了17.7%,19.6%和17.3%.由表1和表2还可以看出,黑麦草地上部分和地下部分对DDT的代谢产物DDE和DDD均有不同程度的吸收累积作用,随着修复时间的增加其含量均呈上升趋势,但DDE在黑麦草地上部分的含量始终高于DDD.T2处理中黑麦草地上部分和地下部分两种代谢产物的含量均高于T1.黑麦草地上部分DDTs的变化规律与DDT及其降解产物的变化规律相一致.至盆栽实验结束时,T1处理下黑麦草地上部分中DDTs的含量占原施药量的0.33%,T2处理下黑麦草地上部分对DDTs的吸收量比T1提高了21.7%,占原施药量的0.42%;T2处理下黑麦草地下部分中DDTs的含量仅占原施药量的1.2%,比T1提高了17.9%.
上述结果表明,黑麦草地上部分对DDT及其代谢产物的吸收作用很小,地下部分对DDT及其降解产物的直接吸收作用也十分有限,但明显高于黑麦草地上部分的吸收能力.Tween80-乳酸乙酯复合溶液的加入能够提高黑麦草地上部分和地下部分对土壤中有机物的吸收能力,主要原因在于Tween80-乳酸乙酯复合溶液能够有效增加污染物的溶解度,提高其植物可利用性,从而增加了污染物在黑麦草体内的含量.
2.2 黑麦草对DDTs的富集作用
茎富集系数和叶富集系数是植物茎和叶中污染物浓度与土壤中污染物浓度的比值,可以在某种程度上分别反映植物茎和叶对污染物的吸收和富集能力,其比值越大,表示吸收与富集能力越强.[20]植物根中污染物浓度与土壤中污染物浓度的比值,即根富集系数,可用来反映植物地下部分对污染物的富集能力,其比值越大,表示根对污染物的富集作用越强.因此,利用黑麦草茎、叶、根中污染物的浓度与土壤中污染物浓度的比值来评价黑麦草地上部分和地下部分对DDTs的吸收和富集能力,结果见表3.

表3 黑麦草地上部分和地下部分对DDTs的富集系数
由表3可知,在整个修复过程中T2处理的黑麦草地上部分富集系数均高于T1,说明复合增效溶液促进了植物茎和叶对DDTs的富集作用.除30 d时T1的富集系数小于1以外,其他的富集系数均大于1,说明植物地上部分对土壤中的DDTs产生了明显的富集作用.此外,地上部分的富集系数随着修复时间的增加而增大,说明修复过程中土壤中DDTs的残留量逐渐减少,而DDTs在植物茎和叶中的积累量逐渐增加.由表3还可以看出,黑麦草根对DDTs有强烈的富集作用,而且根对DDTs的富集能力显著高于地上部分.植物对土壤中有机污染物的吸收主要包括有机污染物在水—植物根、植物根—蒸腾流、蒸腾流—茎叶间的一系列连续分配过程,土壤溶液中的有机污染物可以穿过根皮层进入木质部中,再通过根毛细胞的作用累积于植物茎内或通过运输作用达到植物叶并累积.[21]然而,由于DDTs具有强亲脂性,所以不容易从根系中迁移出去而是积累在根系的脂质部分,[22]从而导致黑麦草地下部分中的有机污染物含量比地上部分要高,这与前人的研究结果是一致的[9,17].Tween80-乳酸乙酯复合溶液作用下黑麦草的根富集系数明显高于黑麦草单独修复时的根富集系数,也进一步说明了Tween80-乳酸乙酯复合溶液增加了有机污染物的溶解度,提高了污染物的生物可利用性,从而促进了黑麦草对DDTs的吸收和富集作用.
2.3 黑麦草生物量的变化
生物量是植物内部生理生化变化的外部表现,能够直接反映植物生长和物质积累的情况[23].
Tween80-乳酸乙酯复合溶液强化植物修复DDT污染土壤过程中黑麦草生物量(干重)的动态变化规律见表4.由表4可以看出,同一修复时间内,黑麦草地上部分生物量均小于地下部分生物量.虽然T1和T2处理中黑麦草的生物量在盆栽实验中后期低于CK,但随着时间的增加其地上部分和地下部分的生物量均逐渐增加,说明黑麦草对一定浓度的DDT污染具有较强的耐性.30 d时,T1处理下的地上部分和地下部分生物量均略高于CK,说明在盆栽实验前期DDT可能刺激了黑麦草根系和地上部分生物量的增长.此时的T2与T1及CK之间均未表现出显著性差异,说明添加Tween80-乳酸乙酯复合溶液对黑麦草生物量的增长没有表现出抑制作用.60 d时,T1和T2处理中黑麦草地上部分和地下部分生物量迅速增加,但均显著低于CK;T1和T2处理下的黑麦草地上部分生物量分别比CK低11.1%和10.1%,地下部分生物量分别比CK低21.0%和17.1%.上述结果表明,随着DDT污染胁迫时间的增加,DDT对黑麦草生物量增长的抑制作用逐渐显现出来,而且对黑麦草地下部分生物量的影响大于地上部分.复合增效溶液在土壤中累积量的增加并未进一步抑制黑麦草生物量的增长,反而表现出一定的刺激作用,从而使T2处理中黑麦草地上部分和地下部分生物量均大于T1,但彼此之间并无显著性差异.然而,随着污染胁迫时间的进一步增加,90 d时DDT污染土壤中黑麦草的生物量与CK之间的差距也有增大的趋势,T2处理中黑麦草地上部分和地下部分的生物量低于T1,T1和T2处理中黑麦草地上部分生物量分别比CK低14.9%和17.8%,地下部分生物量分别比CK低20.6%和24.0%.Ke等[24]在利用秋茄和木榄对芘污染土壤进行修复的研究过程中发现,污染土壤中芘的生物量明显低于对照组;Reilly等[25]的研究指出,有机污染物可能通过直接降低土壤为植物生长发育提供水和营养的能力而间接导致植物生物量的减小.

表4 黑麦草地上部分和地下部分生物量的动态变化
2.4 黑麦草叶绿素含量的变化
叶绿素含量常被作为植物抗性的指标来评价环境污染物对植物的影响.叶绿素含量在逆境胁迫下通常会降低,所以研究叶绿素含量的变化对于研究植物在有机污染环境中的生理变化具有重要意义.
Tween80-乳酸乙酯复合溶液强化植物修复DDT污染土壤过程中黑麦草的叶绿素含量随修复时间的动态变化规律如图1所示.随着修复时间的增加,不同处理方式下的叶绿素含量均呈下降趋势.T1与T2处理中的叶绿素含量都显著低于CK,30 d时T1和T2处理中黑麦草叶绿素含量分别比CK下降了11.1%和8.2%,60 d时分别比CK下降了18.7%和22.0%,90 d时分别比CK下降了20.2%和21.7%,说明有机污染胁迫下黑麦草叶绿素的合成受到了抑制.30 d时各处理中的叶绿素含量与60 d和90 d的均有显著性差异;对于相同处理在不同时间上的变化而言,除T1以外,CK和T2处理中的叶绿素含量在60 d和90 d之间无显著性差异;而对于同一时间不同处理方式下的叶绿素含量变化,T1和T2处理中黑麦草的叶绿素含量在各采样时间内均无显著性差异,只与CK之间存在显著性差异.由此可以看出,叶绿素含量随着时间的增加而减少主要是因为受到目标污染物的影响,而Tween80-乳酸乙酯复合溶液并未进一步抑制叶绿素的合成.Huang等[26]的研究也发现植物叶片中的叶绿素含量会在植物受到胁迫时降低,但耐性较强的植物叶绿素含量会减少得相对缓慢;洪有为和袁东星[27]的实验结果也表明秋茄幼苗的叶绿素含量在菲和荧蒽的污染胁迫下,随污染物浓度和污染时间的增加而持续降低,相同处理下荧蒽对秋茄幼苗叶绿素含量的抑制作用大于菲.
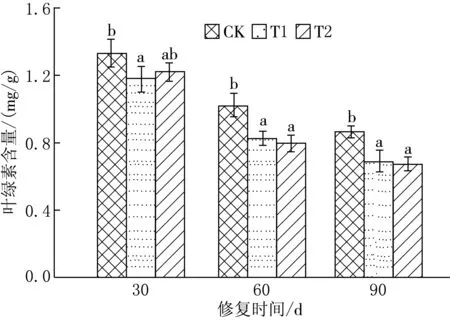
图1 黑麦草叶绿素含量的动态变化
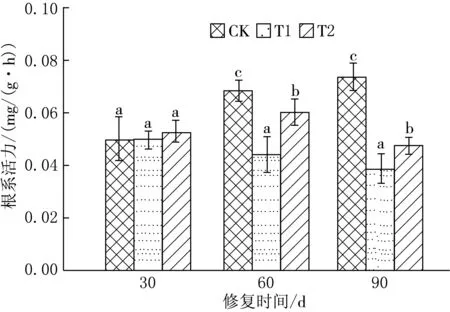
图2 黑麦草根系活力的变化
2.5 黑麦草根系活力的变化
植物根系是保证植物正常生长发育的重要器官,根系活力是反映根系代谢能力强弱的重要指标之一,可直接影响植物的生长水平和抗逆性.
Tween80-乳酸乙酯复合溶液强化植物修复DDT污染土壤过程中,黑麦草的根系活力动态变化情况如图2所示.由图2可知,30 d时DDT污染胁迫下的黑麦草根系活力与CK相比无显著性差异,说明在实验前期DDT对根系活力并未产生明显的抑制作用,而且T2处理中黑麦草的根系活力还表现出一定程度的应激反应.60 d时,T1处理中黑麦草的根系活力明显降低,比CK降低了35.1%;而T2处理中黑麦草的根系活力显著增强,仅比CK低13.5%,说明随着污染胁迫时间的增加,DDT对黑麦草的毒害作用逐渐显现出来.然而,T2处理中黑麦草的根系活力有所提高,一方面可能是由于表面活性剂提高了植物-微生物对污染土壤的修复效率,减小了目标污染物在土壤中的残留浓度,从而缓解了DDT对黑麦草根系的毒害作用;另一方面可能是由于表面活性剂的加入给土壤微生物提供了新的碳源,促进了土壤微生物数量的增加,提高了土壤有机质含量,从而有利于根系活力的提高.90 d时,T1和T2处理中黑麦草的根系活力都有所降低,分别比CK降低了47.4%和35.2%.这可能是因为在长时间的有机污染胁迫下,植物根细胞遭到了破坏,从而引起自由基过氧化损伤,而且根系在刺激作用下会分泌芬酸物质抑制植物根系的生长,[28]导致植物根系受损严重,根系活力明显降低.此外,有机污染物导致土壤水分和养分的传输受阻,进而造成植物的生长和新陈代谢等生理障碍也可能是导致黑麦草根系活力下降的原因之一.[29]
3 结论
本文采用盆栽实验方法,研究了Tween80-乳酸乙酯复合溶液对黑麦草吸收、转化污染土壤中DDT的作用,并考察了黑麦草生物量、叶绿素含量和根系活力的动态变化规律,得出了以下主要结论.
(1) 黑麦草对土壤中的DDT具有一定的吸收、降解能力,且地下部分的吸收、富集能力明显高于地上部分.但黑麦草对有机物的直接吸收作用十分有限.Tween80-乳酸乙酯复合溶液存在条件下黑麦草地上部分和地下部分对DDTs的吸收量比单一植物修复分别提高了21.7%和17.9%,说明Tween80-乳酸乙酯复合溶液强化了黑麦草对土壤有机物的吸收、富集能力,主要原因在于它能够有效增加污染物的溶解度,提高其植物可利用性,从而增加了污染物在黑麦草体内的含量.
(2) 在整个盆栽实验过程中,不同处理下的黑麦草生物量均随着时间的增长而增加,但不同时期表现出不同的差异.盆栽实验前期,DDT对黑麦草的生长具有一定刺激作用,Tween80-乳酸乙酯复合溶液对黑麦草的生长也未表现出抑制作用;实验中后期,随着DDT污染胁迫时间的增长,DDT对黑麦草生物量增长的抑制作用逐渐显现出来,而且对黑麦草地下部分生物量的影响大于地上部分,Tween80-乳酸乙酯复合溶液并未显著抑制黑麦草生物量的增长,反而在修复中期表现出一定的刺激作用.
(3) 黑麦草叶绿素含量始终随着修复时间的增加而减少,主要是因为受到目标污染物的影响,Tween80-乳酸乙酯复合溶液的加入并未进一步抑制叶绿素的合成.
(4) 在整个盆栽实验过程中,不同处理下的黑麦草根系活力在不同时期表现出不同的差异,两种处理条件下的黑麦草根系活力都低于CK.实验前期,黑麦草根系活力在DDT污染胁迫下并未受到明显抑制,且根系活力在Tween80-乳酸乙酯复合溶液作用下还产生一定程度的应激反应;随着污染胁迫时间的增长,实验中后期DDT对黑麦草的毒害作用逐渐显现出来,但Tween80-乳酸乙酯复合溶液则在一定程度缓解了DDT对根系活力的抑制作用.
以上结果结论希望能为进一步开展表面活性剂-植物修复联用技术修复有机污染土壤的研究提供数据支持和理论依据.
[1] 曹晓燕,景建宁,杨桂朋,等.表面活性剂对DDT在胶州湾沉积物上吸附行为的影响[J].环境科学,2011,32(11):3327-3334.
[2] CAO X Y,HAN H Y,YANG G P,et al.The sorption behavior of DDT onto sediment in the presence ofsurfactant cethltrimethylammoniumbromide[J].Marine Pollution Bulletin,2011,62:2370-2376.
[3] CAO M H,WANG L L,WANG L,et al.Remediation of DDTs contaminated soil in novel Fenton-like systemwith zero-valent iron[J].Chemosphere,2013,90:2303-2308.
[4] MITTON F M,RIBAS FERREIRA J L,GONZALEZ M,et al.Antioxidant responses in soybean and alfalfa plants grown in DDTs contaminated soils:useful variables for selecting plants for soil phytoremediation[J].Pesticide Biochemistry and Physiology,2016,130:17-21.
[5] 沈源源,滕应,骆永明,等.几种豆科、禾本科植物对多环芳烃复合污染土壤的修复[J].土壤,2011,43(2):253-257.
[6] MITTON F M,GONZALEZ M,PEA,et al.Effects of amendments on soil availability and phytoremediation potential of aged p,p′-DDT,p,p′-DDE andp,p′-DDD residues by willow plants (Salixsp.) [J].Journal of Hazardous Materials,2012,203/204:62-68.
[7] WANG G M,SUN C,XIE X Q.Effect of nonionic surfactant Tween80 and DOM on the behaviors of desorption of phenanthrene and pyrene in soil-water system[J].Environmental Sciences & Ecology,2007,28(4):832-837.
[8] WU N Y,ZHANG S Z,HUANG H L,et al.DDT uptake by arbuscularmycorrhizal alfalfa and depletion in soil as influenced by soil application of a non-ionic surfactant[J].Environmental Pollution,2008,151(3):569-575.
[9] 高彦征,朱利中,胡晨剑,等.Tween80对植物吸收菲和芘的影响[J].环境科学学报,2004,24(4):713-718.
[10] LIAO C J,LIANG X J,LU G N,et al.Effect of surfactant amendment to PAHs-contaminated soil forphytoremediation by maize (ZeamaysL.)[J].Ecotoxicology and Environmental Safety,2015,112:1-6.
[11] 谢文明,李宛泽,安丽华,等.表面活性剂对南瓜消解土壤中DDT的影响[J].农业环境科学学报,2007,26(5):1640-1644.
[12] GUO P,CHEN W W,LI Y M,et al.Selection of surfactant in remediation of DDT-contaminatedsoil by comparison of surfactant effectiveness[J].Environmental Science and Pollution Research,2014,21:1370-1379.
[13] LITCHFIELD J H.Microbiological production of lactic acid[J].Advanced in Applied Microbiology,1996,42:45-95.
[14] 王金梅,王强,郭红岩,等.单技术修复复合污染土壤的初步研究[J].农业环境科学学报,2007,26(3):1107-1100.
[15] 鲍士旦.土壤农化分析:第3版[M].北京:中国农业出版社,2000.
[16] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[17] 安凤春,莫汉宏,郑明辉,等.DDT及其主要降解产物污染土壤的植物修复[J].环境化学,2003,22(1):19-25.
[18] REID B J,JONES K C,SEMPLE K T,et al.Bioavailability of persistent organic pollutants in soils and sediments-a perspective on mechanisms,consequences and assessment[J].Environmental Pollution,2000,108(1):130-112.
[19] 朱雪梅,陶澍,林健枝.根际土壤中DDTs的残留与转化[J].环境化学,2004,23(2):157-162.
[20] LIN H,TAO S,ZUO Q,et al.Uptake of polycyclic aromatic hydrocarbons by maizeplants[J].Environmental Pollution,2007,148(2):614-619.
[21] APRILL W,SIMS R C.Evaluation of the use of prairie grasses for stimulating polycyclic aromatic hydrocarbon treatment in soil[J].Chemosphere,1990,20(1/2):253-265.
[22] WILD E,DENT J,THOMAS G O,et al.Direct observation of organic contaminant uptake,storage,and metabolism within plant roots[J].Environmental Science and Technology,2005,39(10):3695-3702.
[23] 胡单,杨永红.不同施氮对冬青稞幼苗光合色素·生物量及产量的影响[J].安徽农业科学,2011,39(24):14561-14563,14585.
[24] KE L,WANG W,WONG T W Y,et al.Removal of pyrene from contaminated sediments by mangrove microcosms[J].Chemosphere,2003,51(1):25-34.
[25] REILLY K A,BANKS M K,SCHWAB A P.Dissipation of polycyclic aromatic hydrocarbons in the Rhizosphere[J].Journal of Environmental Quality,1996,25(2):212-219.
[26] HUANG X D,El-ALWAI Y,PENROSE D M,et al.Responses of three grass species to creosote duringphytoremediation[J].Environmental Pollution,2004,130(3):453-463.
[27] 洪有为,袁东星.秋茄(Kandeliacandel)幼苗对菲和荧蒽污染的生理生态效应[J].生态学报,2009,29(1):445-455.
[28] 吴晓丽,罗玉明,徐迎春,等.镉胁迫对狭叶香蒲某些生理指标的影响[J].植物资源与环境学报,2007,16(1):74-76.
[29] 宋玉芳,周启星,许华夏,等.菲、芘、1,2,4-三氯苯对土壤高等植物根伸长抑制的生态毒性效应[J].生态学报,2000,22(11):1945-1950.
(责任编辑:方林)
DDTuptakebyplantincontaminatedsoilenhancedbyTween80-ethyllactatecompoundedsolution
GUO Ping1,CHEN Tao2,CHEN Wei-wei1,YANG Ping1,ZHANG Wen-qing1
(1.Key Lab of Groundwater Resources and Environment Ministry of Education, Jilin Province Key Lab of Water Resources and Aquatic Environment, College of Environment and Resources,Jilin University,Changchun 130021,China; 2.State Grid Jilin Electric Research Institute,Changchun 130021,China)
A pot experiment was conducted to study the influence of the Tween80-ethyl lactate compounded solution on ryegrass(LoliumperenneL.)uptake and transform of DDT in contaminated soil,and examine the dynamic change regulations of the ryegrass biomass,chlorophyll content and root activity.The experimental results indicated that DDT uptake and enrichment in ryegrass can be enhanced by the Tween80-ethyl lactate compounded solution through increasing the solubility of DDT,and DDT can be degraded to DDE and DDD efficiently.The enrichment of DDT in ryegrass root was more than that in the shoot,and DDTs content in ryegrass shoot and root just accounted for 0.42% and 1.2% for the initial application dosage of DDT in the presence of the compounded synergistic solution respectively,which was 21.7% and 17.9% more than that by phytoremediation alone.The three kinds of resistant physiological and biochemical indexes exhibited various change regulations,in which the content of biomass,chlorophyll content and root activity was mainly decreased by DDTs,however,the growth and resistance level of ryegrass in organic contaminated soil can be controlled by the Tween80-ethyl lactate compounded solution to a certain extent.
DDT;phytoremediation;Tween80-ethyl lactate compounded solution;biomass;chlorophyll content;root activity
1000-1832(2017)03-0150-08
10.16163/j.cnki.22-1123/n.2017.03.030
2016-12-01
国家重大科技专项课题(2012ZX07202-009).
郭平(1972—),女,博士,教授,博士研究生导师,主要从事环境污染防治与生物修复研究;通讯作者:陈薇薇(1982—),女,博士,工程师,主要从事环境污染修复技术与机理研究.
X 53 [学科代码] 610·1035
A
