高速逆流色谱技术分离纯化藜芦中甾体类生物碱
2017-09-21姜姣姣闫慧娇文蕾郑秀花王晓陈燕平
姜姣姣,闫慧娇,文蕾,郑秀花,王晓*,陈燕平
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省中药质量控制技术重点实验室 山东省分析测试中心,山东 济南 250014;3.烟台出入境检验检疫局,山东 烟台 264000)
·基础研究·
高速逆流色谱技术分离纯化藜芦中甾体类生物碱
姜姣姣1,2,闫慧娇2,文蕾1,2,郑秀花1,2,王晓2*,陈燕平3
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省中药质量控制技术重点实验室 山东省分析测试中心,山东 济南 250014;3.烟台出入境检验检疫局,山东 烟台 264000)
目的:采用高速逆流色谱(HSCCC)技术对藜芦中的甾体类生物碱进行分离鉴定。方法:以石油醚-乙酸乙酯-甲醇-水(5∶5∶3∶7,V/V)为溶剂系统,在转速为850 r·min-1、流速为2.0 mL·min-1、检测波长为280 nm的实验条件下进行分离。结果:从300 mg粗提物中分离得到2.1 mg的藜芦酰棋盘花胺(veratroylzygadenine)和9.3 mg的介芬胺(Jervine),经HPLC分析,其纯度分别为91.34%、98.10%。结论:该方法简便、重现性好、分离量大,适合于甾体类生物碱的分离纯化。
高速逆流色谱;藜芦;甾体类生物碱
藜芦VeratrumnigrumL.为百合科藜芦属植物[1],多年生草本,主要生长在海拔较高的山坡林下或草丛中,主产于中国的东北、华北、贵州、陕西等地区[2]。藜芦又名黑藜芦、山葱,在《神农本草经》、《别录》和《本草纲目》中均有记载,其味辛、苦,性寒,具有祛痰、催吐、杀虫等作用[3],通常用于治疗中风、癫痫、虐疾、跌打损伤、头癣等疾病,此外还可灭蛆、蝇[4],其主要药效成分有藜芦生物碱、茋类、二肽类、黄酮类及其他化合物[5]。
近年来,研究发现藜芦中有效成分藜芦生物碱还具有强心降压、改善脑循环、抗癌等生理活性[6-7],但是目前国内对藜芦生物碱的研究还比较少。藜芦生物碱主要为甾体类生物碱,其基本母核为胆甾烷类化合物,特点是没有紫外吸收,且含量较低,为藜芦生物碱的分离纯化增加了很大的难度。传统的分离方法主要包括柱色谱法[8]、薄层色谱法[9]、高效液相色谱法[10]等。这些方法不仅耗费时间长、效率低,还容易对被分离成分产生死吸附、变性等影响。为了进一步研究藜芦生物碱的生理活性,更好地开发利用藜芦生物碱,本文研究建立一种高效的分离制备藜芦生物碱的方法,制备了纯度较高的藜芦酰棋盘花胺和介芬胺两个单体化合物(化学结构式见图1)。
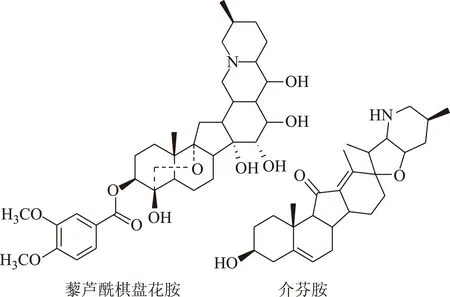
图1 藜芦酰棋盘花胺和介芬胺的化学结构
1 仪器与材料
TBE-300A高速逆流色谱仪(上海同田生物技术有限公司),该系统由TBP5002泵、多层聚四氟乙烯螺旋管、8823-B紫外检测器(上海胜斯贸易有限公司)、3057-11记录仪(上海精科实业有限公司)组成;Agilent 1260高效液相色谱系统[配有蒸发光散射检测器(ELSD),美国Agilent 公司];旋转蒸发仪(上海况胜科技有限公司)。
样品前处理以及高速逆流色谱中所用到的石油醚、乙酸乙酯、甲醇均为分析纯(邹平鲁岳化工有限公司),水为过滤蒸馏水;高效液相色谱所用乙腈为色谱纯(美国天地公司),实验用水为过滤蒸馏水及娃哈哈纯净水。
藜芦药材购于哈尔滨三棵树药材专业市场,经山东中药医药大学李佳教授鉴定为百合科植物藜芦VeratrumnigrumL.的干燥根茎。
2 方法
2.1藜芦生物碱粗提物的制备
将藜芦药材5kg粉碎,过40目筛,将其平均置于3个10L的圆底烧瓶中,分别加入95%的乙醇6L回流提取3次(提取时间分别为3、2、2h),过滤,合并滤液,减压浓缩至无乙醇味道,得浓缩液1200mL。在浓缩液中慢慢加入10%HCl溶液,调节溶液pH值达到3,然后加入等体积的石油醚萃取3次,将石油醚萃取后的水相加入氨水调节溶液至pH值达到10,得沉淀105g。将105g沉淀溶于pH值为10的碱水溶液中,超声振荡后用乙酸乙酯萃取,回收溶剂得乙酸乙酯萃取物,将其用酸水溶解后,再加入氨水调节pH值为10,过滤得较纯样品30g,用于进一步分离。
2.2两相溶剂系统和样品溶液的制备
实验所采用的溶剂体系为石油醚-乙酸乙酯-甲醇-水(5∶5∶3∶7,V/V),将上述溶剂按比例置于2000mL的分液漏斗中,充分振荡,静置,使其分层。使用前分出上下相,将上层溶液作为固定相,下层作为流动相,放于不同容器中,然后超声脱气5min,待用。
取400mg纯化后的样品,因其溶解性差,在上相中稍好,故取上述溶剂系统的上相溶解样品,作为样品溶液。
2.3分离和鉴定
2.3.1HSCCC的分离制备过程 将预先准备好的上相,以20mL·min-1的流速泵入HSCCC的螺旋管中,待上相充满HSCCC的螺旋管时,启动仪器,顺时针缓慢调节转速至850r·min-1,转速稳定后,以2mL·min-1的流速泵入下相,当在出口观察到有下相流出时,说明上下相已经建立了动态平衡。将样品溶液通过进样阀注入分离柱中,然后开启紫外检测器(检测波长280nm)和记录仪,根据HSCCC图谱手动收集馏分。
2.3.2HPLC分析 根据HSCCC图谱将分离得到的馏分及吹出液用HPLC进行分析。色谱柱为InertsilODS-SP(250mm×4.6mm,5μm);柱温为25℃;检测波长为265nm;流动相为乙腈(A相)、0.1%三氟乙酸水溶液(B相),梯度洗脱(0~5min,20%A;5~30min,20%A~40%A;30~40min,40%~100%A;40~45min,100%A);流速为1.0mL·min-1;进样量:20μL。
3 结果与讨论
3.1HPLC条件的优化
本实验考察了甲醇-水、乙腈-0.05%甲酸水溶液、甲醇-0.1%三氟乙酸水溶液和乙腈-0.1%三氟乙酸水溶液等作为流动相时样品中各组分的分离效果,也考察了等度洗脱和梯度洗脱的影响。结果发现当采用乙腈-0.1%三氟乙酸的水溶液进行梯度洗脱时,样品中的各组分具有较好的分离效果,如图3所示。
3.2HSCCC分离条件的优化
HSCCC分离效果的好坏关键在于所选择的溶剂系统是否合适,而溶剂系统是根据两相溶剂中的分配系数(KD)为指标来决定的。通常,KD值范围是0.5~2.0时说明此溶剂系统较好[11]。本实验利用HPLC测定了在不同比例的石油醚-乙酸乙酯-甲醇-水中目标化合物的KD值。结果发现,当溶剂体系石油醚-乙酸乙酯-甲醇-水的比例为5∶5∶3∶7时,样品中的两个生物碱具有合适的KD值,见表1。
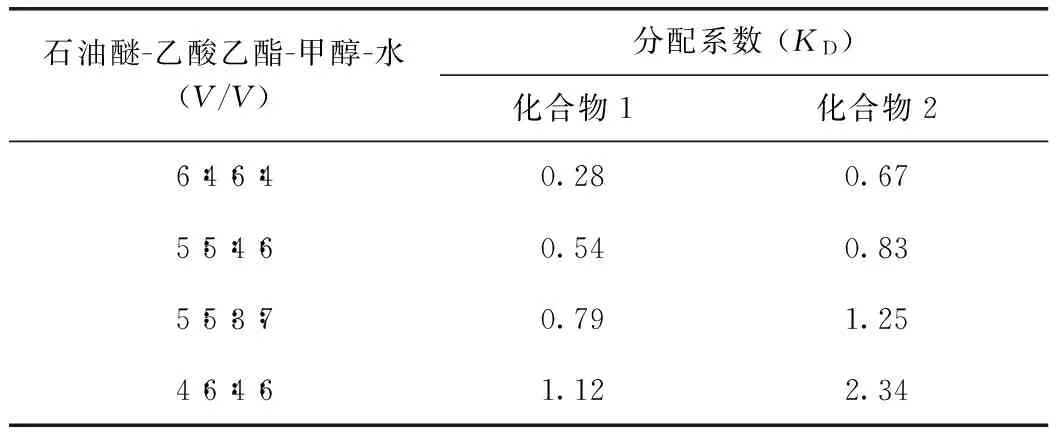
表1 样品中的2个生物碱在不同溶剂系统中的KD值
从表1中的数据可以看出,样品中的2个生物碱在石油醚-乙酸乙酯-甲醇-水(6∶4∶6∶4,V/V)的溶剂系统中KD值较小,使用这个溶剂系统能够很快洗脱样品中的2个生物碱,因此两组分将得不到较好的分离。当溶剂系统为石油醚-乙酸乙酯-甲醇-水(4∶6∶4∶6,V/V)时,化合物1、2的KD值分别为1.12和2.34,可以看出此时的KD偏大,需要较长的时间才能使两个组分洗脱出来。而溶剂系统为石油醚-乙酸乙酯-甲醇-水5∶5∶4∶6和5∶5∶3∶7时,两个目标化合物的KD值基本符合要求。通过实验发现,当石油醚-乙酸乙酯-甲醇-水体积比为5∶5∶3∶7更为合适,两组分的分离效果更好,且分离时间较短。
3.3HSCCC分离纯化
利用上述优化的溶剂系统石油醚-乙酸乙酯-甲醇-水(5∶5∶3∶7,V/V)进行化合物的分离。一次进样300mg藜芦生物碱粗提物,在5.5h内完成一次分离,根据图2进行馏分的手动收集,最终得到藜芦酰棋盘花胺(峰1)2.1mg和介芬胺(峰2)9.3mg,分离制备的化合物经HPLC进行分析,其纯度分别为91.34%和98.10%(见图3)。
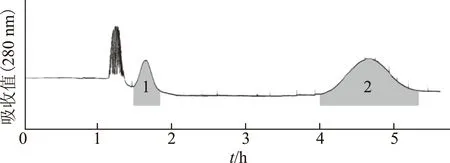
注:1.藜芦酰棋盘花胺峰;2.介芬胺峰。图2 藜芦中甾体生物碱的的HSCCC图谱
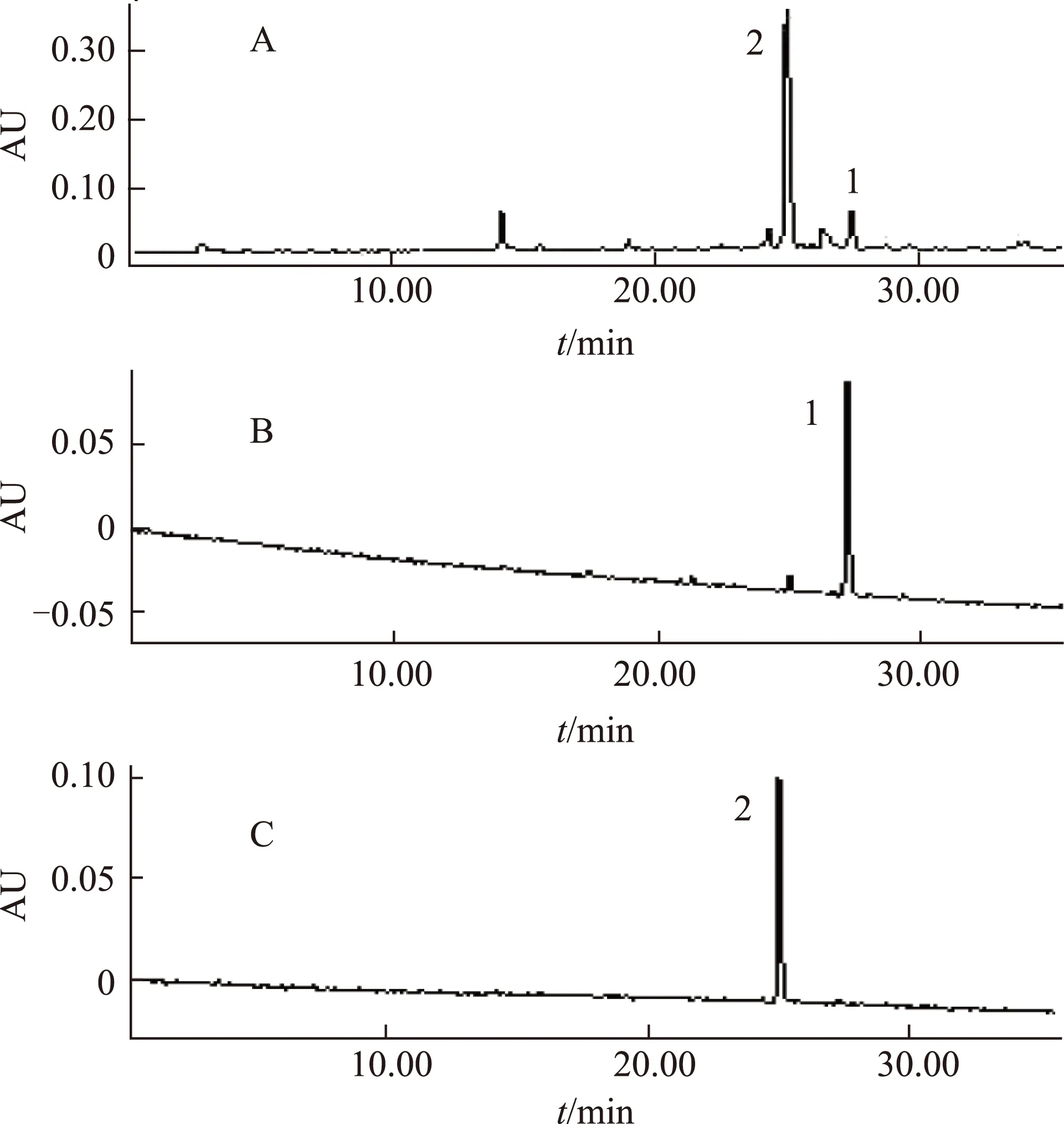
注:A.藜芦粗提物;B.藜芦酰棋盘花胺;C.介芬胺;1.藜芦酰棋盘花胺峰;2.介芬胺峰。图3 藜芦粗提物及得甾体生物碱的HPLC图
3.4化合物的结构鉴定
化合物1:无色针状结晶,碘化铋钾试剂显黄色,1H-NMR (600 MHz,DMSO-d6),δ:1.06 (3H,s,H-19),1.08 (3H,d,J=7.0 Hz,H-27),1.25 (3H,s,H-21),3.29 (1H,s,OH-20),3.81 (3H,s,OMe-4′),3.84 (3H,s,OMe-5′);13C-NMR (150 MHz,DMSO-d6) δ:32.64 (C1),26.76 (C2),75.47 (C3),104.15 (C4),46.64 (C5),19.17 (C6),17.02 (C7),43.92 (C8),95.41 (C9),43.92 (C10),95.41 (C11),46.92 (C12),32.85 (C13),80.52 (C14),69.58 (C15),70.30 (C16),45.56 (C17),63.52 (C18),19.51 (C19),72.06 (C20),19.71 (C21),70.75 (C22),17.59 (C23),30.93 (C24),26.76 (C25),62.52 (C26),17.42 (C27),165.30 (C1′),122.70 (C2′),111.57 (C3′),148.91 (C4′),153.48 (C5′),112.22 (C6′),123.63 (C7′),56.14 (COMe-4′),55.95 (COMe-5′)。以上数据与文献对比[12-13],数据基本一致,鉴定为藜芦酰棋盘花碱(veratroylzygadenine) 。
化合物2:无色针状结晶,碘化铋钾试剂显黄色,1H-NMR (600 MHz,DMSO-d6),δ:0.93(3H,d,J=6.4Hz,H-27),1.12(3H,d,J=7.1Hz,H-21),1.09(3H,s,H-19),2.06(3H,s,H-18),2.50(1H,m,H-8),2.52(1H,m,H-14),3.05(1H,m,H-22),3.28(1H,m,H-23),3.52 (1H,m,H-3),5.33(1H,m,H-6);13C-NMR(150 MHz,DMSO-d6),δ:36.95 (C1),31.26 (C2),70.48 (C3),41.82 (C4),142.75 (C5),120.79 (C6),30.42 (C7),38.37 (C8),62.09 (C9),38.17 (C10),206.88 (C11),137.05 (C12),145.75 (C13),44.09 (C14),24.51 (C15),30.61 (C16),85.1 (C17),12.08 (C18),18.51 (C19),41.23 (C20),11.13 (C21),66.39 (C22),75.58 (C23),38.94 (C24),32.07 (C25),54.06 (C26),19.08 (C27)。以上数据与文献对比[14-15],数据基本一致,鉴定为介芬胺(jervine)。
4 结论
藜芦具有广泛的药用价值,为了进一步筛选出具有药理活性的化学成分,需要高纯度的单体化合物,因此高效快速地分离纯化技术显得尤为重要。本研究采用酸溶碱沉的方法对藜芦中生物碱进行提取,然后将粗提物作为样品,以石油醚-乙酸乙酯-甲醇-水(5∶5∶3∶7,V/V)为溶剂系统,经一次高速逆流色谱分离,在5 h内从300 mg藜芦粗提物中得到藜芦酰棋盘花胺(2.1 mg)和介芬胺(9.3 mg),纯度分别为91.34%和98.10%。该方法简便易操作,且所得单体纯度高,为甾体类生物碱制备及分离提供了一种新思路。
[1] 薛兵,温辉梁,温文.藜芦中化学成分[J].南昌大学学报(理科版),2013,37(2):152-154.
[2] 赵瑜,陆国才,张卫东,等.藜芦甾体生物碱药理毒理学研究进展[J].毒理学杂志,2007,21(4):310-311.
[3] 赵朗,欧志强,王刊,等.兴安藜芦中甾体生物碱成分的研究[J].中国中药杂志,2009,34(23):3039-3042.
[4] 梁光义.藜芦属植物中生物碱的研究概况[J].药学学报,1984,19(4):309-320.
[5] 李伟,陆艳娟,王清,等.黑藜芦生物碱的降压作用机制[J].中国老年学杂志,2011,32(1):97-99.
[6] 周剑侠,康露,毕京博,等.异甾体生物碱-环巴胺的研究进展[J].中国天然药物,2006,4(6):468-472.
[7] 赵瑜,陆国才,张卫东,等.藜芦生物碱药理和毒理学研究进展[J].中药新药与临床药理,2008,19(3):240-242.
[8] 聂利月,汤建,李慧梁,等.兴安藜芦乙酸乙酯部位化学成分的研究[J].中国药学杂志,2008,43(13):971-973.
[9] 全香花,朴惠善,孙向红,等.兴安藜芦的化学成分的研究[J].中国药学杂志,2003,38(12):914-916.
[10]张盛,周剑侠,寿清耀,等.高效液相色谱-蒸发光散射检测法测定藜芦中的介藜芦碱和藜芦胺[J].色谱,2008,26(1):56-59.
[11]Shu X K,Duan W J,Liu F,et al.Preparative separation of polyphenols from the flowers ofPaeonialactifloraPall.by high-speed counter-current chromatography[J].J Chromatogr B,2014,947-948(1):62-67.
[12]Kadota S,Chen S Z,Li J X,et al.A steroidal alkaloid from Veratrum oblongum[J].Phytochemistry,1995,38(3):777-781.
[13]周剑侠,康露,沈征武.天目藜芦生物碱成分研究[J].中国药学杂志,2006,41(18):1379-1380.
[14]Wang L S,Zhao D Q,Liu Y H.Quality assessment ofVeratrumnigrumL.By LC-ELSD fingerprints and LC quantitative analysis[J].Chromatographia,2008,68:961-967.
[15]Atta-ur-Rahman,Ali R A,Ashraf M,et al.Steroidal alkaloids fromVeratrumAlbum[J].Phytochemistry,1996,43(4):907-911.
SeparationandPurificationofSteroidalAlkaloidsfromVeratrumnigrumbyHigh-speedCounter-currentChromatography
JIANG Jiaojiao1,2,YAN Huijiao2,WEN Lei1,2,ZHENG Xiuhua1,2,WANG Xiao2*,CHEN Yanping3
(1.ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;2.KeyLaboratoryofTCMQualityControlTechnology,ShandongAnalysisandTestCenter,Jinan250014,China;3.YantaiEntry-ExitInspectionandQuarantineBureau,Yantai264000,China)
Objective:To separate and purify steroidal alkaloids from the crude extract ofVeratrumnigrumL.by HSCCC.Methods:Petroleum ether-ethyl acetate-methanol-water (5∶5∶3∶7,V/V) was used as the solvent system.Separation was performed at a rotating speed of 800 r·min-1.The flow rate was 2.0 mL·min-1and the detection wavelength was set at 280 nm.Results:2.1 mg veratroylzygadenine and 9.3 mg jervine were purified from 300 mg of the crude extract with the purity of 91.34% and 98.10% determined by HPLC,respectively.Conclusion:The method is simple,good reproducible and efficient which is suitable for the separation of steroidal alkaloids.
High-speed counter-current chromatography;VeratrumnigrumL.;steroidal alkaloids
国家自然基金(ZR2016YL006);山东省科技进步计划(2014GZX219003)
] 王晓,研究员,博士,硕士生导师,研究方向:天然产物研究与开发;Tel:(0531)82605319,E-mail:wangx@sdas.org
10.13313/j.issn.1673-4890.2017.5.011
2016-07-20)
*[
