人参致病菌拮抗菌株的筛选及鉴定△
2017-09-21邵天蔚丁万隆李勇
邵天蔚,丁万隆,李勇
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·中药农业·
人参致病菌拮抗菌株的筛选及鉴定△
邵天蔚,丁万隆,李勇*
(中国医学科学院 北京协和医学院 药用植物研究所,北京100193)
目的:筛选对人参黑斑菌、人参锈腐菌等人参致病菌有较好抑菌活性的微生物菌株,为人参病害生防防治提供参考依据。方法:采用平板稀释法从人参栽培土壤和菌剂产品中分离菌株;以人参致病菌为靶标,采用对峙培养法筛选拮抗菌;分别采用16S rDNA和28S rDNA序列分析方法鉴定细菌和真菌菌株的分类学地位。结果:共计从人参栽培土壤中分离到66株菌,其中菌株X对人参致病菌表现较好抑菌活性;从商品化菌剂中分离出17株菌,其中菌株QM、BM2、HZ3、GG、HC和DD对人参致病菌表现较好抑菌活性。经鉴定,菌株X为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),QM、BM2和HZ3为甲基营养型芽孢杆菌(B.methylotrophicus),GG为枯草芽孢杆菌(B.subtilis),HC为棘孢木霉(Trichodermaasperellum),DD为平展木霉(T.effusum)。结论:筛选出的7株拮抗菌对多种人参致病菌有较好抑菌活性,菌株X可用于生防菌剂开发,与菌株QM、BM2、HZ3、GG、HC和DD对应的商品化菌剂可用于人参病害防治。
人参;病害;拮抗菌;筛选;鉴定
人参PanaxginsengC.A.Mey.是五加科多年生宿根植物,我国传统名贵中药材。我国人参栽培面积居世界首位,吉林省长白山区作为我国人参主产区,年人参产量超过全国80%[1],出口量占世界总量60%,在世界人参产业中具有举足轻重的地位[2]。人参根部发病率平均约20%左右,重者高达70%以上,严重影响人参的产量和品质[3]。土传根病防治一直是人参生产中的难点问题。目前,人参病害防治仍主要依赖化学杀菌剂,长期使用不仅严重破坏自然生态环境,导致人参农药残留超标,也给人参用药安全带来重大安全隐患。
随着人们对中药材农药残留问题的认识日益深刻以及环保理念的逐渐深化,中药材病害生物防治逐渐被愈来愈多的人所认可[4-5]。针对中药材病害,筛选高效、稳定的生防菌株对中药材病害防治具有重要意义。本研究以人参常见病害为靶标,从人参根围土和市售菌剂中筛选对人参致病菌具有较好抑菌活性的菌株,借助16S rDNA或28S rDNA序列分析对菌株进行分类学鉴定,本研究结果对开展菌株抑菌机理研究以及菌剂产品合理应用等均具有很好的指导作用。
1 材料与方法
1.1材料
1.1.1供试菌株和土壤 人参锈腐菌Cylindrocarpondestructans、人参黑斑菌Alternariapanax、人参根腐菌Fusariumsolani、人参灰霉菌Botrytiscinerea由本课题组保存。土壤样品于2015年7月采自吉林省靖宇县水库屯试验地、板石参场、镇郊参场和药用植物研究所内试验田的人参栽培土壤。商品化菌剂及其生产厂家如表1所示。
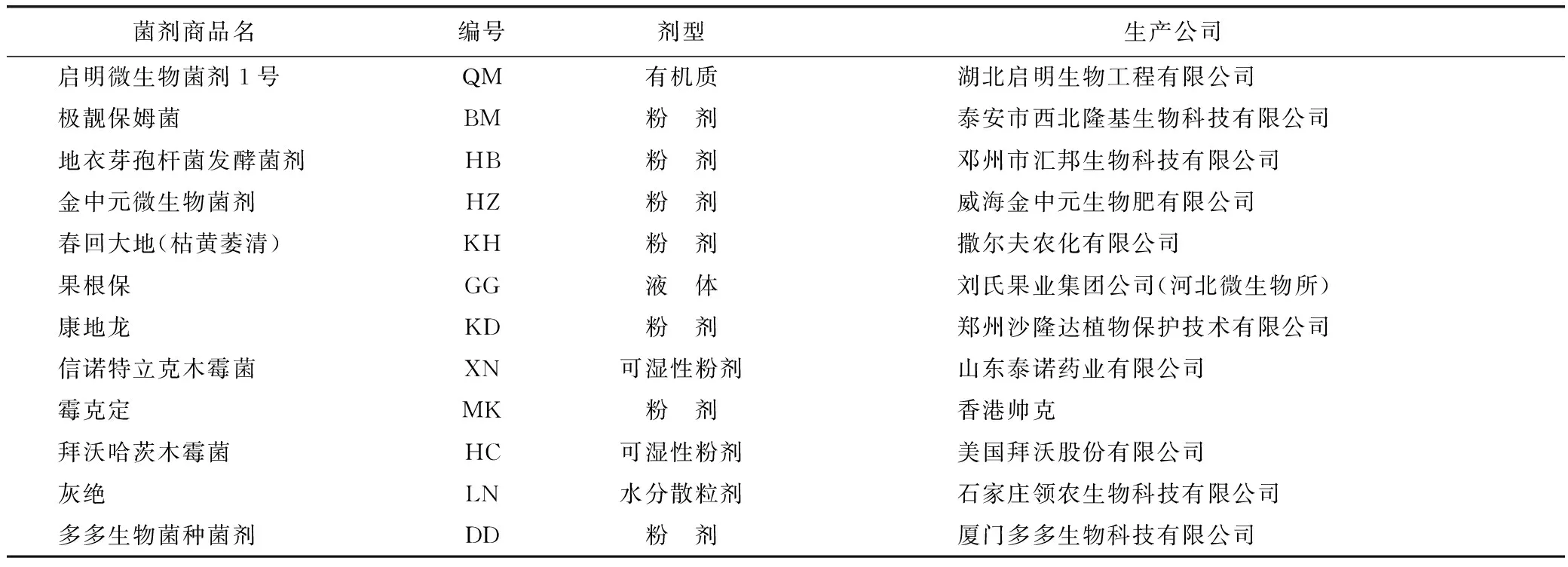
表1 微生物菌剂来源
1.1.2 培养基 PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15~20 g、水1000 mL,pH 7.0;NA培养基:牛肉膏3 g、蛋白胨5 g、NaCl 5 g、琼脂20 g、水1000 mL、pH 7.4~7.6;LB培养基:蛋白胨10 g,NaCl 10 g,酵母粉5 g,琼脂10~15 g,蒸馏水1000 mL,pH 7.0。
1.2方法
1.2.1菌株分离、纯化与保存 采用梯度稀释法分离土壤样品中的微生物菌株。采回土样编号分组,风干后过20目筛,分别称取10g置于三角瓶中,加入90mL无菌水及玻璃珠振荡10~30min得到土壤样品悬液。1mL悬浊液,加入9mL无菌水后40℃热浴20min,得菌悬液。取1mL菌悬液体,梯度稀释10-3、10-4、10-5,分别取100μL,均匀涂布在NA培养基表面,3次重复。28℃恒温培养2~3d,挑取性状差异明显的单菌落进行编号,划线法纯化培养,4℃保藏,备用。拮抗细菌分离采用LB培养基,35℃暗培养3~5d,拮抗木霉菌分离采用PDA培养基,25℃暗培养5~7d,分离得到的拮抗菌株纯化后,4℃保存。
1.2.2抑菌活性筛选 以四种人参致病菌为靶标,采用对峙培养法筛选拮抗菌株。将预先培养好的人参致病菌菌饼置于PDA培养基中心,四周距平板边缘1cm处对称接种拮抗菌株,每种处理3~5次重复。28℃暗培养5~7d,观察,记录对照及处理组人参致病菌菌落直径。
1.2.3抗菌株的鉴定 采用16SrDNA序列分析方法鉴定所得细菌菌株。取适量细菌至无菌水中,充分震荡成细菌悬浊液,用引物fD1(5’-AGAGTTTGATCCTGGCTCAG-3’)和rP1(5’-ACGGTTACCTTGTTACGACTT-3′)扩增细菌16SrDNA。扩增体系25μL,包括:10×PCRBuffer(100mmol·L-1Tris,500mmol·L-1KCl,20mmol·L-1Mg2+,pH8.3)2.5μL,dNTP(2.5mmol·L-1)1μL,引物各1μL,TaqDNA聚合酶(2.5U·μL-1)1μL,模板DNA(菌悬液)1μL,重蒸水补足25μL。扩增程序:94℃预变性5min;94℃变性1min,55℃退火1min,72℃延伸1min,30次循环,72℃延伸10min。扩增产物用1%琼脂糖凝胶电泳检测。FungalDNAKit(OMEGA)用于真菌基因组提取,通用引物NL-1(5’-GCATATCAATAAGCGGAG-3’)和NL-4(5’-GGTCCGTGTTTCAAGACGG-3’)用于真菌菌株28SrDNA序列扩增。扩增体系25μL,包括:2×PCRPremixTaqTM(Verdion2.0TakaRa)12.5μL,ddH2O5.5μL,DNA模板5μL,NL-1和NL-4各1μL。PCR程序:95℃预变性5min,94℃变性1min,52℃退火30s,72延伸1min,32次循环,72℃延伸10min。PCR产物用1%琼脂糖凝胶电泳检测。
PCR产物送三博远志公司测序,测得序列与GenBank数据库进行BLAST分析,MEGA6.0软件分析序列同源性,以Neighbor-joining方法构建系统发育树,Bootstrap(1000次重复)进行检验。
1.3数据分析
用Excel2010对统计数据进行计算和制作图表。
2 结果与分析
2.1拮抗菌株分离、纯化
共计从人参栽培土和菌剂产品中分离到83株菌。由人参栽培土壤分离到66株,从商品化菌剂中分离到17株(表2)。
2.2拮抗菌株筛选
研究发现,对人参致病菌有抑菌活性的菌株共计13株。其中,对人参黑斑菌有抑菌作用的菌株13株,占拮抗菌总株数的100%;对人参锈腐菌有抑菌作用的菌株9株,占拮抗菌总株数的69.23%;对人参根腐菌有抑菌作用的菌株8株,占拮抗菌总株数的61.54%;对人参灰霉菌有抑菌作用的菌株7株,占拮抗菌总株数的53.85%(表3)。

表2 分离所得菌株编号与数目
在上述13株具有抑菌效果的微生物菌株中,QM、BM2、HZ3、GG、X、HC和DD对4种供试人参致病菌均有较好的抑菌活性(表4)。
2.3拮抗菌株鉴定
5株拮抗细菌同源性分析结果表明,菌株QM、BM2、HZ3与甲基营养型芽孢杆菌B.methylotrophicus(KC790324,JF460743)的序列同源性最高(99%),它们位于系统发育树同一分支上(图1),综合同源性比对结果,QM、BM2、HZ3属于甲基营养型芽孢杆菌B.methylotrophicus。菌株GG与枯草芽孢杆菌B.subtilis(AB924083)的序列同源性达99%,二者位于系统发育树同一分支上(图1)。综合同源性比对结果,GG属于枯草芽孢杆菌B.subtilis。菌株X与解淀粉芽孢杆菌B.amyloliquefaciens(HQ003407)的同源性达99%,二者位于系统发育树同一分支上(图1)。综合同源性比对结果,X应属于解淀粉芽孢杆菌B.amyloliquefaciens。

表3 分离菌株的抑菌活性
注:+.菌株对病原菌具有抑菌效果;-.菌株对病原菌无抑菌作用。
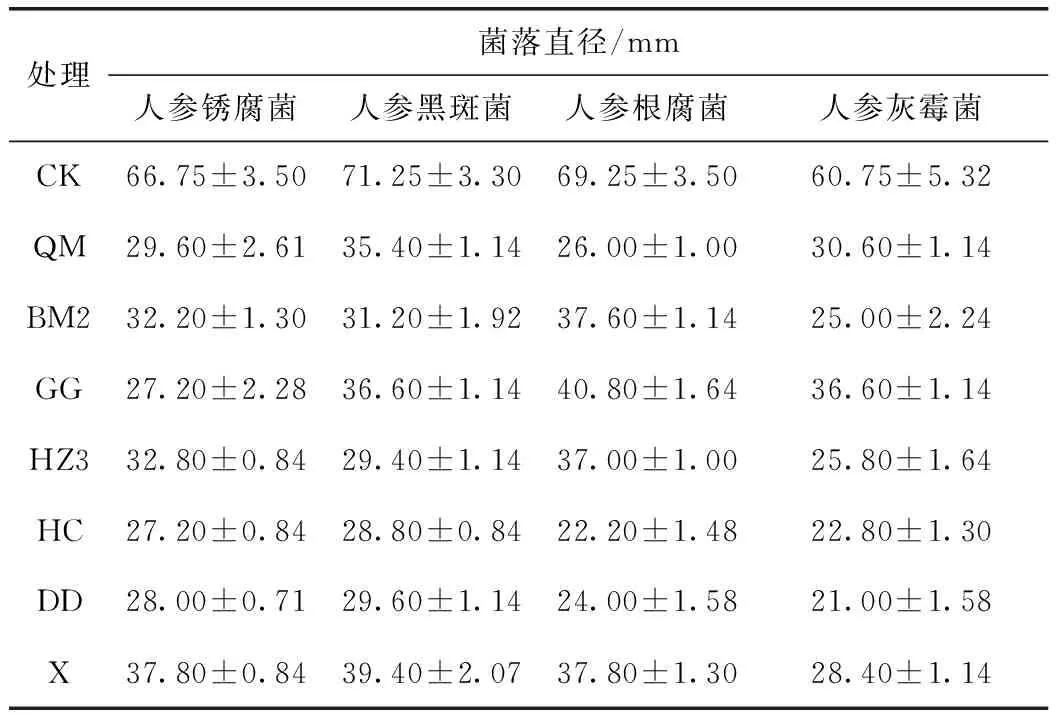
表4 7株分离菌对人参致病菌生长的抑制情况
2株拮抗真菌同源性分析结果表明,菌株HC与棘孢木霉T.asperellum(KF723005)的序列同源性达99%,它们位于系统发育树同一分支上(图2)。综合同源性比对结果和HC与棘孢木霉在发育系统中的位置,该菌应属于棘孢木霉T.asperellum。菌株DD与平展木霉T.effusum(KC171306)序列同源性达99%,二者位于系统发育树同一分支上(图2)。综合同源性比对结果和DD与平展木霉在发育系统中的位置,该菌应属于平展木霉T.effusum。
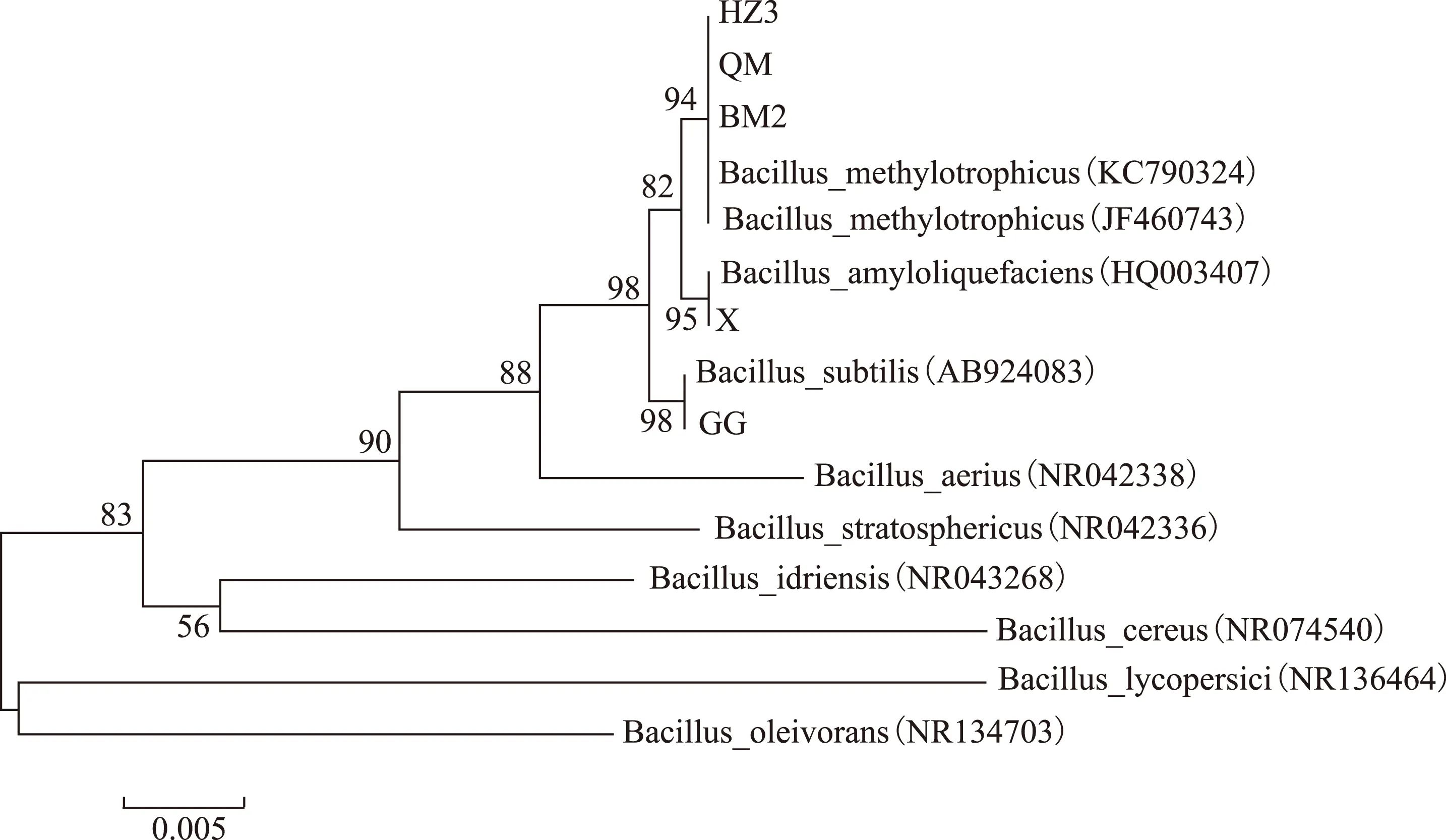
图1 细菌菌株QM、GG、BM2、HZ3和X系统发育树

图2 真菌菌株的系统发育树
3 讨论
芽孢杆菌属是普遍用于防治植物病害的菌属,具有抗逆性强、耐高温、易贮存、对人畜无毒害、环境友好等优点,是较为理想的生防微生物资源[6]。研究表明,芽孢杆菌对人参锈腐菌和人参黑斑菌抑菌效果明显且防治效果稳定[7-8]。甲基营养型芽孢杆菌是2011年才被鉴定的新种[9],刘利强等[10]利用该菌种防治黄瓜灰霉病。枯草芽孢杆菌和解淀粉芽孢杆菌作为芽孢杆菌属的重要成员,在防治传统农业产品病害的同时,也逐渐用于人参病害生物防治。胡陈云等[11]分离出的枯草芽孢杆菌分泌的抑菌脂肽能够导致人参黑斑菌和人参锈腐菌菌丝体的形态异常和发育畸形;贾斌等[12]利用解淀粉芽孢杆菌拮抗人参黑斑病菌,抑菌率达到80%。本实验筛选出的5株拮抗细菌均为芽孢杆菌。实验结果表明,人参病原菌与拮抗细菌对峙培养时抑菌带明显,推测可能是拮抗细菌生成的次生代谢产物及几丁质酶、纤维素酶、葡聚糖酶等降解酶类对病原菌生长产生的抑制作用。
应用于植物病害防治的生防真菌主要有木霉(Trichodermaspp.)、小盾壳霉(Conithyriumminitans)和链霉菌(Streptomycetaceae)等。据已有研究报道,木霉对人参锈腐菌等引发的人参根部病害有较好的防治效果[13]。丁万隆等[14]研究发现,木霉菌剂可显著降低西洋参立枯病的发病率。本实验结果表明,人参病原菌受到木霉菌抑制后有明显的生长停滞甚至萎缩现象,据已知木霉菌生防机制,推测可能是木霉菌生长速度快,对病原菌形成营养和空间的双重竞争,使病原菌因缺乏营养和空间而萎缩;另外也可能是木霉对病菌菌丝得重寄生作用,导致病菌菌丝生长的抑制作用。
对于本实验筛选出的7株拮抗菌对四种人参致病菌均有较强的抑菌活性,证明其在人参病害生物防治领域有较大的应用潜力。后续将深入探索上述菌株对人参致病菌的抑菌作用机理,结合田间病害防效测定,为人参病害生物防治提供科学依据。
[1] 杨利民,陈长宝,王秀全,等.长白山区参后地生态恢复与再利用模式及其存在的问题[J].吉林农业大学学报,2004,26(5):546-549.
[2] 安美花,安金花.人参研究进展[J].宁夏农林科技,2010,53(6):79-80.
[3] 李玉.农业植物病理学[M].长春:吉林科学技术出版社,1992.
[4] Hojin R,Hoon P,Dong S S,et al.Biological control ofColletotrichumpanacicolaonPanaxginsengbyBacillussubtilisHK-CSM-1[J].Journal of Ginseng Research,2014,38(3):215-219.
[5] Jiang CM,Shi JL,Liu YL,et al.Inhibition ofAspergilluscarbonariusand fungal contamination in table grapes usingBacillussubtilis[J].Food Control,2014,35(1):41-48.
[6] 刘秀花.芽孢杆菌生物学及其应用[M].郑州:河南大学出版社,2007:1-6.
[7] 李勇,赵东岳,丁万隆,等.人参内生细菌的分离及生防菌株的筛选[J].中国中药杂志,2012,37(11):1532-1535.
[8] 刘敏.人参内生细菌ge15抑菌机理及病害防治效果评价研究[D].北京:北京协和医学院,2014.
[9] Madhaiyan M,Poonguzhali S,Lee J S,et al.Bacillusrhizosphaeraesp.nov.,an novel diazotrophic bacterium isolated from sugarcane rhizosphere soil[J].Antonie van Leeuwenhoek,2011,100(3):437-444.
[10]刘利强,杨士玲,陈强,等.30亿个/g甲基营养型芽孢杆菌可湿性粉剂防治黄瓜灰霉病田间药效试验[J].现代农业科技,2014(9):130-133.
[11]胡陈云,李勇,刘敏,等.枯草芽孢杆菌ge25对两种人参病原菌的抑制作用及脂肽类抑菌代谢产物的鉴定[J].中国生物防治学报,2015,31(3):386-393.
[12]贾斌,赵贞丽,沈国娟,等.人参黑斑病生防用内生拮抗菌分离鉴定及发酵浓缩液的性质[J].中国森林病虫,2014,33(3):5-10.
[13]强薇,郭帅,张爱华,等.人参根际土壤中生防人参病害微生物的筛选[J].华南农业大学学报,2014,35(5):76-81.
[14]丁万隆,程惠珍,陈君.应用木霉制剂防治几种药用植物病害的研究[J].中国中药杂志,2003,28(1):28-31.
ScreeningandIdentificationofAntagonisticStrainsagainstPhytopathogensofPanaxginseng
SHAO Tianwei, DING Wanlong, LI Yong*
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100193,China)
Objective:To screen strains that having antagonistic activity againstCylindrocarpondestructans,Alternariapanaxetc.,providing references for biocontrol of soilborne diseases prevailing inP.ginseng.Methods:Strains were separated from ginseng-cultivating soils and commercial microbial agents by the plate dilution method.Confronting culture method was used to screen antagonistic strains against pathogens ofP.ginseng.Antagonistic agents were identified by 16S and 28S ribosomal DNA sequencing.Results:In total,66 stains were isolated from ginseng cultivating soil.Among them,strain X shown significant antagonistic activity against pathogens ofP.ginseng.Another 17 stains were isolated from commercial microbial pesticides,in which strains QM,BM2,HZ3,GG,HC and DD had antagonistic activity against pathogens ofP.ginseng.Homology results showed that,strain X was identified asB.amyloliquefaciens,QM,BM2 and HZ3 wasBacillusmethylotrophicus,GG wasB.subtilis,HC wasTrichodermaasperellumand DD wasT.effusum.Conclusion:Seven strains having antagonistic activity against pathogens ofP.ginsengwere identified.Strain X can be used to develop microbial pesticide,while commercial agents corresponding to QM,BM2,HZ3,GG,HC and DD can be used directly to control soil-borne diseases ofP.ginseng.
Panaxginseng;diseases;antagonists;screen;identification
中医药行业科研专项(201407005);中国医学科学院医学与健康科技创新工程(2016-I2M-3-017)
] 李勇,研究员,研究方向:药用植物病害生物防治技术研究;E-mail:liyong@implad.ac.cn
10.13313/j.issn.1673-4890.2017.5.020
2016-11-22)
*[
