三种根类药材上污染真菌的分离方法优化△
2017-09-21苏春燕魏江春胡永建罗毅高微微
苏春燕,魏江春,,胡永建,,罗毅,高微微*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.沈阳药科大学 中药学院,辽宁 沈阳 110016;3.河南省农业科学院 农业质量标准与检测技术研究所,河南 郑州 450002)
·中药农业·
三种根类药材上污染真菌的分离方法优化△
苏春燕1,魏江春1,2,胡永建1,3,罗毅1,高微微1*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京100193;2.沈阳药科大学 中药学院,辽宁 沈阳110016;3.河南省农业科学院 农业质量标准与检测技术研究所,河南 郑州450002)
目的:优化药材上主要污染真菌的分离方法,并分析三七、柴胡和党参的污染真菌情况。方法:采用L9(34)正交实验方法结合稀释平板法考察药材种类(A)、摇床转速(B)、振摇时间(C)和培养基种类(D)对真菌总数、曲霉菌和青霉菌分离效果的影响,曲霉菌和青霉菌根据形态进行鉴定。超高效液相色谱-质谱联用方法(UPLC-MS/MS)检测三种药材上黄曲霉毒素(AFs)的污染情况。结果:药材上真菌总数和曲霉菌的最优分离条件为转速130r·min-1,振摇时间15min,YES培养基;青霉菌的最优分离条件为转速160r·min-1,振摇时间30min,PDA培养基。党参上的真菌总数高于三七和柴胡,三种药材上曲霉菌数均高于青霉菌数。柴胡上检测到黄曲霉毒素B1的含量为4.54μg·kg-1,三七和党参上未检出AFs。结论:分离条件对分离结果有一定影响,三种药材上曲霉属真菌的污染值得重视。
三七;柴胡;党参;真菌总数;曲霉;青霉;正交实验
中药材在生产、加工和储藏过程中容易受到真菌污染出现发霉的现象,从而影响药材质量,霉菌中的曲霉属(Aspergillus)和青霉属(Penicillium)中的一些种可以产生黄曲霉毒素(AFs)、赭曲霉毒素、展青霉素、桔霉素等真菌(霉菌)毒素[1-2],进而影响中药材的安全。
菌株分离是污染真菌研究中的第一个环节,在以往文献报道中,中药材表面真菌的分离多参考粮食、坚果等振摇式分离结合稀释平板培养的方法,采用摇床转速从60 r·min-1到130 r·min-1不等[3-4],振摇时间从3 min到30 min不等[3,5-7],选用的培养基也有所不同[8-10],尚没有统一的标准。本文采用正交实验设计,分析不同的分离条件对药材表面污染真菌,特别是青霉属和曲霉属真菌分离效果的影响,旨在建立根类药材表面真菌的适宜分离方法,为药材上产毒真菌及后续的真菌毒素研究提供方法学支持。
1 材料与方法
1.1供试药材
三七和柴胡饮片,购自河北安国市药材交易大厅,贮藏时间为2年;党参药材于购自湖北板桥县党参种植基地的药材仓库,贮藏时间1年。3种药材各购买1kg,用无菌密封袋独立密封,放置于室温下,1周内完成分离及检测。
1.2正交实验设计
采用L9(34)正交实验,设计药材种类(A)、转速(B)、处理时间(C)和分离培养基(D)4个因素,每个因素各设3个水平,制定因素水平表(表1),以真菌总数,曲霉属和青霉属真菌数为指标,确定药材上污染真菌的最佳分离方法。

表1 正交实验因素水平表L9(34)
1.3培养基
PDA培养基(200g土豆,20g葡萄糖,15g琼脂,1000mL蒸馏水),MEA培养基(20g麦芽浸粉,20g葡萄糖,1g蛋白胨,15g琼脂,1000mL蒸馏水),酵母蔗糖培养基(YES)(20g酵母浸粉,150g蔗糖,0.5gMgSO4·7H2O,20g琼脂,1000mL蒸馏水),于121℃灭菌30min。
1.4真菌分离及培养
采用稀释平板法进行污染菌分离。将每种药材充分混匀,称取10g药材,加入含90mL无菌水的三角瓶中,放置到摇床(ZWY-240,上海智城分析仪器制造有限公司)上,按正交实验设计进行不同转速和不同振摇时间处理。振摇结束后静置5min,将上清液进行10倍梯度稀释,至浓度为10-4。分别取原液和各浓度稀释液1mL,接种于不同培养基上,每个浓度设5个重复。接种后的平板于25℃恒温培养3d。选择每个平板上的菌落数在10~60个范围的浓度用于菌落计数。
1.5真菌形态学鉴定
将纯化的菌株,接种于MEA培养基上,25℃培养7d,观察菌落形态和显微形态,参考《中国真菌志》[11-12],鉴定曲霉属和青霉属真菌,并分别记录各自菌落数。
1.6黄曲霉毒素(AFs)提取及含量测定
药材样品于50℃烘干至恒重,粉碎。精密称取10g药材粉末,加入50mL85%甲醇,超声提取30min,抽滤,滤液用氮气吹干,残渣用2mL甲醇溶解,于6000r·min-1离心5min,所得上清溶液用水定容到5mL后过C18柱净化,洗脱液用氮气吹干,残渣溶解至1mL甲醇中,用0.22μm尼龙滤膜过滤,注入超高效液相色谱-质谱联用仪(UPLC-MS/MS)检测AFs的含量。UPLC-MS/MS采用ShimadzuLC20ADXR液相色谱仪(日本岛津公司)串联5500QTRAP质谱仪(美国ABSciex公司)。色谱柱采用ZORBAXElipseC18反相柱(50mm×2.1mm,1.8μm,美国安捷伦科技有限公司),流动相为(A)0.1%甲酸+5mmol·L-1乙酸铵水溶液-(B)0.1%甲酸乙腈,洗脱梯度为0.00~4.00min(70%~20%B);4.00~5.00min(20%~70%B);5.00~6.00min(70%B),流速0.2mL·min-1,柱温30℃,进样量5μL。质谱条件为正离子模式,电喷雾离子源(ESI);扫描方式为多反应监测(MRM);电喷雾电压5500V;离子源温度550℃。用于定量AFs分子的离子对信息:AFB1为m/z313.0~285.1,m/z313.0~241.3,m/z313.0~185.1;AFB2为m/z315.0~259.0,m/z315.0~287.0,m/z315.0~243.0;AFG1为m/z329.0~243.0,m/z329.0~311.0,m/z329.0~283.0;AFG2为m/z331.0~235.1,m/z331.0~257.0,m/z331.0~189.0[8]。
2 结果与分析
2.1分离方法的优化结果
正交实验结果表明,4个因素对污染真菌的分离效果有较大影响。对于真菌总数,极差值(R1)A>B>C>D,说明药材种类(A)是影响真菌总数的决定因素,即不同药材受污染的程度有较大差异;摇床转速(B)次之,再次为振摇时间(C),培养基(D)的影响最小(表2)。对于曲霉菌数,极差值(R2)D>C>A>B,表明培养基种类和振摇时间的影响大于药材种类和转速(表2)。对于青霉菌数,极差值(R3)A>D>C>B,表明药材种类是主要因素,培养基种类次之,转速和振摇时间的影响较小(表2)。综合分析,确定分离药材上总真菌和曲霉的最佳分离方法为B2C1D3,即转速为130r·min-1,振摇时间为15min,培养基为YES。青霉的最佳分离方法为B3C2D1,即转速为160r·min-1,振摇时间为30min,培养基为PDA。方差分析表明4个因素的影响均不显著(表3)。
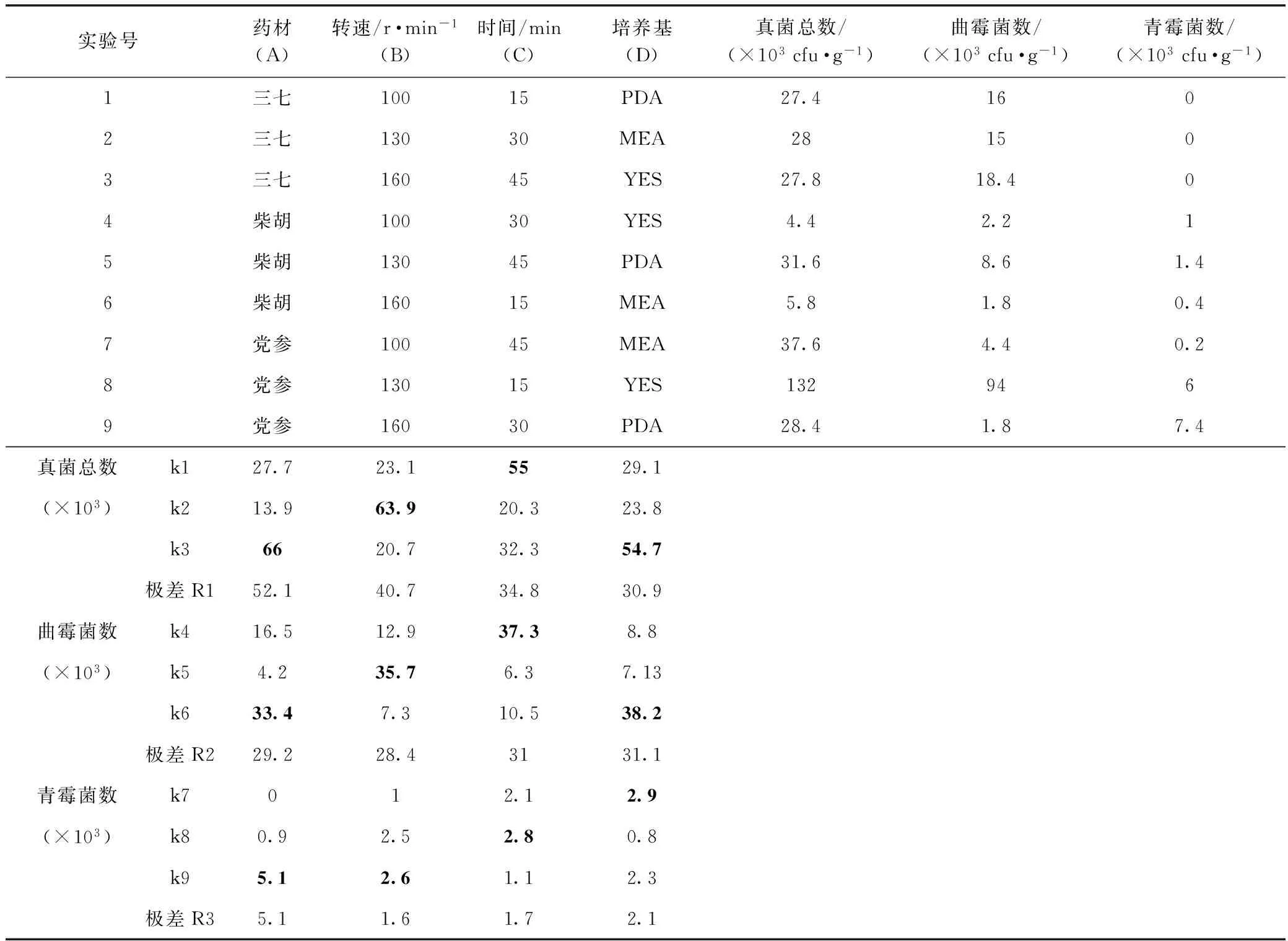
表2 正交实验结果
2.2三种药材的污染真菌对比
从三七,柴胡和党参三种药材样品上均分离到真菌,真菌污染率为100%(表2),所有样品上的真菌总数均大于103cfu·g-1。党参上的真菌总数多于三七和柴胡。柴胡和党参上均分离到了曲霉属和青霉属真菌,且不同处理方法得到的曲霉菌数大于青霉菌数;从三七样品上只分离到曲霉属真菌(表2)。
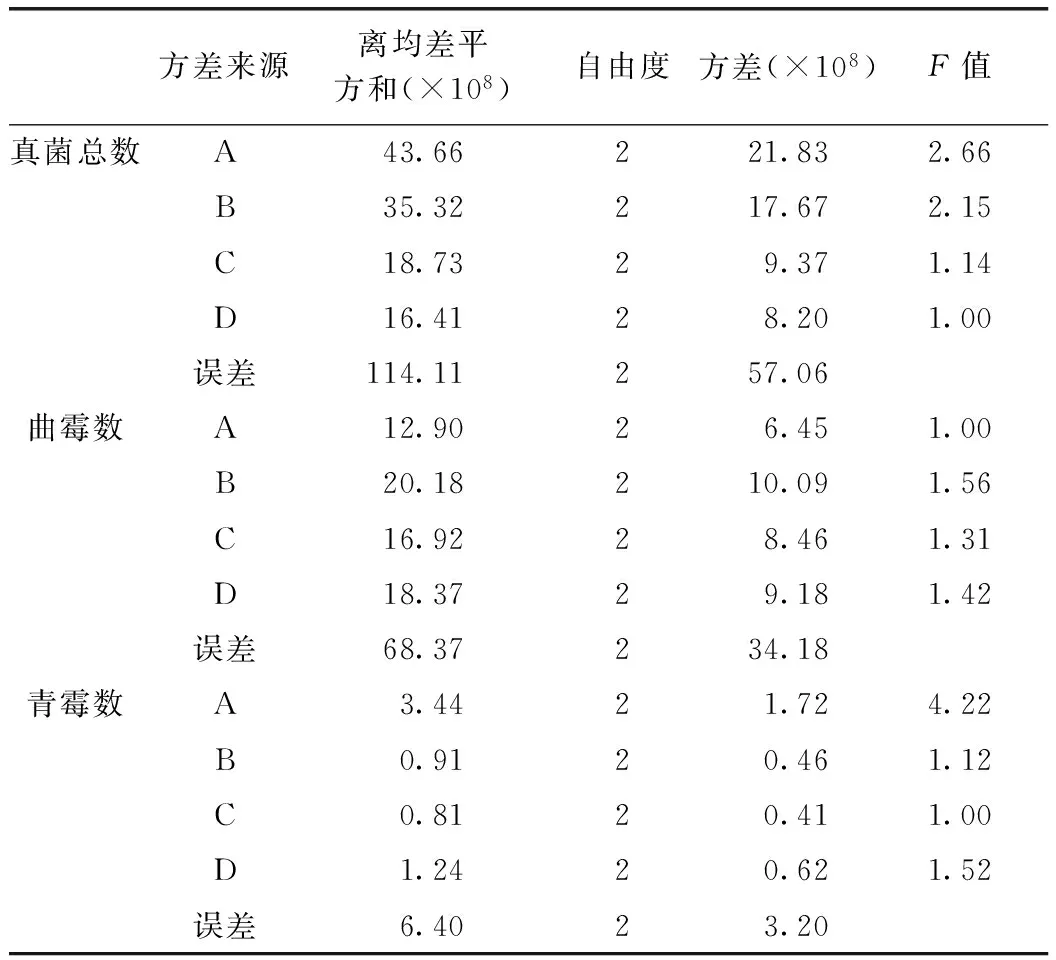
表3 正交实验方差分析结果
注:F(2,2)=19.0。
2.3分离方法对3种药材分离结果的影响
将柴胡的3个处理组(4、5、6)进行对比,真菌总数、曲霉菌数和青霉菌数在不同处理组间的差异较大(表2),说明柴胡上的真菌分离结果受分离方法的影响较大;党参的情况也类似。然而三七的不同处理组间分离到的真菌总数和曲霉菌数差异较小,说明分离方法对三七表面真菌分离的结果影响较小。可能是三七表面较光滑,且质地坚硬,真菌孢子一般被局限在药材表面,且容易脱落,摇床转速和振摇时间的改变对污染真菌的分离效果影响较小。
2.4三种药材上AFs的含量
从柴胡样品上检测到黄曲霉毒素B1(AFB1),含量为4.54μg·kg-1,未检测到黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)和黄曲霉毒素G2(AFG2);三七和党参样品上均未检出以上4种毒素。
3 讨论
根类药材饮片一般表面粗糙,结构上木质纤维多,有较大的间隙,附着的真菌孢子往往不容易被分离。本实验选择三七、柴胡和党参等3种表面及内部结构不同的根类药材,采用正交实验的方法,优化药材上污染真菌的分离条件,并考察药材上真菌污染情况。实验结果表明,针对真菌总数、曲霉菌数和青霉菌数,各因素对分离结果的影响大小顺序不同。对于真菌总数和青霉菌来说,药材种类为主要影响因素,说明污染真菌受寄主影响较大;对于曲霉菌来说,培养基种类为主要因素,说明曲霉属真菌对营养条件的要求更为严格,张初署等[13]报道黄曲霉在高盐分的培养基上生长旺盛,YES培养基因具有高糖和高盐的特点,可能是中药材上曲霉属真菌比较好的分离培养基。另外,实验结果表明,转速及振摇时间并不是越长越好,两者的增加可能会因为加大了真菌孢子与药材和三角瓶壁的碰撞力度,造成孢子细胞被破坏而丧失活力。
分析三种药材上真菌污染情况,党参的三个处理得到的真菌总数最多,这可能跟药材来源于湖北,经过夏季高温高湿的贮藏条件及质地有关。本文中三七上的优势属为曲霉属,宋美芳等[14]报道三七在西双版纳储藏6个月后的优势属为拟青霉属(Paecilomyces);王文丽等[5]从党参上只分离到一株散囊属真菌(Eurotium)和一株青霉属真菌;以上文献中的结果与本实验结果不同,可能与药材的采集地,及贮藏的条件不同有关。柴胡上污染真菌的情况以往未见报道。
三种药材的毒素测定结果表明,仅柴胡上检测到含AFB1(4.54μg·kg-1),以往也有研究者[15-16]检测到柴胡上有AFB1污染,且污染水平大于10μg·kg-1,本文在三七上未检测到AFs,与郑荣等[17]的结果一致;在党参上未检测到AFs污染,与郝爱鱼等[18]的结果一致,而谭婧等[19]曾检测到党参上有AFG2的污染,达到为471μg·kg-1。结合药材上真菌污染情况,虽然党参上真菌总数和曲霉菌数较多,却没有检测到AFs,原因是AFs主要来源于曲霉属中的黄曲霉(Aspergillusflavus)和寄生曲霉(Aspergillusparasiticus),而本实验对分离的真菌没有鉴定到种,党参上分离得到的曲霉菌可能不是产毒菌,但不排除产毒菌的存在。柴胡上的AFs污染需要引起重视,应该加强产毒菌的相关研究。在接下来的工作中,需要对得到真菌做进一步种水平上的鉴定。
[1] Varga J,Baranyi N,Chandrasekaran M,et al.Mycotoxin producers in theAspergillusgenus:an update[J].Acta Biologica Szegediensis,2015,59(2):151-167.
[2] Frisvad J C,Smedsgaard J,Larsen T O,et al.Mycotoxins,drugs and other extrolites produced by species inPenicilliumsubgenusPenicillium[J].Stud Mycol,2004,49:201-241.
[3] 宋美芳,陈娟,李学兰,等.云南地区三七和草果上真菌污染的初步分析[J].中国中药杂志,2012,37(12):1734-1737.
[4] Vitullo M,Ripabelli G,Fanelli I,et al.Microbiological and toxicological quality of dried herbs[J].Lett Appl Microbiol,2011,52(6):573-580.
[5] 王文丽,徐晖,陈慧芝,等.15种中药材表面污染真菌的分离与分子鉴定[J].中国中药杂志,2013,38(12):1910-1914.
[6] Hashem M,AlamriS.Contamination of common spices in Saudi Arabia markets with potential mycotoxin-producing fungi[J].Saudi J Boil Sci,2010,17(2):167-175.
[7] Singh P,Srivastava B,Kumar A,et al.Fungal contamination of raw materials of some herbal drugs and recommendation ofCinnamomumcamphoraoil as herbal fungitoxicant[J].Microbial Ecol,2008,56(3):555-560.
[8] Chen A J,Jiao X,Hu Y,et al.Mycobiota and mycotoxins in traditional medicinal seeds from China[J].Toxins,2015,7(10):3858-3875.
[9] Ahmad B,Ashiq S,Hussain A,et al.Evaluation of mycotoxins,mycobiota,and toxigenic fungi in selected medicinal plants of Khyber Pakhtunkhwa,Pakistan[J].Fungal Biol,2014,118(9):776-784.
[10]Zheng R,Wang W,Tan J,et al.An investigation of fungal contamination on the surface of medicinal herbs in China[J].Chin Med,2017,12(1):1-8.
[11]齐祖同.中国真菌志·曲霉属及其相关有性型:第5卷[M].北京:科学出版社,1997.
[12]孔华忠.中国真菌志·青霉属及其相关有性型属:第35卷[M].北京:科学出版社,2007.
[13]张初署,刘阳,邢福国,等.七种培养基对黄曲霉分离效果的比较[J].核农学报,2013,27(2):208-212.
[14]宋美芳,张忠廉,李学兰.3种云南主产中药材上污染真菌在贮藏过程中的变化[J].时珍国医国药,2015,26(4):955-957.
[15]李汶,庄学聪.ELISA法检测常用中药黄曲霉毒素B1[J].中国药事,2000,14(2):101-102.
[16]李延生,陈建民.ELISA试剂盒定量检测中药材和中成药的黄曲霉毒素B1[J].中草药,2000,31(8):586-587.
[17]郑荣,毛丹,王少敏,等.11种中药材中黄曲霉毒素 G2,G1,B2,B1的 HPLC 法测定[J].中国医药工业杂志,2010,41(5):368-372.
[18]郝爱鱼,赵丽元,刘英慧,等.HPLC 柱后光衍生荧光法测定中药饮片中黄曲霉毒素残留量[J].药物分析杂志,2012,32(12):2203-2207.
[19]谭婧,郑润生,王文丽,等.中药饮片中黄曲霉毒素和玉米赤霉烯酮的液质联用检测分析[J].时珍国医国药,2013,23(10):2469-2472.
OptimizationofIsolationMethodofContaminationFungionThreeRootMedicinalHerbs
SU Chunyan1,WEI Jiangchun1,2,HU Yongjian1,3,LUO Yi1,GAO Weiwei1*
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China;2.SchoolofTraditionalChineseMateriaMedica,ShenyangPharmaceuticalUniversity,Shenyang110001,China;3.InstituteofAgriculturalQualityStandardsandTestingTechnology,HenanAcademyofAgriculturalSciences,Zhengzhou450002,China)
Objective:To obtain the optimal condition of isolation method of contamination fungi from medicinal herbs,and compare the contaminated fungi onPanaxpseudoginseng,Astragalusmembranaceus,andCodonopsispilosula.Methods:According to the orthogonaltest L9(34),the effect of four factors including herb species (A),shaking speed (B),shaking time (C) and medium (D) on the fungal counts of total fungi,AspergillusandPenicilliumwere measured by using the dilution plating method.All isolates ofAspergillusandPenicilliumwere identified based on morphological criteria using macro- and micro-characters.The root samples were further tested for aflatoxins using UPLC-MS/MS.Results:The optimal isolation method for both total fungi andAspergilluswas 130 r·min-1of shaking speed,15 min of shaking time,and YES medium.The optimal isolation method forPenicilliumwas 160 r·min-1of shaking speed,30 min of shaking time,and PDA medium.The fungal count of total fungi onC.pilosulawas higher than that of the other two root medicinal herbs.Moreover,the fungal count ofAspergilluson three root medicinal herbs were higher than that ofPenicillium.With respect of aflatoxins occurrence,A.membranaceuswas contaminated with AFB1at concentration of 4.54 μg·kg-1,while no AFs were detected fromP.pseudoginsengandC.pilosula.Conclusion:The isolation method affected fungi isolation results.The contamination of three herbs withAspergillusshould be paid more attention.
Panaxpseudoginseng;Astragalusmembranaceus;Codonopsispilosula;fungal count;Aspergillus;Penicillium;orthogonal test
国家自然科学基金(81274071和81473345);国家中药标准化项目(ZYBZH-Y-JIN-34)
] 高微微,研究员,研究方向:中药质量与安全、中药资源生态、药用植物病理;Tel:(010)57833423,E-mail:wwgao411@sina.com
10.13313/j.issn.1673-4890.2017.5.019
2017-02-13)
*[
