长穗偃麦草EeHKT1;4基因的克隆与植物表达载体构建
2017-09-20李杉杉毛培春田小霞
张 琳,郭 强,李杉杉,毛培春,田小霞,孟 林
(北京市农林科学院,北京草业与环境研究发展中心,北京 100097)
长穗偃麦草EeHKT1;4基因的克隆与植物表达载体构建
张 琳,郭 强,李杉杉,毛培春,田小霞,孟 林
(北京市农林科学院,北京草业与环境研究发展中心,北京 100097)
采用RT-PCR方法从长穗偃麦草(Elytrigiaelongata)中克隆得到高亲和K+转运蛋白基因,命名为EeHKT1;4,全长cDNA序列为1 977 bp,开放阅读框1 722 bp,编码573个氨基酸,与一粒小麦(Triticummonococcum)TmHKT1;4-A2的氨基酸同源性为94%。系统进化树分析结果显示,EeHKT1;4与单子叶植物HKT1;4亲缘关系较近。利用In-Fusion技术,成功构建了pBI121-35S-EeHKT1;4-Nos植物表达载体,为长穗偃麦草EeHKT1;4的耐盐功能鉴定奠定基础。
长穗偃麦草;高亲和K+转运蛋白(HKT);In-Fusion技术;载体构建
长穗偃麦草(Elytrigiaelongata)又名长穗薄冰草,是禾本科偃麦草属小麦族(TriticeaeDumort)多年生根茎疏丛型草本植物,生境为海滨和盐碱草甸,具有较强的耐盐性。既是重要的优质牧草资源,又是防风固沙、水土保持、改良盐碱地的理想植物[1-2],同时是小麦(Triticumaestivum)的近缘种,可成为改良小麦不可缺少的野生基因库[3-5]。
高亲和性K+转运蛋白(High Affinity K+Transporter,HKT)是植物遭受盐胁迫伤害时,提高植物耐盐的关键[6-7]。Schachtman和Schroeder首次从小麦(Triticumaestivum)中克隆得到TaHKT2;1蛋白[7],随后相继在其他植物中也发现了HKT类蛋白[7-14]。根据异源表达结果将HKT转运蛋白分为家族I和家族II[15],其中HKT I类蛋白家族是Na+选择性的转运体,主要参与木质部Na+的卸载及韧皮部中Na+回流[16-18],以降低植物地上部Na+浓度,维持植株地上部K+的稳态,提高植物地上部的K+/Na+,避免植物叶片遭受盐胁迫的伤害[19]。HKT Ⅱ类蛋白家族,是K+/Na+共转运体,在K+、Na+选择性吸收中起重要的作用[6]。有研究表明,拟南芥(Arabidopsisthaliana)AtHKT1;1的作用是从植株叶木质部导管中将Na+卸载到其周围的薄壁细胞组织中,通过韧皮部再循环至根,降低叶片中Na+浓度[16]。水稻(Oryzasativa)OsHKT1;5的主要功能是从植株根木质部中卸载Na+,从而参与Na+的再循环[20]。一粒小麦(Triticummonococcum)TmHKT1;5主要参与根木质部中的Na+卸载,以降低植株地上部Na+的积累,从而维持较高的K+/Na+[21];TmHKT1;4能够从叶鞘和根木质部汁液中卸载Na+,从而防止叶片中的Na+积累至毒害水平[22]。
长穗偃麦草具有极强的抗逆性,蕴含丰富的抗逆性基因,又是小麦的近缘种,既可以改良盐碱地,又可以成为改良小麦的野生基因库。有研究报道,HKT1;4具有较强的耐盐性,与植物耐盐机制密切相关[6-7,25],为了深入了解长穗偃麦草EeHKT1;4的生物学特性和耐盐机制,采用RT-PCR方法从长穗偃麦草(Elytrigiaelongata)中克隆HKT蛋白基因cDNA,利用In-Fusion技术构建植物表达载体,通过PCR方法实现载体线性化,自由克隆基因,实现完美的无缝连接,成功构建EeHKT1;4植物表达载体,为继续深入研究其生物学特性和耐盐机制奠定科学基础和技术支持。
1 材料和方法
1.1试验材料
以4 周龄长穗偃麦草幼苗的鲜根为植物材料,种子采自北京市农林科学院小汤山草资源试验基地,感受态E.coliCompetent Cells DH5α购自TaKaRa公司,植物表达载体pBI121购自鼎国生物技术有限公司。
1.2主要试剂
TaKaRa Tks Gflex DNA Polymerase(货号:R060A),限制性内切酶,In-Fusion○RHD Cloning Kit(货号:639649)购自宝生物工程(大连)有限公司。SanPrep柱式DNA胶回收试剂盒(货号:B518131-0050),SanPrep柱式质粒DNA小量抽提试剂盒(货号:B518191-0050)等均购自生工生物工程(上海)股份有限公司。其他生化试剂均为进口或国产分析纯。
1.3试验方法
1.3.1 总RNA的提取与cDNA的合成 从4周龄长穗偃麦草幼苗的鲜根(经200 mmol/L NaCl处理24 h)中提取总RNA,参照TaKaRa总RNA提取试剂盒(货号:9769)操作。cDNA第1链的合成按照TaKaRa试剂盒(货号:6110A)操作进行。
1.3.2EeHKT1;4基因目的片段的获得 通过Primer 5软件设计特异引物ORF-F、ORF-R,采用PCR进行扩增长穗偃麦草EeHKT1;4基因,使用TaKaRa Tks Gflex DNA Polymerase,PCR反应程序为:94℃ 1 min;98℃ 10 s,55℃ 15 s,68℃ 1 min,30循环。使用1.2%琼脂糖凝胶检测PCR扩增产物,进行胶回收。将胶回收产物连接到pUCm-T载体上,转化到E.coliDH5α中,在含有50 μg/mL氨苄青霉素的LB固体培养基平板上进行蓝白斑筛选,挑取转化白斑菌株,经质粒PCR鉴定确认为阳性克隆后,送至上海生工测序。
引物信息:
ORF-F:5′-ACGGGGGACTCTAGAATGCAAC TCCCAAGTCATAA-3′
ORF-R:5′-AGGGACTGACCACCCGGGCTAA CTAAGCTTCCAGGTCC-3′
1.3.3 pBI121载体片段获得 将pBI121质粒进行XbaⅠ、SmaⅠ双酶切,酶切体系:pBI121 10 μL,10×T Buffer 5 μL,0.1% BSA 5 μL,XbaⅠ (10 U/μL) 1.5 μL,SmaI (10 U/μL) 1.5 μL,dH2O 27 μL,Total 50 μL。酶切条件为:37℃酶切4 h。使用1%凝胶电泳检测酶切产物,并回收载体片段,命名为pBI121 Vector。
1.3.4 重组载体获取 使用In-Fusion○R HD Cloning Kit试剂盒进行无缝连接。In-Fusion反应体系:5×In-Fusion HD Enzyme Premix 2 μL,pBI121 Vector 1 μL,EeHKT1;4 3 μL,dH2O 4 μL,Total 10 μL。In-Fusion反应条件:50℃孵育15 min,于冰上终止反应。命名为pBI121-35S-EeHKT1;4-Nos。
1.3.5 重组载体pBI121-35S-EeHKT1;4-Nos的转化 将重组载体pBI121-35S-EeHKT1;4-Nos转化到E.coliCompetent Cells DH5α中,将转化体涂布于含有Kan(50 mg/L)的LB培养基平板上,37℃过夜培养,挑选阳性菌株,PCR检测阳性菌株,以pBI121F1/5’HKT1;4WR1为引物,使用SanPrep柱式质粒DNA小量抽提试剂盒提取阳性菌株质粒,使用XbaⅠ、SmaⅠ对阳性菌株进行双酶切检测,以保证构建载体的准确性。
引物信息:
pBI121F1:5′-ATCTCCACTGACGTAAGG-3′
HKT1;4WR1:5′-GTCTCATCATCGGCGGTA GTCG-3′。
1.3.6 生物信息学分析 序列的比较、翻译和系统进化树分析分别在DNAMAN 6.0、Primer 5.0和MEGA 6.0软件上进行。
2 结果与分析
2.1EeHKT1;4基因目的片段获得
以长穗偃麦草幼苗根部mRNA为模板,使用ORF框引物,通过RT-PCR方法克隆EeHKT1;4,测序结果表明,得到含1 722 bp的EeHKT1;4开放阅读框(图1)。
2.2EeHKT;4基因生物信息学分析

图1 EeHKT1;4基因PCR片段Fig.1 PCR products of EeHKT1;4 fragment
克隆EeHKT1;4获得1 722 bp的开放阅读框,可以编码573个氨基酸,推测分子质量为62.92 ku,等电点为9.73。经多重序列比较表明,EeHKT1;4与其他植物HKT1氨基酸序列同源性达65%以上,其中与一粒小麦TmHKT1;4-A2、硬粒小麦TdHKT1;4-1的氨基酸同源性分别为94%、85%;特别是,长穗偃麦草EeHKT1;4氨基酸序列上存在编码P-loop A区域的一段保守序列LFFTAVSAATVSSMSTV,红色箭头所指的S(丝氨酸)为P-loop A区域特异选择性位点,与Na+转运功能相关(图2)。系统进化树分析发现,长穗偃麦草EeHKT1;4与单子叶植物HKT1;4亲缘关系较近,而与其他植物HKT2类蛋白亲缘关系较远(图3)。以上结果表明,EeHKT1;4编码高亲和性K+转运蛋白。

图2 长穗偃麦草EeHKT1;4与一粒小麦TmHKT1;4-A2、硬粒小麦TdHKT1;4-1氨基酸的多重比较Fig.2 Amino acid sequence alignment of EeHKT1;4 with those from TmHKT1;4-A2,TdHKT1;4-1注:箭头所指的S(丝氨酸)为P-loop A区域特异选择性位点
2.2线性载体pBI121获得
使用XbaⅠ与SmaⅠ双酶切植物真核表达载体pBI121,待双酶切反应结束后,用1%凝胶电泳检测酶切产物,获得pBI121线性载体(图4),大小14 745 bp的片段,将pBI121线性载体进行胶回收纯化。
2.3pBI121-35S-EeHKT1;4-Nos重组载体获得
根据In-Fusion无缝连接技术将EeHKT1;4基因片段与pBI121线性载体连接,得到pBI121-35S-EeHKT1;4-Nos重组载体,将重组载体转化到大肠杆菌E.coliCompetent Cells DH5α中,将得到的阳性菌株进行pBI121F1/5’HKT1;4WR1引物PCR检测以及XbaⅠ、SmaⅠ双酶切检测,PCR检测产物与双酶切产物如图2.5,2.6所示,经测序结果分析显示,该单克隆菌为带有EeHKT1;4目的基因的阳性克隆,证实已成功获取重组载体pBI121-35S-EeHKT1;4-Nos。
3 讨论
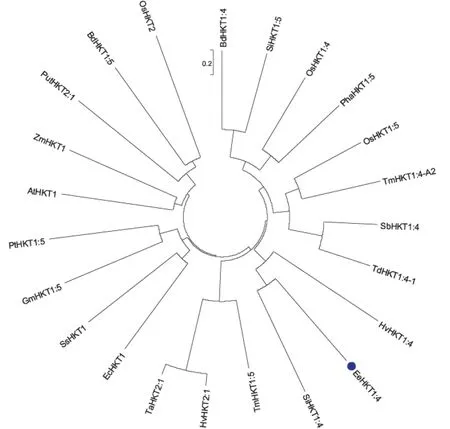
图3 EeHKT1;4与其他植物HKT1;4的系统进化树Fig.3 Phylogenetic tree of EeHKT1;4 and HKT 1;4 from other plants注:AtHKT1(拟南芥,Arabidopsis thaliana);BdHKT1;4、BdHKT1;5(二穗短柄草,Brachypodium distachyon);EcHKT1(桉树,Eucalyptus)EeHKT1;4(长穗偃麦草,Elytrigia elongata);GmHKT1;5(大豆,Glycine max);HvHKT1;4、HvHKT2;1(大麦,Hordeum vulgare);OsHKT1;4、OsHKT1;5、OsHKT2(水稻,Oryza sativa);PhaHKT1;5(芦苇,Phragmites australis);PtHKT1;5(毛果杨,Populus trichocarpa);PutHKT2;1(小花碱茅,Puccinellia tenuiflora);SbHKT1;4(高粱,Sorghum bicolor);SiHKT1;4、SiHKT1;5(小米,Setaria italica);SsHKT1(盐地碱蓬,Suaeda salsa);TaHKT2;1(小麦,Triticum aestivumLinn);TdHKT1;4-1(硬粒小麦,Triticum durum);TmHKT1;4-A2、TmHKT1;5(一粒小麦,Triticum monococcum);ZmHKT1(玉米,Zea mays)。
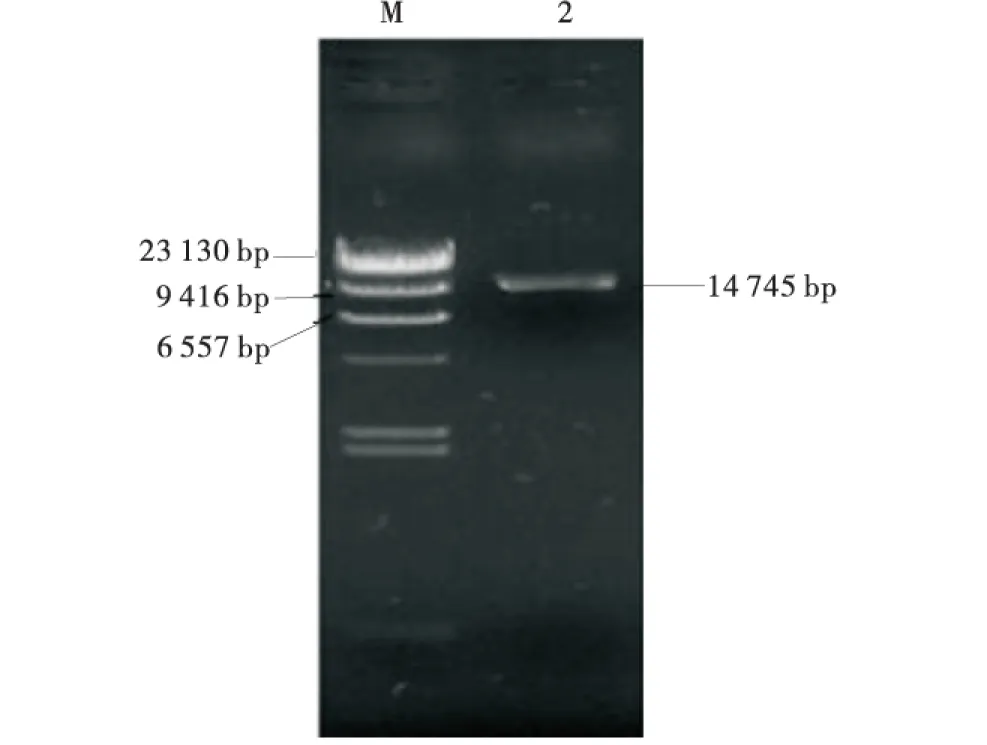
图4 pBI121载体酶切产物Fig.4 Enzyme-digested product of pBI121 vector

图5 pBI121-35S-EeHKT1;4-Nos载体PCR鉴定Fig.5 PCR identification of pBI121-35S-EeHKT1;4-Nos vector.Note: 3~6 : PCR products
随着土壤盐渍化日益加剧,盐胁迫给植物生长造成的伤害主要是Na+毒害[26-28]。在面临环境胁迫的条件下,植物通过限制Na+内流、Na+外排、Na+区域化等防御手段稳定植物细胞内较低浓度的Na+及高K+/Na+比以抵制Na+毒害,从而提高植物的耐盐性[16,20,29-37]。相关研究报道,HKT在植物耐盐中发挥着重要作用[6],其中HKT I类蛋白主要是Na+选择性转运候选基因,在植物体内主要参与木质部Na+的卸载以及韧皮部Na+的回流[17-18]。有研究表明,拟南芥AtHKT1;1通过木质部Na+卸载、韧皮部Na+向根部的回流,降低植物内部Na+浓度,以提高植物耐盐性[38]。小麦TaHKT1是高亲和K+/Na+同向转运载体[39],主要介导Na+内流,参与根部Na+的吸收,植物主要通过降低其表达量来限制Na+内流,从而降低植物体内Na+浓度[40]。硬粒小麦耐盐品系149由Nax1与Nax2通过调控木质部Na+外排来减少Na+从根部向地上部的运输,同时也可促进K+的吸收,另外Nax1 主要通过消除叶鞘(叶片末端)木质部中Na+的聚集,阻止Na+在叶片中过量积累[41]。一粒小麦中Nax1与Nax2的候选基因TmHKT1;4、TmHKT1;5通过木质部Na+外排,阻止Na+过量积累[42]。水稻OsHKT1;5主要在植物根中表达,是Na+的转运蛋白,主要特异性调节Na+的内流,可以从根的木质部中将过多的Na+卸载到周围薄壁细胞中,促进Na+的卸载,提高植株地上部组织中的K+/Na+[43-44]。经研究发现,OsHKT1;5的功能与AtHKT1;1的功能一致[16]。因此,HKT I类蛋白主要通过限制根部Na+的吸收,增加Na+外排,以维持植物体内,特别是地上部低的Na+浓度和高的K+/Na+比,是高等植物耐盐性的关键[45]。
此次研究从长穗偃麦草中克隆出EeHKT1;4基因,经多重序列比较发现,EeHKT1;4与其他植物HKT1;4核酸序列的同源性均在85%以上,而氨基酸序列的同源性则在80%以上,特别是与一粒小麦TmHKT1;4 氨基酸同源性高达94%。研究表明,HKT1类蛋白第1个P-loop区域含有一段高度保守片段(FFTAVSAATVSSMS),均具有一个丝氨酸离子选择性位点[46]。长穗偃麦草EeHKT1;4的P环结构中也存在LFFTAVSAATVSSMSTV片段,且有丝氨酸位点,系统进化树分析表明,EeHKT1;4主要与单子叶植物HKT1;4亲缘关系较近。这表明,EeHKT1;4是一个特异的Na+离子转运蛋白,可能将Na+从叶鞘组织及根木质部汁液中卸载,以防止植物光合组织中的Na+积累至毒害水平,从而在维持植株地上部K+、Na+稳态中发挥着重要的作用。
4 结论
长穗偃麦草是小麦的近缘种,经过长期的研究发现,其自身蕴含了丰富的耐盐基因,可作为小麦改良中的野生基因库,也是改良盐碱地的理想植物。研究利用In-Fusion技术成功构建了pBI121-35S-EeHKT1;4-Nos植物表达载体。为EeHKT1;4耐盐功能鉴定及遗传稳定性的评价奠定基础,进而揭示EeHKT1;4在长穗偃麦草Na+转运中的作用,这将对农作物和优良牧草的耐盐遗传改良提供理论依据和应用价值。
[1] 谷安琳.耐盐碱栽培牧草-长穗薄冰草[J].中国草地,2004,26(2):9.
[2] Guo Q,Meng L,Mao P C,etal.Salt tolerance in two tall wheatgrass species is associated with selective capacity for K+over Na+[J].Acta Physiol Plant,2015,37:1708.
[3] 孟林,毛培春,张晓燕,等.3份长穗偃麦草种质的体细胞核型分析[J].草地学报,2013,21(4):821-827.
[4] 马渐新,周荣华,董玉琛,等.来自长穗偃麦草的抗小麦条锈病基因的定位[J].科学通报,1999,44 (1):65-69.
[5] 郭强,孟林,毛培春,等.长穗偃麦草Actin基因片段克隆及表达模式分析[J].生物技术通报,2014(3):73-78.
[6] Pardo J M,Cubero B,Leidi E O,etal.Alkali cation exchangers:roles in cellular homeostasis and stress tolerance[J].Journal of Experimental Botany,2006,57(5):1181-1199.
[7] Schachtman D P,Schroeder J I.Structure and transport mechanism of a high-affinity potassium uptake transporter from higher plants[J].Nature,1994,370:655-658.
[8] Uozumi N,Kim E J,Rubio F,etal.The Arabidopsis HKT1gene homolog mediates inward Na+currents in Xenopus laevisoocytes and Na+uptake inSaccaromycescerevisiae[J].Plant Physiology,2000,122:1249-1259.
[9] Fairbairn D J,Liu W H,Schachtman D P,etal.Characterisation of two distinct HKT1-like potassium transporters from Eucalyptus camaldulensis[J].Plant Molecular Biology,2000,43:515-525.
[10] Horie T,Yoshida K,Nakayama H,etal.Two types of HKT transporters with different properties of Na+and K+transport inOryzasativa[J].The Plant Journal,2001,27(2):129-138.
[11] Su H,Balderas E,Vera-Estrella R,etal.Expression of the cation transporter McHKT1 in a halophyte[J].Plant Molecular Biology,2003,52(5):967-980.
[12] Haro R,Banuelos M A,Senn M E,etal.HKT1 mediates sodium uniport in roots:pitfalls in the expression of HKT1 in yeast[J].Plant Physiology,2005,139(3):1495-1506.
[13] Shao Q,Zhao C,Han N,etal.Cloning and expression pattern of SsHKT1 encoding a putative cation transporter from halophyteSuaedasalsa[J].DNA Sequence,2008,19(2):106-144.
[14] 李剑,张金林,王锁民,等.小花碱茅HKT2;1基因全长cDNA的克隆与生物信息学分析[J].草业学报,2013,22(2):140-149.
[15] Platten J D,Cotsaftis O,Berthomieu P,etal.Nomenclature for HKTtransporters,key determinants of plant salinity tolerance[J].TrendsPlant Science,2006,11:372-374.
[16] Sunarpi H T,Motoda J,Kubo M,etal.Enhanced salt tolerance mediated by AtHKT1 transporter-induced Na+unloading from xylem vessels to xylem parenchyma cells[J].The Plant Journal,2005,44(6):928-938.
[17] Horie T,Hauser F,Schroeder J I.HKT transporter-mediated salinity resistance mechanisms in Arabidopsis and monocot crop plants[J].Trends Plant Science,2009,14(12):660-668.
[18] Hauser F,Horie T.A conserved primary salt tolerance mechanism mediated by HKT transporters:a mechanism for sodium exclusion and maintenance of high K+/Na+ratio in leaves during salinity stress[J].Plant Cell & Environment,2010,33(4):552-565.
[19] 赵常玉,李剑,张金林,等.HKT蛋白与植物耐盐性研究进展[J].草业科学,2012,29(10):1604-1612.
[20] Ren Z H,Gao J P,Li L G,etal.A rice quantitative trait locus for salt tolerance encodes a sodium transporter[J].Nature Genetics,2005,37(10):1141-1146.
[21] Munns R,James R A,Xu B,etal.Wheat grain yield on saline soils is improved by an ancestral Na+transporter gene[J].Nature Biotechnology,2012,30(4):360-364.
[22] James R A,Blake C,Zwart A B,etal.Impact of ancestral wheat sodium exclusion genes Nax1 and Nax2 on grain yield of durum wheat on saline soils[J].Functional Plant Biology,2012,39(7):609-618.
[23] Horie T,Costa A,Kim T H,etal.Rice OsHKT2;1 transporter mediates large Na+influx component into K+-starved roots for growth[J].The EMBO Journal,2007,26:3003-3014.
[24] GassmannW,Rubio F,Schroeder J I.Alkali cation selectivity of the wheat root high-affinity potassium transporter HKT1[J].The Plant Journal,1996,10:869-882.
[25] 张琳,郭强,毛培春,等.长穗偃麦草HKT1;4基因片段的克隆及序列分析[J].基因组学与应用生物学,2014,33(4):869-874.
[26] Rains D W,Epstein E.Transport of sodium in plant tissue[J].Science,1965,148:1611.
[27] 张俊莲,张金文,陈正华,等.植物Na+/H+逆向转运蛋白与植物耐盐性的研究[J].草原与草坪,2005(4):3-8.
[28] 杜利霞,董宽虎,朱慧森.植物Na+/H+逆向转运蛋白研究进展[J].草原与草坪,2012(2):82-86.
[29] Flowers T J,Läuchli A.Sodium versus potassium:substitution and compartmentation[J].Inorganic Plant Nutrition,1983(15):651-681.
[30] Gorham J,Hardy C,Wyn Jones R G,etal.Chromosomal location of a K/Na discriminating character in the D genome of wheat[J].Theoretical and Applied Genetics,1987,74:584-588.
[31] Schachtman D P,Bloom A J,Dvorak J.Salt-tolerantTriticumlophopyrumderivatives limit the accumulation of sodium and chloride ions under saline-stress[J].Plant,Cell & Environment,1989,12:47-55.
[32] Dubcovsky J,Maria G S,Epstein E,etal.Mapping of the K+/Na+discrimination locusKna1 in wheat[J].Theoretical and Applied Genetics,1996,92:448-454.
[33] Apse M P,Blumwald E.Na+transport in plants[J].FEBS Letters,2007,581:2247-2254.
[34] Apse M P,Aharon G S,Snedden W A,etal.Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiport in Arabidopsis[J].Science,1999,285:1256-1258.
[35] Serrano R,Rodr guez-Navarro A.Ion homeostasis during salt stress in plants[J].Current Opinion in Cell Biology,2001,13:399-404.
[36] Shi H,Quintero F J,Prado J M,etal.The putative plasma membrane Na+-H+antiporter SOS1 controls longdistance Na+transport in plants[J].The Plant Cell,2002,14:465-477.
[37] Guo Q,Wang P,Ma Q,etal.Selective transport capacity for K+over Na+is linked to the expression levels of PtSOS1 in halophyte Puccinellia tenuiflora[J].Functional Plant Biology,2012,39(12):1047-1057.
[38] Berthomieu P,Conejero G,Nublat A,etal.Functional analysis ofAtHKT1 in Arabidopsis shows that Na+recirculation by the phloem is crucial for salt tolerance[J].The EMBO Journal,2003,22:2004-2014.
[39] Rubio F,Gassmann W,Schroeder J I.Sodium-driven potassium uptake by the plant potassium transporter HKT1 and mutations conferring salt tolerance[J].Science,1995,270:1660-1663.
[40] Laurie S,Feeney K A,Maathuis F J,etal.A role for HKT1 in sodium uptake by wheat roots[J].The Plant Journal,2002,32:139-149.
[41] Munns R,Rebetzke G J,Husain S,etal.Genetic control of sodium exclusion in durum wheat[J].Australian Journal of Agricultural Research,2003,54:627-635.
[42] James R A,Davenport R J,Munns R.Physiological characterization of two genes for Na+exclusion in durum wheat,Nax1 and Nax2[J].Plant Physiology,2006,142:1537-1547.
[43] Lin H X,Zhu M Z,Yano M,etal.QTLs for Na+and K+uptake of the shoots and roots controlling rice salt tolerance[J].Theor Appl Genet,2004,108:253-260.
[44] Cotsaftis O,Plett D,Johnson A A T,etal.Root-specific transcript profiling of contrasting rice genotypes in response to salting tress[J].Molecular Plant,2011,4(1):25-41.
[45] Zhang J L,Flowers T J,Wang S M.Mechanisms of sodium uptake by roots of higher plants[J].Plant Soil,2010,326:45-60.
[46] Cotsaftis O,Plett D,Shirley N,etal.A two-staged model of Na+exclusion in rice explained by 3D modeling of HKT transporters and alternative splicing[J].Plos One,2012,7(7):839-865.
GenecloningandconstructionofplantexpressionvectorofEeHKT1;4inElytrigiaelongata
ZHANG Lin,GUO Qiang,LI Shan-shan,MAO Pei-chun,TIAN Xiao-xia,MENG Lin
(BeijingResearchandDevelopmentCenterforGrassandEnvironment,BeijingAcademyofAgricultureandForestryScience,Beijing100097,China)
A high-affinity K+transporter gene was cloned fromElytrigiaelongatausing the RT-PCR technique.This Gene was designated asEeHKT1;4,and contained a 1 722 bp open reading frame and encoded 573 amino acids residues.The length of cDNA was 1 977 bp.The gene shared 94% of homology withTmHKT1;4-A2 from wheat (Triticummonococcum).The gene has a closer genetic relationship with the HKT1;4 from other monocotyledons using phylogenetic tree analyzing.In addition,the pBI121-35S-EeHKT1;4-Nos vector was constructed successfully using the In-Fusion technology.This would provide the important basis for further study in salt tolerance ofEeHKT1;4 inElytrigiaelongata.
Elytrigiaelongata;high-affinity K+transporter gene;In-Fusion technology;construction of expression vector
2016-12-27;
:2017-01-04
国家自然科学基金项目(31272489);北京市农林科学院科技创新能力建设专项(KJCX20140103)资助
张琳(1988-),女,河北邱县人,硕士研究生。 E-mail:zl827935831@126.com 孟林为通讯作者。
S 512
:A
:1009-5500(2017)04-0001-07
