IL-35抑制炎症反应和T细胞反应性减轻变应性鼻炎的机制研究
2017-09-20何庆文肖才文
徐 翔 何庆文 肖才文 辛 鹏
(江汉大学附属医院(武汉市第六医院)耳鼻咽喉科,武汉430015)
IL-35抑制炎症反应和T细胞反应性减轻变应性鼻炎的机制研究
徐 翔 何庆文①肖才文 辛 鹏
(江汉大学附属医院(武汉市第六医院)耳鼻咽喉科,武汉430015)
目的:探讨IL-35在变应性鼻炎中对炎症反应和T细胞反应性的作用及其机制。方法:选取2012年1月至2016年1月间本院收治的37例变应性鼻炎患者(观察组)及35例行变应性鼻炎过敏原检测后排除变应性鼻炎的健康志愿者(对照组)为研究对象,采集观察组和对照组的外周血液,ELISA检测患者血清中IL-35水平。建立小鼠变应性鼻炎动物模型,收集小鼠外周血液,ELISA检测小鼠血清中IL-35及IgE水平。小鼠鼻切片后组织染色检测嗜酸性粒细胞;分离小鼠脾脏细胞后加入卵清蛋白抗原,加入或不加入IL-35至培养基中,检测卵清蛋白特异性T细胞反应性;ELISA检测T细胞培养上清中细胞因子IL-2、IL-4、IL-5、IL-10、IL-13,IL-17、 IL-23、IL-27以及TNF-α含量;荧光定量PCR(Real-time PCR)检测培养T细胞中IL-2、IL-4、IL-5、IL-10、IL-13、IL-17、IL-23、IL-27以及TNF-α mRNA表达水平;Western blot 检测培养T细胞JNK、Erk1/2及p38信号途径的激活水平。结果:观察组血清IL-35水平显著低于对照组(P<0.05);变应性鼻炎组小鼠组织染色结果显示嗜酸性粒细胞浸润数量显著高于正常组(P<0.05),而血清IL-35水平则显著低于正常小鼠(P<0.05); 卵清蛋白特异性T细胞反应性检测显示IL-35能显著抑制其反应性;ELISA及Real-time PCR结果均显示,IL-35能够显著下调IL-4、IL-5、IL-13、IL-17、IL-23及TNF-α的表达,上调IL-2、IL-10及IL-27的表达。Western blot结果显示,IL-35能够显著抑制卵清蛋白特异性T细胞中JNK、Erk1/2及p38信号途径的激活水平。结论:IL-35能够调控炎症反应中的炎症因子表达和T细胞的反应性,从而减轻变应性鼻炎,其机制可能是通过调控JNK、Erk1/2及p38信号途径的激活水平。
IL-35;炎症;T细胞反应性;变应性鼻炎
变应性鼻炎(Allergic rhinitis,AR)是机体接触致敏原后由免疫球蛋白E(IgE)介导引起的鼻腔黏膜炎症性疾病。AR的主要症状是打喷嚏、流涕、鼻塞、鼻痒,此外约60%~70%的患者还经常会伴有眼睛痒或红肿流泪[1]。尽管AR不会对患者的生命造成威胁,但其症状往往会影响患者的工作和生活质量,给个人及社会产生很大的负担。它能导致患者产生身体和精神并发症,特别是在青少年,能够引起睡眠呼吸紊乱、行为和注意力障碍,从而影响青少年的学习成绩[2]。在我国,随着工业化进程的发展、现代生活方式的改变、生态环境的持续破坏、雾霾持续的加重等因素,导致我国AR发病率呈逐年上升趋势[3]。AR的发病是由多因素造成的,其发病机制和影响其发生的因素十分复杂,但最主要的病理过程是非感染性的炎症,因此,控制该疾病病理过程中的炎症反应能有效地控制疾病的症状[4]。IL-35是近年来发现的IL-12家族成员之一,它被发现具有抑制炎症反应的作用。研究表明,在尘螨诱导的过敏性哮喘中,IL-35能够抑制支气管肺泡灌洗液中的IgE、IL-4、IL-5及IL-13的产生,从而抑制炎症反应[5]。但IL-35在变应性鼻炎中的作用目前仍知之甚少。本研究拟初步探讨IL-35在AR中的表达及其对AR的影响。
1 资料与方法
1.1资料
1.1.1患者及标本 选取本院2012年1月至2016年1月间本院收治的37例变应性鼻炎患者为观察组,其中男20例,女17例,年龄15~49岁,平均(30.6±18.1)岁。同期选择35例在本院行变应性鼻炎过敏原检测后排除变应性鼻炎的健康志愿者(对照组)为对照组,其中男19例,女16例,年龄14~47岁,平均(31.4±16.2)岁。抽取两组患者的外周血液并制备血清备用。
1.1.2试剂与设备 主要试剂包括RPMI1640培养基、胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶、青霉素、链霉素购自美国Sigma公司,JNK、p-JNK、Erk1/2、p-Erk1/2、p38、p-p38、beta-actin抗体购自Abcam(均为兔单克隆抗体),ECL试剂Thermo fisher,Real-time PCR Master Mix购自TOYOBO,人IL-35 ELISA试剂盒和重组人IL-35购自美国R&D Systems,小鼠IL-2、IL-4、IL-5、IL-10、IL-13、IL-17、IL-23、IL-27、 IL-35以及TNF-α ELISA试剂盒购自Elabscience Biotechnology,总RNA提取试剂盒、细胞裂解液、PMSF(蛋白酶抑制剂)及BCA试剂盒购自上海碧云天生物技术研究所,Real-time PCR 引物由上海生工合成,Mouse IL-2:sense 5′-GAGCCTTATGTGTTGTAAGC-3′,antisense 5′-GTGCTCCTTGTCA-ACAGCGC-3′;Mouse IL-4:sense 5′-CATGGTGGCTC-AGTACTACG-3′,antisense 5′-TCTTTCTCGAATGTAC-CAGG-3′;Mouse IL-5:sense 5′-TCCCTGCTACTCTCCCCAAAC-3′,antisense5′-TGGCACAGTCTGATTCA-TACATAGG-3′;Mouse IL-10:sense 5′-GGACAACAT-ACTGCTAACCGAC-3′,antisense 5′-AAAATCACTCTTCACCTGCTCC-3′;Mouse IL-13:sense 5′-GCTTATTGAGGAGCTGAGCAACA-3′,antisense 5′-GGCCAGGTCCACACTCCATA-3′;Mouse IL-17:sense 5′-CTGC-TGAGCCTGGCGGCTAC-3′,antisense 5′-CATTGCGGTGGAGAGTCCAGGG-3′;Mouse IL-23:sense 5′-TGCTGGATTGCAGAGCAGTAA-3′,antisense 5′-CTGGAGGAGTTGGCTGAGTC-3′;Mouse IL-27:sense 5′-GGCCAGGTGACAGGAGACC-3′,antisense 5′-CAGC-TTGTACCAGAAGCAAGGG-3′;Mouse TNF-α:sense 5′-TCTTGAGGCCACTTTCTGCT-3′,antisense 5′-ACTCATCCTCCACGTCCTTG-3′; Mouse GAPDH:sense 5′-GCCTCGTCCCGTAGACAAAA-3′,antisense 5′-GATGGGCTTCCCGTTGATGA-3′。 SDS-PAGE试剂购自Bio-Rad。主要设备包括CO2培养箱,超净工作台, 实时荧光定量PCR仪、荧光显微镜,Bio-Rad垂直电泳仪,Bio-Rad Western blot化学发光成像系统。
1.2方法
1.2.1纳入及排除标准 纳入研究的观察组患者诊断均符合AR诊断标准,参照AR诊断和治疗指南(2009年,武夷山):(1)有以下2项以上的临床症状,且每天症状持续或累计在1 h以上:喷嚏、流清水样涕、鼻塞、鼻痒。此外可伴有眼痒、结膜充血等眼部症状。(2)体征:鼻内镜检查常见鼻黏膜苍白、水肿,鼻腔水样分泌物。(3)皮肤点刺激试验:使用标准化变应原试剂,在患者前臂掌侧皮肤点刺激,设置阴性和阳性对照,20 min后出现阳性结果即可判断。(4)血清特异性IgE检测升高。确诊AR需临床表现结合皮肤点试验,结果阳性或血清特异性IgE升高。排除标准:排除并发恶性肿瘤、鼻部其他疾病、高血压、其他过敏性疾病及自身免疫性疾病、严重呼吸系统、循环系统疾病患者。所有患者均签署知情同意书,研究获得医院伦理委员会批准。
1.2.2小鼠AR模型建立及小鼠脾脏CD4+CD25-T细胞分离及培养 96只8周龄的BALB/c 小鼠购自武汉大学试验动物中心,根据实验设计,在第0天和第14天给小鼠每天2次注射2 mg Al(OH)3,根据分组,实验组小鼠除给以上处理外,在第21天至27天鼻腔给予卵清蛋白(200 μg/d)。在最后一次给药后,根据参考文献的方法[6],记录20 min内小鼠打喷嚏和鼻摩擦运动的次数,并在第28天时采集所需鼻腔黏膜组织、小鼠外周血液、脾脏。将分离小鼠脾脏,参照文献的方法[7],利用磁珠分选法从小鼠脾脏分离CD4+CD25-T细胞,分离后计数,然后根据实验设计,将细胞培养于六孔板中,每孔加入2×106个细胞,加入终浓度为10 μg/ml的OVA抗原培养,然后加入或不加入终浓度为20 ng/ml 的IL-35细胞因子共培养。
1.2.3卵清蛋白特异性T细胞反应性检测 在加入终浓度为10 μg/ml的OVA抗原后加入或不加入终浓度为20 ng/ml 的IL-35细胞因子共培养的CD4+CD25-T细胞培养3 d后,向其中加入1 μCi的[3H]胸腺嘧啶核苷后再培养16 h,按照试剂盒说明书将细胞收集至玻璃纤维过滤器,然后采用放射性液体闪烁计数器测定cmp值。
1.2.4ELISA检测 IgE检测参照文献[8]的方法,收集血清,按照试剂盒的说明书,向板中加入血清,加入生物素标记的OVA后,向板中加入抗生物素蛋白过氧化物酶孵育,加入显色底物后按照说明书 450 nm 处测定光密度值。细胞因子检测参照文献的方法[9],收集血清及细胞培养上清,按照试剂盒说明书检测IL-2、IL-4、IL-5、IL-10、IL-13、IL-17、IL-23、IL-27、IL-35以及TNF-α的含量。
1.2.5Real-time PCR 总RNA提取试剂盒提取细胞总RNA,逆转录合成cDNA。使用SYBR Green Master Mix检测人细胞中IL-2、IL-4、IL-5、IL-10、IL-13、IL-17、IL-23、IL-27以及TNF-α mRNA水平。
1.2.6Western blot检测 将收集的细胞采用细胞裂解液充分裂解,同时加入PMSF防止蛋白降解,充分裂解后4℃离心机12 000 r/min离心5 min,取上清,BCA法蛋白定量后,加入5×loading buffer,沸水煮10 min后置冰上,然后进行SDS-PAGE,每孔加入40 μg蛋白,电泳结束后转膜、洗膜(5 min×3次)、5%BSA封闭,封闭结束后洗膜(5 min×3次),孵育单克隆一抗,4℃冰箱过夜,然后再次洗膜(5 min×3次),加入HRP小鼠抗兔二抗孵育,37℃低速摇床1 h,结束后洗膜(5 min×3次),然后配置化学发光试剂,ECL法曝光。
1.3统计学分析 所有实验均单独重复3次,所得实验数据均采用SPSS20.0软件进行分析,组件比较采用单因素方差分析,P<0.05表示有统计学意义。
2 结果
2.1IL-35在AR患者中的表达 AR患者外周血液中IL-35的表达结果见图1,结果显示,AR患者外周血液中IL-35表达显著低于正常健康人(P<0.001)。
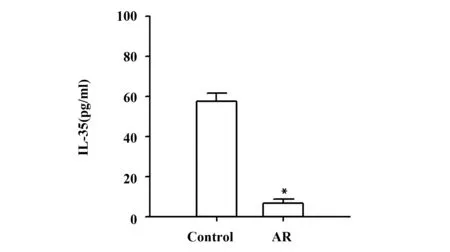
图1 IL-35在AR患者外周血液中的表达Fig.1 Expression of IL-35 in peripheral blood of patients with ARNote: *.P<0.001.
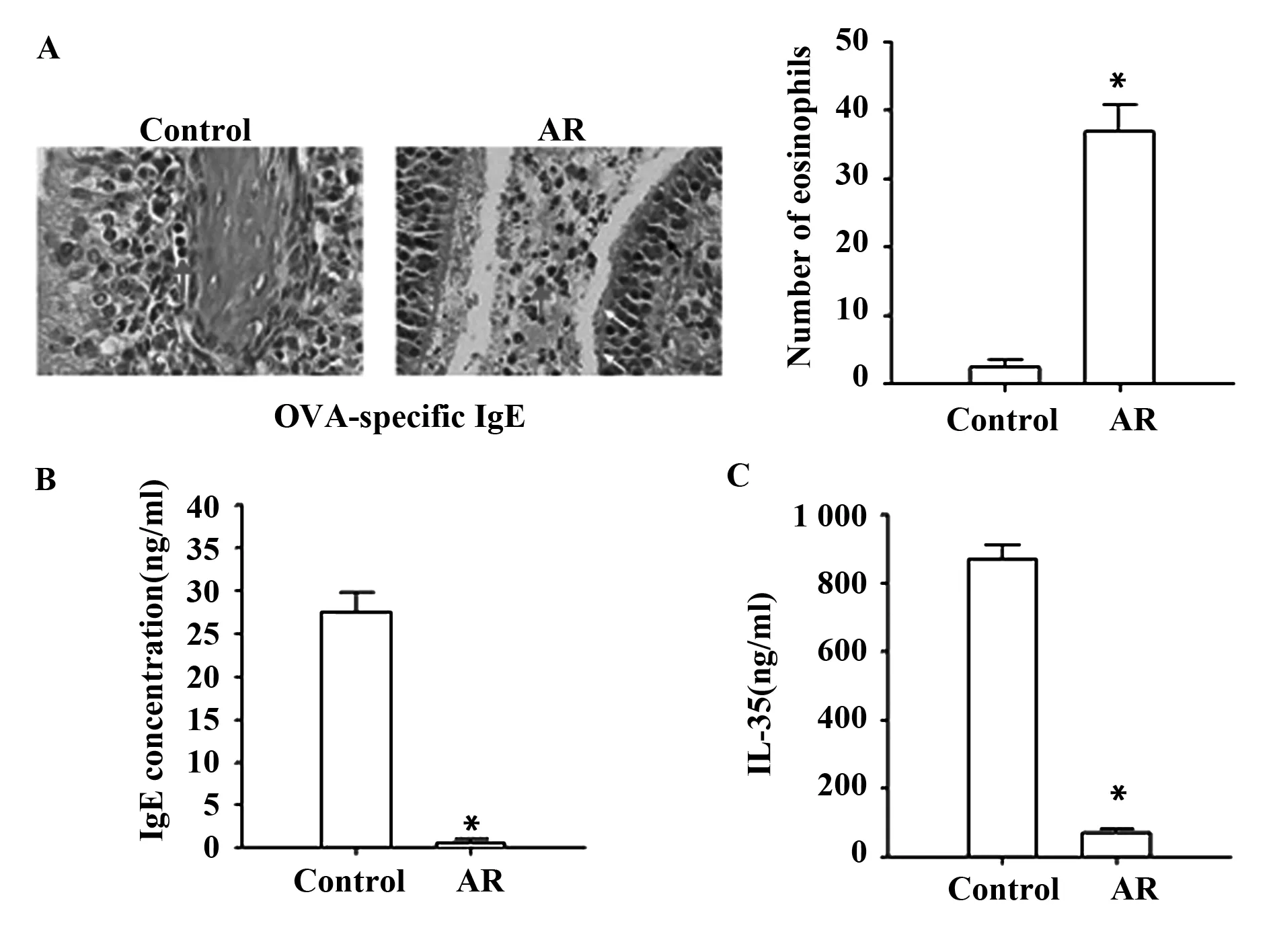
图2 AR小鼠鼻组织切片中嗜酸性粒细胞检测及外周血液中IgE及IL-35水平检测Fig.2 Detection of eosinophils in nasal tissues of AR mice, and expression of IgE and IL-35 in peripheral blood of AR miceNote: *.P<0.001.

图4 IL-35对卵清蛋白特异性T细胞炎症因子产生的影响Fig.4 Production of cytokines that expressed by OVA specific T cell affected by IL-35Note: *.P<0.05,**.P<0.001.

图3 卵清蛋白特异性T细胞反应性检测Fig.3 Ovalbumin specific T cell response was detectedNote: *.P<0.001.
2.2AR小鼠鼻组织切片中嗜酸性粒细胞检测及外周血液中IgE、IL-35水平检测 AR模型小鼠鼻组织染色切片结果见图2A,结果显示,AR小鼠嗜酸性粒细胞数量显著高于正常小鼠(P<0.05)。外周血液中IgE及IL-35水平检测显示(图2B、C),AR小鼠IgE水平显著高于正常小鼠,而IL-35则显著低于正常小鼠(P<0.05)。
2.3卵清蛋白特异性T细胞反应性检测 卵清蛋白特异性T细胞反应性检测结果见图3,结果显示,IL-35能够显著抑制卵清蛋白特异性T细胞的反应性(P<0.05)。

图5 IL-35对JNK、Erk1/2及p38信号途径激活水平影响Fig.5 Effect of IL-35 on activation of JNK,Erk1/2 and p38 signaling pathway
2.4IL-35对卵清蛋白特异性T细胞炎症因子的影响 IL-35对卵清蛋白特异性T细胞炎症因子表达的影响见图4,结果显示,IL-35能够显著抑制IL-4、IL-5、IL-13、IL-17、IL-23及TNF-α的表达(图4A、B),而显著上调IL-2、IL-10及IL-27的表达(图4C、D)。
2.5IL-35对JNK、Erk1/2及p38信号途径激活水平影响 IL-35对JNK、Erk1/2及p38信号途径激活水平影响见图5,结果显示,IL-35能够显著抑制JNK、Erk1/2及p38的磷酸化水平,即能显著抑制JNK、Erk1/2及p38信号途径的激活。
3 讨论
IL-35是近年来发现的IL-12家族新成员,它是一种重要的炎症抑制细胞因子。研究表明,IL-35是一种负向调控蛋白,它通过抑制T淋巴细胞的增殖及效应功能发挥其生理活性功能[10]。此外,IL-35对Treg细胞的抑制功能发挥也具有重要的作用。已有报道显示,在多种非致命性自身免疫反应疾病模型中,当功能性的IL-35表达下调后, Treg细胞的抑制功能明显降低,机体的炎症反应也进一步加重[11]。值得注意的是,有研究表明,在过敏性哮喘患者体内,IL-35蛋白及mRNA水平均显著低于健康对照人群,而患者血浆中的IL-4及IL-17则显著高于健康对照,此外,患者血清总IgE、IL-4、嗜酸性粒细胞计数也显著高于健康对照,IL-35与以上指标呈明显的负相关[12]。这表明,IL-35可能作为一种重要的负向调控细胞因子,在机体免疫功能异常中扮演着重要的角色。而AR作为一种过敏性的非感染性炎症性疾病,主要原因是致敏原导致机体细胞免疫功能出现异常。在本研究中,我们发现,在AR中,IL-35的表达明显低于正常健康人,进一步的研究则表明,IL-35能够降低致敏原导致的T细胞的反应性,同时还能调控部分炎症因子的表达从而抑制AR的炎症反应。
众所周知,在AR的发病过程中,CD4+T细胞数量明显增多,这一异常增多,导致IL-2家族某些成员的异常升高表达,如IL-4、IL-5、IL-13等[13,14]。研究表明,IL-4、IL-5、IL-13在过敏性哮喘、AR的炎症反应中发挥着非常重要的作用[12]。因此,调控IL-4、IL-5、IL-13的表达,能够降低AR过程中的炎症反应,在本研究中,IL-35能够显著降低CD4+CD25-T细胞产生IL-4、IL-5、IL-13。IL-12、IL-23、IL-27及IL-35是IL-12家族的成员,有研究表明,IL-23信号途径能够提高Th2的极化水平,当小鼠过表达IL-23后,支气管肺泡冲洗液中的嗜酸性粒细胞和血清中IgE、IL-23、IL-17及IL-4水平则显著升高,而当沉默IL-23 RNA后,则正好相反[15]。在本研究中,IL-35能够显著抑制IL-23的表达,这表明,IL-35可能是通过调控IL-23的表达,从而抑制AR的炎症反应。IL-27在免疫反应中具有两种不同的功能,其一可以作为Th1型免疫反应的引发剂,另一种是作为免疫或炎症反应的衰减器[16]。研究表明,在卵清蛋白致敏的小鼠,鼻腔给予IL-27可抑制卵清蛋白诱导的气道高反应性和气道炎症[17]。因此,IL-27可能是治疗Th2细胞相关疾病的一个新的治疗靶点,如支气管哮喘、变应性鼻炎等。在本研究中,IL-35能显著上调IL-27的表达,这一结果表明,IL-35在AR小鼠模型中,可能是通过上调IL-27的表达从而减轻变应性鼻炎。
IL-17在驱动中性粒细胞浸润至气道中起着关键的作用[18]。研究表明,鼻腔黏膜中IL-17的表达与鼻腔嗜酸性粒细胞增多症和AR的临床严重程度呈正相关[19]。本研究结果显示,IL-35在AR模型小鼠中能够抑制CD4+CD25-T细胞产生IL-17。此外,IL-23也具有诱导幼稚前体T细胞分化为Th17细胞的能力,并诱导CD4 Th17细胞产生IL-17[20],因此,IL-35减轻变应性鼻炎的机制之一可能是通过抑制IL-23的产生,从而降低Th17细胞的反应,减少IL-17的产生。此外,在过敏原驱动的气道炎症小鼠模型中,TNF-α能通过上调上皮细胞和内皮细胞黏附分子从而介导中性粒细胞在炎症组织中的募集[21]。而在小鼠AR模型中,抗TNF-α治疗后,能明显减轻AR的过敏反应、减少鼻黏膜嗜酸性粒细胞浸润、降低总IgE和特异性IgE水平、抑制Th2型细胞因子的产生[22]。在本研究中,IL-35能够抑制TNF-α的表达,这提示IL-35调控TNF-α可能是其抑制AR过敏反应的机制之一。IL-2在天然免疫自身耐受的维护中起着至关重要的作用[23],本研究结果表明,IL-35能够显著的增加IL-2的量,这提示IL-35在AR中可能是通过调控IL-2从而诱导天然免疫自身耐受。有研究发现,IL-10能减轻鼻黏膜过敏[24],为此,我们检测了AR模型小鼠中IL-35对CD4+CD25-T细胞IL-10表达的影响,结果显示,IL-35能够上调IL-10的表达。这提示,IL-35不仅诱导CD4效应 T细胞转化为Treg细胞,同时还能通过增加IL-10的表达量促进Treg细胞的存活。
研究表明,IL-35能够通过抑制MAPK信号途径的激活而抑制内皮细胞的激活,从而抑制LPS诱导的炎症因子表达[25]。为此,我们检测了AR模型中,IL-35对CD4+CD25-T细胞MAPK信号途径的影响,结果显示,IL-35能够明显抑制JNK、Erk1/2及p38的激活水平,这提示,IL-35可能是通过抑制MAPK信号途径的激活从而减轻AR的,其具体机制尚需深入研究。
综上所述,我们的研究阐明了IL-35在AR中的表达变化,同时我们也发现,在AR中,IL-35通过抑制炎症反应和T细胞的反应性,减少炎症因子的产生,从而减轻变应性鼻炎。此外,本研究还发现,在AR病理过程中,IL-35能够抑制MAPK信号途径的激活,其减轻变性鼻炎的机制是否是通过该信号途径实现的,尚需进一步的研究证明。
[1] 李华斌.变应性鼻炎的发病机制及诊治进展[J].中华耳鼻咽喉头颈外科杂志,2014,49(4):347-352.
[2] 张念武,董曦文,王利霞,等.变应性鼻炎患者的生活质量状况及影响因素[J].山东医药,2014,54(13):78-79.
[3] 张罗.变应性鼻炎是临床严峻挑战[J].中华耳鼻咽喉头颈外科杂志,2014,49(4):265-267.
[4] 梁美君,徐 睿,许 庚.变应性鼻炎研究新进展[J].临床耳鼻咽喉头颈外科杂志,2015,29(3):202-206.
[5] Whitehead GS,Wilson RH,Nakano K,etal.IL-35 production by inducible costimulator(ICOS)-positive regulatory T cells reverses established IL-17-dependent allergic airways disease[J].J Allergy Clin Immunol,2012,129(1):207-215.
[6] Suzuki M,Zheng X,Zhang X,etal.A novel allergen-specific therapy for allergy using CD40-silenced dendritic cells[J].J Allergy Clin Immunol,2010,125(3):737-743.
[7] Odeh AN,Simecka JW.Regulatory CD4+CD25+T cells dampen inflammatory disease in murine mycoplasma pneumonia and promote IL-17 and IFN-γ responses[J].PLoS One,2016,11(5):e0155648.
[8] Amo G,García-Menaya J,Campo P,etal.A nonsynonymous FCER1B SNP is associated with risk of developing allergic rhinitis and with IgE levels[J].Sci Rep,2016,6:19724.
[9] Yan B,Wei JJ,Yuan Y,etal.IL-6 cooperates with G-CSF to induce protumor function of neutrophils in bone marrow by enhancing STAT3 activation[J].J Immunol,2013,190(11):5882-5893.
[10] Li X,Mai J,Virtue A,etal.IL-35 is a novel responsive anti-inflammatory cytokine--a new system of categorizing anti-inflammatory cytokines[J].PLoS One,2012,7(3):e33628.
[11] Hu D.Role of Anti-inflammatory cytokines IL-35 and IL-37 in asthma[J].Inflammation,2017,40(2):697-707.
[12] Huang CH,Loo EX,Kuo IC,etal.Airway inflammation and IgE production induced by dust mite allergen-specific memory/effector Th2 cell line can be effectively attenuated by IL-35[J].J Immunol,2011,187(1):462-471.
[13] Wills-Karp M,Luyimbazi J,Xu X,etal.Interleukin-13:central mediator of allergic asthma[J].Science,1998,282(5397):2258-2261.
[14] Benson M,Carlsson L,Guillot G,etal.A network-based analysis of allergen-challenged CD4+T cells from patients with allergic rhinitis[J].Genes Immun,2006,7(6):514-521.
[15] Peng J,Yang XO,Chang SH,etal.IL-23 signaling enhances Th2 polarization and regulates allergic airway inflammation[J].Cell Res,2010,20(1):62-71.
[16] Yoshida H,Nakaya M,Miyazaki Y.Interleukin 27:a double-edged sword for offense and defense[J].J Leukoc Biol,2009,86(6):1295-1303.
[17] Cao J,Wong CK,Yin Y,etal.Activation of human bronchial epithelial cells by inflammatory cytokines IL-27 and TNF-α:implications for immunopathophysiology of airway inflammation[J].J Cell Physiol,2010,223(3):788-797.
[18] Fogli LK,Sundrud MS,Goel S,etal.T cell-derived IL-17 mediates epithelial changes in the airway and drives pulmonary neutrophilia[J].J Immunol,2013,191(6):3100-3111.
[19] Guo C,Chen G,Ge R.IL-23,rather than IL-17,is crucial for the development of ovalbumin-induced allergic rhinitis[J].Mol Immunol,2015,67(2 Pt B):436-443.
[20] Hunter CA.New IL-12-family members:IL-23 and IL-27,cytokines with divergent functions[J].Nat Rev Immunol,2005,5(7):521-531.
[21] Lukacs NW,Strieter RM,Chensue SW,etal.TNF-α mediates recruitment of neutrophils and eosinophils during airway inflammation[J].J Immunol,1995,154(10):5411-5417.
[22] Mo JH,Kang EK,Quan SH,etal.Anti-tumor necrosis factor-alpha treatment reduces allergic responses in an allergic rhinitis mouse model[J].Allergy,2011,66(2):279-286.
[23] Banchereau J,Pascual V,O′Garra A.From IL-2 to IL-37:the expanding spectrum of anti-inflammatory cytokines[J].Nat Immunol,2012,13(10):925-931.
[24] Fu CL,Ye YL,Lee YL,etal.Effects of overexpression of IL-10,IL-12,TGF-beta and IL-4 on allergen induced change in bronchial responsiveness[J].Respir Res,2006,7:72.
[25] Sha X,Meng S,Li X,etal.Interleukin-35 inhibits endothelial cell activation by suppressing MAPK-AP-1 pathway[J].J Biol Chem,2015,290(31):19307-19318.
[收稿2017-01-10 修回2017-03-05]
(编辑 许四平 刘格格)
MechanismofIL-35inhibitionofinflammatoryresponseandTcellresponseinalleviateofallergicrhinitis
XUXiang,HEQing-Wen,XIAOCai-Wen,XINPeng.
ENTHypersensitivityDepartment,AffiliatedHospitalofJianghanUniversity(TheSixthHospitalofWuhan),Wuhan430015,China
Objective:To investigate the effect of IL-35 on inflammatory response and T cell response in allergic rhinitis.Methods: 37 patients(observation group) with allergic rhinitis and 35 healthy volunteers(control group) after allergen detection of allergic rhinitisin in our hospital from Jan 2012 to Jan 2016 were selected as study subjects.The peripheral blood of observation group and control group were collected,and the serum levels of IL-35 were detected by ELISA.The animal model of allergic rhinitis in mice was established,the peripheral blood of mice was collected,and the serum level of IL-35 and IgE were detected by ELISA.The eosinophils that infiltrated in nasal mucosa were detected after tissue biopsy in mice.The mouse spleen cells were isolated and the ovalbumin antigen was added in the culture medium,IL-35 was or was not added into the culture medium,the ovalbumin specific T cell responses was detected.The cytokines IL-2,IL-4,IL-5,IL-10,IL-13,IL-17,IL-23,IL-27 and TNF-α in culture supernatant of ovalbumin specific T cells were detected by ELISA.The expression of IL-2,IL-4,IL-5,IL-10,IL-13,IL-17,IL-23,IL-27 and TNF-α in ovalbumin specific T cells were detected by Real-time PCR.The activation of JNK,Erk1/2 and p38 signal pathway in ovalbumin specific T cells were detected by Western blot.Results: The serum level of IL-35 in observation group was significantly lower than control group(P<0.05).The results showed that the number of eosinophils which infiltrated in AR mice nasal mucosa was significantly higher than normal mice(P<0.05),while the serum level of IL-35 in AR mice was significantly lower than normal mice(P<0.05).Ovalbumin specific T cell reactivity assay showed that IL-35 could significantly inhibit the T cell response.ELISA and Real-time PCR results showed that IL-35 could significantly down regulate the expression of IL-4,IL-5,IL-13,IL-17,IL-23 and TNF-α,and up regulate the expression of IL-2,IL-10 and IL-27.The Western blot results showed that IL-35 can inhibit the activation of JNK,Erk1/2 and p38 signal pathway of ovalbumin specific T in cells.Conclusion: IL-35 can regulate the expression of inflammatory cytokines in inflammatory response and inhibit T cell response,thus reducing allergic rhinitis,the mechanism may be through regulation of JNK,Erk1/2 and p38 signal pathway activation.
IL-35;Inflammation;T cell response;Allergic rhinitis
10.3969/j.issn.1000-484X.2017.09.023
徐 翔(1980年-),男,主治医师,主要从事耳鼻咽喉方面的研究,E-mail:xuxiang34451@163.com。
及指导教师:辛 鹏(1980年-),男,主治医师,主要从事变态反应方面的研究。
R765.21
A
1000-484X(2017)09-1386-06
①江汉大学附属医院(武汉市第六医院)变态反应科,武汉430015。
