用于CH4/N2分离的高效活性炭制备及其吸附平衡和动力学研究
2017-09-19刘程琳于建国
杨 林, 杨 颖, 刘程琳, 李 平, 于建国
(华东理工大学化学工程联合国家重点实验室,上海 200237)
用于CH4/N2分离的高效活性炭制备及其吸附平衡和动力学研究
杨 林, 杨 颖, 刘程琳, 李 平, 于建国
(华东理工大学化学工程联合国家重点实验室,上海 200237)
以椰壳为活性炭原材料,通过高温炭化、对KOH活化条件进行优化,制备出高比表面积活性炭,并采用CO2二次活化提高微孔材料对CH4/N2的吸附选择性,研制出高效吸附分离CH4/N2的椰壳活性炭。采用磁悬浮热天平测量了303~363 K、0~1 000 kPa下CH4和N2在所制备的高效椰壳活性炭上的吸附等温线,采用Toth模型对吸附平衡数据进行拟合,获得模型参数和吸附热等动力学参数。建立等温、无动量损失的双分散二级孔结构扩散模型,采用稀释穿透曲线法研究了CH4和N2在此高效椰壳活性炭上的吸附动力学。最后,通过固定床吸附分离CH4/N2的实验,研究了椰壳活性炭动态吸附分离CH4/N2机理,为优化设计CH4/N2吸附分离过程提供基础理论依据。
椰壳基活性炭; CH4/N2分离; 吸附平衡; 吸附动力学; 非常规天然气
天然气作为一种清洁、高效的能源,近几十年来需求量日益增加[1]。非常规天然气的来源主要包括:煤层气、垃圾填埋气、沼气等。这些来源气通常都含有甲烷、烃类、氮气、二氧化碳、二氧化硫、水蒸气等。要充分利用这些非常规天然气发电或者作为化工原料时,甲烷的分离和提纯过程是必不可少的[2]。CH4和N2的动力学直径相近,且物化性质相似,是分离提纯的重点和难点。
变压吸附法由于其低成本、高效率、操作简单等优点成为气体分离浓缩中最常用的技术[3]。吸附剂的性能对变压吸附过程起着至关重要的作用。目前用于吸附分离CH4/N2的吸附剂主要包括沸石材料、金属有机骨架材料、硅铝分子筛、碳分子筛和活性炭等。沸石材料吸附量较低,金属有机骨架材料制备成本高,这些限制了它们的工业应用。碳分子筛是基于动力学机理吸附分离甲烷和氮气的,它适用于高浓度(CH4摩尔分数高于70%)的CH4和N2混合气的浓缩。另外,煤层气等富含水蒸气,会影响硅铝分子筛等吸附剂的吸附性能。活性炭由于具有高比表面积(1000m2/g以上)、疏水性、低廉的成本和可调的孔径分布,使其成为非常具有前景的吸附剂。
活性炭可以采用棉杆[4-5]、椰壳[6-7]、种壳[8-9]或其他廉价易得、可循环再生的生物质材料,经过高温活化,如水蒸气活化、KOH活化、CO2活化等,制备高比表面积的微孔吸附材料。椰壳在我国南方地区资源丰富,成本低,固定碳含量高,结构致密多孔,是用来制备活性炭的优质材料。
本文以椰壳为原料,提供了一种简单、低成本的方法来制备用于CH4/N2分离的、具有高吸附量和良好选择性的颗粒状活性炭。先通过优化KOH活化条件,制备出高比表面积的活性炭。再通过CO2二次活化对其进行孔径调控提高活性炭对CH4/N2竞争吸附选择性。最后测量、模拟了CH4和N2在制备的椰壳活性炭的吸附平衡和吸附动力学。并基于平衡分离对CH4和N2的床层动力学进行了研究,为后续的工艺设计和模拟提供了基本数据。
1 实验部分
1.1材料与气体
本实验所用的破碎椰壳购于海南省文昌县,破碎筛选至450~900 μm,并用去离子水清洗烘干。试剂氢氧化钾为分析纯,购于国药集团化学试剂有限公司。所用气体由上海加杰气体公司提供,CH4、N2、CO2、He的纯度分别高于99.99%、99.995%、99.998%、99.999%。
1.2椰壳活性炭的制备方法
以椰壳为活性炭原材料,经高温炭化、KOH活化以及CO2二次活化制备高效椰壳活性炭,主要制备步骤如下:
(1) 高温炭化。取一定量的预处理好的颗粒状椰壳放在弧形刚玉舟中,并置于水平管式炉(德国Nabertherm公司)中部。先向管式炉内通入N25 min,然后开启程序,让管式炉以3 K/min的升温速率由室温升至1 073 K,保温2 h后冷却至室温。整个过程管式炉都在N2氛围中。
(2) KOH活化。将炭化料与KOH按照一定质量比混合,置于聚四氟乙烯烧杯中,并加入适量的去离子水,在408 K温度下搅拌直至混合物成泥浆状。然后将混合物置于管式炉内,在N2氛围中,以5 K/min的升温速率升至所需温度。活化结束后,将混合物用热的去离子水和0.1 mol/L稀盐酸反复冲洗过滤,直至滤液的pH接近7。最后将活性炭颗粒烘干、筛分,用于接下来的实验。
(3) CO2二次活化。对优化实验条件下得到的高比表面积活性炭进行CO2二次活化。将活性炭置于水平管式炉的中央,在流量为300 cm3/min的N2氛围中,以5 K/min的升温速率升温至923 K,然后将N2切换至相同流量的CO2,反应6 h。最后再切回N2氛围,冷却至室温,得到活性炭(GAC)。
1.3分析与表征
1.3.1 工业组分及元素组成分析 用红外快速煤质分析仪(5E-MACⅢ,长沙开元公司)、元素分析仪(Vario MACRO,德国Elementar公司)对椰壳原料和椰壳炭化料进行工业分析、元素分析。
1.3.2 比表面积及孔结构分析 用静态容积分析仪(ASAP2020M,美国Micrometrics Instrument公司)测量N2在77 K,相对压力为1×10-6~1下的吸附、脱附曲线。测量前,样品需在523 K真空条件下脱气12 h。样品的比表面积(SBET)由Brunauer-Emmett-Teller (BET)理论计算得到;微孔孔容(Vmic)和孔径分布分别由t-plot法和HK法确定。
1.3.3 表观形貌观察 将样品均匀涂布在导电胶上,喷金,由扫描电子显微镜(QUANTA 250,美国 FEI 公司)在高真空下观察表面形貌。测试电压为12.50 kV,放大倍数为5 000倍。
1.4CH4/N2吸附等温线的测定
CH4和N2在GAC上的吸附等温线用磁悬浮热天平(德国Rubotherm公司)测定。关于磁悬浮热天平装置的描述和浮力校正已在我们课题组之前发表的文章中报道过[10-11]。先将GAC在423 K下真空活化10 h以除去吸附剂中的水蒸气,后续测量过程中吸附剂仅通过抽真空来脱气。CH4和N2纯组分的吸附等温线在303、333、363 K下测量,压力为0~1 000 kPa。
1.5CH4/N2的吸附/解吸曲线及稀释穿透曲线
CH4和N2在椰壳活性炭上的竞争吸附选择性是通过吸附穿透曲线实验得到的,实验装置如图1所示。关于实验装置的具体描述见文献[12]。详细的实验条件和参数列于表1。在开始测量前,吸附柱里面的吸附剂在423 K、氦气吹扫下,活化10 h。实验采用质谱仪(HPR20 QIC,英国Hiden公司)分析吸附柱顶端流出气体的组成,并实时记录。通过六通阀位置A和B两种状态的切换来进行测量。
竞争吸附选择性αCH4/N2由式(1)计算得到:
(1)
CH4和N2在GAC上的吸附动力学由稀释穿透曲线实验研究。实验装置与穿透曲线实验装置一致,但进料气换为CH4或N2摩尔分数为1%的CH4/He或N2/He混合气。测量了压力为101 kPa,温度为303、318、333 K下GAC的孔扩散系数。
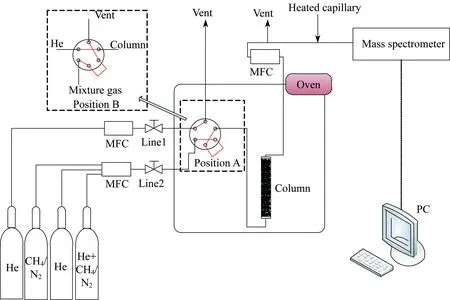
MFC—Mass flow controller 图1 稀释与穿透曲线实验装置图Fig.1 Schematic diagram of experimental apparatus for diluted and breakthrough curves表1 穿透曲线实验条件及吸附柱参数Table 1 Experimental conditions for breakthrough curves and parameters of adsorprtion column

Columnlength/cmColumndiameter/cmT/KTotalpressure/kPaFlowrate/(cm3·min-1)He1)He2)CH42)N22)19.81.05303101.33100502525
1) Line 1;2)Line 2
2 结果与讨论
2.1高效椰壳活性炭的制备与表征
本文以450~900 μm的颗粒状椰壳为活性炭原材料,经高温炭化得到炭化料,然后基于KOH活化的单因素实验和响应曲面实验对实验条件进行优化,确定了最佳的活化条件,在活化温度为1 110.23 K、活化时间为0.96 h、碱料质量比为2.92时,制得SBET=1 792.23 m2/g,αCH4/N2=3.57 (303 K,pCH4=pN2=25 kPa)的椰壳基活性炭(简写为GACKOH)。
本实验所选用的椰壳原料和椰壳炭化料的元素组成及工业分析结果列于表2。由表2可知,椰壳炭化料的碳元素质量分数高达89.19 %,固定碳质量分数(92.15 %)远远高于灰分(1.52 %),是制备活性炭吸附剂的优良原料。
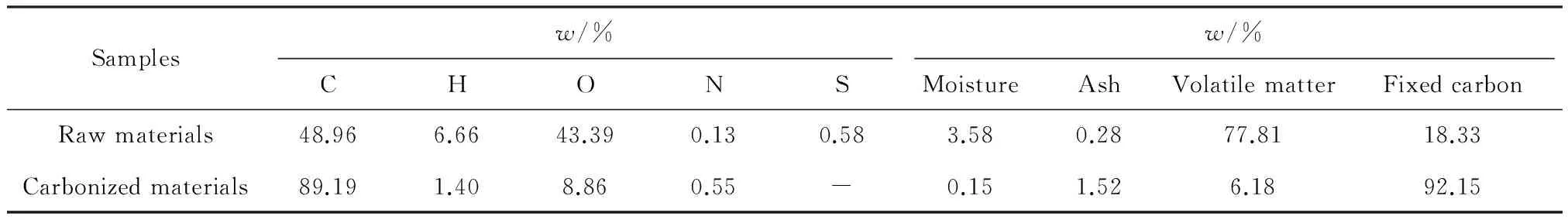
表2 椰壳原料和炭化料元素组成及工业分析Table 2 Elemental and proximate analysis results of coconut shell raw materials and carbonized materials
用于CH4/N2分离的良好吸附材料,不仅要有高的CH4吸附量,良好的CH4/N2选择性也是必不可少的。因为所有的活性炭样品都是通过KOH活化的方式制得,所以活性炭表面具有相似的官能团。具有相同表面官能团的吸附剂优先吸附那些吸附势能大、动力学直径小的气体。活性炭吸附剂对CH4/N2的最大吸附势能取决于其孔径分布[13],因此,我们通过对已经制得的GACKOH在923 K的温和条件下进行CO2二次活化来调节活性炭的孔径分布,从而制得高CH4/N2竞争选择性的活性炭GAC。
图2示出了制备优化的活性炭(GACKOH)的孔径分布、CO2二次活化处理过的活性炭(GAC)孔径分布及其低温氮吸附-脱附图。由图2可以看出,CO2处理过的活性炭的孔径分布出现了明显的右移,孔径分布更加集中在0.65~0.85 nm,αCH4/N2也由3.57提高到4.32 (由式(1)求得)。可以得出孔径分布在0.65~0.85 nm的活性炭对CH4/N2有更好的选择性,这与文献报道结果相符[14-15]。GAC的低温氮吸附-脱附曲线属于Ⅰ型(IUPA)等温线,说明CH4/N2在GAC上的吸附为微孔吸附。处理前后两种活性炭的详细结构参数列在表3中。从表3可以看出由于CO2的扩孔作用,处理过的活性炭孔径变大,相应的SBET有所减少,由1 792.23 m2/g变为1 450.87 m2/g;Vmic也相应减少,由0.66 cm3/g降为0.49 cm3/g;活性炭对CH4的吸附量在低压处(25 kPa)却基本没有减少。
图3(a)和3(b)分别为椰壳炭化料和GAC的扫描电镜图。从图3可以看出在炭化料表面没有可见孔的分布,只有不规则的裂隙和凹面,炭化料的比表面积为29.71 m2/g,也表明椰壳炭化料几乎没有孔隙存在。从图3(b)可以清晰地看到GAC表面均匀分布的大孔,适宜数量和分布的大孔和中孔给活性炭内部大量的微孔提供了传质通道,有利于吸附传质。

图2 GACKOH与GAC孔径分布图(a)及GAC低温氮吸附-脱附曲线(b)Fig.2 Pore size distributions of GACKOH and GAC (a) and N2 adsorption-desorption isotherms on GAC (b)表3 GACKOH和GAC的物性参数Table 3 Physical properties of GACKOH and GAC

AdsorbentPelletdiameter/μmSBET/(m2·g-1)Totalporevolume/(cm3·g-1)Vmic/(cm3·g-1)Averageporevolume/(cm3·g-1)Medianporewidth/nmGACKOH400~9001792.230.740.661.640.76GAC400~9001450.870.590.491.630.78

图3 椰壳炭化料和GAC的扫描电镜图Fig.3 SEM images of coconut shell carbonization sample and GAC
2.2CH4/N2在GAC上的吸附平衡及等量吸附热
图4所示为0~1 000 kPa,303、333、363 K下CH4和N2在制备的GAC上的吸附等温线,图中点代表测量数据,实线代表Toth模型[16]拟合结果。Toth模型表达式如下:
(2)
(3)
从图4可以看出,Toth模型可以较好地拟合实验数据,模型拟合的参数列于表4。由于活性炭对CH4/N2的吸附是放热过程,所以不论是CH4还是N2,随着吸附温度的降低,其平衡吸附量逐渐升高。同时,从图4可以看出,随着吸附压力的增加,CH4/N2的平衡吸附量也逐渐增加,在低压处增加较快,而后增加速度逐渐趋于缓慢。在相同的温度和压力下,CH4的平衡吸附量均明显高于N2。

图4 CH4和N2在GAC上的吸附等温线Fig.4 Adsorption equilibrium isotherms of CH4 and N2 on GAC表4 CH4和N2在GAC上吸附平衡的Toth模型拟合参数Table 4 Fitting parameters of Toth model for CH4 and N2 adsorption isotherms on GAC
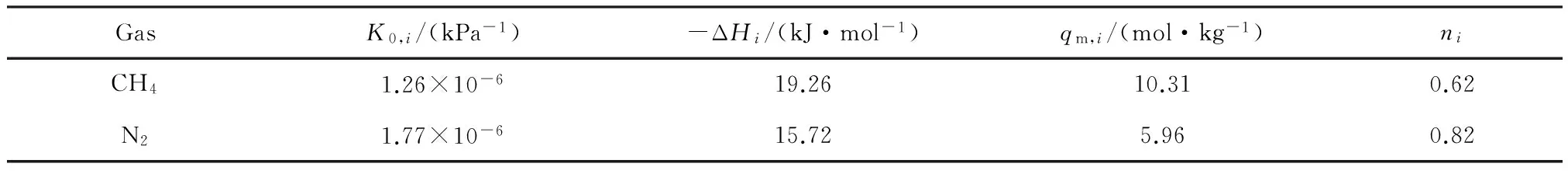
GasK0,i/(kPa-1)-ΔHi/(kJ·mol-1)qm,i/(mol·kg-1)niCH41.26×10-619.2610.310.62N21.77×10-615.725.960.82
CH4和N2在GAC上的等量吸附热如图5所示,其中点是由van’t Hoff方程[17]根据吸附平衡数据计算所得,实线由Toth模型拟合得到。从图5可以看出,吸附热随着吸附量的增大逐渐减少,直到趋于定值,表明颗粒状椰壳基活性炭具有非均匀表面。同时,在Toth模型中,参数ni用于描述吸附剂界面的非均匀性,ni比1越小,表明吸附剂表面的非均匀性越强[17]。在本实验拟合中,ni值分别为0.62和0.82,均小于1,表明GAC表面具有非均匀性。并且较高的CH4吸附热也表明CH4与GAC的吸附作用更强。

图5 CH4和N2在GAC上的等量吸附热Fig.5 Isosteric heat of adsorption for CH4 and N2 adsorption on GAC
2.3CH4/N2在GAC上的扩散系数
CH4和N2在吸附剂颗粒上的扩散系数由稀释穿透曲线实验测定。实验时,采用低摩尔分数(1%)的吸附质气体(CH4和N2)保证吸附平衡是线性的(吸附处于亨利区),吸附热很小,近似为等温过程。同时,极小的吸附质可以假设气体沿吸附柱速度不变,仅存在轴向扩散的活塞流。基于以上假设,采用等温无动量损失的双分散二级孔结构扩散模型(Bi-pore Diffusion Model)[18]描述CH4和N2的吸附动力学,模型的相关关系式见式(4)~式(13)。其中,活性炭吸附剂的孔曲折因子为4.0,孔隙率为0.46。
对吸附质组分i进行物料衡算:
(4)
初始条件Ci(0,z)=0;
边界条件
对组分i在吸附剂颗粒内进行物料衡算:
(5)
初始条件Cip(0,R)=0;
边界条件
对组分i在吸附剂晶体微孔中进行物料衡算:
(6)
初始条件q(0,r)=0;
边界条件
Dax=(0.45+0.55εc)Dm+0.35Rpu
(7)
(8)
(9)
(10)
(11)
Dij可由Chapman-Enskoy方程[19]求得:
(12)
(13)
CH4和N2在303、318、333 K下的稀释穿透曲线如图6所示,图中点代表实验数据,线代表拟合值,两者吻合较好。从图6可以直观地看出,随着填充床吸附温度的升高,CH4和N2稀释穿透曲线的穿透点不断前移,且从穿透到饱和的时间越来越短。说明随着温度的逐渐升高,传质越来越快,传质效果也越来越好。在相同的条件下,N2在GAC上的扩散速度大于CH4。
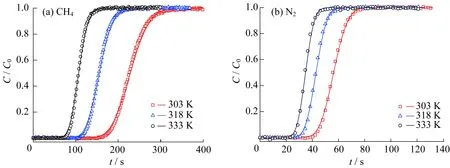
图6 CH4和N2在GAC填充的床层上的稀释穿透曲线Fig.6 Diluted breakthrough curves of CH4 and N2 in GAC packed bed
CH4和N2在GAC上的各个扩散系数如表5所示,在相同温度下,N2的Dc/r2值比CH4高一个数量级。图7描述了不同温度下Dc/r2值与温度呈现出的一定指数关系,据此关系可以计算其指前因子和Ea,由此可以计算出任何温度下CH4和N2在GAC上的扩散系数。

表5 CH4和N2在GAC填充床层上的扩散系数Table 5 Mass transfer parameters for CH4 and N2 on the GAC packed bed

图7 CH4和N2在GAC上微孔扩散系数与温度的关系Fig.7 Temperature dependence of micropore diffusivity of CH4 and N2 on GAC
线性吸附平衡条件下,文献[20]提出了一个包括所有阻力影响的总传质系数k′来分析各个扩散系数的相对重要性,表达式见式(14):

(14)
式(14)等号右边的每一项代表不同扩散阻力,从左到右依次为轴向扩散阻力、外膜扩散阻力、大孔扩散阻力和微孔扩散阻力。根据表5中的数据,可以计算外膜扩散阻力、大孔扩散阻力及微孔扩散阻力对GAC颗粒内传质的贡献,结果列于表6。从表6可以看出,CH4和N2在GAC上的微孔扩散阻力贡献最大,所以微孔扩散是CH4和N2在GAC上扩散的控制步骤。
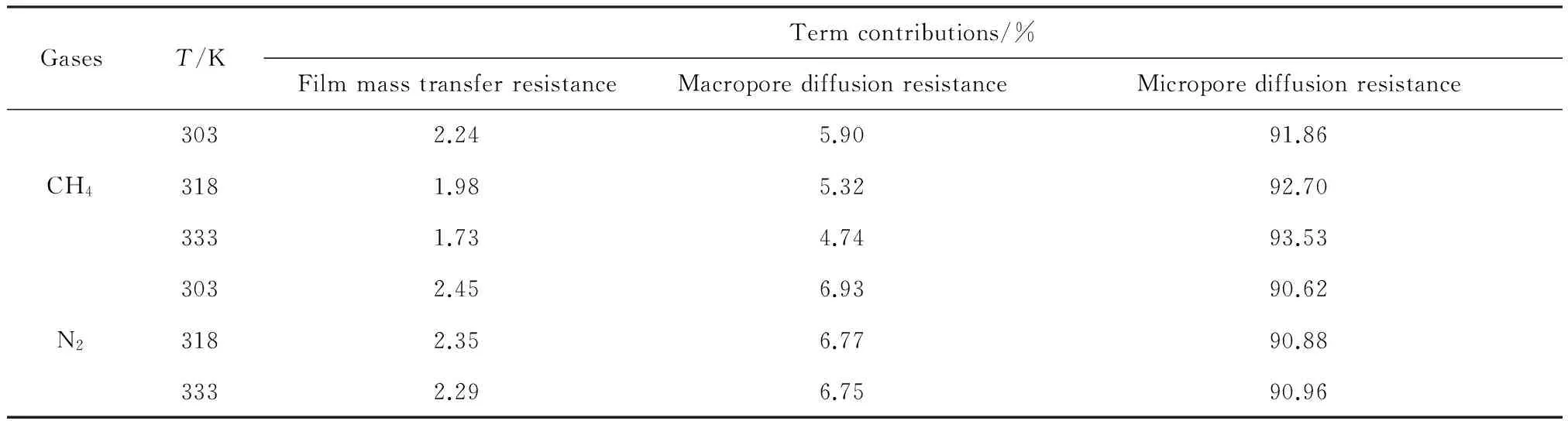
表6 外膜扩散阻力、大孔扩散阻力及微孔扩散阻力在GAC颗粒内的相对比例Table 6 Relative proportion of the film mass transfer resistance,macropore diffusion resistance and micropore diffusion resistance for CH4 and N2 on GAC
2.4椰壳活性炭填充床动态吸附分离CH4/N2
CH4和N2均为非极性气体,其物化性质相似,且CH4动力学直径(0.38 nm)接近N2动力学直径(0.364 nm)。尽管活性炭对CH4的吸附优于N2(平衡效应),但是活性炭在选择性吸附CH4时,其微孔孔道位阻效应高于N2(动力学效应),导致其在分离CH4与N2时两种效应部分相抵,降低了分离效果。本文制备的高效椰壳活性炭GAC材料也是如此,从图4看出,在相同压力和温度下,CH4的平衡吸附量明显高于N2平衡吸附量。吸附动力学实验发现N2在GAC的微孔内扩散速度大于CH4,如图6所示。
图8所示为303 K、总压101.325 kPa、CH4和N2分压均为25 kPa下,CH4和N2在GAC床层上的单组分和双组分穿透和解吸曲线。从曲线可以看出,CH4作为强吸附组分,在相同条件下,其穿透时间明显比N2滞后,通过穿透曲线的积分计算可以求出CH4和N2单组分在303 K、25 kPa下的吸附量,计算值与磁悬浮热天平测量值一致。此外,通过曲线计算的CH4和N2吸附、解吸的量相同,说明吸附过程是一个可逆过程。从图8(c)所示的CH4和N2双组分竞争穿透解吸曲线结果可以看出,采用研制的GAC填充固定床,CH4和N2主要是通过平衡效应进行分离,弱吸附组分N2出现“鼓包”现象。这是因为在吸附过程中CH4作为强吸附
组分会把之前GAC吸附的弱吸附组分N2替换出来,导致弱吸附组分N2在吸附床层的摩尔分数高于进料摩尔分数。通过CH4/N2摩尔流量的积分计算可以求得αCH4/N2为4.32。同时,根据图4所示CH4和N2在303 K下的吸附平衡数据,可以估算出相同分压下CH4和N2的平衡选择系数α12,即为303 K下CH4和N2的纯组分平衡吸附量之比(α12=qCH4/qN2)。图9示出了CH4和N2的平衡分离系数和竞争吸附选择性随压力的变化。如图9所示,随着压力的升高,α12逐渐降低。在低压区,GAC的α12较高。图9中圆点为303 K、25 kPa下CH4和N2在GAC上的αCH4/N2,可以看出在相同的低压下,αCH4/N2接近α12,说明平衡分离效应远大于动力学分离效应,所以,CH4/N2在椰壳活性炭填充床吸附分离属于平衡分离效应。
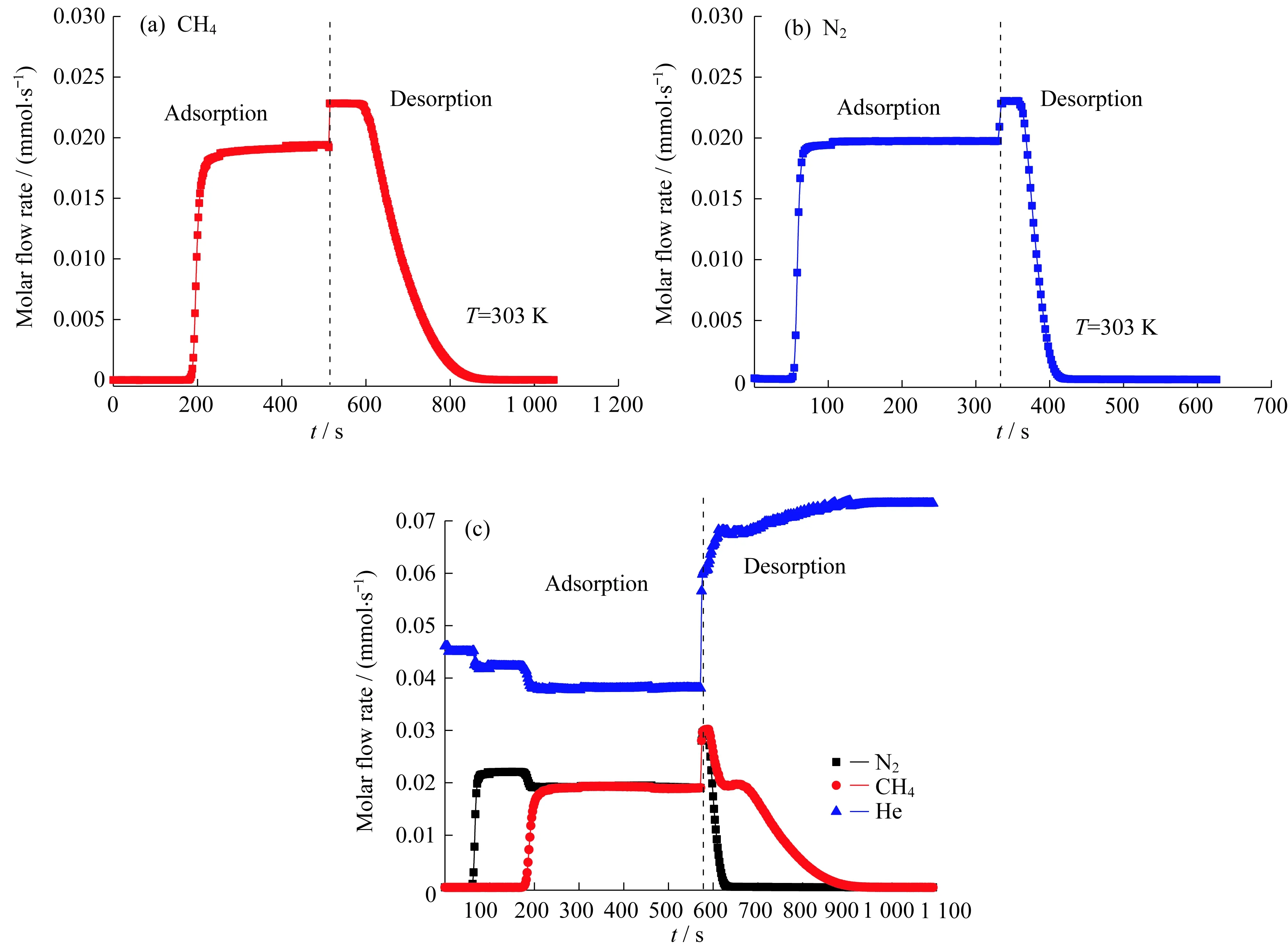
图8 CH4和N2在GAC床层上吸附穿透曲线Fig.8 Breakthrough curves of CH4 and N2 in column packed with GAC
表7比较了CH4和N2在不同炭基吸附剂上的吸附平衡。从表7可以看出,在温度为298 K左右,压力为100 kPa左右时,不同的炭基材料对CH4和N2的吸附量及平衡选择性呈现出一定的差异。其中,本实验所制得的椰壳活性炭GAC具有最高的CH4吸附量,为1.46 mol/kg;其次为Monolith活性炭,CH4吸附量为1.30 mol/kg。对于CH4和N2的平衡选择系数,颗粒活性炭JX-101最大,柱状活性炭Xtrusorb A754最小。基质、官能团、孔径分布和比表面积的差异是造成炭基材料对CH4和N2分离效果差异的主要因素。本实验制备的高吸附量的炭基材料非常有利于CH4/N2变压吸附分离过程。

图9 CH4和N2的平衡分离系数和竞争吸附选择性随压力的变化Fig.9 Changes of equilibrium separation factors and competitive adsorption selectivity of CH4/N2 with pressure
3 结 论
将椰壳炭化料进行KOH活化和CO2二次活化,可以得到高CH4吸附量、高CH4/N2选择性的椰壳颗粒状活性炭GAC。制备的椰壳基活性炭CH4吸附量达到1.46 mol/kg (303 K,101 kPa),CH4/N2竞争吸附选择性达到4.32 (303 K,pCH4=pN2=25 kPa),明显高于其他文献报道的活性炭吸附分离性能。Toth模型可以较好地预测CH4和N2在GAC上的吸附平衡数据,CH4是强吸附组分,N2是弱吸附组分。CH4和N2在GAC上的扩散控制步骤为微孔扩散,且N2在GAC的微孔内扩散速度大于CH4的扩散速度。
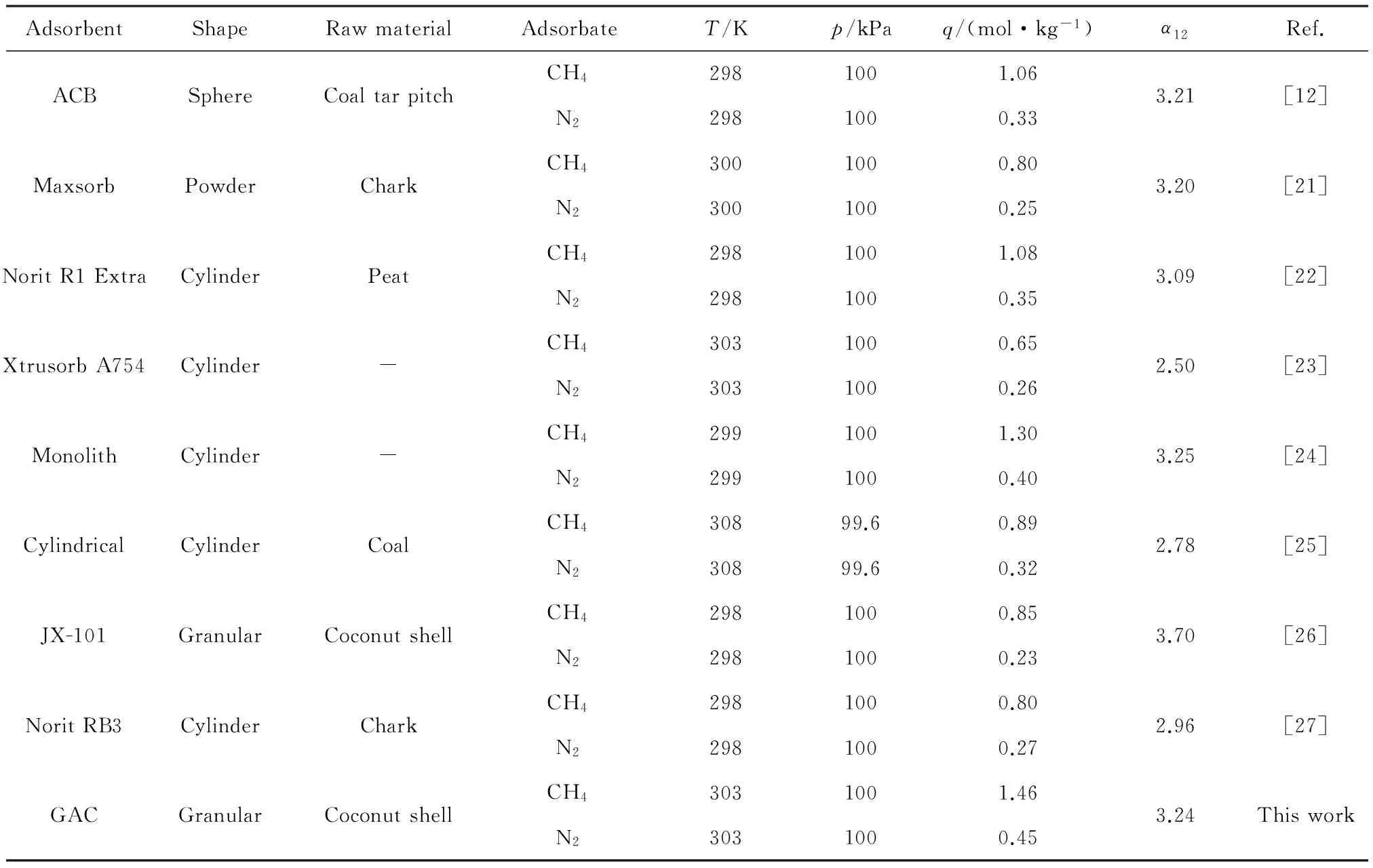
表7 CH4和N2在不同炭基材料上吸附性能比较Table 7 Comparison of adsorption properties of CH4 and N2 on different carbon adsorbents
椰壳活性炭填充床中双组分CH4/N2竞争吸附穿透曲线显示N2优先穿透并出现“鼓包”,表明CH4的吸附能力强于N2,结合动力学数据可知,CH4和N2在吸附剂上的扩散速度较快,可以判断,CH4的吸附能力强于N2,主要由于平衡吸附量不同造成,因此CH4/N2混合物在椰壳活性炭填充床吸附分离属于平衡分离效应。
符号说明:
Ci——组分i在气相中的浓度,mol/m3
C(i)0——组分i进料浓度,mol/m3
Cip——组分i在大孔中的气相浓度,mol/m3
Dax——轴向扩散系数,m2/s
Dc——微孔扩散系数,m2/s

Dij——双组分的分子扩散系数,m2/s
Dk,i——Knudsen扩散系数,m2/s
Dm,i——分子扩散系数,m2/s
Dp——大孔扩散系数,m2/s
Ea——活化能,kJ/mol
H——亨利系数,m3/kg
KC——量纲为一的亨利吸附平衡常数
Ki——组分i的吸附平衡常数,kPa-1
K0,i——组分i的无限温度吸附平衡常数,kPa-1
kf——膜扩散系数,m2/s
L——吸附柱长度,m
Mi——组分i的相对分子质量,g/mol
ni——界面非均匀参数
p——吸附实验压力,kPa
pCH4——CH4气体的分压,kPa
pN2——N2气体的分压,kPa
q——CH4(N2)平衡吸附量,mol/kg
qs——对应的平衡吸附量,mol/kg
qCH4——CH4在吸附相的竞争吸附量,mol/kg
qN2——N2在吸附相的竞争吸附量,mol/kg
qi——组分i的平衡吸附量,mol/kg
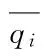
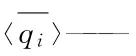
qm,i——组分i的饱和吸附量,mol/kg
Rg——理想气体常数,J/(mol·K)
R——吸附剂颗粒半径,m
r——微孔半径,m
rp——大孔平均半径,m
S——颗粒的形状因子
T——吸附实验温度,K
t——时间,s
u——表观流速,m/s
yi——气相中组分i的摩尔分数
z——轴向坐标,m
αCH4/N2——CH4/N2的竞争吸附选择性
ρp——吸附剂的颗粒密度,kg/m3
ρg——气体密度,kg/m3
ΔHi——组分i的吸附热,kJ/mol
α——CH4/N2平衡选择系数
μ——气体黏度,Pa·s
εc——床层空隙率
εp——吸附剂颗粒的孔隙率
τp——孔曲折率
Ωc——微孔线性推动力系数
Ωp——大孔线性推动力系数
[1] DOMAN LINDA E.International Energy Outlook 2013[R].Washington:U.S.Energy Information Administration,2013.
[2] MOKHATAB SAEID,POE WILLIAM A.Handbook of natural gas transmission and processing[M].Waltham:Elsevier,2012.
[3] SIRCAR Shivaji.Pressure swing adsorption[J].Industrial & Engineering Chemistry Research,2002,41(6):1389-1392.
[4] EL-HENDAWY,ABDEL N A,ANDREW J,etal.Effects of activation schemes on porous,surface and thermal properties of activated carbons prepared from cotton stalks[J].Journal of Analytical and Applied Pyrolysis,2008,82(2):272-278.
[5] HUI Deng,LI Guoxue,YANG Hongbing,etal.Preparation of activated carbons from cotton stalk by microwave assisted KOH and K2CO3activation[J].Chemical Engineering Journal,2010,163(3):373-381.
[6] HU Zhonghua,SRINIVASAN M P.Preparation of high-surface-area activated carbons from coconut shell[J].Microporous and Mesoporous Materials,1999,27(1):11-18.
[7] CAZETTA A L,VARGAS A M M,NOGAMI E M,etal.NaOH-activated carbon of high surface area produced from coconut shell:Kinetics and equilibrium studies from the methylene blue adsorption[J].Chemical Engineering Journal,2011,174(1):117-125.
[8] LI Xiao,XING Wei,ZHUO Shuping,etal.Preparation of capacitor’s electrode from sunflower seed shell[J].Bioresource Technology,2011,102(2):1118-1123.
[9] ABDELHAKIM E,ZULAMITA Z B,FRANCISCO C M,etal.Activated carbons from KOH-activation of argan (Argania spinosa) seed shells as supercapacitor electrodes[J].Bioresource Technology,2012,111(1):185-190.
[10] WU Yijiang,YANG Ying,KONG Xiangming,etal.Adsorption of pure and binary CO2,CH4,and N2gas components on activated carbon beads[J].Journal of Chemical and Engineering Data,2015,60(9):2684-2693.
[11] YANG Y,RIBEIRO A M,LI P,etal.Adsorption equilibrium and kinetics of methane and nitrogen on carbon molecular sieve[J].Industrial & Engineering Chemistry Research 2014,53(43):16840-16850.
[12] YANG Ying,WU Yijiang,LIU Haiqing,etal.Enrichment of ventilation air methane by adsorption with displacement chromatography technology:Experiment and numerical simulation[J].Chemical Engineering Science,2016,149:215-228.
[13] CUI Xiaojun,BUSTIN R M,DIPPLE G.Selective transport of CO2,CH4,and N2in coals:Insights from modeling of experimental gas adsorption data[J].Fuel,2004,83(3):293-303.
[14] LIU Congmin,DANG Yanyan,ZHOU Yaping,etal.Effect of carbon pore structure on the CH4/N2separation[J].Adsorption,2012,18(3-4):321-325.
[15] GU Min,ZHANG Bo,QI Zhendong,etal.Effects of pore structure of granular activated carbons on CH4enrichment from CH4/N2by vacuum pressure swing adsorption[J].Separation and Purification Technology,2015,146:213-218.
[17] DO D D.Adsorption Analysis:Equilibria and Kinetics[M].London:Imperial College Press,1998.
[18] SHEN C Z,GRANDE C A,LI P,etal.Adsorption equilibria and kinetics of CO2and N2on activated carbon beads[J].Chemical Engineering Journal,2010,160(2):398-407.
[19] YANG R T.Gas Separation by Adsorption Processes[M].London:Butterworth-Heinemann,2013.
[20] RUTHVEN D M.Principles of Adsorption and Adsorption Processes[M].New York:John Wiley & Sons,1984.
[21] SHEIKH M A,HASSAN M M,LOUGHLIN K F.Adsorption equilibria and rate parameters for nitrogen and methane on Maxsorb activated carbon[J].Gas Separation & Purification,1996,10(3):161-168.
[22] HIMENO S,TOSHIYA K,FUJITA S.High-pressure adsorption equilibria of methane and carbon dioxide on several activated carbons[J].Journal of Chemical and Engineering Data,2005,50(2):369-376.
[23] KENNEDY D A,MUJCIN M,TRUDEAU E.Pure and binary adsorption equilibria of methane and nitrogen on activated carbons,desiccants,and zeolites at different pressures[J].Journal of Chemical and Engineering Data,2016,61(9):3163-3176.
[24] RIBEIRO R P,SAUER T P,LOPES F V,etal.Adsorption of CO2,CH4,and N2in activated carbon honeycomb monolith[J].Journal of Chemical and Engineering Data,2008,53(10):2311-2317.
[25] PARK Y,MOON D K,KIM Y H,etal.Adsorption isotherms of CO2,CO,N2,CH4,Ar and H2on activated carbon and zeolite LiX up to 1.0 MPa[J].Adsorption,2014,20(4):1-17.
[26] WU Jiaquan,ZHOU Li,SUN Yan,etal.Measurement and prediction of adsorption equilibrium for a H2/N2/CH4/CO2mixture[J].AIChE Journal,2007,53(5):1178-1191.
[27] RUFFORD T E,WATSON G C Y,SALEMAN T L,etal.Adsorption equilibria and kinetics of methane nitrogen mixtures on the activated carbon Norit RB3[J].Industrial & Engineering Chemistry Research,2013,52(39):14270-14281.
PreparationofHighEfficientCoconutActivatedCarbonandItsAdsorptionEquilibriaandKineticsofCH4/N2
YANGLin,YANGYing,LIUCheng-lin,LIPing,YUJian-guo
(StateKeyLaboratoryofChemicalEngineering,EastChinaUniversityofScienceandTechnology,Shanghai200237,China)
Coconut activated carbon with high specific surface area was prepared through carbonization of raw coconut shell and KOH activation under optimum conditions.The adsorption selectivity of CH4/N2was improved with CO2activation in order to prepare the high efficient coconut activated carbon for the separation of CH4/N2.The adsorption equilibrium isotherms of CH4and N2on the high efficient coconut activated carbon were measured at303—363K and0—1000kPa in a magnetic suspension balance.The experimental data were fitted with Toth model,and the model parameters and kinetic ones such as adsorption heat were obtained.Both the isothermal bidisperse pore model and the diluted breakthrough curve experiment were used to study the adsorption kinetics of CH4and N2on the high efficient coconut activated carbon.Furthermore,the fixed-bed adsorption and desorption experiments were carried out to study the separation mechanism of CH4/N2using the coconut activated carbon.The results presented here would be significant for the development and optimization of pressure swing adsorption process for CH4/N2effective separation using the high efficient coconut activated carbon.
coconut activated carbon; CH4/N2separation; adsorption equilibrium; adsorption kinetics; unconventional natural gases
1006-3080(2017)04-0449-10
10.14135/j.cnki.1006-3080.2017.04.001
2016-12-16
国家国际合作项目(2015DFG42220,S2016G1410);国家自然科学基金(U1610102)
杨 林(1991-),男,山东烟台人,硕士生,研究方向为吸附分离。
于建国,E-mail:jgyu@ecust.edu.cn
TQ021
A
