肾络通对高糖培养足细胞VEGF和Flt-1的影响❋
2017-09-18娄菲菲潘利敏王月华丁英钧河北医科大学第三医院石家庄05008河北省沧州市中西结合医院沧州0600河北省中医院石家庄0500河北中医学院石家庄05000
娄菲菲,方 超,潘利敏,王月华△,丁英钧,郭 帅,李 英(. 河北医科大学第三医院,石家庄 05008; . 河北省沧州市中西结合医院,沧州 0600; . 河北省中医院,石家庄 0500; . 河北中医学院,石家庄 05000)
【实验研究】
肾络通对高糖培养足细胞VEGF和Flt-1的影响❋
娄菲菲1,方 超2,潘利敏3,王月华1△,丁英钧4,郭 帅1,李 英1
(1. 河北医科大学第三医院,石家庄 050081; 2. 河北省沧州市中西结合医院,沧州 061001; 3. 河北省中医院,石家庄 050011; 4. 河北中医学院,石家庄 050200)
目的:探讨肾络通对高糖培养足细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(vascular endothelial growth factor receptor-1,VEGFR1/Flt-1)的影响。方法:将12只SPF级雄性SD大鼠按随机数字表法分为对照组和低、中、高剂量中药组。对照组给予生理盐水,处理组给予不同剂量的肾络通中药灌胃,各组均在灌胃3 d后心脏无菌取血制备中药血清,小鼠足细胞的培养分为空白对照组、高糖组、正常鼠血清对照组和低、中、高剂量中药血清组,刺激24 h后采用免疫细胞化学(immunocytochemistry)、免疫印迹(western blot)、荧光实时定量PCR(Real-time PCR)法观察VEGF、Flt-1表达的变化。结果:VEGF、Flt-1在高糖组和正常鼠血清组小鼠足细胞均可见阳性表达,中药血清组的足细胞VEGF、Flt-1蛋白和mRNA均较高糖组和正常鼠血清组降低,差异有统计学意义。结论:肾络通可抑制高糖环境下足细胞VEGF、Flt-1的表达,减轻足细胞的损伤,保护肾功能。
糖尿病肾病;中药;足细胞;血管内皮生长因子
糖尿病肾病(diabetic nephropathy, DN)是糖尿病患者重要的并发症之一,以糖尿病为原发病的慢性肾脏病患者罹患更高的死亡率、心血管事件和肾衰竭的风险[1],DN现已成为导致终末期肾脏病(end-stage renal disease,ESRD)的重要病因。
前期研究中,我们以益气养阴消癥通络为DN的治疗大法,研究证实该法通过对DN大鼠TGF-β/Smads、氧化应激、肾素-血管紧张素-醛固酮(RASS)系统、足细胞裂孔隔膜蛋白[2]的影响发挥对DN的治疗作用。本研究继以高糖环境下培养的足细胞为研究对象并进行体外实验,从细胞水平观察肾络通对高糖刺激足细胞VEGF及Flt-1表达的影响。
1 材料
1.1 动物
SPF级SD雄性大鼠12只,体质量200~220 g(动物合格证编号1404079),购自河北医科大学实验动物中心。
1.2 药物及细胞
肾络通组成:地龙12 g,鳖甲15 g,丹参15 g,大黄6 g,僵蚕10 g,乌梢蛇10 g,水蛭3 g,黄芪20 g,玄参15 g,熟地15 g,山萸肉10 g,均为免煎颗粒(广东一方制药有限公司)。中剂量中药组为临床剂量,低、高剂量分别为临床的半量和2倍用量,按Meeh-Rubner公式[3-4]折算。永生化小鼠足细胞购自北京协和医学院基础学院基础医学细胞中心。
1.3 主要试剂与仪器
兔抗小鼠VEGF多克隆抗体,Affitiny AF5131(英国EterLife公司);兔抗小鼠Flt-1多克隆抗体,Affinity AF6204(武汉三鹰生物技术有限公司); HRP标记的山羊抗兔二抗,Maibio HSA0003(上海麦约尔生物技术有限公司)。表1显示,VEGF、Flt-1、GAPDH引物由广州复能基因有限公司合成;Real-time PCR试剂盒,Takara公司;转移电泳仪,北京六一仪器厂;PCR扩增仪,西安天隆科技有限公司;Real-time PCR仪,美国Stratagene Mp3005p。
2 方法
2.1 分组与血清制备
按随机数字表法将12只SD大鼠分为正常对照组和低、中、高剂量中药血清组,适应性饲养24 h后,每只大鼠每12 h灌胃1次,连续给药3 d后心脏无菌取血制备药物血清。
2.2 小鼠足细胞培养
2.2.1 细胞复苏 将冻存管取出后迅速放入37 ℃水浴箱中,勿使水面没过冻存管口以免造成细胞污染,待冻存液溶解后进行细胞培养。
2.2.2 细胞培养及分组 小鼠足细胞在底面积75 cm2的培养瓶中进行培养,加入完全培养基,包括10%胎牛血清(fetal bovine serum,FBS)、10U/ml小鼠重组γ-IFN、双抗100 U/ml青霉素和0.1 mg/ml链霉素(P/S)。将细胞接种均匀后置于33 ℃、5%CO2培养箱中增殖,细胞密度约80%时传代,在无γ-IFN的培养基、37 ℃、5%CO2培养箱中培养10~14 d,待细胞分化成熟后血清饥饿24 h。将细胞分为正常对照组(Normal Control,NC)、高糖组(High Glucose,HG)、正常鼠血清组(Normal Rat,NR)、低剂量中药血清组(Low dose of drug,LD)、中剂量中药血清组(Normal dose of drug,ND)、高剂量中药血清组(High dose of drug,HD)。NC组细胞培养基为D-glucose 5.5 mmol/L+5%FBS,HG组培养基为D-glucose 30 mmol/L+5%FBS,NR组培养基为D-glucose 30mmol/L+5%FBS+5%正常鼠血清,LD组培养基为D-glucose 30 mmol/L+5%FBS+5%低剂量中药血清,ND组培养基为D-glucose 30 mmol/L+5%FBS+5%中剂量中药血清,HD组培养基为D-glucose 30 mmol/L+5%FBS+5%高剂量中药血清。刺激24 h后进行免疫细胞化学、免疫印迹、荧光实时定量PCR检测。
2.3 指标检测
2.3.1 免疫细胞化学 将细胞接种于铺有载玻片的24孔板,待细胞贴壁后弃培养液,4 ℃预冷的PBS洗涤后空气干燥,于玻片上滴加预冷的4%多聚甲醛200~300 μL,4℃过夜。次日用蒸馏水洗涤玻片后用PBS浸泡5 min,再将玻片放入3% H2O2去离子水中,室温30 min,0.3%Triton X-100通透30 min,10%BSA封闭,室温10 min。将兔抗鼠VEGF多克隆抗体(Affitiny AF5131 1∶100)、兔抗鼠Flt-1多克隆抗体(Affinity AF6204 1∶100)分别滴加于玻片上, 4 ℃过夜。次日取出玻片用PBS洗涤,随后将HRP标记的山羊抗兔二抗(Maibio HSA0003)滴加于载玻片细胞面,室温避光30 min。加入显色液反应后蒸馏水冲洗,苏木素染1 min,充分冲洗后置于不同浓度的乙醇中梯度脱水,中性树胶封片后光镜下观察VEGF、Flt-1的表达情况。
2.3.2 免疫印迹 取出足细胞弃去培养液,用4 ℃预冷的PBS洗涤,吸干PBS加入RIPA细胞裂解液,冰上裂解30 min后将细胞混悬液收集, 4 ℃、12000 rpm/min离心10 min,吸取上清即为细胞总蛋白。BCA法测定总蛋白浓度,蛋白上样量40 μg,浓缩胶40V,分离胶60V恒压进行电泳,随后进行电转印2 h,结束后用 5%脱脂奶粉室温封闭1 h。滴加兔抗鼠VEGF多克隆抗体(Affitiny AF5131 1∶100),兔抗鼠Flt-1多克隆抗体(Affinity AF6204 1∶100),4 ℃过夜。次日洗膜后用山羊抗兔二抗室温孵育60 min。TBST洗膜后放入Image Quant Las mini成像系统, Image J进行灰度分析,以对照组为l,计算余组表达量。
2.3.3 荧光实时定量PCR 提取细胞总RNA在培养瓶中加入Trizol 1ml,15 min后将细胞收集至EP管中,每管加入200 μL三氯甲烷混匀,随后4℃12000 rpm/min离心20 min,取上层水相移至新的EP管后,加入等体积异丙醇混匀后冰上静置15 min。4℃12000 rpm/min离心20 min,弃上清后干燥,75%无水乙醇lml充分洗涤RNA沉淀再次离心,弃上清后室温干燥,加入适量1‰ DEPC水溶解RNA,并用枪轻柔吹打混匀,对RNA样品进行品质鉴定。混匀PCR Mix并将室温孵育1 h。表1显示,95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,40个循环后记录CT值。以GAPDH作为内参,用2-△△CT法进行分析,以对照组为1,计算其他各组的相对表达量。
2.4 统计学方法
3 结果
3.1 免疫细胞化学检测VEGF、Flt-1
图1、2显示,显微镜下观察VEGF、Flt-1主要在足细胞的胞浆内表达,在正常组的细胞浆内少量表达;高糖组、正常鼠血清组在细胞浆、核周均可见阳性表达,2组表达量相近。中药组胞浆中的表达均较高糖组、正常鼠血清组低,且中剂量中药组VEGF、Flt-1的表达较弱。

图1 免疫细胞化学检测VEGF的表达(×200)

图2 免疫细胞化学检测 Flt-1 的表达(×200)
3.2 免疫印迹法检测VEGF、Flt-1蛋白表达量
图3、4显示,高糖组、正常鼠血清组VEGF表达明显升高,2组与空白对照组和中剂量中药组比较差异有统计学意义(P<0.05)。中药组较高糖组、正常鼠血清组VEGF表达量降低,且用药剂量与VEGF表达量呈负相关。Flt-1与VEGF趋势一致,高糖和正常鼠血清组均出现高表达,中药组表达量降低。
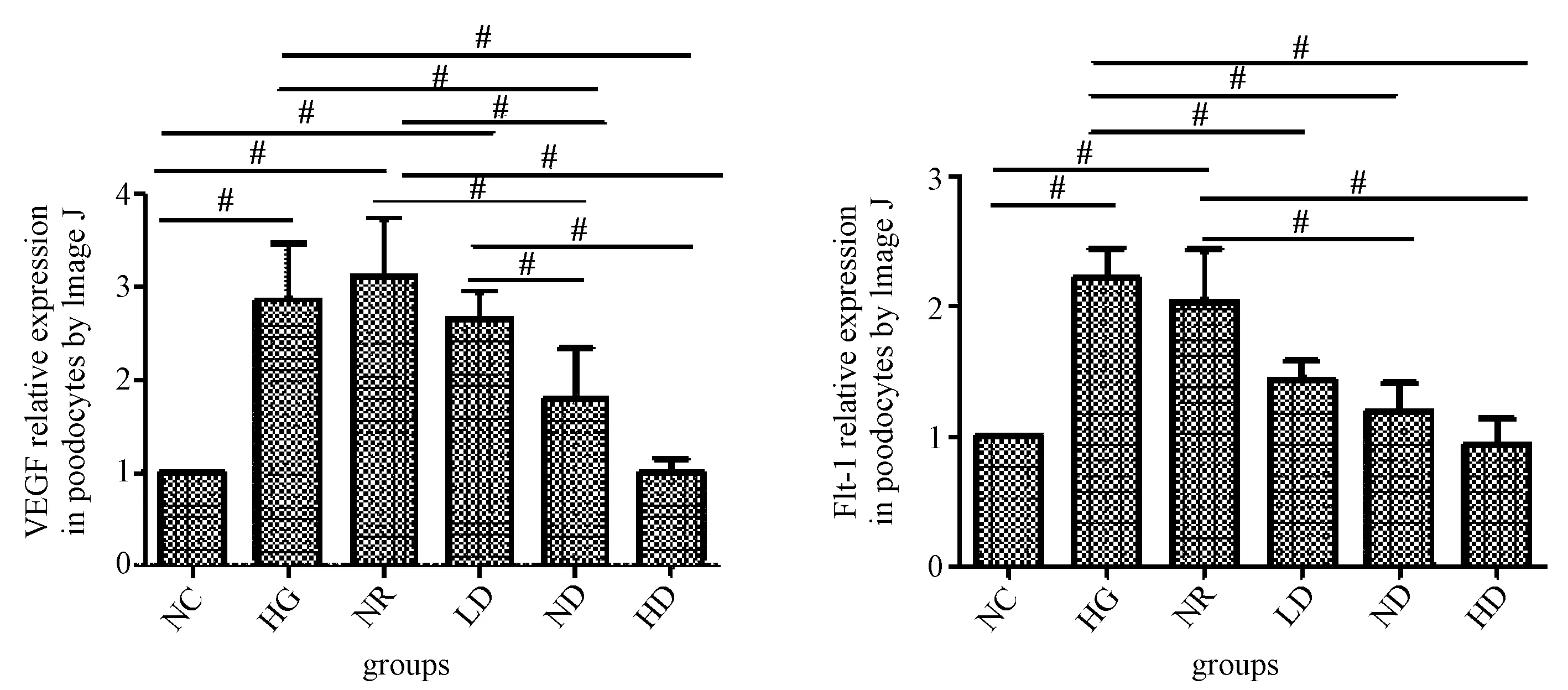
图4 免疫印迹检测VEGF和 Flt-1蛋白表达量
3.3 荧光实时定量PCR法检测VEGF、Flt-1的mRNA表达量
图5显示,高糖组和正常鼠血清组VEGF mRNA表达量均较空白对照组和中药组高(P<0.05)。中药组较高糖组和正常鼠血清组VEGF表达下调,且药物剂量与VEGF呈负相关,差异有统计学意义(P<0.05)。Flt-1 mRNA表达趋势与VEGF大致一致,中药组较高糖组和正常鼠血清组显著降低,说明剂量越大表达量越低。

表1 VEGF FLT-1 GAPDH基因序列
4 讨论
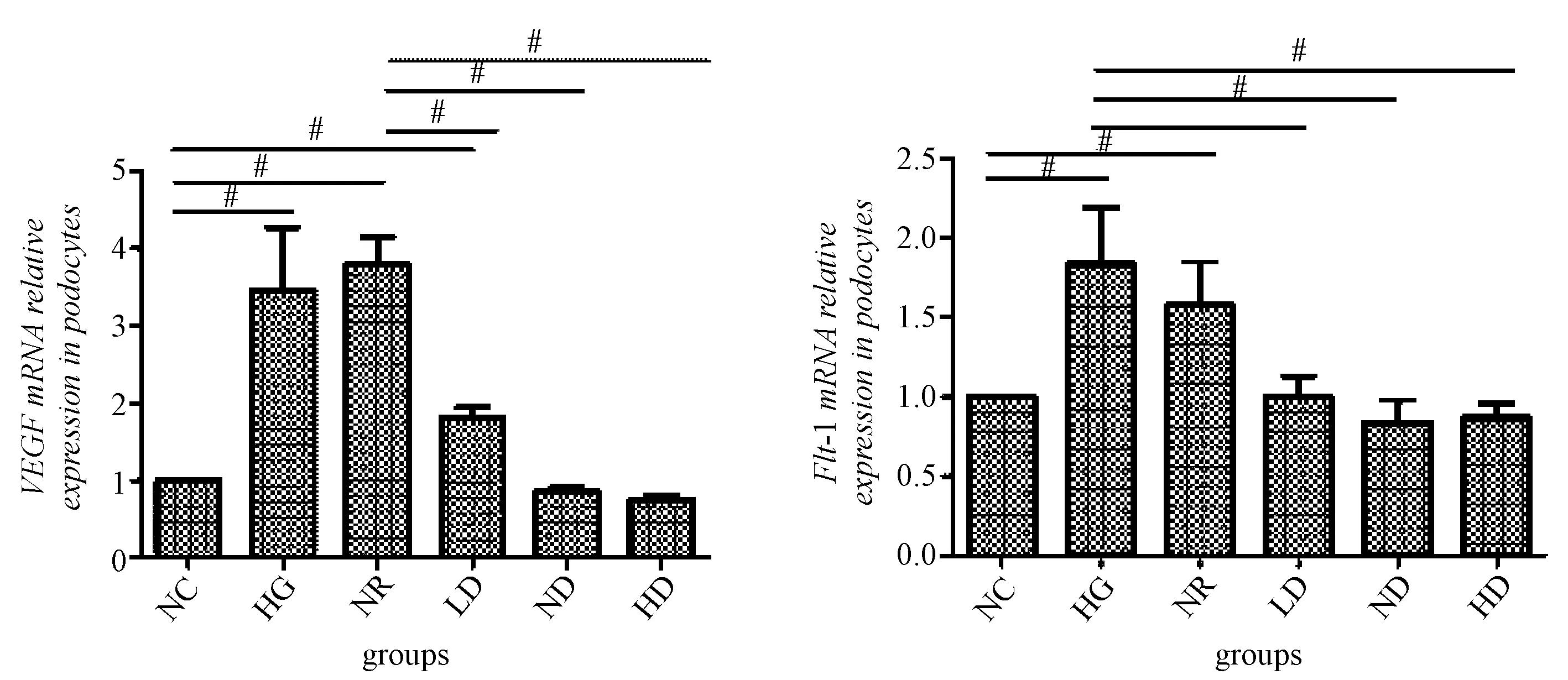
图5 实时荧光定量PCR检测VEGF 和 Flt-1的mRNA表达量
足细胞是肾小球血管壁的主要成分之一,对于维持血管壁的完整性至关重要。足细胞的损伤会导致肾小球高压力、高滤过,加速蛋白尿的产生和肾脏病的进展。微血管病变是DN发病及病情进展的重要因素,VEGF是体内最具活力的血管生长因子,在DN微血管病变中的意义重大,其在肾脏内主要由足细胞分泌,并且在肾小球内皮细胞、肾小管上皮细胞和系膜细胞中均有一定表达。Flt-1、Flk为VEGF的特异性受体,其中Flt-1参与细胞的增殖和分化过程,全长7680 bp位于13q12号染色体上,分子量约180KD,由7个免疫球蛋白样环的胞外区、跨膜区和酪氨酸激酶区构成,可结合于VEGF121、VEGF165[5]。VEGF过表达并通过旁分泌途径对酪氨酸激酶受体Flt-1发挥正向调控作用,二者结合后才能激活一系列信号通路进而发挥生物学效应[6],最主要的是可以增加内皮细胞通透性,并可能会使足细胞骨架结构发生改变、足突融合,使肾小球滤过屏障受损,导致蛋白尿的产生,加速DN的进展[9]。另有研究发现,VEGF在血管生成过程中可激活Notch信号通路。John C. Chappell等[10]发现,Flt-1作为Notch信号通路的上游,通过调节VEGF信号可以在血管形成的过程中介导重要的VEGF-Notch通路反馈环,Flt-1调节VEGF信号功能的缺失会使Notch信号过高表达。Flt-1在此信号通路中发挥重要作用,其缺失会使信号通路出现紊乱,且Flt-1基因敲除后会导致静脉出现畸形。
由于DN发病率的升高,越来越多的患者因长期血糖控制欠佳进展至终末期肾脏病,远期预后不良。中医药对于DN治疗有一定的优势,临床常能取得较好疗效。我们认为,DN的基本病机是气虚无力运血而致血瘀,阴虚火旺、煎熬津液、津亏液少则血液黏稠不畅而致“阴虚血瘀”,病久不愈深伏于肾络渐成微小癥积,致使肾体受损、肾用失司导致DN的发生。结合“病久必瘀、病久入络”的中医学理论,提出该病位在络,“瘀血癥积阻于肾络”可能是病机之关键,同时结合DN气阴两虚的基本病机,经过临证的反复筛选确定了一个相对固定治疗DN的基本方肾络通,以消癥通络为主兼以益气养阴。其中黄芪、玄参益气养阴,地龙、僵蚕、乌梢蛇、鳖甲等消癥通络。前期动物实验和临床实验[2、11-13]中,我们运用肾络通治疗早期DN患者,发现其化验指标、临床症状、体征和生存质量都得到显著改善。本研究在前期的基础上,采用细胞培养技术,模拟DN患者体内的高糖环境,观察肾络通对足细胞VEGF和Flt-1表达的影响。发现其对于早期DN足细胞有一定的保护作用,高糖组和正常鼠血清组VEGF、Flt-1高水平表达,而在中药组中显著降低,预期进一步可降低血管通透性,改善肾小球高滤过,从而减轻足细胞的损伤和蛋白尿的产生,起到保护肾功能、改善预后的作用。
[1] MARIA L GONZALEZ SUAREZ, DAVID B THOMAS, LAURA BARISONI, et al. Diabetic nephropathy: Is it time yet for routine kidney biopsy [J]. World J Diabetes, 2013, 4(6): 245-255.
[2] 王月华,潘利敏,方超,等.肾络通对糖尿病肾病大鼠裂孔膜蛋白的影响[J].中国中医基础医学杂志,2014,20(11):1496-1498.
[4] HAI LU, JIANMING JIANG, GUOPING XIE, et al. Effects of an aqueous extract of Eucommia on articular cartilage in a rat model of osteoarthritis of the knee [J].Exp Ther Med, 2013,6(3): 684-688.
[5] SHIBUYA M. Angiogenesis vascular endothelia growth factor and it receptors [J].Human Cell, 1999, 12(1):17-24.
[6] 叶仁群,谢嘉嘉,林国彬,等. 补阳还五汤对早期糖尿病肾病患者血管内皮生长因子及其受体Flt-1的影响[J].中国中西医结合肾病杂志,2009,10(2):137-139.
[9] ADVAIN A. Vascular endothelial growth factor and the kidney: something of the marvelous[J].Curr Opin Nephrol Hypertens, 2014,23(1): 87-92.
[10] JOHN C , CHAPPELL, KEVIN P,et al. Flt-1(VEGFR-1) is essential for the VEGF-Notch feedback loop during angiogenesis[J]. Arterioscler Thromb Vasc Biol,2013,33(8): 1952-1959.
[11] 张江华,陈志强,赵雯红,等.益气养阴消癥通络中药对早期糖尿病肾病大鼠24 h尿蛋白及nephrin、podocin基因表达的相关性分析[J].北京中医药大学学报,2013,36(10): 671-675.
[12] 张江华,陈志强,赵雯红,等.益气养阴消癥通络中药对早期糖尿病大鼠肾组织Podocin 基因表达的影响[J].中国老年学杂志,2014,34(6): 3044-3046.
[13] 陈志强,方敬,王月华,等.益气养阴消癥通络中药治疗早期糖尿病肾病的临床观察[J].中国中西医结合杂志,2015,16(11):962-964.
Effects of Shentongluo on VEGF and Flt-1 in Podocytes Cultured with High Glucose
LOU Fei-fei1, FANG Chao2, PAN Li-ming3, WNAG Yue-huang1△,DING Ying-jun4, GOU Shuai1, LI Ying1
(1.No.3HospitalofHebeiMedicalUniversity,Shijiazhuang050081,China; 2.CangzhouHospitalofIntergratedTraditionalChineseandWesterMedicine,Hebei,Congzhou061001,China; 3.TraditionalChineseHospitalofHebeiProvince,Shijiazhang050011,China; 4.CollegeofTraditionalChineseMedicine,Shijiazhuang050200,China)
Objective: To observe the effect of Shen Luo Tong on diabetic nephropathy VEGF and FLT-1. Method: 12 healthy SPF male rats were randomly divided into the control group and experimental groups with six rats in each group. The control group was given normal saline through gavage while the experimental groups were given different doses of the traditional Chinese medicine through gavage for 3 days. Then the rats were sacrificed to collect blood samples from heart. The culture podocytes of rats were divided into the control group, high glucose group, normal rat serum group and another three serum groups were treated by different doses of Chinese medicine. After stimulated for 24hours, the expression of VEGF and Flt-1 were observed by the method of immunocytochemistry、 western blot and real-time PCR.Results: The protein and mRNA expression of VEGF and Flt-1 in normal rat serum group and high glucose group can be clearly observed as positive. The expression in Chinese medicine serum stimulated group was lower compared to high glucose group and normal rat serum group (the difference has statistical significance). Conclusion: The expression of VEGF and Flt-1 of podocyte can be suppressed by Shen Luo tong which can contribute to protect podocytes from injury and renal dysfunction.
Diabetic nephropathy; Traditional Chinese medicine; Podocyte; Vascular endothelial growth factor
国家自然科学基金资助项目(81202829)
娄菲菲(1988-),女,河北沧州人,医师,医学硕士,从事中西医结合肾脏病的临床与基础研究。
△通讯作者:王月华(1973-),女,主任医师,医学博士,硕士研究生导师,从事慢性肾脏病的临床与基础研究, E-mail:wangyuehua@medmail.com.cn。
R587.1
B
1006-3250(2017)08-1074-04
2017-01-10
