三元水盐体系冰点和共晶点的测定、相图表达及计算
2017-09-16刘福云黄雪莉黄文婷王雪莹潘毅
刘福云,黄雪莉,黄文婷,王雪莹,潘毅
三元水盐体系冰点和共晶点的测定、相图表达及计算
刘福云,黄雪莉,黄文婷,王雪莹,潘毅
(新疆煤炭洁净转化与化工过程重点实验室,新疆大学化学化工学院,新疆乌鲁木齐 830046)
针对Na+//Cl-,NO-3-H2O、Na+//Cl-,SO42--H2O和Na+,K+//Cl--H2O 3个三元水盐体系,测定了不同组成时溶液的冰点、共晶点以及降温过程的析盐规律,绘制出三元体系温度-组成立体相图。结果表明:三元体系的冰点、共晶点、相关系与组成可用三棱柱表达,3个三元水盐体系在共晶点温度下均无复盐存在,各含有1个两盐与冰的共晶点,3条单盐与冰或盐盐的共晶线,1个冰和两个单盐结晶区;用三元体系温度-组成立体相图能更直观地表达三元水盐体系的结晶区、冰点、共晶点和溶液组成的关系,可以判断溶液降温过程中的盐或冰的析出类型、温度;同时建立了冰点经验公式,应用经验公式和过量吉布斯自由能模型预测三元体系的冰点和共晶点,计算值和实验值吻合良好。
水盐体系;共晶点;冰点;相图;计算
引 言
盐湖资源的开发利用主要是通过自然蒸发或强制蒸发、冷却、结晶、过滤等传统方法[1-2]加以分离,虽然利用了太阳能和风能,降低了能耗和成本,但也损失了大量的水,对于干旱缺水的盐湖资源地区,这是一个严峻的问题,制约着盐湖化工的发展。因此,开发节水新技术十分必要。
除了利用夏季高温热能蒸发卤水,也可以考虑利用冬季冷能,在不损失或少损失水的条件下,实现卤水的结晶和分离,但目前低温下加工盐湖资源[3-14]的技术很少。由于相平衡规律是盐湖资源开发的理论基础,因此,研究低温条件下水盐体系的冰点、共晶点以及盐析规律,对利用冬季冷能开发低温盐湖化工工艺以及一些含盐废水的低温处理技术[15-17]具有重要的理论指导意义。
对于大部分单盐溶液,其冰点和共晶点数据都有报道[18-20],但对于三元及以上水盐体系报道很少。Oakes等[21]研究了NaCl-CaCl2-H2O体系的冰点;Gibbard等[22]研究了NaCl-MgCl2-H2O体系的冰点;Desnoyers等[23]研究了NaCl-EtOH-H2O体系的冰点;王雪莹等[24]研究了K+//Cl-,SO42-,NO-3-H2O和Na+,K+//SO42-,NO-3-H2O两个四元水盐体系及其相关的6个三元子体系的冰点、共晶点,提出了用简单三棱柱图形来表达三元水盐体系冰点、共晶点与组成的关系,但未对其进行明确的相区划分和应用研究。
一般来说,海水和绝大多数盐湖体系均属于四元以上水盐体系,组分多,相关系复杂,如需对其研究,必须首先进行相关子体系的研究。Na+//Cl-,NO-3-H2O、Na+//Cl-,SO42--H2O和Na+,K+// Cl--H2O 3个三元体系为常见的基础子体系,本文研究了这3个三元体系的冰点、共晶点和盐析规律,为研究四元、五元或更复杂的盐湖卤水体系低温相平衡打下基础,也为实现利用冬季冷能处理废盐水、开发盐湖资源提供理论支持。
1 实验部分
1.1 实验试剂和实验仪器
试剂:NaCl、KCl、NaNO3、Na2SO4均为A.R. 级;实验用水均为蒸馏水。
仪器:DHJF-4010型低温(恒温)搅拌反应浴(郑州长城科工贸有限公司,使用范围-40~100℃,控温精度±0.2℃);JDW-3F型精密电子温差测量仪(北京亚美福科技有限公司,使用范围-50~100℃,精度±0.001℃);XTL-1型体视显微镜(南京江南光电股份有限公司);X 射线衍射仪(荷兰Philip X公司)。
1.2 实验方法
具体实验装置及操作方法详见文献[24-25],本文只作简要说明。
1.2.1 三元体系共晶点温度的测定 以三元体系Na+//Cl-,NO--3-H2O为例,首先,根据常温下该体系的共饱点组成配制300 ml溶液,取约10 ml溶液于直径2 cm的试管中,外加直径为2.5 cm试管为套管,置于低温恒温装置中降温,外加电动增力搅拌器进行搅拌,记录时间、温度,作出时间-温度关系图,根据温度波动点确定体系冰点、共晶点。
1.2.2 三元体系共晶点溶液组成的测定 将配制的剩余溶液放入平底烧瓶,置于低温恒温装置,温度设置为略低于已测出的共晶点或冰点温度,搅拌降温。当溶液到达共晶点温度后,观察到较多的冰析出时,停止搅拌静止约10 min,冰浮于液面,盐沉降于底部,取液相样分析,确定共晶点溶液组成,同时分离固相进行鉴定。
1.3 化学分析方法
Cl-:硝酸银容量法。K+:四苯硼钠重量法。SO42-:比浊法。NO-3:重铬酸钾氧化法。Na+:差减法。固相鉴定采用体式显微镜或X射线晶体衍射综合确定。
2 实验结果与讨论
2.1 三元体系研究结果
上述3个三元体系的共晶点的液相组成和温度数据列于表1中。
由表1数据可知,3个三元体系在低温下均为简单体系,无复盐存在;均含有1个共晶点,对应的共晶点温度均低于所对应的两种单盐溶液的共晶点温度。

表1 三元体系共晶点温度及液相组成
Note: S10—Na2SO4·10H2O; Sy—KCl; NN—NaNO3; Hy—NaCl·2H2O.
2.2 三元体系冰点立体相图
为了能直观地表达三元水盐体系的结晶区、冰点、共晶点和溶液组成的关系,采用三棱柱表达。底面等边三角形为组成面,3个顶点为纯组分;棱代表温度;3个立面分别代表3个二元水盐体系;三棱柱内部为三元水盐体系。
以Na+//Cl-,NO-3-H2O三元体系为例进行具体说明,如图1所示(为清晰起见,立体图局部未严格按照比例绘制)。
由图1可知:
(1)底面等边三角形为NaCl、NaNO3、H2O的组成区,3个顶点分别代表NaCl、NaNO3、H2O 3个纯组分。
(2)3个立面′′、′′和′′分别代表NaCl-H2O、NaNO3-H2O和NaCl-NaNO33个二元体系,其中NaCl-H2O、NaNO3-H2O是水盐体系,NaCl-NaNO3是盐盐体系(′、′分别是NaCl、NaNO3熔点,分别为801℃、306.8℃[26]。NaCl-NaNO3盐盐体系的共熔点,一般低于对应的单盐熔点,具体数据未见报道,本文因只研究水盐体系,故未对其进行测定,设为点3,为示意点;由于3处的氯化钠是以NaCl形式存在,而处的氯化钠是以NaCl·2H2O形式存在,则3线上必有一个转变点,是NaCl和NaCl·2H2O的共晶点,因测定困难,未进行测定,设为点5,为示意点)。
(3)3个空间曲面,代表了3个单固相的饱和溶液面。其中空间曲面′4153′是NaCl和NaCl·2H2O的饱和溶液面;空间曲面′253′是NaNO3的饱和溶液面;空间曲面′12′是冰的饱和溶液面。3个空间曲面上方的空间区域表示不饱和溶液区。
(4)3条空间曲线,代表3组双固相的共晶溶液线。其中1是NaCl·2H2O和冰的共晶溶液线,2是NaNO3和冰的共晶溶液线,53是NaCl、NaCl·2H2O和NaNO3的共晶溶液线,1、2、3分别是二元体系中相应的共晶点。
(5)点是NaCl·2H2O、NaNO3、冰3个固相的共晶点,实验测得该共晶点的冰点温度为-26.91℃。
(6)由图2可知:′3′、′4′、′354′、54、53、构成的多面体为NaCl的结晶区;由45、5415、41、、、5、1构成的多面体为NaCl·2H2O的结晶区;由′3′、′2′、′253′、35、2、构成的多面体为NaNO3的结晶区;由′2′、′1′、′12′、1、2、构成的多面体为冰的结晶区。每种盐或冰的结晶区都有1个断层面,落在底面的投影为线、、、′,这4条线左右的点虽然溶液组成接近,但盐析出温度差别比较大。
(7)由图3可知:、、′、′、′、′、′′′、′′构成的多面体为NaCl和NaCl·2H2O的结晶区;、、′、′′、′构成的多面体为NaCl·2H2O和冰的结晶区;、、、、构成的多面体为NaNO3和冰的结晶区;、、、、构成的多面体为NaCl、NaCl·2H2O和NaNO3的结晶区。
(8)5个三角面、、、′、下方为全固相区域,液相完全消失。
2.3 三元体系变温立体相图的应用
根据绘制出的三元变温立体相图,可以确定任意组成的溶液在降温过程中的冰盐析出顺序、冰点近似温度、单盐结晶温度、共晶点温度和液相组成。
以图4中的点溶液降温过程为例进行说明。
点位于不饱和溶液区,过点向下做垂线——降温线,穿过NaNO3的结晶区,在底面中投影为4点。
当溶液从点降温至1点时,NaNO3析出,1点即为NaNO3的结晶点,对应的纵坐标即为NaNO3的结晶温度;由1点继续降温至2点时,冰也析出,对应的纵坐标即为NaNO3和冰的共晶点温度;继续降温,NaNO3和冰不断析出,液相点由点移向点,到达点后,NaCl·2H2O也饱和析出,总组分点由2降至3,液相全部消失,进入全固相区域。
1点的确定:过和4点画直线1交2线于′点,过′点向上画垂线2交三角面于″点,交2线于点,顺着曲面′253′连接′为线3,与垂线4交于点1,1即是4降温线与NaNO3的饱和溶液面′253′的交点。2点的确定:在曲面2上连接为线4,与垂线4交于点2,2即是4降温线与NaNO3和冰的共晶面2的交点;3点的确定:连接″为线5,与垂线4交于点3,3即是4降温线与三角面的交点。
利用该相图还可以计算出溶液在降温过程中每个阶段的冰或盐的析出量,确定溶液浓度的变化。因篇幅所限,本文不再详述。

表2 三元体系不同组成溶液的冰点

表3 3个三元体系冰点实验值与经验公式计算值的比较
Note: Unit of concerntration is g·(100 g solution)-1.
2.4 三元体系的冰点及共晶点预测
2.4.1 经验公式计算 三元体系变温立体相图的优势在于能够直观地看出溶液在降温过程中的相变化,缺点在于比较复杂,使用不便。由于海水、盐湖卤水以及一些含盐废水的冰点确定意义重大,本文通过补充测定一些位于图1中′12′面上以及′1和′2(二元体系)边上的溶液的冰点数据(见表2),结合上述测定的共晶点数据,拟合出了3个计算三元体系冰点的经验公式,也即三元体系空间曲面′12′的方程,同时列出计算结果与实测冰点的比较,见表3。
总体预测结果较理想,个别值相对偏差较大,是因为这些点本身的冰点温度(绝对值)较小,即使绝对偏差较小,相对偏差也较大。
2.4.2 热力学模型计算 在工程应用上,经验公式很实用,但缺乏理论意义。本文采用Alonso等[27]提出的以扩展UNIQUAC模型为基础的过量吉布斯自由能模型来预测三元体系的冰点和共晶点。各离子的UNIQUAC模型参数由文献[28-31]获得。具体模型及计算过程见文献[25, 32],在此不再详述。模型计算的共晶点值和实验值比较见表4。
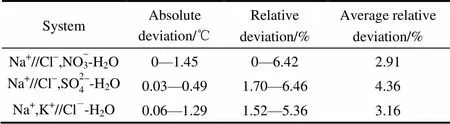
表4 3个三元体系冰点实验值与热力学模型计算值的比较
总体来说,模型计算的共晶点值和实验值吻合较好,计算值比实验值略偏大,低浓度下计算结果更好。
3 结 论
(1)Na+//Cl-,NO-3-H2O、Na+//Cl-,SO42--H2O和Na+,K+//Cl--H2O 3个三元体系在冰点与共晶点温度下无复盐存在,各含有1个两盐与冰的共晶点,对应的共晶点温度分别为-26.91℃、-21.31℃、-24.09℃,均低于所对应的两种单盐溶液的共晶点温度,各含有两个盐结晶区(水合盐与相应的单盐合为1个),1个冰结晶区。
(2)采用三棱柱能直观地表达三元水盐体系的结晶区、冰点、共晶点和溶液组成的关系,可以确定任意组成的溶液在降温过程中的冰盐析出顺序、冰点温度、单盐结晶点温度、共晶点温度和液相组成。
(3)应用本文所获得的二次多项式经验公式和文献中过量吉布斯自由能模型来预测三元体系的冰点和共晶点,计算结果均较理想。
References
[1] SONG P S, LI W, SUN B,. Recent development on comprehensive utilization of salt lake resources[J]. Chinese Journal of Inorganic Chemistry, 2011, 27(5): 801-815.
[2] MA P. Sustainable exploitation and comprehensive utilization of salt lake resources in China[J]. Progress in Chemistry, 2009, 21(11): 2349-2357.
[3] SHEPARD M L, GOLDSTON C S, COCKS F H. The H2O-NaCl-glycerol phase diagram and its application in cryobiology[J]. Cryobiology, 1976, 13(1): 9-23.
[4] 朱巧丽, 黄雪莉.-15℃下Na+,K+,Mg2+//Cl-,SO42--H2O体系相平衡[J]. 化工学报, 2015, 66(4): 1252-1257. ZHU Q L, HUANG X L. Liquid-solid phase equilibrium of Na+,K+,Mg2+//Cl-,SO42--H2O system at-15℃[J].CIESC Journal, 2015, 66(4): 1252-1257.
[5] COCKS F H, BROWER W E. Phase diagram relationships in cryobiology[J]. Cryobiology, 1974, 11(4):340-358.
[6] PERALTA J M, RUBIOLO A C, ZORRILLA S E. Prediction of heat capacity, density and freezing point of liquid refrigerant solutions using an excess Gibbs energy model[J]. Journal of Food Engineering, 2007, 82(4): 548-558.
[7] 付振海, 张志宏, 马艳芳, 等. 硫酸盐型卤水低温处理及其液相蒸发析盐规律的理论研究[J]. 无机盐工业, 2013, 45(2): 29-32. FU Z H, ZHANG Z H, MA Y F,. Freeze sulfate-type brine at low temperature in stages and theoretical study on evaporation and crystallization behavior[J]. Inorganic Chemicals Industry, 2013, 45(2): 29-32.
[8] BEIER N, SEGO D, DONAHUE R,. Laboratory investigation on freeze separation of Saline mine waste water[J ]. Cold Regions Science and Technology, 2007, 48(3): 239-247.
[9] 张杰, 史学伟, 赵双良, 等. 水盐体系相平衡研究进展[J]. 化工学报, 2016, 67(2): 379-389. ZHANG J, SHI X W, ZHAO S L,.Progress in study on phase equilibria of salt-water systems[J]. CIESC Journal, 2016, 67(2): 379-389.
[10] GAYLE F W, COCKS F H, SHEPARD M L. The H2O-NaCl-sucrose phase diagram and applications in cryobiology[J]. Journal of Chemical Technology and Biotechnology, 1977, 27(5): 599-607.
[11] 伍倩, 郑绵平, 乜贞, 等. 西藏当雄错盐湖卤水冬季日晒蒸发实验研究[J]. 地质学报, 2013, 87(3): 433-440. WU Q, ZHENG M P, NIE Z,. Experiment study of solar evaporation of brine form the Dangxiongcuo salt lake in winter[J]. Acta Geologica Sinica, 2013, 87(3): 433-440.
[12] GE X, WANG X. Estimation of freezing point depression, boiling point elevation, and vaporization enthalpies of electrolyte solutions[J]. Industrial & Engineering Chemistry Research, 2009, 48(4): 2229-2235.
[13] 李青海, 顾同欣, 于升松, 等. 南翼山油田卤水低温结晶过程研究[J]. 物理化学学报, 2011, 27(8): 1803-1808. LI Q H, GU T X, YU S S,. Study on the precipitation pathway of Nanyishan oilfield brine at subzero temperatures[J]. Acta Physico-Chimica Sinica, 2011, 27(8): 1803-1808.
[14] 张霞, 黄雪莉. 低温下Na+//Cl-,SO42-,NO-3-H2O体系相平衡研究[J]. 化学通报, 2015, 78(4): 337-341. ZHANG X, HUANG X L. Study on the phase equilibrium of the quaternary system Na+//Cl-,SO42-,NO-3-H2O at low temperatures[J]. Chemistry Bulletin, 2015, 78(4): 337-341.
[15] SUN Y, ZHANG Y, QUAN X. Treatment of petroleum refinery wastewater by microwave-assisted catalytic wet air oxidation under low temperature and low pressure[J]. Separation & Purification Technology, 2008, 62(3): 565-570.
[16] GAO W, SMITH D W, SEGO D C. Ice nucleation in industrial wastewater[J].Cold Regions Science & Technology, 1999, 29(2): 121-133.
[17] LANGENHOFF A, STUCKEY D C. Treatment of dilute wastewater using an anaerobic baffled reactor: effect of low temperature[J]. Water Research, 2000, 34(15): 3867-3875.
[18] SILCOK H. Solubilities of Inorganic and Organic Compounds[M]. 3rd ed. Oxford: New York Pergamon Press, 1979: 1151.
[19] 牛自得, 程芳琴. 水盐体系相图及应用[M]. 天津: 天津大学出版社, 2002: 269. NIU Z D, CHENG F Q. The Phase Diagram of Salt-Water System and Its Application[M]. Tianjin: Tianjin University Press, 2002: 269.
[20] WEAST R C. CRC Handbook of Chemistry and Physics[M]. BocaRaton, USA: CRC Press, 1974: 2661.
[21] OAKES C S, BODNAR R J, SIMONSON J M. The system NaCl-CaCl2-H2O(Ⅰ): The ice liquidus at 1 atm total pressure[J]Geochimica Et Cosmochimica Acta, 1990, 54(3): 603-610.
[22] GIBBARD J R H F, GOSSMANN A F. Freezing points of electrolyte mixtures (Ⅰ): Mixtures of sodium chloride and magnesium chloride in water[J]. Journal of Solution Chemistry, 1974, 3(5): 385-393.
[23] DESNOYERS J E, BILLON M, LÉGER S,. Salting out of alcohols by alkali halides at the freezing temperature[J]. Journal of Solution Chemistry, 1976, 5(10): 681-691.
[24] 王雪莹, 黄文婷, 黄雪莉. 多元水盐体系冰盐共晶点的测定和图形表达[J]. 化工学报, 2016, 67(5): 1687-1693. WANG X Y, HUANG W T, HUANG X L. Determination and graphics expression of ice-salt eutectic points of multicomponent salt-water systems[J]. CIESC Journal, 2016, 67(5): 1687-1693.
[25] 黄文婷. 水盐体系冰点实验研究与计算预测[D]. 乌鲁木齐: 新疆大学, 2015. HUANG W T. The experimental determinatinon and prediction of freezing point of salt-water systems[D]. Urumqi: Xinjiang University, 2015.
[26] 张寒琦, 林英杰, 宋利珠, 等.实用化学手册[M]. 北京: 科学出版社, 2001: 774. ZHANG H Q, LIN Y J, SONG L Z,. Handbook of Practical Chemistry[M]. Beijing: Science Press, 2001: 774.
[27] ALONSO H A T, PERALTA J M, RUBIOLO A C,. Prediction of the freezing point of multicomponent liquid refrigerant solutions[J]. Journal of Food Engineering, 2011, 104(1): 143-148.
[28] THOMSEN K, RASMUSSEN P, GANI R. Correlation and prediction of thermal properties and phase behaviour for a class of aqueous electrolyte systems[J]. Chemical Engineering Science, 1996, 51(14): 3675-3683.
[29] THOMSEN K. Aqueous electrolytes: model parameters and process simulation[D]. Denmark: Technical University of Denmark, 1997.
[30] GARCÍA A V, THOMSEN K, STENBY E H. Prediction of mineral scale formation in geothermal and oilfield operations using the extended UNIQUAC model(Ⅰ): Sulfate scaling minerals[J]. Geothermics, 2005, 34(1): 61-97.
[31] GARCÍA A V, THOMSEN K, STENBY E H. Prediction of mineral scale formation in geothermal and oilfield operations using the extended UNIQUAC model(Ⅱ): Carbonate-scaling minerals[J]. Geothermics, 2006, 35(3): 239-284.
[32] 黄文婷, 黄雪莉. 水盐体系冰点的预测[J]. 盐湖研究, 2015, 23(1): 38-43. HUANG W T, HUANG X L. The experimental determinatinon and prediction of freezing point of salt-water systems[J]. Journal of Salt Lake Research, 2015, 23(1): 38-43.
Determination, graphics expression and calculation of freezing point and eutectic point in ternary salt-water system
LIU Fuyun, HUANG Xueli, HUANG Wenting, WANG Xueying, PAN Yi
(Key Laboratory of Cleaner Transition of Coal & Chemicals Engineering of Xinjiang Uyghur Autonomous Region,College of Chemistry and Chemical Engineering, Xinjiang University, Urumqi 830046, Xinjiang, China)
In this paper, aiming at ternary salt-water systems of Na+//Cl-,NO-3-H2O, Na+//Cl-,SO42--H2O and Na+,K+//Cl--H2O, the freezing points, eutectic points and the crystallization regularities of salts were investigated; the three-dimensional phase diagrams of temperature-composition of the ternary systems were plotted according to experimental data. The results were as following: the relationships among the freezing point, eutectic point, phases and the compositions of solution for the ternary system can be expressed by triangular prism. In the three ternary systems, there were no double salts at the eutectic point temperature, and there was an eutectic point with two salts and ice, three eutectic lines with single salt and ice or two salts, a crystallization zone with ice and two single salt. The three-dimensional phase diagram of temperature-composition of solution can be used to describe the relationships among the crystalline regions, freezing points or eutectic points and the compositions of liquids for the ternary salt-water systems visually, and to determine the precipitation processes of salts or ice as cooling solution. Three empirical formulas about freezing points were established. The empirical formulas of freezing point and the excess Gibbs free energy model were used to predict the freezing point and eutectic point of the ternary systems, which turned out that the calculated values were in good agreement with the experimental values.
salt-water system; eutectic point; freezing point; phase diagram; calculation
10.11949/j.issn.0438-1157.20161809
O 642.5+4
A
0438—1157(2017)09—3336—07
2016-12-26收到初稿,2017-05-12收到修改稿。
黄雪莉。
刘福云(1990-),女,硕士研究生。
国家自然科学基金项目(21166022)。
2016-12-26.
Prof. HUANG Xueli, xuelih@163.com
supported by the National Natural Science Foundation of China (21166022).
