CaO对汞的选择性吸附及SO2毒化特性
2017-10-13李春峰段钰锋汤红健朱纯郑逸武韦红旗
李春峰,段钰锋,汤红健,朱纯,郑逸武,韦红旗
CaO对汞的选择性吸附及SO2毒化特性
李春峰,段钰锋,汤红健,朱纯,郑逸武,韦红旗
(东南大学能源与环境学院,能源热转换及其过程测控教育部重点实验室,江苏南京 210096)
利用Ca(NO3)2作为前体,SiO2为载体,制备了一种担载型CaO吸附剂,在固定床实验装置上分别研究了该吸附剂对元素汞(Hg0)和氯化汞(HgCl2)等不同形态汞的选择性吸附性能,以及SO2对CaO吸附剂汞形态吸附过程的影响,同时结合程序升温脱附和原位红外漫反射表征技术,深入探究了CaO的选择性吸附机理及SO2毒化机制。汞形态吸附实验结果表明,在纯N2气氛和掺杂SO2气氛下,CaO对Hg0均保持了接近100%的穿透率,而对HgCl2在两种气氛下则分别表现出66.0%和60.3%的吸附效率,说明SO2与HgCl2在CaO表面存在竞争吸附关系;吸附实验前后CaO的表征结果显示,与Hg0相比,HgCl2更易与CaO表面各碱性位形成单配位、双配位等多种吸附构型,SO2与HgCl2在易形成单配位的活性位上形成竞争吸附关系,进而在一定程度上降低了CaO对HgCl2的吸附效率。
CaO吸附剂;Hg;HgCl2;选择性吸附;SO2毒化
引 言
汞是一种高挥发性、强毒性的痕量元素,长时期的积累及远距离迁移会对生态环境造成危害[1]。尽管煤中汞的平均含量不高[2],但巨大的煤炭消耗量仍使其成为最大的人为汞排放源之一[3]。燃煤烟气中的汞可分为元素态汞(Hg0)、氧化态汞(Hg2+)和颗粒态汞(Hgp)[4],由于挥发性、溶解性、反应活性等方面的差异,常规污染物控制装置对各形态汞具有不同程度的协同脱除作用[5-6]。因此,实现烟气中不同形态汞的精确测量,不仅有利于明确汞排放及脱除的影响规律,而且也为制定和优化燃煤汞污染防治策略提供坚实的基础。
目前燃煤烟气中汞含量的测量手段主要包括安大略法(OHM)、吸附管法(EPA Method 30B)以及在线测量系统(Hg-CEMS)3种[7]。近年来美国电厂汞排放测试相关项目中,EPA 30B法约占70%[8]。现有的吸附管多用于尾部烟囱最终排烟中总汞的测量,为进一步拓宽吸附管在不同烟气条件下汞分形态测量领域的应用,研发具有高选择性、高吸附性及高抗扰性的新型吸附管填充材料已成为当前研究热点之一。现阶段对于汞形态选择性吸附的研究极其匮乏,国外的Ohio Lumex和Apex Instruments等商业公司均采用special KCl(主要成分未知)配合KI-AC进行汞分价态测量,美国Frontier Geosciences Inc.推行的MESA(mercury speciation adsorption method)中所使用到的填充材料主要为KCl-CaO的复合型吸附剂。国内对吸附管材料研究较多的有武汉天虹以及南京艾森等商业公司,但仅限于总汞吸附管,且效果远不如Ohio Lumex等国外公司。
CaO作为一种碱性吸附剂,在基本气体条件(N2+O2+CO2)下,对于Hg0的吸附效率低于15%,并在30 min内完全穿透[9],而EPA的实验结果[10-12]显示CaO等钙基类物质对HgCl2的吸附效率高达85%。Kim等[13]证实Hg0在CaO表面上的吸附为物理吸附,而HgCl2的吸附能介于物理吸附与化学吸附之间。钙基类脱汞吸附剂容易受烟气中酸性气体特别是SO2的影响,得益于SO2对吸附剂表面的预氧化作用,能一定程度地提高Hg0的吸附[14],但与HgCl2竞争相同的活性吸附位则会抑制其吸附[15]。因此探明CaO的汞吸附及SO2对汞吸附的影响机制,有利于最终实现烟气中Hg2+与Hg0的高效分离和精确测量。
综上所述,本文以CaO为研究对象,在固定床实验装置上研究其对不同形态汞的定向选择吸附特性;通过原位红外漫反射(-DRIFT)以及程序升温脱附(TPD)的方法研究汞在CaO表面的吸附构型,揭示CaO对HgCl2的吸附机理;同时初步探究SO2对CaO吸附HgCl2的影响规律。
1 实验方法
1.1 吸附剂制备
(1)在50 ml的去离子水中加入一定比例的Ca(NO3)2(Sigma-Aldrich,美国)和SiO2(Sigma-Aldrich,美国),并在磁力搅拌器上常温搅拌6 h;(2)将混合均匀的溶液于105℃下烘干;(3)将样品研磨并筛分,取0.70~0.88 mm粒径范围内的颗粒备用;(4)在马弗炉内750℃温度下恒温焙烧4 h;(5)待样品冷却后放置于干燥皿中备用。
1.2 吸附剂表征
采用 BEL SORP Ⅱ型比表面及孔隙度分析仪(Microtrac,美国)进行N2吸附/脱附实验,将样品在300℃下真空脱附处理3 h,然后以N2为吸附质,在77 K下进行测试,获得样品的吸附/脱附等温线,通过Brunauer-Emmett-Teller (BET)方程计算样品的比表面积等孔隙参数,运用Barrett-Joyner-Halenda(BJH)模型获得样品的孔径分布;采用Sirion 200场扫描电镜(配GENESIS 60S能谱及OIM4000电子背散衍射系统)(FEI,荷兰)获得样品表面微观结构及表面元素分布;采用Nicolet 6700 傅里叶红外光谱仪(Nicolet,美国)测定吸附剂表面不同碱性活性位的强度及其数量,吸附剂在样品池中经脱气处理后,在设定的温度下以CO2为探针分子进行动态吸附,红外谱图的分辨率为4 cm-1,扫描次数为64,扫描范围400~4000 cm-1。
1.3 固定床实验装置
Hg0和HgCl2在吸附剂表面的吸附实验在固定床实验装置上进行,实验装置如图1所示。
系统主要由模拟烟气配气系统、汞蒸气发生装置、气体预混及预热系统、固定床吸附装置、汞在线检测系统和尾气处理装置等组成。其中Hg0及HgCl2由汞渗透管(VICI Metronics,美国)产生,采用恒温水浴加热并由高纯N2带入反应装置,浓度由水浴温度和N2载气流量控制。为降低Hg0及HgCl2在壁面的冷凝黏附损失,整套气体管路均采用进口特氟龙和高硼硅玻璃材料。实验系统主体固定床总高20 cm,内径8 mm,中心恒温区5 cm,并采用两段式独立加热设计以精确控制吸附温度。Hg0浓度采用EMP-2型测汞仪(NIC,日本)进行实时检测,该测汞仪采用冷原子吸收法,检测限为0.1 μg·m-3。尾气经过高效活性炭处理后排空。实验结果中Hg0的穿透率由式(1)计算

式中,out为出口汞浓度,μg·m-3;in为入口汞浓度,μg·m-3。
需要强调的是,与Hg0相比,HgCl2具有更强的挥发性,且受限于SnCl2对其还原的反应速率和转换效率,直接分析时存在测量值偏低的现象,为保证对吸附剂吸附HgCl2性能的准确评估[16-18],在固定床反应管中填充两段吸附剂,以惰性玻璃纤维分隔,每段吸附剂的质量为150 mg,其中第1段为HgCl2收集段,第2段为HgCl2穿透检验段,如图1中固定床局部放大实物图所示。定义HgCl2在固定床上的吸附率由式(2)计算

式中,1为收集段的汞质量,μg;2为穿透检验段的汞质量,μg。吸附剂中汞的质量使用RA-915M型测汞仪(Lumex,俄罗斯)进行测定,该测汞仪采用高频塞曼效应原子吸收法,检测限为5 μg·m-3。
Hg0及HgCl2吸附实验条件:载汞N2200 ml·min-1,总气流2 L·min-1,吸附温度120℃,吸附时间30 min,如表1所示。

表1 固定床实验工况
1.4 程序升温脱附实验装置
对吸附后的各吸附剂样品分别在程序升温脱附装置上进行汞脱附实验。脱附系统主要由高纯N2、程序升温高精温控炉、VM 3000测汞仪(Mercury Instruments,德国)及尾气处理装置等组成。程序升温脱附反应器为一内径14 mm的高硼硅玻璃直管。称取一定量的实验样品置于石英方舟中并放到玻璃直管中间位置进行汞脱附实验,升温速率设定为10℃·min-1。
2 实验结果与讨论
吸附剂对于Hg0的吸附能力受其表面几何结构和官能团的影响,良好的表面结构有利于物理吸附,酸性官能团能促进化学吸附[19-21]。HgCl2的性质与Hg0不相同,为直线型酸性分子,表面存在碱性活性位是吸附剂具备HgCl2吸附能力的根本原因[15],而吸附剂表面的几何结构对HgCl2的吸附影响较弱[14],因此提高吸附剂定向吸附HgCl2性能的主要方向之一是强化吸附剂表面的碱性特征。
2.1 吸附剂的表征
分别在N2气氛及掺杂SO2气氛下作用30 min的吸附剂的比表面积及孔隙结构参数如表2所示。根据IUPAC对吸附等温线类型的判断准则,图2所示CaO氮吸附/脱附等温线属于Ⅱ型吸附等温线线型,即在相对压力较低时,吸附量较少,当相对压力/0>0.6时,吸附量急剧增大,这表明实验制备的CaO样品存在的微孔(<2nm)数量较少,而中孔(2~50nm)数量较多[16]。同时可以看到吸附剂的吸附线与脱附线之间形成滞留回环,这主要是由吸附过程中的毛细凝聚作用所造成。根据其滞留回环为H3型且较为宽大,判断吸附剂的孔隙结构为不规整平板狭缝结构,且具有较宽的孔径分布[22]。吸附剂的表面结构对汞在其表面的物理吸附有较大影响,一般比表面积越大、微孔越多则越有利于汞的吸附[14],因此初步推断比表面积较小且微孔不发达的CaO对于两种形态汞的物理吸附作用均十分有限。通过对比SO2作用前后的样品发现,暴露在SO2中的吸附剂比表面积及总孔容积有所降低,这可能是受SO2的影响,吸附剂表面生成了致密的硫酸盐,堵塞了部分孔道,从而引起CaO表面结构参数的变化。

表2 吸附剂的比表面积及孔隙结构参数
为判断SO2对CaO吸附剂的影响情况,对两种吸附剂的表面进行SEM-EDX分析,结果如图3所示。从微观形貌来看,暴露在N2气氛下的吸附剂表面较为平整,而经过SO2处理后吸附剂表面形成了致密性覆盖层,且局部微区的EDX结果表明,SO2作用后吸附剂表面确实有S元素的存在,进一步证实SO2与CaO之间的相互作用。
以CO2为探针分子对N2气氛下作用30 min的CaO样品进行原位红外漫反射(-DRIFT)分析所得谱图如图4所示。直线型的吸附质分子通常能以单配位吸附、双配位吸附等构型吸附于金属氧化物表面[23]。根据Davydov[23]对吸附构型的区分,1603 cm-1处的吸收峰表示双配位吸附,该吸附类型的特点为吸附质分子的中心原子与金属氧化物表面的氧活性位成键,同时一边缘原子也与提供该活性位的金属离子成键;1384 cm-1处的吸收峰属于单配位吸附,其特点为吸附质分子的中心原子与氧活性位成键;1036 cm-1及969 cm-1处的吸收峰属于桥式双配位吸附,特点为吸附质分子的中心原子与氧活性位成键且一边缘原子与微区内的其他金属离子成键。其中,单配位吸附在CaO表面占据的比例最大,在吸附过程中最有可能优先发生该形式的吸附。此外,谱图中其余强度不高的杂峰可能是由吸附剂载体SiO2所造成的,包括SiO键的对称伸缩振动(800 cm-1、1110~1130 cm-1)和硅羟基、吸收水、结合水中OH的弯曲振动和伸缩振动(1700 cm-1)[24]。
2.2 Hg0的固定床吸附
纯N2气氛和掺杂SO2气氛条件下Hg0的穿透曲线如图5所示,在开始吸附2~3 min后,Hg0的穿透率即达95%以上,此后一直维持近乎100%的穿透率,这与Ghorishi等[25]关于CaO对Hg0吸附效率很低的结论相一致。根据吸附剂氮吸附和DRIFT表征结果,CaO的比表面积和孔容积等均远小于传统多孔吸附剂活性炭,且表面呈碱性,因而对显金属性的Hg0的吸附作用极其微弱,即在Hg0气体流经CaO时发生非常小的质量损失。在SO2作用下,吸附起始阶段Hg0的穿透率略低于N2气氛,说明SO2在CaO表面存在酸碱中和修饰功能,能在吸附剂的孔隙结构中产生吸附活性区域,形成预氧化表面,Hg0随后在该区域被氧化吸附,进而可轻微促进对Hg0的吸附[9]。因而在实际汞的分形态测量时,燃煤烟气中的SO2可能会导致填充有钙剂吸附剂的吸收段内汞含量偏高,使得Hg2+测量产生一定偏差。
2.3 HgCl2的固定床吸附
两种气氛下CaO对HgCl2的吸附实验结果如图6所示,纯N2气氛条件下,吸附管中汞收集段的汞吸附质量为0.039 μg,吸附效率为66.0%;加入1000 μl·L-1的SO2后,收集段的汞吸附质量为0.035 μg,吸附效率下降到60.3%。与Hg0相比,CaO对HgCl2的捕获能力显著增强,鉴于CaO不太发达的孔隙结构直接影响吸附质在吸附剂中的内扩散,此外,受反应动力以及HgCl2的弱酸性分子特性的限制,HgCl2在CaO表面的吸附速率并不快,从而导致了HgCl2的吸附穿透,并未实现预期的完全吸附。因此提高CaO的吸附速率,内扩散速率以及降低抽气流速可进一步强化其对HgCl2的吸附。同时,模拟烟气中的SO2与同为酸性气体的HgCl2在碱性CaO表面存在竞争关系,从而造成CaO在SO2存在的条件下对HgCl2的捕获率降低。
2.4 汞的程序升温脱附
为了深入研究SO2对HgCl2在CaO表面吸附过程中的毒化作用,在N2气氛下,对固定床中吸附HgCl2后的吸附剂进行汞脱附实验,如图7所示。纯N2气氛HgCl2吸附后的CaO样品,在程序升温过程中依次出现了3个脱附峰,在230℃处形成的主峰,强度最大,说明对应形成该汞吸附态的活性位点数量最多。而170℃及308℃处较低的脱附峰强度表明该两类活性位点的数量有限。烟气中存在SO2的情况下主脱附峰的强度有所降低,进一步说明了SO2在吸附剂的表面产生了竞争吸附,占据了一部分易于吸附HgCl2的吸附位,这与赵鹏飞[14]采用密度泛函理论研究发现SO2、HCl及NO2等酸性气体的结合能大于HgCl2在CaO表面的结合能,当SO2等酸性气体存在时,酸性气体会优先于汞吸附在CaO表面,从而抑制HgCl2的吸附的结果相一致。同时,EPA的实验结果[26]也表明,在HCl和SO2存在的情况下,钙基吸附剂对HgCl2的吸附效率大大下降。而在高温区间(>300℃)出现了新的脱附峰,说明受SO2的影响,HgCl2与SO2之间可能发生了相互作用而在吸附剂的表面形成了新的汞形态。
2.5 HgCl2的吸附机理及SO2作用机理
固体材料经高温焙烧后会形成完整表面及缺陷表面等不同的表面结构[27],根据原位DRIFT表征及纯N2气氛HgCl2吸附后的CaO样品汞脱附结果,N2气氛下直线型的HgCl2分子在CaO表面会形成如图8所示的单配位、双配位及桥式双配位3种类型的吸附构型。从原位DRIFT谱图中观察到CO2在CaO表面形成单配位吸附构型的数量最多,同时吸附剂中完整表面最常见,因此推断HgCl2以单配位的吸附形式吸附于CaO表面的概率最大,对应着图7中汞脱附曲线上230℃的脱附峰。在缺陷表面形成的吸附构型中,双氧原子的约束作用明显强于单个氧原子,因此双配位吸附对应着脱附曲线上308℃的脱附峰,而170℃处的脱附峰则代表了HgCl2在CaO表面的桥式双配位吸附。
吸附过程中存在SO2时,所得汞脱附曲线在350℃及400℃处出现的新脱附峰,说明SO2在抑制HgCl2吸附的同时,部分SO2和HgCl2在CaO表面发生相互作用,生成了Hg2SO4和HgO,其主要的反应过程如式(3)和式(4)所示
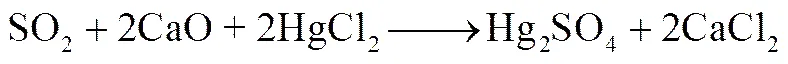
(4)
在汞的纯化合物程序升温脱附实验中[28-29],HgO在320℃附近出现了脱附峰,Hg2SO4在400℃附近存在有脱附峰,因此推断SO2气氛下吸附HgCl2后的CaO样品,经热脱附所得到的汞脱附曲线在350℃处出现的脱附峰为HgO,400℃处的脱附峰为Hg2SO4。为进一步探究SO2与HgCl2的作用机理,分别进行工况5和工况6的吸附实验,再对吸附后的样品进行汞脱附实验,如图9所示为300~475℃之间的脱附曲线。从结果中可以观察到,无论是HgCl2或者SO2先吸附于吸附剂的表面,最终均会在350℃处形成HgO的脱附峰,而在400℃处形成Hg2SO4的脱附峰,因此SO2及HgCl2在CaO表面的相互作用方式满足式(5)和式(6)所示的Eley- Rideal反应机理[30]

(6)
其中A代表了气相中的先吸附于CaO表面的HgCl2或SO2,B代表了另一种未被吸附的物质。竞争同一吸附位的HgCl2和SO2中的一种先吸附于CaO表面,而另一物质则以气态或弱吸附态的形式与吸附在表面的物质发生作用而形成HgO或Hg2SO4。如图10中的反应过程所示,当SO2与HgCl2之间竞争吸附发生时,若局部区域有足够的氧活性位,则主要发生式(4)的反应,形成HgO,而在氧活性位不足的情况下,则发生式(3)中的反应,最终形成Hg2SO4。
3 结 论
本文利用Ca(NO3)2为CaO前体,以介孔SiO2作为载体,制备了一种担载型CaO吸附剂,在固定床实验装置上分别进行了Hg0和HgCl2的吸附性能实验,并对吸附HgCl2后的CaO吸附剂,在热脱附实验装置上进行了程序升温脱附实验。结合相应的表征手段,研究了该担载型CaO吸附剂的HgCl2选择性吸附性能以及SO2毒化特性,主要结论如下。
(1)固定床Hg0的吸附结果表明,无论是在N2气氛或者是掺杂SO2气氛下,CaO对于Hg0均保持了接近100%的穿透率,其在设定的实验条件下对于Hg0基本无吸附作用,这主要是由CaO表面孔隙结构不发达以及缺少酸性官能团所造成的。
(2)固定床HgCl2吸附实验结果表明,担载型CaO吸附剂在纯N2气氛下对HgCl2的吸附效率为66%,而SO2存在的条件下,吸附效率有所降低,主要原因是SO2与HgCl2在CaO表面存在竞争关系,从而造成CaO对HgCl2的吸附效率下降。
(3)通过程序升温脱附的方法并结合原位红外漫反射表征手段,证实了HgCl2能与CaO表面不同碱性位形成单配位、双配位等多种吸附构型,多吸附构型的存在一方面使吸附剂表现出对Hg0及HgCl2一定的吸附选择性和分离性,另一方面也表明了SO2与HgCl2在易形成单配位的活性位上形成竞争吸附,进而在一定程度上造成CaO对HgCl2的吸附效率降低。
(4)通过调整SO2和HgCl2在CaO表面吸附的先后顺序,发现SO2在抑制HgCl2吸附的同时,部分HgCl2与SO2之间会发生相互作用而在吸附剂表面形成HgO与Hg2SO4,其作用方式满足Eley-Rideal反应机理。
References
[1] 吴福全, 梁柱, 王雅玲, 等. 全球大气汞排放清单研究现状[J]. 环境监测管理与技术, 2015, 27(3): 18-21. WU F Q, LIANG Z, WANG Y L,. Study on the status of global atmospheric mercury emission inventory[J]. The Administration and Technique of Environmental Monitoring, 2015, 27(3): 18-21.
[2] 王起超, 沈文国, 麻壮伟. 中国燃煤汞排放量估算[J] . 中国环境科学, 1999, 19(4): 318-321. WANG Q C, SHEN W G, MA Z W. The estimation of mercury emission from coal combustion in China[J]. China Environmental Science, 1999, 19(4): 318-321.
[3] 朱纯, 段钰锋, 尹建军, 等. 卤化铵盐改性生物质稻壳焦的汞吸附特性[J]. 东南大学学报(自然科学版), 2013, 43(1): 99-104. ZHU C, DUAN Y F, YIN J J,. Mercury adsorption by rice husk char sorbents modified by ammonium halide[J]. Journal of Southeast University(Natural Science Edition), 2013, 43(1): 99-104.
[4] 周强, 段钰锋, 冒咏秋, 等. 活性炭汞吸附动力学及吸附机制研究[J]. 中国电机工程学报, 2013, 33(29): 10-17. ZHOU Q, DUAN Y F, MAO Y Q,Kinetics and mechanism of activated carbon adsorption for mercury removal[J]. Proceedings of the CSEE, 2013, 33(29): 10-17.
[5] 李志超, 段钰锋, 王运军, 等. 300MW燃煤电厂ESP和WFGD对烟气汞的脱除特性[J]. 动力工程, 2013, 41(4): 491-498. LI Z C, DUAN Y F, WANG Y J,. Mercury removal by ESP and WFGD in a 300 MW coal-fired power plant[J]. Journal of Fuel Chemistry and Technology, 2013, 41(4): 491-498.
[6] 王震, 张丙凯, 刘晶, 等. H2O和SO2对汞在MnO2表面吸附影响的机理研究[J]. 工程热物理学报, 2016, 37(6): 1335-1339. WANG Z, ZHANG B K, LIU J,. The influencing mechanism of H2O and SO2on elemental mercury adsorption on MnO2surface[J]. Journal of Engineering Thermophysics, 2016, 37(6): 1335-1339.
[7] 钟犁, 肖平, 江建忠, 等. 燃煤电厂大气汞排放监测方法分析及试验研究[J]. 中国电机工程学报, 2012, 32(S1): 158-163.ZHONG L, XIAO P, JIANG J Z,. Study on several measuring methods of mercury emission from coal-fired power plants[J]. Proceedings of the CSEE, 2012, 32(S1): 158-163.
[8] 李辉, 王强, 朱法华. 燃煤电厂汞的排放控制要求与监测方法[J]. 环境工程技术学报, 2011, 1(3): 226-231. LI H, WANG Q, ZHU F H. The control requirements and monitoring methods for mercury emission in coal-fired power plants[J]. Journal of Environmental Engineering Technology, 2011, 1(3): 226-231.
[9] 任建莉, 周劲松, 骆仲泱, 等. 钙基类吸附剂脱除烟气中气态汞的试验研究[J]. 燃料化学学报, 2006, 34(5): 557-561. REN J L, ZHOU J S, LUO Z Y,. Ca-based sorbents form mercury vapor removal from flue gas[J]. Journal of Fuel Chemistry and Technology, 2006, 34(5): 557-561.
[10] KRISHNAN S V, BAKHTEYAR H, SEDMAN C B.Mercury sorption mechanisms and control by calcium-based sorbents[C]//The 89th Air & Waste Management Association Annual Meeting. Nashvile, 1996.
[11] GHORISHI S B, GULLETT B K. An experimental study on mercury sorption by activated carbons and calcium hydroxide[C]//Research Triangle Park. NC, 1997.
[12] WAUGH E G. Mercury control on coal-fired flue gas using dry carbon-based injection pilot-scale demonstration[C]//The AWMA Annual Meeting. San Diego, CA, 1998.
[13] KIM B G, LI X, BLOWERS P. Adsorption energies of mercury-containing species on CaO and temperature effects on equilibrium constants predicted by density functional theory calculations[J]. Langmuir, 2009, 25(5): 2781-2789.
[14] 赵鹏飞. 固体吸附剂脱除燃煤烟气汞的实验与机理研究[D]. 武汉: 华中科技大学, 2010. ZHAO P F. Experimental and mechanism study of elemental mercury removal from coal combustion flue gases by solid sorbents[D]. Wuhan: Huazhong University of Science and Technology, 2010.
[15] GHORISHI S B, SEDMAN C B. Low concentration mercury sorption mechanisms and control by calcium-based sorbents: application in coal-fired processes[J]. Journal of the Air & Waste Management Association, 1998, 48(12): 1191-1198.
[16] 佘敏, 段钰锋, 朱纯, 等. 改性生物质活性焦碳管吸附剂汞吸附性能实验研究[J]. 工程热物理学报, 2015, 36(9): 2060-2064. SHE M, DUAN Y F, ZHU C,. Experimental study on mercury adsorption of modified biomass activated carbon for sorbents traps[J]. Journal of Engineering Thermophysic, 2015, 36(9): 2060-2064.
[17] TANG H J, DUAN Y F, ZHU C,. A novel carbon trap sampling system for coal-fired flue gas mercury measurement[J]. Journal of Southeast University, 2015, 31(2): 244-248.
[18] TANG H J, DUAN Y F, ZHU C,. Characteristics of a biomass-based sorbent trap and its application to coal-fired flue gas mercury emission monitoring[J]. International Journal of Coal Geology, 2016, 170: 19-27.
[19] LI Y H, LEE C W, GULLETT B K. Importance of activated carbon’s oxygen surface functional groups on elemental mercury adsorption[J]. Fuel, 2003, 82(4): 451-457.
[20] ZENG H C, FENG J, GUO J. Removal of elemental mercury from coal combustion flue gas by chloride-impregnated activated carbon[J]. Fuel, 2004, 83(1): 143-146.
[21] LIU J, QU W Q, ZHENG C G. Theoretical studies of mercury-bromine species adsorption mechanism on carbonaceous surface[J]. Proceedings of the Combustion Institute, 2013, 34(2): 2811-2819.
[22] 辛勤. 现代催化研究方法[M]. 北京: 北京科技出版社, 2009: 18-25. XIN Q. Modern Catalytic Research Methods[M]. Beijing:Beijing Science and Technology Press, 2009: 18-25.
[23] DAVYDOV A A. Infrared Spectroscopy of Adsorbed Species on the Surface of Transition Metal Oxides[M]. Chichester, 1990.
[24] 陈和生, 孙振亚, 邵景昌. 八种不同来源二氧化硅的红外光谱特征研究[J]. 硅酸盐通报, 2011, 30(4): 934-937. CHEN H S, SUN Z Y, SHAO J C. Investigation on FT-IR spectroscopy for eight different sources of SiO2[J]. Bulletin of the Chinese Ceramic Society, 2011, 30(4): 934-937.
[25] GHORISHI S B, SEDMAN C B. Combined mercury and sulfur oxides control using calcium-based sorbents[C]//NASA. Washington, DC: 1997.
[26] GHORISHI S B, GULLETT B K. Sorption of mercury species by activated carbons and calcium-based sorbents: effect of temperature, mercury concentration and acid gases[J]. Waste Management & Research, 1998, 16(6): 582-593.
[27] GABER A, ABDEL-RAHIM M A, ABDEL-LATIEF A Y,Influence of calcination temperature on the structure and porosity of nanocrystalline SnO2synthesized by a conventional precipitation method[J]. Int. J. Electrochem. Sci., 2014, 9(1): 81-95.
[28] RUMAYOR M, DIAZ-SOMOANO M, LOPEZ-ANTON M A,. Mercury compounds characterization by thermal desorption[J]. Talanta, 2013, 114: 318-322.
[29] 陈明明, 段钰锋, 周强, 等. 烟气组分对汞吸附影响的程序升温脱附[J]. 化工进展, 2016, 35(12): 4065-4071. CHEN M M, DUAN Y F, ZHOU Q,. Temperature programmed desorption (TPD) studies on the effect of flue gas component on mercury adsorption[J]. Chemical Industry and Engineering Progress, 2016, 35(12): 4065-4071.
[30] PRESTO A A, GRANITE E J. Survey of catalysts for oxidation of mercury in flue gas[J]. Environmental Science & Technology, 2006, 40(18): 5601-5609.
Mercury selective adsorption characteristics and SO2poison performance on CaO
LI Chunfeng, DUAN Yufeng, TANG Hongjian, ZHU Chun, ZHENG Yiwu, WEI Hongqi
(Key Laboratory of Energy Thermal Conversion and Control of Ministry of Education, School of Energy and Environment,Southeast University, Nanjing 210096, Jiangsu, China)
UsingCa(NO3)2as a precursor and SiO2as carrier, a supported CaO adsorbent was prepared. The selective adsorption performances of elemental mercury (Hg0) and mercuric chloride (HgCl2) of the sorbent were conducted in a fixed bed, and the effects of SO2on CaO mercury adsorption process were also investigated. At the same time, combined with the program temperature desorption (TPD) anddiffuse reflectance infrared spectroscopy (-DRIFT) characterization technology, the selective adsorption mechanism of CaO and the mechanism of SO2poisoning were deeply investigated. The mercury adsorption results showed that CaO maintained a breakthrough of nearly 100% for Hg0in pure N2atmosphere and doped SO2atmosphere, while HgCl2manifested 66.0% and 60.3% adsorption efficiency in two atmospheres, respectively, indicating that there was a competitive adsorption relationship between SO2and HgCl2on CaO surface. The characterized results of CaO before and after adsorption suggested that as compared with Hg0, HgCl2was able to form monodentate, bidentate and other adsorption structure with the basic sites on the CaO surface. SO2and HgCl2formed a competitive adsorption relationship in the active sites where the bridged bidentate was easily formed, resulting in the reduction of adsorption efficiency of HgCl2on CaO.
CaO adsorbents; elemental mercury; mercuric chloride; selective adsorption; sulfur poisoning
10.11949/j.issn.0438-1157.20170343
X 511
A
0438—1157(2017)09—3565—08
2017-04-01收到初稿,2017-05-27收到修改稿。
段钰锋。
李春峰(1991—),男,硕士研究生。
国家重点研发计划项目(2016YFC0201105);国家自然科学基金项目(51576044, 51676041)。
2017-04-01.
Prof.DUAN Yufeng, yfduan@seu.edu.cn
supported by the National Key R&D Program of China (2016YFC0201105) and the National Natural Science Foundation of China (51576044, 51676041).
