右旋布洛芬/尿素改性蒙脱土复合物的制备及体外释药性能
2017-10-13李婷婷赵乐乐郑子良王振军张瑞平
李婷婷,赵乐乐,郑子良,王振军,张瑞平
右旋布洛芬/尿素改性蒙脱土复合物的制备及体外释药性能
李婷婷1,赵乐乐1,郑子良2,王振军3,张瑞平3
(1山西医科大学药学院,山西太原 030001;2山西医科大学转化医学研究中心,山西太原 030001;3山西医科大学第一医院影像科,山西太原 030001)
以蒙脱土为药物载体,利用尿素固相研磨法将蒙脱土层间距撑大,以提高其载药量;采用溶液插层法实现右旋布洛芬的有效负载,制备右旋布洛芬/尿素改性蒙脱土[S(+)-IBU/urea-MMT]复合物;借助X射线衍射(XRD)和傅里叶红外变换光谱(FT-IR)对复合物进行结构表征;采用透析法研究复合物中药物的体外释药性能;运用3种数学模型对其体外释放行为进行拟合分析,探索释药机理。结果表明,在尿素的作用下,蒙脱土的层间距由1.20 nm增大到1.79 nm,右旋布洛芬的负载量最高可达227.9 mg·g-1,较改性前提高了30%;S(+)-IBU/urea-MMT复合物具有良好的缓释效果,在人工模拟胃液(pH 1.2)和人工模拟肠液(pH 6.8)中的累计释放量分别为19.2%和88.4%;复合物的释药行为基本符合零级释放动力学模型。
蒙脱土;右旋布洛芬;尿素;缓释;药物
引 言
布洛芬(ibuprofen,IBU)为芳基烷酸类化合物,是一种疗效确切的抗炎镇痛药物[1]。布洛芬存在右旋布洛芬[S(+)-IBU]和左旋布洛芬[S(-)-IBU]两个光学异构体,其中S(+)-IBU的药理活性是S(-)-IBU的160倍[2-3]。目前,S(+)-IBU临床上广泛用于治疗各种中度疼痛及炎症、发热等疾病,特别是作为风湿性、类风湿性关节炎和骨关节炎的长期用药,其治疗效果明显[4-5]。但S(+)-IBU的生物半衰期短(1.8~2 h),维持治疗浓度需要频繁给药(每日3~4次),长期口服可导致消化不良、呕吐、胃肠道溃疡等副作用[6-7]。为了获得良好的临床用药效果,减少不良反应,国内外对右旋布洛芬进行了各种新剂型方面的研究,其中缓控释制剂的研发是关注的热点[8]。
蒙脱土(montmorillonite,MMT)是自然界中蕴藏丰富的2:1型层状硅酸盐黏土矿物[9-12],具有许多优异的物理化学性能,如离子交换性、分散性、吸附性等。近几年来国内外学者根据蒙脱土高比表面积和强吸/脱附能力的特性,认为它是一种优良的缓/控释药物载体[13-14]。药物-蒙脱土复合物不仅大大增加了药物分子与介质的接触表面积,提高难溶性药物的体外溶出度,还可作为高效的药物传递系统,使药物在体内以恒定速度缓慢释放,从而保持血药浓度平稳,减小毒副作用和给药次数[15-16]。除此以外,蒙脱土还具有优越的生物相容性、口服安全性、独特的药物保护作用、药物控释能力等特点。但蒙脱土表面的亲水性不利于其在有机相中的分散以及对有机体的吸附,因此当蒙脱土与有机体系复合时,需要对其层间进行有机改性处理,使表面疏水化,强化其作为生物化学复合材料的理化性能[17]。
本文以蒙脱土作为右旋布洛芬的载体材料,构筑右旋布洛芬/尿素改性蒙脱土[S(+)-IBU/urea- MMT]药物缓释复合系统。首先借助尿素固相研磨法修饰蒙脱土的层间结构,撑大层间距,然后通过溶液插层法实现右旋布洛芬的有效承载,同时探索复合物在不同释放介质中的释放规律和缓释机理。这对于丰富硅酸盐类粘土矿物材料的医药应用,具有一定的科学意义和较高的社会经济价值。
1 实 验
1.1 原料
钠基蒙脱土(浙江三鼎科技有限公司),其化学组成为[%(质量)]:SiO261.68,Al2O319.55,Fe2O31.71,TiO20.06,K2O 0.68,MgO 3.63,CaO 2.58,Na2O 4.06,P2O50.08,SO30.07。烧失量[%(质量)]:6.40。阳离子交换容量(CEC):110 mmol/100 g。右旋布洛芬原料药(湖北远成集团);无水乙醇、尿素、磷酸二氢钾均为分析纯(天津市科密欧化学试剂有限公司)。
1.2 S(+)-IBU/urea-MMT复合物的制备
根据蒙脱土的交换容量,精密称取相应质量的尿素(1~5倍CEC),与1 g的蒙脱土共混,置于研钵中研磨2 h,备用。取尿素处理后的蒙脱土粉末1 g加入50 ml无水乙醇,超声振动30 min,制得混悬液;准确称取一定量的右旋布洛芬原料药加入到上述混悬液中,室温下搅拌2 h(以上过程均在最佳实验条件下完成)。反应结束后,在3500 r·min-1的台式离心机中离心20 min,将离心后得到的产物干燥,研磨并过75mm筛,即得右旋布洛芬/尿素改性蒙脱土[S(+)-IBU/urea-MMT]复合物。
1.3 S(+)-IBU/urea-MMT复合物的表征
采用X射线衍射(XRD)表征样品的晶相结构。所用仪器为日本Rigaku公司的D/Max-2500型X射线衍射仪,采用Cu靶Kα射线,靶电压为40 kV,扫描范围为5°~40°。
采用Bruker公司的NICOLET Nexus型傅里叶变换红外光谱仪测定样品中原子的成键情况。样品测试前需要进行KBr压片处理,扫描范围为4000~400 cm-1。测试所得数据经OMNIC软件进行处理后使用。
1.4 S(+)-IBU/urea-MMT复合物载药量的测定
分别精确称取100 mg蒙脱土和尿素改性蒙脱土,加入不同浓度的S(+)-IBU溶液,常温载药4 h,离心,取上层清液。采用吸光光度法测定右旋布洛芬的浓度,根据式(1)计算载药量。
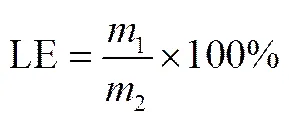
式中,LE为S(+)-IBU/urea-MMT复合物的载药量,%;1为复合物中S(+)-IBU的质量,g;2为复合物的总质量,g。
1.5 S(+)-IBU/urea-MMT复合物的体外释放性能考察
按照《中国药典》规定,分别以pH 1.2的人工模拟胃液(稀盐酸溶液)和pH 6.8的人工模拟肠液(磷酸缓冲液)为释放介质,精确称取一定量的尿素改性前后的S(+)-IBU/MMT复合物粉末装入透析袋,然后将其放入振荡仪中。根据式(2)计算不同时间内的累积释放百分率t(%)。

式中,C为第次置换时释放液中的药物浓度,µg·ml-1;为载药量,mg·g-1;drug为S(+)-IBU/urea-MMT复合物的质量,mg;为置换介质的次数;e为释放介质置换体积,ml;0为起始释放液体积,ml。
2 结果与讨论
2.1 尿素插层分析
蒙脱土层间距的改变是确定药物插层效果的重要参数之一。对尿素固相研磨法处理后的蒙脱土进行XRD分析,研究蒙脱土层间距的变化情况,结果见表1。从表1可以看出,未经尿素处理的蒙脱土层间距只有1.20 nm,随着尿素用量的增加,层间距逐渐增大到1.79 nm,当尿素的用量增到5CEC之后,层间距基本保持不变。这是因为蒙脱土层间所吸附的粒子具有离子交换性能。在物理研磨处理过程中,尿素分子与蒙脱土层间离子发生交换作用,使其层间距扩大[18]。离子交换属化学计量反应,符合质量守恒定律,当交换容量达饱和后,蒙脱土的层间距不再增大。尿素在载药复合物制备过程中的媒介作用如图1所示。

表1 不同比例的尿素与MMT研磨后的层间距大小

图1 尿素进入MMT层间的直观反映图
2.2 XRD分析
采用溶液插层法将右旋布洛芬载入经尿素改性后的蒙脱土上,其XRD分析如图2所示。蒙脱土的特征衍射2=7.3º。根据Bragg方程[19],其对应的层间距为1.20 nm。未经处理的蒙脱土直接与右旋共混后,其(001)面衍射峰的位置略向小角偏移,对应的层间距略有增加,约为1. 32 nm。蒙脱土经尿素改性后再上载右旋布洛芬,其(001)面衍射峰的位置向小角方向偏移的更为明显,对应的层间距也更大,001值约为1.86 nm。这是因为借助固相研磨法使尿素分子进入蒙脱土层间并使层间距扩大,离子交换为一可逆过程,尿素分子与蒙脱土的结合力为较弱的范德华力,在外界介质的作用下尿素分子可从蒙脱土层间退出进入溶液,这为大量右旋布洛芬进入蒙脱土层间提供了可能,实现药物与载体的有效负载,弥补单一蒙脱土载药量低的缺陷,该过程的直观示意图如图3所示。
2.3 FT-IR分析
右旋布洛芬/蒙脱土复合物的红外光谱如图4所示。改性前蒙脱土在3616和3527 cm-1附近的两个特征吸收峰是蒙脱土的特征红外光谱,分别表示蒙脱土晶格中的—OH基伸缩振动吸收峰和板层层间吸附水的—OH基伸缩振动吸收峰。在1031~1103 cm-1附近的特征吸收峰是由蒙脱土骨架间的四面体Si—O—Si 面内不对称伸缩振动引起的,796 cm-1处的吸收峰代表着石英中Si—O对称伸缩振动峰,在526和470 cm-1处出现的吸收峰分别对应于蒙脱土的Al—O—Si和Si—O—Si 的弯曲振动吸收峰[20]。经尿素预处理负载右旋布洛芬后,出现一些新的吸收峰:3000 cm-1为右旋布洛芬烷基伸缩振动峰,1720 cm-1为布洛芬分子结构中羧基非对称振动峰。2390、1558和1390 cm-1处为布洛芬结构中的RCOO—与蒙脱土结构中的—OH和Al3+发生络合作用的特征峰[21]。所得复合物中并未发现尿素的特征吸收峰,可见尿素与蒙脱土是以相对较弱的范德华力结合,在外界溶液的作用下,尿素从蒙脱土层间“逃逸”出来,为右旋布洛芬的顺利载入提供了有利的空间条件。
2.4 初始药物浓度对蒙脱土载药量的影响
载药量与初始药物浓度之间的关系如图5所示。随着右旋洛芬初始浓度的增加,单一蒙脱土和经尿素改性后蒙脱土的载药量都有明显增加,直到右旋布洛芬初始浓度增大至5 mg·ml-1后,载药量趋于平稳,即使再增大药物初始浓度直,载药量的增大幅度都很小,说明右旋布洛芬和蒙脱土的结合位点已趋于饱和。若初始药物浓度相同,尿素改性蒙脱土的载药量总是大于单一蒙脱土的载药量。经尿素预处理的蒙脱土载药量最高可达227.9 mg·g-1,而单一蒙脱土的载药量只有175.9 mg·g-1,改性后的载药量较改性前提高了近30%。这是因为尿素将蒙脱土的层间距撑大,更利于右旋布洛芬的上载,这与XRD和FT-IR的结构分析吻合。除此以外,尿素的引入,将蒙脱土层间亲水特性修饰为亲脂特性,这也有利于有机药物布洛芬的进入。因此,尿素改性能明显提高蒙脱土的载药能力,实现右旋布洛芬的有效负载。
2.5 S(+)-IBU/urea-MMT复合物体外释放性能研究
本文对右旋布洛芬原料药和S(+)-IBU/urea- MMT在人工模拟胃液(pH 1.2)和人工模拟肠液(pH 6.8)中进行体外释放实验,并计算不同时间内的累积释放百分量。根据图6的研究结果可知,未与蒙脱土复合的原料药布洛芬,在人工模拟胃液(pH 1.2)释放曲线较平缓,呈缓慢上升趋势,累积释放量较小;在人工模拟肠液(pH 6.8)中快速释放,在0.5 h内完全释放,可见布洛芬口服吸收迅速,在短时间内血药浓度即达峰值,维持治疗浓度需要频繁给药,但长期大量服用可引起肠道刺激反应甚至导致胃肠道出血,同时肾脏损伤作用也增强了。为了提高药物的安全性和有效性,需要对右旋布洛芬进行剂型改良[22]。与蒙脱土复合后,布洛芬在人工模拟胃液(pH 1.2)中的累积释放量依旧很小,这是因为右旋布洛芬是一种弱酸性药物,在强酸介质中的溶解度较小,无法扩散形成一定的浓度差,而药物浓度差是蒙脱土层间离子交换反应的驱动力。由于驱动力不足,导致蒙脱土层间右旋布洛芬无法继续释放[23]。S(+)-IBU/MMT在人工模拟肠液(pH 6.8)中释放效果良好,前2 h内,有42.8%的药物从复合物体系中释放出来;之后的10 h内,累积释放量逐渐增加至88.4%,基本实现药物的缓释效果,并具有一定的pH响应性[24-25]。根据载药量与释药量之间药物的物料衡算,药物无法实现完全释放。主要原因是蒙脱土层间域的离子交换反应存在吸附-脱附平衡,当蒙脱土层间与环境的药物浓度达到平衡后,右旋布洛芬将不再与释放介质中的离子进行交换,累积释放量达到稳定状态[26]。

图6 S(+)-IBU原料药和S(+)-IBU/urea-MMT复合物在不同释放介质的释放曲线
2.6 S(+)-IBU/urea-MMT体外释药机理研究
根据右旋布洛芬在人工模拟肠液中的累积释放曲线,分别按照零级(zero-order)、一级释放模型(first-order)和Higuchi方程进行体外释放拟合[27-28],拟合结果见表2。其中为药物累积释放百分含量,R为确信系数,为释放时间。零级释放动力学方程的拟合相关性优于一级和Higuchi方程的数学模型,说明零级释放动力学方程更接近实验值。在释放的初始阶段,被吸附于蒙脱土表面的右旋布洛芬溶解于周围介质中,蒙脱土的板层之间因水分子的介入发生溶胀作用,导致层间距增大,促使药物分子进一步溶出。由于浓度差的推动作用,蒙脱土孔道中的右旋布洛芬缓慢溶出,致使释药过程发生。蒙脱土独特的离子交换特性,使蒙脱土层间与环境的药物浓度达到平衡后,药物分子不再与体液中的离子进行交换,累积释放量即达平衡状态。综上所述,S(+)-IBU/urea-MMT在释放介质中的释放是物理扩散、离子交换和药物溶解等协同作用的结果,其释放机理比较复杂。右旋布洛芬与蒙脱土复合后,其体外释放效果较单一药物具缓释作用,药物有效浓度长时间保持恒定,弥补了单一右旋布洛芬半衰期短的缺陷,也证实了蒙脱土是一种性能优异的药物缓释载体[29]。通过尿素预处理提高了蒙脱土的载药量,不仅为寻求廉价安全的口服药物载体提供理论依据,也为实现蒙脱土的高附加值开发利用,提供积极的研究价值和良好的应用前景[30]。

表2 S(+)-IBU/urea-MMT在人工模拟肠液中释放的不同动力学模型拟合结果
3 结 论
用天然蒙脱土为右旋布洛芬的药物载体,采用固相研磨法将尿素引入蒙脱土层间,使层间距由1.20 nm 增大到1. 79 nm。预处理后的蒙脱土再经溶液插层法,右旋布洛芬顺利进入到蒙脱土层间,成功制备S(+)-IBU/urea-MMT复合物。固相研磨法显著提高了蒙脱土的载药能力,最高载药量约为227.9 mg·g-1,较改性前提高了30%,为提高临床药效、延长药物作用时间提供了可能性。S(+)-IBU/urea-MMT具有缓释制剂的药物效果,且有一定的pH响应性,pH 6.8的肠液环境有利于药物的释放,累积释放量可达88.4%。零级动力学模型能更好描述右旋布洛芬在人工肠液中的体外释放度随时间的变化,S(+)-IBU/urea-MMT的释放是物理扩散、离子交换和药物溶解等协同作用的结果。
References
[1] SHIN D, LEE S J, HA Y M,. Pharmacokinetic and pharmacodynamic evaluation according to absorption differences in three formulations of ibuprofen[J]. Drug Des. Dev. Ther., 2017, 11: 135-141.
[2] JOANNA D, ROLA M, ANA Q,. Preparation, characterization and application in controlled release of ibuprofen-loaded guar gum/montmorillonite bionanocomposites[J]. Appl. Clay Sci., 2017, 135: 52-63.
[3] GIRIJA S, ADARSH R K, VINEETH M V,. Design, preparation and characterization of pH-responsive prodrug micelles with hydrolyzable anhydride linkages for controlled drug delivery[J]. J. Colloid Interface Sci., 2017, 492: 61-72.
[4] WAN Y Z , CUI T,XIONG G Y,Magnetic lamellar nanohydroxyapatite as a novel nanocarrier for controlled delivery of 5-fluorouracil[J].Ceram. Int., 2017, 43: 4957-4964.
[5] 奚利飞. 药物蒙脱土缓释体系的制备和体外释放的研究[D]. 天津: 天津大学, 2004. XI L F. Study on preparation andrelease experiments of drugs/montmorillonite sustained-release systems[D]. Tianjin: Tianjin University, 2004.
[6] 赵乐乐, 李婷婷, 代灵华, 等. 右旋布洛芬/蒙脱土的制备及体外释放性能研究[J]. 硅酸盐通报, 2016, 35(10), 3393-3397. ZHAO L L, LI T T, DAI L H,. Preparation and release of S(+)-ibuprofen/montmorillonite nanocomposites[J]. Bull. Chin. Ceram. Soc., 2016, 35(10): 3393-3397.
[7] 高琳. 双模型介孔SiO2表面功能化及其在药物缓控释中的应用[D]. 北京: 北京工业大学, 2011. GAO L. Surface functionalization of bimodal mesopores silicas and the application in drug delivery[D]. Beijing: Beijing University of Technology, 2011.
[8] FORESTI M L, GALLE M, FERREIRA M L,. Enantioselective esterification ofibuprofen with ethanol as reactant and solvent catalyzed by immobilized lipase: experimental and molecular modeling aspects[J]. J. Chem. Technol. Biot., 2009, 84: 1461-1473.
[9] HUANG Y, TAO Q, HOU D Z,. A novel ion-exchange carrier based upon liposome-encapsulated montmorillonite for ophthalmic delivery of betaxolol hydrochloride[J].Int. J. Nanomed., 2017, 12: 1731-1745.
[10] JOANNA D, ROLA M,ANA Q,.Preparation, characterization and application in controlled release of ibuprofen-loaded guar gum/montmorillonite bionanocomposites[J]. Appl. Clay Sci., 2017, 135: 52-63.
[11] CARVALHO P O, CONTESINI F J, BIZACO R,. Optimization of enantioselective resolution of racemic ibuprofen by native lipase from aspergillus niger[J]. J. Ind. Microbiol. Biot., 2006, 33: 713-718.
[12] 范兆明.蒙脱土纳米复合药物释放载体的研究[D]. 天津: 天津大学, 2009. FAN Z M. Study on montmorillonite nanocompound drug delivery carrier[D]. Tianjin: Tianjin University, 2009.
[13] 孙申美,徐海军,邵强.环糊精侧链对聚羧酸减水剂抑制蒙脱土的影响[J]. 化工学报, 2017, 68(5): 2204-2210.SUN S M, XU H J, SHAO Q.Effect of-cyclodextrin pendant on dispersion robustness of polycarboxylate superplasticizers toward montmorillonite[J].CIESC Journal, 2017,68(5): 2204-2210.
[14] 李婷婷, 殷雪梅, 谢鲜梅. Ni-Cu/蒙脱土乙醇水蒸气重整制氢催化剂性能研究[J]. 硅酸盐通报, 2015, 34(4): 1058-1065. LI T T, YIN X M, XIE X M. Performance of catalysts Ni-Cu/montmorillonite for preparation of hydrogen from ethanol steam reforming[J]. Bull. Chin. Ceram. Soc., 2015, 34(4): 1058-1065.
[15] LI T T, ZHANG J F, XIE X M,. Montmorillonite-supported Ni nanoparticled for efficient hydrogen production from ethanol steam reforming[J]. Fuel, 2015, 143: 55-62.
[16] 杨飞, 张莹, 李传宪, 等.EVA/纳米蒙脱土复合降凝剂对长庆含蜡原油的作用规律[J].化工学报, 2015, 66(11): 4611-4617.YANG F, ZHANG Y, LI C X,.Effects of pour point depressant of EVA/nano MMT composites on Changqing crude oil[J]. CIESC Journal, 2015, 66(11): 4611-4617.
[17] 韩朗, 庹必阳, 杨慧, 等. 锆柱撑蒙脱石对黄药的吸附机理[J].硅酸盐学报,2017, 45(5): 1-8.HAN L, TUO B Y, YANG H,. Adsorption mechanism of xanthate by zirconium pillared montmorillonite[J].J. Chin. Ceram. Soc.,2017, 45(5): 1-8.
[18] MORTEZA R, HOSSEIN S, ALI H R. Gallic acid-loaded montmorillonite nanostructure as a new controlled release system[J]. Appl. Clay Sci., 2016, 119: 236-242.
[19] 吴洁, 丁师杰, 陈静, 等.酸化凹凸棒石/海藻酸复合材料的制备及其缓释性能[J].化工学报, 2014, 65(11): 4627-4632.WU J, DING S J, CHEN J,.Preparation and sustained release properties of acidified-attapulgite/alginate composite material[J]. CIESC Journal, 2014, 65(11): 4627-4632.
[20] 刘莉. 蒙脱石载药缓释微球的制备[D]. 广州: 广东药学院, 2013.LIU L. Montmorillonite as a drug delivery system: intercalation and preparation of Betaxolol microspheres[D]. Guangzhou: Guangdong Pharmaceutical University, 2013.
[21] SHILPA J, MONIKA D. Montmorillonite-alginate microspheres as a delivery vehicle for oral extended release of Venlafaxine hydrochloride[J]. J. Drug Deliv. Sci. Tec., 2016, 33: 149-156.
[22] SUMANTA K, TEJINDER K, THIRUGNANAM A. Microwave-assisted synthesis of porous chitosan-modified montmorillonite-hydroxyapatite composite scaffolds[J]. Int. J. Biol. Macromol., 2016, 82: 628-636.
[23] 张彩云, 王静, 印红红, 等.蒙脱石/苦参碱纳米复合物的制备及体外性能的研究[J].中国药学杂志, 2014, 49(2): 134-137. ZHANG C Y,WANG J,YIN H H,.Preparation andproperties of montmorillonite/matrine nanocomposite[J]. Chin. Pharm. J., 2014, 49(2): 134-137.
[24] INMACULADA S, CAROLA A, GIUSEPPINA S,.biocompatibility and mucoadhesion of montmorillonite chitosan nanocomposite: a new drug delivery[J]. Appl. Clay Sci., 2012, 55: 131-137.
[25] 林粤顺, 周红军, 周新华, 等.pH 响应性 PAA/毒死蜱/氨基化介孔硅缓释体系的制备与性能[J]. 化工学报, 2016, 67(10): 4500-4507.LIN Y S, ZHOU H J, ZHOU X H,.Preparation and properties of pH-responsive control release system of PAA/chlorpyrifos/amino functionalized mesoporous silica[J]. CIESC Journal, 2016, 67(10): 4500-4507.
[26] CHEN Y M, ZHOU A N, LIU B,. Tramadol hydrochloride/montmorillonite composite: Preparation and controlled drug release[J]. Appl. Clay Sci., 2010, 49(3): 108-112.
[27] 吴文胜, 张灿阳, 李秀喜, 等.跨尺度方法研究聚合物载药胶束的定量构性关系[J]. 化工学报, 2015, 66(6): 3403-3412.WU W S, ZHANG C Y, LI X X,.Cross-scale method for quantitative structure-property relationship of drug-loaded polymeric micelles[J]. CIESC Journal, 2015, 66(6): 3403-3412.
[28] SISHEN F,LIN M,PANNEERSELVAN A,.Poly(lactide)- vitamin E derivative/montmorillonite nanoparticle formulations for the oral delivery of Docetaxel[J].Biomaterials, 2009, 30: 3297-3306.
[29] GHANSHYAM V J, BHAVESH D K,HASMUKH A P,. Montmorillonite as a drug delivery system: intercalation andrelease of timolol maleate[J].Int. J. Pharm., 2009, 374: 53-57.
[30] 李婷婷, 赵乐乐, 王锐利, 等. 酮洛芬/酸改性蒙脱土缓释体系的制备及体外释药研究[J]. 高等学校化学学报, 2017, 38(5): 722-728. LI T T, ZHAO L L, WANG R L,.Preparation andproperties of ketoprofen/acid-montmorillonite[J]. Chem. J. Chinese Universities, 2017, 38(5): 722-728.
Preparation andproperties of S(+)-ibuprofen/urea-montmorillonite
LI Tingting1, ZHAO Lele1, ZHENG Ziliang2, WANG Zhenjun3, ZHANG Ruiping3
(1College of Pharmacy, Shanxi Medical University, Taiyuan 030001, Shanxi, China;2Translational Medicine Research Center, Shanxi Medical University, Taiyuan 030001, Shanxi, China;3Imaging Department, The First Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi, China)
In order to improve the drug loading, urea was used to insert into the montmorillonite interlayer by solid-phase grinding method. After this process, the ibuprofen was loaded by the solution blending to obtain ibuprofen/urea-montmorillonite (S(+)-IBU/urea-MMT) composite. The composites were characterized by X-ray diffraction (XRD) and Fourier transformed infrared (FT-IR) spectroscopy. Thedrug release behaviors of S(+)-IBU/urea-MMT were investigated by the dialysis method. Three models ofdrug release could be used to simulate the release performance of the S(+)-IBU/urea-MMT composites. The results show that the urea was intercalated into the montmorillonite layers, and the interlayer spacing of montmorillonite was enlarged from 1.20 to 1.79 nm. The maximum loading capacity of S(+)-IBU on the modified montmorillonite was 227.9 mg·g-1, increased by a factor of 30%. In the artificial gastric juice (pH 1.2) andin the artificial intestinal juice (pH 6.8), thecumulative amount of the compositeswere 19.2% and 88.4% respectively. The variation ofrelease rate can be well described by the zero order kinetics model.
montmorillonite; S(+)-ibuprofen; urea; sustained release; pharmaceuticals
10.11949/j.issn.0438-1157.20170424
O 611. 4
A
0438—1157(2017)09—3631—07
2017-04-18收到初稿,2017-06-17收到修改稿。
张瑞平。
李婷婷(1984—),女,博士,讲师。
国家自然科学基金项目(81571747);山西省青年科技研究基金项目 (201601D202105);山西省重点研发计划项目(2016021);山西医科大学校博士启动基金项目(03201529)。
2017-04-18.
Prof. ZHANG ruiping, lily8631@163.com
supported by the National Natural Science Foundation of China (81571747), the Natural Science Foundation for Shanxi Province (201601D202105), the Key Research and Development Project of Shanxi Province (2016021) and the Foundation for PhD of Shanxi Medical University (03201529).
