不同溶藻菌对小球藻破碎及油脂提取效果的影响
2017-09-16邓春芳章莹颖成家杨
邓春芳,崔 岩,章莹颖,成家杨
(北京大学深圳研究生院环境与能源学院,广东 深圳 518055)
生物工程
不同溶藻菌对小球藻破碎及油脂提取效果的影响
邓春芳,崔 岩,章莹颖,成家杨
(北京大学深圳研究生院环境与能源学院,广东 深圳 518055)
为探究溶藻菌对微藻细胞破碎及油脂提取效果的影响,以小球藻为研究对象,选取5株溶藻菌进行混合培养。结果表明:不同溶藻菌对小球藻细胞破碎及油脂提取效果各不相同。不同溶藻菌的溶藻率依次为:Aeromonahydrophila(73%)>Pseudomonasflurescens(65%)>Bowmanelladenitrificans(56%)、Bacilluscirulans(56%)>Kordiasp. (43%)。利用正己烷对小球藻油脂进行提取,提油率依次为:Bowmanelladenitrificans(58.4%)>Kordiasp.(52.7%)>Pseudomonasflurescens(24.1%)>Bacilluscirulans(22.5%)>Aeromonahydrophila(21.1%)>对照组(10.4%)。其中Bowmanelladenitrificans菌株在24 h内就能达到高溶藻率,且提油率相比对照组提高4.6倍。
溶藻菌;小球藻;细胞破碎;油脂提取
随着经济的快速发展,能源的需求不断增加,能源短缺已经成为制约全球经济发展的一个重要因素。生物柴油作为主要的生物能源之一,是一种可生物降解、无毒的可再生能源,具有环境友好、原料可再生的等优点,是当前可持续发展再生能源的研究热点。目前生物柴油在世界各国得到了大力推进,已成为发展最快、应用最广的环保型可再生能源。微藻是最有发展潜力的生物柴油的原料之一,具有生长繁殖快、生长周期短、油脂含量高并且不受气候与季节限制的特点[1-3]。
小球藻是一种单细胞真核微藻,在自然界中分布范围广,对生长条件要求低,环境耐受性好,繁殖速度快,人工培养较容易,以淡水环境居多,是可进行大规模户外培养的微藻品种之一。同时,小球藻细胞内油脂累积可高达干重的55%,主要油脂成分以C16和C18的脂肪酸甘油酯为主,与大豆等植物中提取的油脂成分相似,酯交换后得到的脂肪酸甲酯其燃烧性能与石化柴油极其相似。但其大规模生产应用还需要解决不同环节存在的技术和经济问题,其中,研发具有高效节能的油脂提取技术是降低成本的有效途径之一[4-6]。
溶藻菌是指能够抑制藻类生长或杀死藻类、溶解藻细胞的细菌的统称[7]。在水生生态系统中,溶藻菌作为生物种群结构和功能的重要组成部分,对维持微藻的生物平衡具有十分重要的作用。在1942年,Geitler报道了一种能够使刚毛藻死亡的粘细菌,之后有其他学者陆续从海洋和淡水系统中分离出多株溶藻菌[8]。主要有:粘细菌(Myxobacter)[9],交替单胞菌(Alteromonas)[10],杆菌(Bacillus)[11],假单胞菌(Pseudomonas)[12],交替假单胞菌(Pseudoalteromonas)[13],葡萄球菌属(Staphylococcus)[14],噬胞菌属(Cytophaga)[15],纤维弧菌属(Cellvibrio)节杆菌(Arthrobacter)[16],黄杆菌属(Flavobacterium)弧菌(Vibrio)[17]等。这些溶藻菌大多数为革兰氏阴性菌,溶藻目标广泛,如蓝藻、硅藻、甲藻及绿藻等。而有些则具有一定的特异性,只能对某些单一种属的微藻产生溶藻作用。因此,不同种类的溶藻菌在目标藻种及溶藻效果方面都存在一定差异。
目前国内对于溶藻菌研究主要集中在生物防治有害藻华,包括溶藻菌株的分离鉴定、溶藻方式的探讨以及溶藻活性物质的分离纯化,而利用溶藻菌对微藻进行预处理以提高油脂提取率的研究较少。2013年Chen等[18]报道利用溶藻菌Flammeovirgayaeyamensis对小球藻进行细胞破壁预处理,小球藻油脂提取率可以达到100%。2014年Wang等[19]将溶藻菌Sagittulastellata和两种微藻(Nannochloropsisoculata、Dunaliellasalina)分别进行混合共培养,得到油脂提取率相比对照分别提高1.39倍和1.85倍。章莹颖等[20]通过比较不同破碎方法对微藻细胞破碎和油脂提取效果的影响,发现溶藻菌不仅具有较好的细胞破碎效果,且能提高油脂提取率。因此,本研究以小球藻为研究对象,选取5株已报道过具有较强溶藻效果的细菌与小球藻进行混合培养,探究溶藻菌对微藻细胞破碎及油脂提取效果的影响。
1 材料与方法
1.1 试验材料
1.1.1 藻种
小球藻由实验室自主采集及分离,采用BG-11培养基进行摇瓶培养,其配方为:在1 L水中加入Na2EDTA 0.001 g,柠檬酸铁铵0.006 g,柠檬酸0.006 g,CaCl2·2H2O 0.036 g, MgSO4·7H2O0.075 g,K2HPO4·3H2O 0.04 g,H3BO30.002 86 g,MnCl2·4H2O 0.001 86 g,ZnSO4·7H2O 0.000 222 g,CuSO4·5H2O 0.000 079 g,Co(NO3)2·6H2O 0.000 05 g,Na2MoO4·2H2O 0.000 391 g,Na2CO30.02 g,NaNO31.5 g。
1.1.2 溶藻菌
试验中的5株溶藻菌从国内具有资质认证的微生物菌种保藏管理中心获得,如表1所示。表1中菌株在文中依次简称为Kordia、Bowmanella、Aeromona、Pseudomonas、Bacillus,相应图表中分别用Kor、Bow、Aer、Pse、Bac表示。
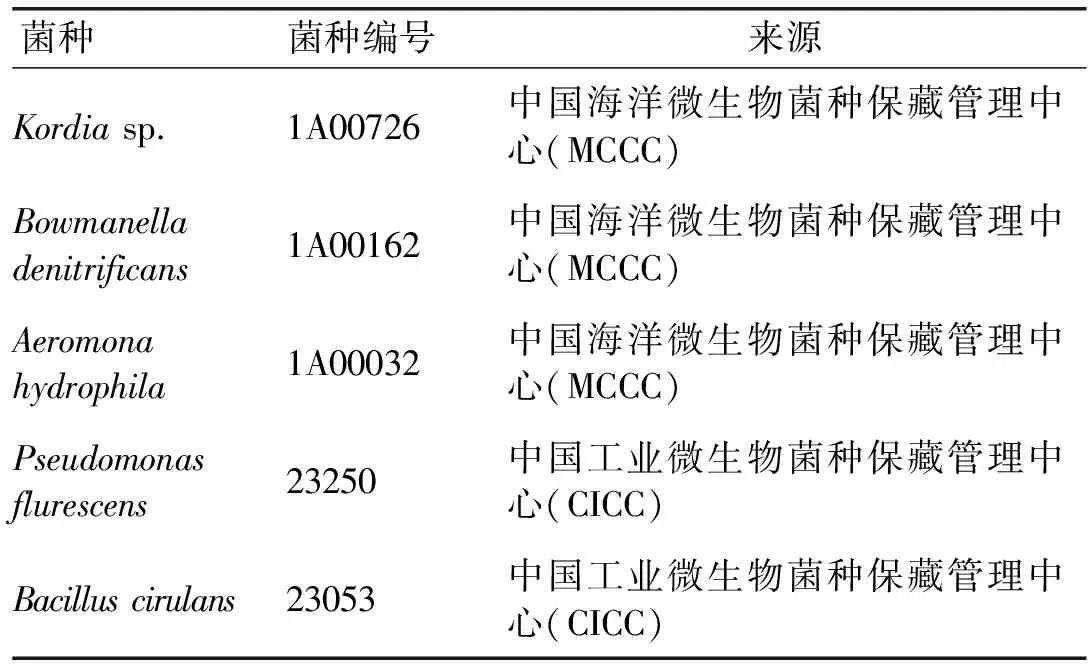
表1 试验菌种来源
其中溶藻菌Kordia、Bowmanella、Aeromona均采用LB培养基进行培养,其配方为:1 L水中加入胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g。Pseudomonas培养基采用菌种库提供配方:在1 L水中加入蛋白胨5.0 g,牛肉浸取物3.0 g,氯化钠5.0 g。Bacillus培养基采用菌种库提供配方:在1 L水中加入蛋白胨5.0 g,牛肉浸取物3.0 g,氯化钠5.0 g,MnSO4·H2O 5.0 mg。
1.1.3 仪器与试剂
TS-2102GZ 光照摇床,RF5301立式压力蒸汽灭菌器,RF5301荧光光度计,AL104电子天平,BX-53荧光显微镜,pH计,DHG-9053A烘箱,水浴锅,RV10旋转蒸发仪,UV-1800可见分光光度计,离心机,血球计数板(16格×25格),S-4800场发射扫描电子显微镜。
正己烷(色谱纯),丙酮(色谱纯),尼罗红,戊二醛(分析纯)。
1.2 试验方法
小球藻在温度26℃、转速120 r/min,光暗比12 h∶12 h的摇床里进行培养,每间隔24 h测定藻细胞浓度、光密度(OD值)和相对荧光强度。将培养至对数期的溶藻菌与小球藻按体积比1∶1进行混合,置于避光摇床(30℃、120 r/min)中,通过定期观察微藻细胞的破碎情况,测定最终提油率,探究5株溶藻菌对小球藻破碎及油脂提取效果的影响。
1.2.1OD值和相对荧光强度的测定
OD值:利用可见分光光度计测定藻活体细胞在最大吸收波长680 nm处的吸光值和5株溶藻菌在最大吸收波长600 nm处的吸光值。
藻细胞相对荧光强度测定:取4 mL藻液,8 000 r/min离心10 min,弃上清液,用PBS缓冲液重悬,加入12 μL尼罗红丙酮溶液进行染色,利用荧光光度计在激发波长480 nm、400~700 nm内扫描,峰值为吸收强度[21]。
1.2.2 藻细胞浓度的测定及溶藻率计算
藻细胞浓度:利用血球板计数法在显微镜下对完整微藻细胞进行计数。
为直观反映溶藻菌的溶藻效果,引用溶藻率作为评价指标,其计算公式如下:
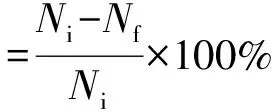
(1)
式中:Ni为藻细胞原始个数,Nf为经过破碎后完整藻细胞个数。
1.2.3 提油率计算
小球藻油脂提取采用有机溶剂(正己烷)浸提法:取藻菌混合液120 mL(菌藻各60 mL)分装于6个50 mL的离心管,按1∶1的比例加入正己烷,在150 r/min摇床过夜,12 h后,进行离心(4 000 r/min,15 min),收集上清液。将收集的上清液进行蒸馏分离(蒸馏瓶100 mL,温度45℃,转速110 r/min),在65℃烘箱中干燥1.5 h后称重(烘箱提前预热)。
提油率计算公式如下:

(2)
式中:W2为提取油质量;WD为细胞干重,其测定方法为取60 mL藻液于已称重离心管(W0)中,在4 000 r/min条件下离心10 min,去上清液,在真空冷冻干燥机干燥12 h后称重(W1),WD=W1-W0。
1.2.4 扫描电镜分析
取15 mL样品,在离心机中离心10 min(2 800 r/min),弃去上清液,留下絮状物,即刻在离心管中加入2.5%戊二醛固定液进行固定,12 h后用微孔滤膜截留样品,再用pH 7.0的磷酸缓冲溶液清洗2 h。然后经乙醇上升梯度脱水,其顺序为30%、50%、70%、80%和90%,每梯度各1次,每次15 min,100%乙醇脱水3次,每次15 min,放入-20℃冰箱12 h,再放入-80℃冰箱4 h,之后在冷冻干燥机中干燥24 h。将预处理完的样品在场发射扫描电子显微镜进行观察拍照。
2 结果与讨论
2.1 小球藻生长情况
为选取最优时间点进行小球藻收获,本试验通过可见分光光度计和荧光光度计分别测定OD680和相对荧光强度来表征小球藻生长和油脂积累情况,结果见图1。

图1小球藻OD680与相对荧光强度随时间变化规律
由图1可知,在培养时间1~15 d内,小球藻的OD680和相对荧光强度随时间的延长而逐渐增大,在15 d时,OD680为1.216,相对荧光强度达到最大值56.868。此后OD680仍逐渐增大,相对荧光强度缓慢减小。由此可知,微藻细胞内油脂含量会随着培养时间的延长逐渐积累,到一定阶段油脂总量达到稳定值。因而本试验选取培养至15 d的小球藻进行试验研究。
2.2 溶藻菌的生长情况
溶藻菌的生长曲线如图2所示。
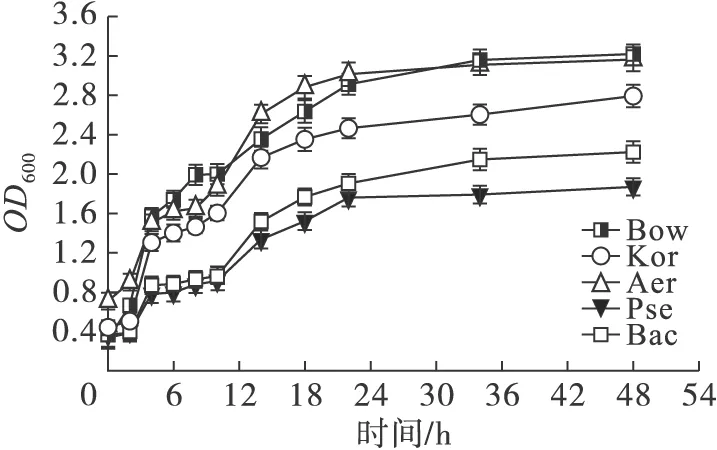
图2 5株溶藻菌的生长曲线
由图2可知,5株溶藻菌在接种后的0~4 h处于延滞期,4~24 h处于对数生长期,24 h后进入稳定期。为使溶藻菌的溶藻效果达到最优,本试验选取了培养至24 h的溶藻菌进行混合培养试验。
2.3 不同溶藻菌的溶藻效果研究
将溶藻菌和小球藻进行混合培养,每隔24 h取样计数完整藻细胞,溶藻率计算结果如图3所示。

图3 5株溶藻菌对小球藻溶藻率的影响
由图3可知,5株溶藻菌对小球藻均具有良好的溶藻效果,且溶藻率随着时间的延长而逐渐增大。在本试验中藻菌混合培养至96 h时,5株溶藻菌的溶藻率均达到最高,依次为Aeromona(73%)>Pseudomonas(65%)>Bowmanella(56%)、Bacillus(56%)>Kordia(43%)。在混合24 h时,Bowmanella溶藻率迅速升高,较于其他4个菌种最高(47%),说明该菌种对小球藻具有较强攻击性,能达到迅速溶藻效果。Aeromona在混合24 h时溶藻率最低,但在72 h内溶藻率呈现线性增长趋势,从14%增长到65%,说明该菌株需要对环境的适应,一旦适应环境后可迅速达到较好的溶藻效果。Bacillus,Kordia和Pseudomonas在藻菌混合后溶藻率变化趋势相似,即溶藻率在48 h内迅速增长,之后呈现缓慢增长的趋势。
溶藻率试验结果表明:不同溶藻菌对小球藻的适应能力和攻击能力呈现差异性。结合5菌株的生物安全性,以及时间和管理成本,能在短时间内达到较好溶藻效果的Bowmanella菌株将更具有实际应用潜力。
2.4 扫描电镜分析
为进一步分析小球藻和溶藻菌细胞结构所发生的变化,采用扫描电镜对共培养4 d后的藻菌混合液进行观察,结果如图4所示。由图4可知,未经处理的小球藻形态完好,表面光滑,细胞结构完整,呈椭圆形。而经不同溶藻菌处理后的小球藻在视野范围内观察不到完整的藻细胞,细胞壁破碎,体积变小,发生了不同程度的变形和破坏。直观判断加入Aeromona和Pseudomonas溶藻菌后的小球藻的藻细胞结构破坏最严重,藻细胞整体变小,细胞结构发生重度变形,有网状结构和孔隙。扫描电镜图进一步说明了溶藻菌的破碎作用,至于溶藻菌对藻细胞表面结构的破坏性不同可能与它们分泌的溶藻物质不同有关,具体的溶藻机理有待于进一步深入研究。

注:(a)小球藻;(b)Bow和小球藻;(c)Kor和小球藻;(d)Aer和小球藻;(e)Pse和小球藻;(f)Bac和小球藻。
图4小球藻溶藻前后扫描电镜图
2.5 不同溶藻菌的油脂提取效果研究
试验采用有机溶剂浸提法对溶藻菌处理之后的微藻细胞进行油脂提取。为了排除溶藻菌对最后提油效果的影响,采用正己烷浸提法对5株溶藻菌分别进行油脂提取的预试验。结果表明,5株溶藻菌均无油脂提取出来。说明采用此方法提取的藻菌混合液中的油脂均来源于小球藻。
对5株溶藻菌处理前后的小球藻进行油脂提取,所得结果如图5所示。
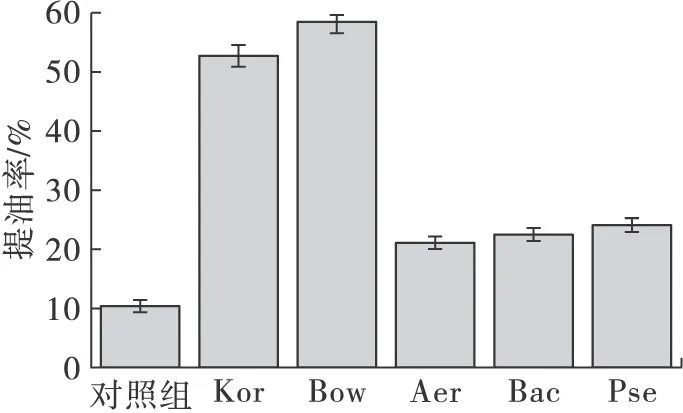
图5 5株溶藻菌对小球藻提油率的影响
由图5可知,小球藻的提油率依次为:Bowmanella(58.4%)>Kordia(52.7%)>Pseudomonas(24.1%)>Bacillus(22.5%)>Aeromona(21.1%)>对照组(10.4%,对照组为未经溶藻菌处理的小球藻)。由此可知,采用溶藻菌进行预处理对小球藻油脂提取有明显的促进作用。其中Bowmanella和Kordia对小球藻的提油率相对于对照组分别提高了4.6倍和4.1倍,另外3株菌Aeromona、Pseudomonas、Bacillus对小球藻的提油率较对照组均提高1倍以上。
Lenneman等[22]将自主分离的溶藻菌(AeromonashydrophilaAD9)与两种微藻(Dunaliellatertiolecta,Neochlorisoleoabundans)分别进行混合培养,利用正己烷进行油脂提取,其提油率相比未经溶藻菌处理的对照组分别提高12倍和6倍。试验结果表明,溶藻菌对微藻细胞的油脂提取有促进作用,但提油率的高低与微藻细胞以及菌种的选择有直接关系。虽然利用溶藻菌降解藻细胞相对于传统的机械和化学方法具有较好的经济效益,但溶藻菌对微藻细胞具有选择特异性,菌的接种量需要严格控制,否则很难达到预期效果[23]。
3 结 论
综合溶藻率和提油率可知,Bowmanelladenitrificans是5株溶藻菌中最具应用潜力的菌株。因其不仅可在短时间内达到高溶藻率,且油脂提取率最高,可以同时满足对时间成本和技术成本的要求。5株溶藻菌对小球藻油脂的提取均有明显的促进作用,为开发高效、低能耗的生物油脂生产工艺提供了部分理论依据。
虽然本研究初步证实了溶藻菌应用于微藻油脂的提取是可行的,但藻菌之间的作用方式和作用机理仍未清楚,有待进一步深入研究。此外,由于溶藻菌对微藻具有选择特异性,所以关于溶藻菌和藻种的选择、菌用量的控制以及对溶藻时间点的把握都是后续一系列可开展的工作。
[1] 李涛,李爱芬,万凌琳,等. 中国微藻生物质能源专利技术分析[J]. 可再生能源,2012(3):36-42.
[2] 贺赐安,余旭亚,赵鹏,等. 微藻油脂提取方法研究进展[J]. 中国油脂,2012,37(8):16-20.
[3] 缪晓玲,吴庆余. 微藻油脂制备生物柴油的研究[J]. 太阳能学报,2007,28(2):219-222.
[4] 徐进,徐旭东,方仙桃,等. 高产油小球藻的筛选及其油脂分析[J]. 水生生物学报,2012,36(3):426-432.
[5] MERCER P, ARMENTA R E. Developments in oil extraction from microalgae[J]. Eur J Lipid Sci Technol, 2011, 113(5): 539-547.
[6] HALIM R, GLADMAN B, DANQUAH M K, et al. Oil extraction from microalgae for biodiesel production[J]. Bioresour Technol, 2011, 102(1): 178-185.
[7] 吴刚,席宇. 溶藻细菌研究的最新进展[J]. 环境科学研究,2002,15(5):43-46.
[8] 杨丽丽. 溶藻细菌L7溶藻活性物质的发酵生产与提纯技术研究[D]. 广州:华南理工大学,2010.
[9] DAFT M J, MCCORD S B, STEWART W D P. Ecological studies on algal-lysing bacteria in fresh waters[J]. Freshw Biol, 1975, 5(6): 577-596.
[10] IMAI I, ISHIDA Y, SAKAGUCHI K, et al. Algicidal marine bacteria isolated from northern Hiroshima Bay, Japan[J]. Fish Sci, 1995, 61(4): 628-636.
[11] 彭超,吴刚,席宇,等. 3株溶藻细菌的分离鉴定及其溶藻效应[J]. 环境科学研究, 2003,16(1):37-40.
[12] BAKER K H, HERSON D S. Interactions between the diatomThallasiosirapseudonannaand an associated pseudomonad in a mariculture system[J]. Appl Environ Microbiol, 1978, 35(4): 791-796.
[13] LEE S, KATO J, TAKIGUCHI N, et al. Involvement of an extracellular protease in algicidal activity of the marine bacteriumPseudoalteromonassp. strain A28[J]. Appl Environ Microbiol, 2000, 66(10): 4334-4339.
[14] 史顺玉. 溶藻细菌对藻类的生理生态效应及作用机理研究[D]. 武汉:中国科学院研究生院,2006.
[15] IMAI I, ISHIDA Y, HATA Y. Killing of marine phytoplankton by a gliding bacteriumCytophagasp., isolated from the coastal sea of Japan[J]. Mar Biol, 1993, 116(4): 527-532.
[16] BERGER P S, RHO J, GUNNER H. Bacterial suppression ofChlorellaby hydroxylamine production[J]. Water Res, 1979, 13(3): 267-273.
[17] YOSHIKAWA K, ADACHI K, NISHIJIMA M, et al.β-cyanoalanine production by marine bacteria on cyanide-free medium and its specific inhibitory activity toward cyanobacteria[J]. Appl Environ Microbiol, 2000, 66(2): 718-722.
[18] CHEN C Y, BAI M D, CHANG J S. Improving microalgal oil collecting efficiency by pretreating the microalgal cell wall with destructive bacteria[J]. Biochem Eng J, 2013, 81: 170-176.
[19] WANG M, YUANG W. Bacterial lysis of microalgal cells[J]. J Sustainable Bioenergy Syst, 2014, 4(4): 243.
[20] 章莹颖,邓春芳,崔岩,等. 不同方法对微藻细胞破碎及油脂提取效果的影响[J]. 中国油脂,2016,41(3):61-65.
[21] 胡小文,马帅,弓淑芬,等. 荧光光谱法检测微藻中油脂[J]. 中国油脂,2011,36(4):70-74.
[22] LENNEMAN E M, WANG P, BARNEY B M. Potential application of algicidal bacteria for improved lipid recovery with specific algae[J]. FEMS Microbiol Lett, 2014, 354(2): 102-110.
[23] DEMUEZ M, GONZLEZ-FERNNDEZ C, BALLESTEROS M. Algicidal microorganisms and secreted algicides: new tools to induce microalgal cell disruption[J]. Biotechnol Adv, 2015, 33(8): 1615-1625.
EffectsofalgicidalbacteriaoncelldisruptionandoilextractionofmicroalgaeChlorellavulgaris
DENG Chunfang, CUI Yan, ZHANG Yingying, CHENG Jiayang
(School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055, Guangdong, China)
In order to investigate the effects of algicidal bacteria on the cell disruption and oil extraction of microalgaeChlorellavulgaris, with microalgaeChlorellavulgarisas the study object, five strains of algicidal bacteriaKordiasp.,Bowmanelladenitrificans,Aeromonahydrophila,Pseudomonasflurescens, andBacilluscirulanswere mixed cultured. The results showed that the effects of different algicidal bacteria on the cell disruption and oil extraction of microalgaeChlorellavulgariswere different.The aglae-lysing rate ofAeromonahydrophila,Pseudomonasflurescens,Bowmanelladenitrificans,BacilluscirulansandKordiasp. were 73%, 65%, 56%, 56% and 43%, respectively. The oil was extracted fromChlorellavulgarisbyn-hexane.The oil extraction rate ofBowmanelladenitrificans,Kordiasp.,Pseudomonasflurescens,Bacilluscirulans,Aeromonahydrophilaand control group were 58.4%, 52.7%, 24.1%, 22.5%, 21.1% and 10.4%, respectively.Bowmanelladenitrificanswas the most potential algicidal bacterium with high aglae-lysing rate which could be reached in 24 h and the oil extraction rate was 4.6 times higher than that of the control group.
algicidal bacteria;Chlorellavulgaris; cell disruption; oil extraction
2016-10-29;
:2017-03-14
深圳市科创委基础研究项目(JCYJ20150626110855791);海洋公益性行业科研专项经费项目(201305022)
邓春芳(1992),女,硕士研究生,研究方向为生物能源(E-mail)dcfalice@126.com。
崔 岩,助理研究员,博士(E-mail)cuiyan@pkuse.edu.cn。
TS222+.3;TS225.6
:A
:1003-7969(2017)07-0106-05
