花生粗油体制备工艺研究
2017-09-16徐泽健章绍兵
徐泽健,章绍兵
(河南工业大学 粮油食品学院, 郑州 450001)
花生粗油体制备工艺研究
徐泽健,章绍兵
(河南工业大学 粮油食品学院, 郑州 450001)
研究了花生粗油体制备工艺,并对粗油体基本组分进行了分析。在单因素试验基础上,通过Box-Behnken设计进行三因素三水平响应面试验,确定水剂法一次提取制备花生粗油体最优工艺条件为胶磨间隙5 μm、NaCl浓度0.9 mol/L、pH 5.5、胶磨时间25.5 min,在此条件下粗油体提取率为(63.28±0.80)%,脂肪回收率为(82.07±0.69)%;结合二次提取工艺,粗油体总的脂肪回收率达到(91.63±0.62)%;花生粗油体经过3次水洗后纯度得到显著提高,粗脂肪含量为(76.73±0.50)%。
花生粗油体;水剂法;响应面法
花生油体是花生细胞中由半单位膜包裹液态三酰甘油酯而形成的圆球体,是一种亚细胞结构[1]。Anthony等[2]对花生油体组分及粒径进行了研究,结果显示花生油体粒径1.95 μm,中性脂肪含量98.1%,蛋白质含量0.94%。花生油体乳液具有良好的乳化性能和稳定性,可作为天然乳化剂应用于食品加工领域[3-4]。高纯度油体可被用于研究油体的显微结构、特性与功能及油体蛋白等,但制备过程复杂,油体损失率高;当油体被应用于食品领域,要求制备的油体成品安全无污染,油体不需要高纯度,即油体表面可吸附较多的杂蛋白,这样可以有效降低提取过程中油体损失率。含有杂蛋白的油体在营养价值及稳定性上相对于高纯度油体,具有一定优势[5-8]。前人研究了NaCl对油体乳液稳定性的影响[6,9]以及在制备油体过程中添加NaCl,但多以清洗油体表面吸附蛋白为目的[10-11],而添加NaCl对花生粗油体提取效果的影响未见报道。本文对添加NaCl、pH及胶磨条件对花生粗油体提取效果的影响进行了研究,在对花生粗油体一次提取单因素试验基础上,采用响应面法优化水剂法制备花生粗油体,在最优制备工艺条件下,进行二次提取,并对花生粗油体基本组分进行了分析,为花生油体相关产品研发提供理论参考。
1 材料与方法
1.1 试验材料
市售花生仁55℃烘烤3 h脱红衣,脱红衣花生仁(水分2.71%,蛋白质28.73%,粗脂肪49.89%);乙酸钾、氯化钠、蔗糖、冰乙酸等均为分析纯。
MS半微量型号电子天平(梅特勒-托利多仪器有限公司),XL150精密pH计(赛默飞世尔有限公司),KCH-50V型混合机,A-88型组织匀浆捣碎机,JMS-SODX型胶体磨,THZ-82A水浴恒温振荡器,TC1850-WS台式高速离心机,DHG-9076电热恒温鼓风干燥箱,KDN-1凯氏定氮仪,SZC-101脂肪测定仪。
1.2 试验方法
1.2.1 花生粗油体制备工艺流程
参照Kapchie等[12]的方法,并做一定更改。
一次提取:在0.1 mol/L、pH 5.0乙酸钾缓冲液中加入适量NaCl,以固液比1∶10浸泡脱红衣花生仁(20 g)12 h,组织破碎2 min,胶体磨以一定间隙研磨一定时间,用冰乙酸和氢氧化钠溶液调节花生浆至一定pH,水浴振荡(50℃,150 r/min,90 min)后,10 000g离心10 min,取上层粗油体待测。
二次提取:将一次提取所剩水相及残渣混合均匀,重复一次提取过程中水浴振荡及离心步骤,取上层粗油体待测。
1.2.2 花生粗油体提取率及脂肪回收率的计算
参照Kapchie等[12]的计算方法,所有试验均重复3次,取平均值,粗油体提取率计算方法见式(1),脂肪回收率计算方法见式(2)。
(1)

(2)
式中:W2为粗油体质量,g;W1为脱红衣花生仁质量,g;M2为粗油体脂肪含量,%;M1为脱红衣花生仁脂肪含量,%。
1.2.3 花生粗油体基本组分测定
水分含量测定采用直接干燥法,参照GB/T5009.3—2003;
蛋白质含量测定采用凯氏定氮法,参照GB/T5009.5—2010;
粗脂肪含量测定采用索氏抽提法,参照GB/T5009.6—2003。
1.2.4 数据处理
采用SPSS16.0软件进行试验数据统计分析,用Duncan’s多重分析进行组间显著性检验,显著水平为P<0.05,极显著水平为P<0.01。
2 结果与分析
2.1 单因素试验
2.1.1NaCl浓度对花生粗油体提取率及脂肪回收率的影响
在胶磨间隙15μm、胶磨时间2min、pH5条件下,考察乙酸钾缓冲液中NaCl浓度(0、0.3、0.6、0.9、1.2、1.5mol/L)对花生粗油体提取率及脂肪回收率的影响,结果如图1所示。
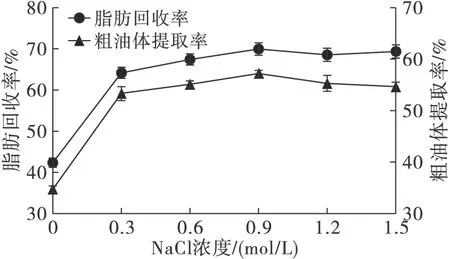
图1 NaCl浓度对花生粗油体提取率及脂肪回收率的影响
从图1可以看出,随着NaCl浓度的增加,粗油体提取率呈先增大后减小的趋势,脂肪回收率呈先增大后稳定趋势。原因可能是盐溶效应增加了油体表面蛋白质分子的溶解性,促使油体均匀分散,减少了粗油体聚集沉淀现象的发生概率;但是随着NaCl浓度增大,花生蛋白盐析程度提高,导致花生粗油体表面的蛋白质分子聚集沉淀,因此粗油体提取率下降。因此,选取NaCl浓度0.6、0.9、1.2mol/L3个水平进行响应面优化试验。
2.1.2pH对花生粗油体提取率及脂肪回收率的影响
在胶磨间隙15μm、胶磨时间2min、NaCl浓度0.9mol/L条件下,考察pH(3、4、5、6、7、8、9、10、11)对花生粗油体提取率及脂肪回收率的影响,结果如图2所示。

图2 pH对花生粗油体提取率及脂肪回收率的影响
从图2可以看出,随着pH的增加,花生粗油体提取率先下降后升高,变化非常显著。原因可能是,愈趋近于花生蛋白等电点,油体表面负载电荷量愈少,油体之间静电斥力愈小,粗油体聚集更加紧密,进而湿基粗油体含水量较低,导致粗油体提取率较低。偏离等电点时,花生粗油体之间的聚集较为松散,含水量高,因此粗油体提取率也较高。在pH为3时,粗油体提取率达到174.97%,其中水分含量达到61.57%,脂肪含量仅为19.76%。粗油体脂肪回收率随pH的增加总体变化幅度不大,这是因为体系中存在NaCl,即使在花生蛋白等电点时,盐溶效应的存在也会使较多的蛋白质保持溶解状态,粗油体不至于聚集沉淀。因此,当体系中存在NaCl时,在等电点附近提取花生粗油体,既能保证油体的脂肪含量高,也不会影响粗油体的脂肪回收率。因此,选取pH4、5、6 3个水平进行响应面优化试验。
2.1.3 胶磨间隙对花生粗油体提取率及脂肪回收率的影响
在胶磨时间2min、NaCl浓度0.9mol/L、pH5条件下,考察胶磨间隙(5、30、60、90、120、150μm)对花生粗油体提取率及脂肪回收率的影响,结果如图3所示。

图3 胶磨间隙对花生粗油体提取率及脂肪回收率的影响
从图3可以看出,随着胶磨间隙增大,花生粗油体提取率与脂肪回收率呈下降趋势,可见胶磨间隙越小,花生细胞破碎越充分,对粗油体提取越有利,印证了Nikiforidis等[8]的研究结果,即充分磨碎增加了物料颗粒比表面积,增大物料颗粒与水溶液接触机会,利于粗油体提取。因此,5μm为最佳胶磨间隙。
2.1.4 胶磨时间对花生粗油体提取率及脂肪回收率的影响
在胶磨间隙5μm、NaCl浓度0.9mol/L、pH5条件下,考察胶磨时间(5、10、15、20、25、30min)对花生粗油体提取率及脂肪回收率的影响,结果如图4所示。
从图4可以看出,随着胶磨时间延长,花生粗油体提取率与脂肪回收率呈先上升后下降趋势,在25min时,粗油体提取率与脂肪回收率同时达到最高;进一步延长胶磨时间,导致粗油体提取率与脂肪回收率下降。因此,选取胶磨时间20、25、30min3个水平进行响应面优化试验。
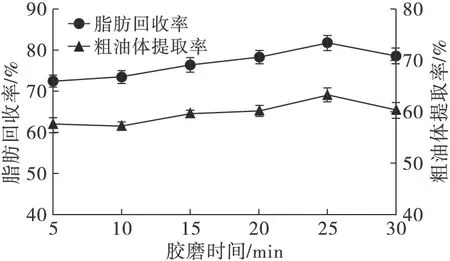
图4 胶磨时间对花生粗油体提取率及脂肪回收率的影响
2.2 响应面优化试验
2.2.1 响应面优化试验设计及结果
在单因素试验的基础上,进行响应面优化试验。根据Box-Behnken设计原理,固定胶磨间隙为5μm,以NaCl浓度(A)、pH(B)、胶磨时间(C)3个对花生粗油体提取效果影响较为显著的因素为自变量,以一次提取花生粗油体脂肪回收率(Y)为响应值。因素水平见表1,响应面试验设计及结果见表2。

表1 Box-Behnken设计因素水平
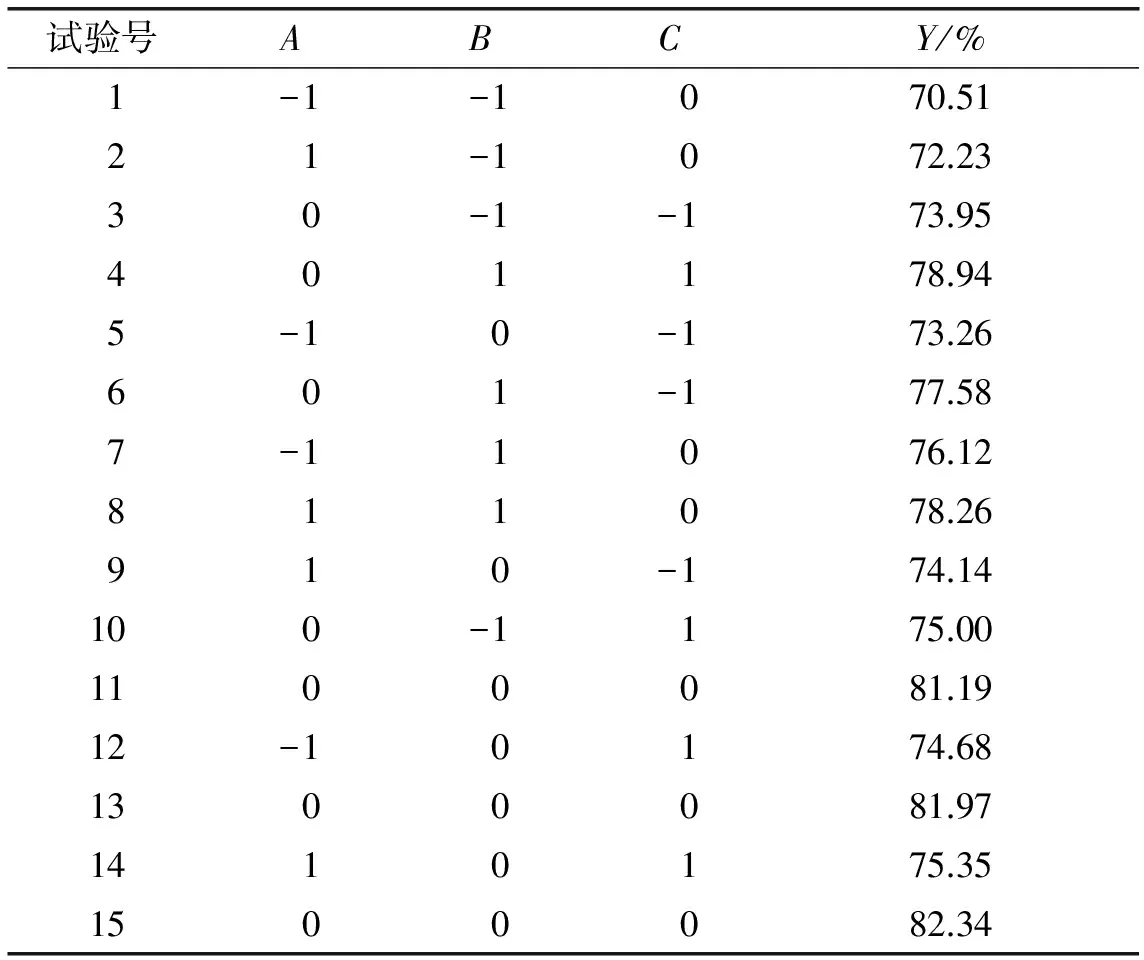
表2 响应面试验设计及结果
运用Design-Expert8.0.6软件对表2试验数据进行回归分析,得到二次多元回归模型:Y=-112.307 5+97.012 5A+29.415 42B+5.468 33C+0.35AB-0.035AC+0.015 5BC-53.129 63A2-2.771 67B2-0.107 77C2。对回归方程进行方差分析,结果见表3。

表3 方差分析
注:**P<0.01,差异极显著。
2.2.2 一次提取花生粗油体工艺响应面分析(见图5)
由图5Ⅰ可知,随着NaCl浓度与pH水平的增加,响应值均先增加后减小,在中心点附近粗油体脂肪回收率最高。由图5Ⅱ可知,随着NaCl浓度与胶磨时间水平的增加,响应值先增加后减小,在中心点粗油体脂肪回收率最高。由图5Ⅲ可知,随着pH与胶磨时间水平的增加,响应值先增加后减小,在中心点附近粗油体脂肪回收率最高。由以上分析可知,在各因素中心点附近,一次提取花生粗油体脂肪回收率最高,回归方程具备最优水平。
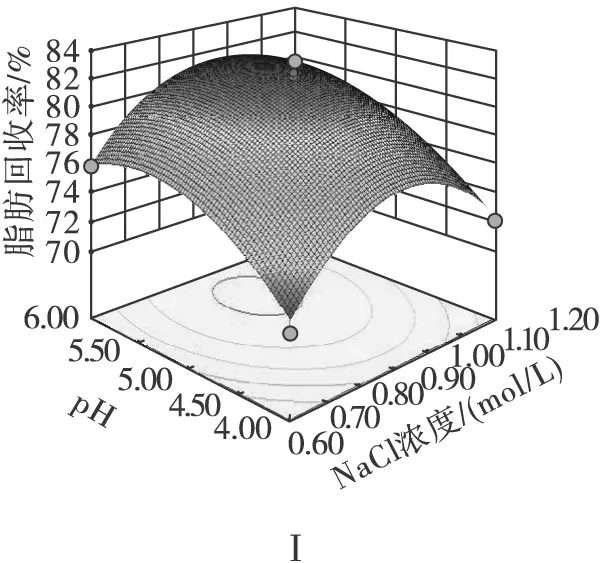
图5各因素交互作用对脂肪回收率的影响
2.2.3 花生粗油体制备条件优化及验证试验结果
根据所建立的数学模型进行工艺参数最优化分析,得到优化条件为NaCl浓度0.92 mol/L、pH 5.44、胶磨时间25.61 min,粗油体脂肪回收率预测值82.42%。为验证该模型准确性,需要进行验证试验。从试验的可行性考虑,对最优工艺参数进行调整,即NaCl浓度0.9 mol/L、pH 5.5、胶磨时间25.5 min,在该条件下进行3次重复试验,所得花生粗油体提取率为(63.28±0.80)%,脂肪回收率为(82.07±0.69)%,试验结果与预测值非常接近,且重复试验相对偏差较小,说明模型对最佳工艺条件进行分析和预测可靠。
2.3 二次提取试验及花生粗油体基本组分
通过上述响应面法优化一次提取花生粗油体试验,对一次提取后所得水相及残渣进行二次提取,二次提取脂肪回收率为(9.56±0.54)%。两次提取脂肪回收率总体达到(91.63±0.62)%。对花生粗油体及经过3次蒸馏水洗的花生油体进行基本组分测定,结果见表4。由表4可知,水洗后花生油体表面吸附的蛋白质含量及水分含量均显著减少,油体纯度得到显著提高,粗脂肪含量为(76.73±0.50)%。

表4 花生粗油体(湿基)基本组分 %
3 结 论
在单因素试验基础上进行响应面优化,确定水剂法一次提取制备花生粗油体最优工艺条件为胶磨间隙5 μm、NaCl浓度0.9 mol/L、pH 5.5、胶磨时间25.5 min。在最优工艺条件下粗油体提取率为(63.28±0.80)%,脂肪回收率为(82.07±0.69)%;结合二次提取工艺,粗油体总脂肪回收率达到(91.63±0.62)%;花生粗油体经过3次水洗后纯度得到显著提高,粗脂肪含量为(76.73±0.50)%。
[1] TZEN J T, ANTHONY H, HUANG C. Surface structure and properties of plant seed oil bodies[J]. J Cell Biol, 1992, 117(2):327-335.
[2] ANTHONY H, HUANG C. Oil bodies and oleosins in seeds[J]. Annu Rev Plant Physiol Plant Mol Biol, 1992, 43(4):177-200.
[3] DECKERS H M, VAN ROOIJEN G, BOOTHE J, et al. Uses of oil bodies: US 6146645[P]. 2000-11-14.
[4] BERRY M J, COX A R, KEENAN R D, et al. Ice confection and its manufacturing process: US 20050037111[P]. 2006-07-12.
[5] CHEN Y, CAO Y, ZHAO L, et al.Macronutrients and micronutrients of soybean oil bodies extracted at different pH[J]. J Food Sci, 2014, 79(7):1285-1291.
[6] KARKANI O A, NENADIS N, NIKIFORIDIS C V, et al. Effect of recovery methods on the oxidative and physical stability of oil body emulsions[J]. Food Chem, 2013, 139(4):640-648.
[7] NIKIFORIDIS C V, KIOSSEOGLOU V. Physicochemical stability of maize germ oil body emulsions as influenced by oil body surface-xanthan gum interactions[J]. J Agric Food Chem, 2010, 58(1):527-532.
[8] NIKIFORIDIS C V, VASSILIOS K. Aqueous extraction of oil bodies from maize germ (Zeamays) and characterization of the resulting natural oil-in-water emulsion[J]. J Agric Food Chem, 2009, 57(12):5591-5596.
[9] IWANAGA D, GRAY D A, FISK I D, et al. Extraction and characterization of oil bodies from soybeans: a natural source of pre-emulsified soybean oil[J]. J Agric Food Chem, 2007, 55(21):8711-8716.
[10] JACKS T J, HENSARLING T P, NEUCERE J N, et al. Isolation and physicochemical characterization of the half-unit membranes of oilseed lipid bodies[J]. J Oil Fat Ind, 1990, 67(6):353-361.
[11] TZEN J T, PENG C C, CHENG D J, et al. A new method for seed oil body purification and examination of oil body integrity following germination[J]. J Biochem, 1997, 121(4):762-768.
[12] KAPCHIE V N, TOWA L T, HAUCK C, et al. Evaluation of enzyme efficiency for soy oleosome isolation and ultrastructural aspects[J]. Food Res Int, 2010, 43(1):241-247.
Preparationtechnologyofcrudepeanutoilbodies
XU Zejian, ZHANG Shaobing
(School of Food Science and Technology, Henan University of Technology, Zhengzhou 450001, China)
Preparation technology of crude peanut oil bodies was investigated and the basic composition of crude oil bodies was analyzed. Based on single factor experiment, the optimal conditions of aqueous extraction of crude peanut oil bodies in the first extraction step was obtainend by Box-Behnken response surface methodology as follows: grinding gap 5 μm, NaCl concentration 0.9 mol/L,pH 5.5, grinding time 25.5 min. Under these conditions, extraction rate of crude oil bodies was (63.28±0.80)% and recovery rate of fat was (82.07±0.69)%. Combined with the secondary extraction process, the total recovery rate of fat of crude oil bodies was (91.63±0.62)%. The purity of crude oil bodies increased significantly after washing for three times using deionized water, and crude fat content was (76.73±0.50)%.
crude peanut oil bodies; aqueous extraction; response surface methodology
2016-09-29;
:2017-02-10
国家自然科学基金(31671887)
徐泽健(1989),男,硕士研究生,研究方向为食品资源开发与利用(E-mail)x861436752@163.com。
章绍兵,副教授,博士(E-mail)shaobingzhang@126.com。
S664.1; Q946
:A
:1003-7969(2017)07-0005-05
