Cdyl、G9a、及HDAC1在肾阳虚大鼠睾丸组织中的表达*
2017-09-15尤耀东李广森
蔡 涛,尤耀东,张 磊,李广森,蔡 剑Δ
1.彭州市中医医院(彭州 611930); 2.成都中医药大学,(成都 610075);3.成都中医药大学附属医院 (成都 610072)
·论著·
Cdyl、G9a、及HDAC1在肾阳虚大鼠睾丸组织中的表达*
蔡 涛1,尤耀东2,张 磊3,李广森3,蔡 剑2Δ
1.彭州市中医医院(彭州 611930); 2.成都中医药大学,(成都 610075);3.成都中医药大学附属医院 (成都 610072)
目的观察Cdyl、G9a、HDAC1在肾阳虚大鼠睾丸组织中的表达,探讨Cdyl及相关因子引起雄性大鼠肾阳虚的机制。方法20只健康雄性SD大鼠随机分为空白组与模型组,模型组采用环磷酰胺50 mg/kg·d腹腔注射,空白组给予等量生理盐水注射。大鼠造模后第6天,将大鼠取血处死,分离睾丸、附睾进行相关指标检测。结果与空白组比较,模型组大鼠精子浓度、活力及活率明显降低;模型组大鼠睾丸组织Cdyl、G9a表达明显降低(P<0.01),HDAC1表达明显升高(P<0.01)。结论Cdyl、G9a表达降低,HDAC1表达升高与雄性大鼠肾阳虚相关。
Cdyl基因;G9a基因;HDAC1基因;肾阳虚;大鼠
“肾藏精”是祖国医学藏像理论的重要内容。中医学认为肾藏精,是人体生长、发育、生殖之源;肾在中医学中被视为“先天之本”,具有极为重要的地位。“主生殖”是“肾藏精”的重要表现,两性的生殖之精,尤其是男性的精液质量通常是衡量“肾藏精”功能状态的重要依据。肾阳虚是肾虚的最基本证型之一,通常也会出现精液质量下降、生殖能力减退等反映“肾藏精”功能减退的临床症状。在中医内科学教材中,由于肾阳虚、肾阴虚等肾虚证候,男性出现精液质量下降或异常,生殖能力减退是肾系疾病的重要内容。随着基因蛋白技术在中医学中运用的深入,现已认识到中医证型与特定基因蛋白表达相关[1]。Cdyl与组蛋白去乙酰化酶1(histone deacetylase1,HDAC1)、组蛋白甲基化酶G9a,又称常染色质组蛋白赖氨酸N-甲基转移酶2(euchromatic histone-lysine N-methyltransferase2,EHMT2)[2]在睾丸中均有分布,Cdyl及相关因子异常表达与精液质量异常有关。基于“肾藏精,主生殖”的中医理论,本研究采用环磷酰胺制作肾阳虚大鼠模型[3],从模型大鼠睾丸组织特定基因蛋白表达差异角度,探讨肾阳虚证型的分子生物学机制,为中医药治疗肾阳虚证候的中医肾系疾病提供现代医学证据。
1 材料与方法
1.1实验材料
1.1.1 实验动物 在成都中医药大学实验动物中心购买2月龄雄性SD大鼠(清洁级)20只,体质量200±20 g,专业检疫合格。购入的SD大鼠在成都中医药大学附属医院动物实验中心饲养。
1.1.2 主要实验药物及试剂 环磷酰胺(Cyclopho sphamide, CP):山西普德药物股份有限公司,0.2 g/瓶,批号:04150605。一抗:兔多克隆抗体,批号:ab5188,英国abcam-艾博抗(上海)贸易有限公司;二抗:生物素化山羊抗兔IgG(H+L),批号:13152A11,北京中山金桥生物有限公司;三抗:辣根酶标记链霉素卵蛋白素(HRP/A-V),批号:13152A11,北京中衫金桥生物有限公司。
1.1.3 主要仪器 WL-9000型伟力彩色精子质量检测系统(北京伟力公司);数码三目摄像显微镜(麦克奥迪实业集团有限公司),型号BA400Digital;实时荧光定量(RT-PCR)仪(美国ThermoFisher仪器有限公司),型号PIKORed 96。
1.2实验方法
1.2.1 动物分组与造模 将20只SD大鼠按数字随机法分为空白组10只,模型组10只,造模大鼠采用CP 50 mg/kg进行腹腔注射,每天1次,连续5 d,空白组予以等量生理盐水腹腔注射。
1.2.2 取材 CP 腹腔注射造模5天后,各组大鼠均予以水合氯醛腹腔注射麻醉,腹主动脉抽血处死大鼠,迅速摘取附睾、睾丸,将右侧睾丸分成两半,均投入4%多聚甲醛中保存,另一侧睾丸投入液氮中保存,分别用于睾丸组织HE染色,免疫组化及RT-PCR检测。
1.2.3 精液质量分析 取一侧附睾尾部放入3 mL 37 ℃生理盐水中,剪碎,放置1分钟左右,经处理后,取少量加到计数板上,采用WLJY-9000型精子质量检测系统(Computer-aided sperm analysis,CASA),进行精子质量检查。主要测试指标:精子密度、精子活力、精子活率。
1.2.4 大鼠睾丸组织形态学观察 检测标本为保存于4%多聚甲醛中的大鼠右侧的1/2睾丸。睾丸组织固定后经全自动脱水机脱水,包埋,切片,置于载玻片上,进行HE染色,再将切片经二甲苯透明,加拿大树胶封片后供镜检。用光学显微镜进行睾丸病理组织学检查,主要观察睾丸生精小管内生精细胞的病变情况。
1.2.5 大鼠睾丸组织Cdyl、HDAC1、G9a免疫组化检测 检测标本为保存于4%多聚甲醛中的大鼠右侧的另1/2睾丸。固定睾丸组织经石蜡切片后置于防脱玻片上,进行常规脱蜡、热修复抗原处理后,依次加入一抗、二抗、三抗及各种相关试剂,予以DBA显色。显色结果在图像采集后,随机抽取3个400倍采集图像区域,Image-Pro Plus 6.0图像分析系统测定分析图像平均光密度。
1.2.6 大鼠睾丸组织Cdyl、G9a、HDAC1的RT-PCR检测 从美国国家生物技术信息中心(NCBI)数据库中搜索Cdyl、G9a、HDAC1基因序列,使用引物设计软件Primer5.0设计筛选特异性引物,引物及碱基序列见表1。将保存在液氮中大鼠睾丸组织在液氮中充分研磨,进行匀浆处理,从匀浆的大鼠组织提取RNA,使用逆转录试剂盒将RNA逆转录合成cDNA。使用Sequence Detection soft wareversion 1.2.3软件(Applied Biosy stems公司)分析PCR过程各检测样本的CT( Threshold cycle)值,通过2-△△CT计算X相对mRNA表达水平。

表1 本次检测所用引物及碱基序列
1.3统计分析
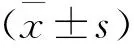
2 实验结果
2.1大鼠基本情况
造模的5 d过程中,空白组与模型组大鼠体质量无明显变化,无大鼠死亡。造模过程中,模型组大鼠开始出现精神萎靡、反应迟钝、活动度减少、眼神无光、卷缩、畏寒等肾阳虚的症状和体征,与岳宗相[4]的实验结果相似。
2.2大鼠精子质量比较
模型对照组在腹腔CP液 (50 mg/kg·d) 注射5天后,附睾精子密度下降、精子活力下降、精子活率减低,与空白组比较有显著差异(P<0.01)(表2)。说明模型大鼠睾丸内存在生精障碍,本实验造模成功。

表2 各组大鼠精液常规的比较
2.3大鼠睾丸组织结构变化
空白组生精小管饱满,生精上皮外界膜均匀、完整;各级生精细胞排列规则,可见不同发育阶段的生精细胞,精子形态和数量正常,睾丸间质细胞排列均匀。模型组生精小管变形、塌陷,数量增多;生精小管内生精细胞脱落及排列紊乱,各级生精细胞数量减少,生精上皮变薄,睾丸间质细胞排列稀疏,间质透明样变性。模型组睾丸病理损伤程度明显大于空白组,见图1。

图1 空白组与模型组大鼠睾丸组织HE染色注:A.空白组(×100);B.模型组(×100)
2.4大鼠睾丸组织Cdyl、G9a、HDAC1免疫组化结果
在睾丸组织中,Cdyl、G9a、HDAC1免疫阳性产物为浅黄色或棕黄色,阳性表达在基部细胞质、精子细胞、支持细胞等。Cdyl、G9a、HDAC1蛋白免疫组化显微图片见图2。
每组免疫组化结果选取相同部位,进行平均光密度统计分析。与空白组相比,模型组大鼠睾丸组织Cdyl、G9a平均光密度明显降低,差异具有统计学意义(P<0.01);HDAC1平均光密度明显升高,差异具有统计学意义(P<0.01),统计分析结果见表3。
2.5大鼠睾丸组织Cdyl、G9a、HDAC1基因表达
本研究统计了药物对大鼠睾丸组织中Cdyl、G9a、HDAC1的2-△△CT(基因表达值)的统计结果。与空白组相比,模型组大鼠睾丸组织Cdyl和G9a的mRNA表达均明显降低,差异具有统计学意义(P<0.01);HDAC1的mRNA表达明显升高,差异具有统计学意义(P<0.01),统计分析结果见表4。

表3 大鼠睾丸组织Cdyl、G9a、HDAC1平均光密度的影响


组别CdylG9aHDAC1空白组1.00±0.07 0.99±0.05 1.00±0.12 模型组0.64±0.18**0.51±0.11**1.21±0.17**t6.0912.38-3.14P<0.001<0.001<0.001

图2 大鼠睾丸组织Cdyl、G9a、HDAC1免疫组化
注:A.空白组Cdyl表达(×400);B.模型组Cdyl表达(×400);C.空白组G9a表达(×400);D.模型组G9a表达(×400);E.空白组HDAC1表达(×400);F.模型组HDAC1表达(×400)
3 讨论
“主生殖”是“肾藏精”的重要内容,男性精子生成障碍,精液质量下降,生殖能力减退也是“肾藏精”功能减退的重要表现。在中医门诊中,随着现代生活方式改变,伴有精液质量下降、生殖功能减退的肾阳虚证候也愈发常见。肾阳虚中医证侯可能与蛋白基因的表达差异相关[5],从基因蛋白靶点研究肾阳虚机制,为中医药治疗肾阳虚证候的“肾藏精”功能减退提供现代医学证据,是中医学研究的热点。在生精功能障碍的诸多相关因子中,Y染色体长臂上的无精子因子(azoospermia factor, AZF)是其中的重要一类,AZF区通常分为AZFa区、AZFb区、AZFc区,其中AZFc区的微缺失是生精功能障碍研究的热点。CDY位于AZFc区,CDY基因表达异常会导致生精障碍[6]。G9a即常染色质组蛋白赖氨酸甲基转移酶,具有甲基化活性,在精子发生过程中有重要作用[7],G9a在动物睾丸中广泛分布,动物实验研究发现[8],将小鼠的G9a基因敲除后,会导致小鼠生精功能障碍,出现不育现象。HDAC是一类水解蛋白酶,HDAC1是HDACs家族成员之一,具有去乙酰化作用,HDAC1在鼠类等动物睾丸中大量存在,研究[9-10]显示HDACs表达异常与生精功能障碍相关。
组蛋白修饰机制在精子发生过程中的发挥着重要调控作用[11],是雄性生殖机制研究的热点。组蛋白修饰包括甲基化、去甲基化、乙酰化、去乙酰化等。研究显示,人类CDY蛋白与鼠类Cdyl 蛋白的chromo结构域能够选择性结合组蛋白H3甲基化的ARK(S/T)基序[12-13],CDY的“CoA口袋”结构域还能与HDACs结合,因此,CDY(L)蛋白可以将表观遗传学中组蛋白的甲基化修饰与乙酰化修饰联系起来。已知人体存在CDY(L)、HDAC1、G9a蛋白复合体[14],CDY(L)可以将一些重要的组蛋白甲基转移酶如G9a,去乙酰化酶如HDAC1招募到染色质上,提示CDY(L)及相关G9a、HDAC1因子可通过表观遗传中组蛋白甲基化及乙酰化修饰机制调控精子发生。
在本实验中,通过腹腔注射具有明确生殖毒性环磷酰胺药物,模型组雄性大鼠出现肾阳虚证候,大鼠精液质量下降,表现出“肾藏精”功能减退症状,大鼠睾丸组织内Cdyl、G9a基因蛋白表达量明显下降,HDAC1基因蛋白表达明显升高。该结果提示大鼠睾丸中Cdyl、G9a基因蛋白表达下降,HDAC1基因蛋白表达升高与肾阳虚证型,及“肾藏精”功能减退相关,可能由于Cdyl及相关基因蛋白异常表达会导致精子发生表观遗传过程中甲基化、乙酰化修饰机制异常,但需更加深入的后续实验研究予以明确。
[1]李靖, 杨立宏, 曾斌芳. 慢性萎缩性胃炎中医证候与分子生物学理论研究[J]. 中医药导报, 2014, 20(7): 1-3.
[2]薛伟丽, 孙瑜, 郑凌. 组蛋白甲基化转移酶G9a的最新研究进展[J]. 生命科学仪器, 2015, 13(2): 23-29.
[3]何帮剑. 肾阳虚证动物模型的研究进展[J]. 中国中医急症, 2012, 21(8): 1293-1294.
[4]岳宗相. 金匮肾气丸对雄性环磷酰胺大鼠生殖功能的影响[D]. 成都:成都中医药大学, 2008:6.
[5]王艺茹, 王雯婷, 李亚楠, 等. 肾阳虚大鼠股骨皮质骨差异蛋白质表达分析[J]. 福建中医药, 2015, 46(6): 50-53.
[6]杨骁, 陈泰中, 费城, 等. 生精障碍相关的CDYLs基因家族研究进展[J]. 国际生殖健康计划生育杂志, 2016, 35(2): 123-127.
[7]Liu C, Qian P, Yang L,etal. Pubertal exposure to di-(2-ethylhexyl)-phthalate inhibits G9a-mediated histone methylation during spermatogenesis in mice[J]. Arch Toxicol, 2016, 90(4): 955-969.
[8]Tachibana M, Nozaki M, Takeda N,etal. Functional dynamics of H3K9 methylation during meiotic prophase progression[J]. The EMBO Journal, 2007, 26(14): 3346-3359.
[9]Fenic I, Hossain H M, Sonnack V,etal. In vivo application of histone deacetylase inhibitor trichostatin-a impairs murine male meiosis[J]. J Androl, 2008, 29(2): 172-185.
[10] Fenic I, Hossain H M, Sonnack V,etal. In vivo application of histone deacetylase inhibitor trichostatin-a impairs murine male meiosis[J]. J Androl, 2008, 29(2): 172-185.
[11] Luo M, Zhou J, Leu N A,etal. Polycomb protein SCML2 associates with USP7 and counteracts histone H2A ubiquitination in the XY chromatin during male meiosis[J]. PLoS Genet, 2015, 11(1): e1004954.
[12] Zhang Y, Yang X, Gui B,etal. Corepressor protein CDYL functions as a molecular bridge between polycomb repressor complex 2 and repressive chromatin mark trimethylated histone lysine 27[J]. J Biol Chem, 2011, 286(49): 42414-42425.
[13] Escamilla-Del-Arenal M, da Rocha S T, Spruijt C G,etal. Cdyl, a new partner of the inactive X chromosome and potential reader of H3K27me3 and H3K9me2[J]. Mol Cell Biol, 2013, 33(24): 5005-5020.
[14] Shi Y, Sawada J, Sui G,etal. Coordinated histone modifications mediated by a CtBP co-repressor complex[J]. Nature, 2003, 422(6933): 735-738.
ExpressionofCdyl,G9aandHDAC1intheTestistissueofMaleRatswithKidney-yangDeficiency
CaiTao1,YouYaodong2,ZhangLei3,LiGuangsen3,CaiJian2Δ.
1.PengzhouHospitalofTraditionalChineseMedicine,Pengzhou611930,China;2.ChengduUniversityofT.C.M,Chengdu610075,China;3.TeachingHospitalofChengduUniversityofT.C.M,Chengdu610072,China
ObjectiveTo observe the expression of chromodomain Y-like (Cdyl), G9a (also known as euchromatic histone lysine N-methyltransferase2) and histone deacetylase1(HDAC1) in the testis tissue of the male rats with kidney-yang deficiency and explore the mechanism of male rats′ kidney-yang deficiency induced by Cdyl and the relevant factors.Methods20healthy male SD rats were randomly divided into the blank control group and model group. The model group was administered with intraperitoneal injection of50mg/kg·d Cyclophosphamide, while the blank control group was given the same amount of normal saline injection. On the6th day of modeling, the rats were sacrificed. The testis and epididymis were separated for inspection.ResultsCompared with the blank control group, the sperm density, progressive motility and vitality reduced in the model group; the expression of Cdyl and G9a in the testis tissue decreased significantly (P<0.01) in the model group, while the expression of HDAC1increased significantly (P<0.01).ConclusionThe expression decrease of Cdyl and G9a and the expression increase of HDAC1are correlated with the kidney-yang deficiency of male rats.
Cdyl; G9a; HDAC1; Kidney-yang deficiency; Rat
http://kns.cnki.net/kcms/detail/51.1705.R.20170829.1026.006.html
10.3969/j.issn.1674-2257.2017.04.017
四川省教育厅基金资助(No:14ZB0078)
:蔡剑,E-mail:1581942151@qq.com
R256.5
A
△
