阿托伐他汀对脑出血大鼠脑组织NF-κB、TNF-α和IL-1β表达的影响*
2017-09-15邹显巍程闰夏
吴 煜,邹显巍,程闰夏
1.成都医学院 发育与再生四川省重点实验室(成都 610500);2.成都医学院第一附属医院 (成都 610500);3.西南医科大学(泸州 646000)
·论著·
阿托伐他汀对脑出血大鼠脑组织NF-κB、TNF-α和IL-1β表达的影响*
吴 煜1,邹显巍2△,程闰夏3
1.成都医学院 发育与再生四川省重点实验室(成都 610500);2.成都医学院第一附属医院 (成都 610500);3.西南医科大学(泸州 646000)
目的观察阿托伐他汀对脑出血大鼠血肿周围组织中NF-κB、TNF-α和IL-1β表达的影响,探讨阿托伐他汀对脑出血大鼠的脑保护作用及可能的机制。方法将120只SD大鼠按随机数字表法随机分为假手术组、脑出血组和治疗组。脑出血组和治疗组采用自体血立体定向注射法,建立脑出血动物模型。假手术组于相同部位注射等量0.9%氯化钠注射液。治疗组于术后2 h将阿托伐他汀按10 mg/kg进行灌胃。于造模后12 h、1 d、2 d、3 d和5 d分别处死各组大鼠留取脑组织。采用免疫组化法和Western blot法检测各组大鼠脑组织TNF-α、IL-1β及NF-κB的蛋白表达情况。结果与假手术组相比,脑出血组TNF-α、IL-1β和NF-κB的表达增加(P<0.05),均为12 h开始持续增加,3 d时达高峰,持续表达至5 d;与脑出血组相比,治疗组TNF-α、IL-1β和NF-κB的表达减少(P<0.05)。结论脑出血大鼠血肿周围脑组织存在NF-κB、TNF-α和IL-1β的高表达。阿托伐他汀可通过下调NF-κB信号分子的表达及炎性细胞因子的产生,减轻脑出血后脑组织的炎症反应,从而起到脑保护的作用。
阿托伐他汀;脑出血;NF-κB;TNF-α;IL-1β
脑出血在脑卒中各亚型中发病率仅次于缺血性脑卒中,居第2位。脑出血在亚洲人、高龄、男性和中低收入国家更普遍。脑出血病死率高(1个月为40%,1年为54%),仅12%~39%的患者能实现长期功能独立[1-2]。脑出血致残致死率均较高,但目前缺乏有效的治疗措施。临床和实验证据表明,脑出血发生后,除血肿压迫引起的机械性神经组织损害外,还存在血肿周边继发性损伤,包括脑组织水肿,炎症、局部脑血流下降和细胞凋亡等,其中炎症反应在脑出血继发性损害中发挥重要作用,日益引起重视。本实验通过观察阿托伐他汀对脑出血大鼠血肿周围组织中NF-κB、TNF-α和IL-1β表达的影响,明确其对脑出血血肿周围组织是否有脑保护功能。
1 材料与方法
1.1动物
健康雄性SD大鼠120只,购于成都达硕实验动物有限公司,体质量250~300 g。
1.2药物与试剂
阿托伐他汀钙片购于辉瑞制药有限公司。兔抗大鼠NF-κB、TNF-α和IL-1β多克隆抗体,通用型二抗试剂盒及Western blot试剂盒购于武汉三鹰生物技术有限公司。GAPDH兔多克隆抗体购于杭州贤至生物科技有限公司。免疫组化试剂盒购于北京中杉金桥生物技术有限公司。
1.3分组与造模
将大鼠按随机数字表法随机分成假手术组、脑出血组和治疗组,每组40只。治疗组于造模后2 h给予10 mg/kg的阿托伐他汀灌胃, 1次/d。假手术组和脑出血组在相同时间给予相同剂量的0.9%的氯化钠注射液灌胃。制备大鼠脑出血模型。用10%的水合氯醛腹腔麻醉大鼠(400 mg/kg)。参考文献[3-4],将大鼠俯卧位固定于立体定位仪上,调节门齿托高度,使大鼠前囟、后囟处于同一水平。沿头皮正中切10~20 mm切口,无菌操作暴露前囟,用30%的双氧水烧灼前囟。待前囟烧灼清楚后,定位于前囟前0.4 mm,中线向右旁开3 mm处钻一直径为0.5 mm的小孔,进针深度为5.5~6.0 mm(即尾状核位置)。将大鼠尾部消毒,断尾后用微量进样器取自体血50 μL,迅速将微量进样器通过颅骨钻孔进针到尾状核位置。用微量泵按15 μL/min注射自体血,留针10 min以防止血液溢出。第2次抽取50 μL自体血,按同样方法注入尾状核。注射后留针10 min,缓慢退出微量进样器,用医用石蜡封闭骨孔。观察无出血后缝合皮肤。对照组操作方法同上,只将微量进样器注射到目标脑区,不注射自体血,留针10 min。本实验严格按照无菌要求进行,术后将大鼠放回笼中继续饲养。
1.4脑出血模型成功评价
参考Longga 5级评分法对大鼠神经进行神经功能评分。0级:无体征,记0分。1级:动物不能完全伸直前肢,记1分。2级:动物一侧肢体瘫痪,有追尾现象,记2分。3级:动物不能站立或打滚,记3分。4级:无自发性活动,有意识障碍记4分。本实验共造模成功103只,造模失败17只(术中不明原因死亡7只,术后死亡10只。)
1.5WesternBlot分析
从-80 ℃冰箱取各组的脑组织,将尾状核附近组织剪下约100 mg,倒入少许液氮后研磨成粉末,加入蛋白裂解液裂解1 h,13 000r/min,4 ℃离心15 min,取上清分装,放入-80 ℃冰箱保存备用。进行聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,兔抗大鼠的NF-κB、TNF-α和IL-1β(稀释浓度均为1∶1 000),兔抗大鼠的GAPDH(稀释浓度为1∶2 000),4 ℃孵育过夜。用TBST漂洗3次,10 min/次。然后用羊抗兔的Ig-G(稀释浓度为1∶4 000)37 ℃孵育2 h。用TBST漂洗3次后,将条带放在化学发光仪上,按1∶1比例将适量显影液混匀后滴加在蛋白表达条带上进行显影。以Image J软件对蛋白表达条带进行灰度扫描和定量分析。以目标蛋白与GAPDH蛋白平均吸光度值(OD值)的比值作为分析对象。
1.6免疫组化
将各组大鼠按不同时间点灌注取脑,用4%多聚甲醛固定2 d,将脑组织取出用PBS漂洗3次,加30%蔗糖脱水沉底,OTC包埋剂包埋后用液氮进行快速冰冻成块,放入-20 ℃冰箱保存备用。将包埋好的组织按10 μm厚度进行切片。按免疫组化试剂盒说明书进行操作。
1.7统计学方法
2 结果
2.1实验性脑出血大鼠周围组织NF-κB的定量表达
在不同时间点,假手术组可见少量NF-κB表达;与假手术组相比,脑出血组可见大量的NF-κB蛋白表达(P<0.05);各时间点治疗组NF-κB蛋白表达量较脑出血组减少,差异均有统计学意义(P<0.05)(图1~3、表1)。

图1WesternBlot检测不同时间点(12h、1d)脑组织中各炎症因子蛋白的表达
2.2实验性脑出血大鼠周围组织TNF-α的定量表达
在不同时间点,假手术组中的TNF-α蛋白呈弱表达;与假手术组相比,脑出血组的TNF-α蛋白表达增多(P<0.05);治疗组与脑出血组相比,TNF-α蛋白的表达量减少(P<0.05)(图1~3、表2)。

图2WesternBlot检测不同时间点(2d、3d)脑组织中各炎症因子蛋白的表达

图3WesternBlot检测不同时间点(5d)脑组织中各炎症因子蛋白的表达
2.3实验性脑出血大鼠周围组织IL-1β的定量表达
假手术组可见微量的IL-1β表达;与假手术组相比,脑出血组可见大量的IL-1β蛋白表达(P<0.05);治疗组与脑出血组相比,IL-1β蛋白的表达量减少(P<0.05)(图1~3、表3)。
2.4相关性分析
脑出血后血肿周围脑组织NF-κB与TNF-α的蛋白表达水平呈正相关(各组r>0,P<0.01);同时与IL-1β的蛋白表达水平也呈正相关(各组r>0,P<0.01)。

表1 脑组织中NF-κB p65蛋白表达的定量分析(OD值
注:与假手术组相比,#P<0.05;与脑出血组相比,*P<0.05

表2 脑组织中TNF-α蛋白表达的定量分析 (OD值
注:与假手术组相比,#P<0.05;与脑出血组相比,*P<0.05

表3 脑组织中IL-1β蛋白表达的定量分析 (OD值
注:与假手术组相比,#P<0.05;与脑出血组相比,*P<0.05
2.5实验性脑出血大鼠周围组织IL-1β的定位表达
IL-1β阳性细胞在脑组织中主要表现为细胞膜或细胞浆中出现棕褐色颗粒。假手术组偶见IL-1β阳性细胞。脑出血组可见大量IL-1β阳性细胞,1 d、2 d时阳性细胞明显增多,3 d达高峰,5 d时明显减少。与相同时间点的脑出血组相比,治疗组中的阳性细胞明显减少(图4)。
2.6实验性脑出血大鼠周围组织TNF-α的定位表达
TNF-α阳性细胞呈棕褐色,主要分布在细胞浆和细胞膜。假手术组可见微量的TNF-α阳性细胞。脑出血组1 d、2 d时阳性细胞持续增多,3 d达高峰,5 d时明显减少。与相同时间点的脑出血组相比,治疗组中的阳性细胞可见大量减少(图5)。
2.7实验性脑出血大鼠周围组织NF-κB的定位表达
NF-κB阳性细胞呈棕褐色,主要分布在细胞核。假手术组可见极少量的阳性细胞。与假手术组相比,脑出血组NF-κB阳性细胞明显增多,1 d、2 d时阳性细胞持续增多,3 d达高峰,5 d时明显减少。与相同时间点的脑出血组相比,治疗组的NF-κB阳性细胞明显减少(图6)。

图4 脑组织中IL-1β的表达(免疫组织化学染色,400X)
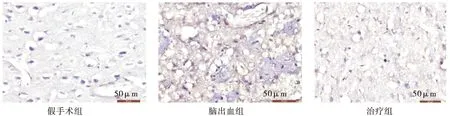
图5 脑组织中TNF-α的表达(免疫组织化学染色,400X)

图6 脑组织中NF-κB p65的表达(免疫组织化学染色,400X)
3 讨论
本实验就创伤性脑损伤后NF-κB与TNF-α(或IL-1β)的表达进行了相关性分析,结果显示,NF-κB与TNF-α(或IL-1β)均呈正相关性,揭示NF-κB 可能正向调控TNF-α和IL-1β蛋白的表达,从而引发炎症反应。这可能与脑出血继发性损害中出现炎症反应有关。NF-κB在炎症相关疾病的发病机制中起到关键作用[5]。多种炎症介质基因的启动子和增强子中存在一个或多个κB序列,如IL-8 、IL-6 、TNF-a和VCAM-1等。NF-κB是炎症反应中的关键性核转录因子,活化的NF-κB可单独或与其他转录因子协同参与上述介质基因的诱导表达[6-8]。NF-κB犹如炎症介质基因转录的启动开关,可诱导多种细胞因子和黏附分子等的表达,从而激发炎症瀑布反应,造成组织损伤。NF-κB可刺激TNF-α和IL-1β等细胞因子的表达,同时这些细胞因子又是NF-κB的刺激剂,可进一步活化NF-κB,只有激活的NF-κB才能被转运到细胞核,从而造成持续或放大的炎症反应[9]。动物实验研究[10-12]发现,他汀类药物可能从以下几个方面起作用:1)减轻炎症反应,他汀类药物可通过直接减少体内炎性介质(TNF-α和IL-1β)的表达或抑制NF-κB的活性,从而减轻神经功能损伤。2)抗氧化作用,他汀类药物具有广泛的抗氧化作用,减轻脑血管病后的氧化应激反应,从而起到脑保护作用[13]。孟令丽[14]研究发现,阿托伐他汀可能通过抑制TLR4/NF-κB信号通路调控IL-1β介导的炎症反应,降低脑组织的含水量,改善神经功能损伤,从而减轻脑出血后继发性神经损伤,对脑出血大鼠起重要的神经保护作用。本实验Western blot和免疫组化的结果显示,脑出血后给予阿托伐他汀治疗,NF-κB和TNF-α、IL-1β的表达水平较出血组明显减少,这可能是NF-κB的活性得到明显抑制,从而导致TNF-α、IL-1β的合成与释放大量减少,减慢了脑出血组织周围炎症反应的进一步发生和发展。所以阿托伐他汀可能通过抗炎途径抑制炎症介质的表达,从而起到神经保护作用,这为阿托伐他汀在脑出血的临床应用提供了理论依据。
[1]Poon M T, Bell S M, Al-Shahi Salman R. Epidemiology of Intracerebral Haemorrhage[J]. Front Neurol Neurosci, 2015, 37: 1-12.
[2] An S J, Kim T J, Yoon B W. Epidemiology, Risk Factors, and Clinical Features of Intracerebral Hemorrhage: An Update[J]. J Stroke, 2017, 19(1): 3-10.
[3]鲁华山, 于长义, 田志佳, 等. 脑出血实验动物模型研究进展[J]. 中华神经外科疾病研究杂志, 2016, 15(2): 184-186.
[4]王哲, 刘震, 刘昕, 等. 两种实验性大鼠脑出血模型的对比研究[J]. 第三军医大学学报, 2016, 38(13): 1494-1500.
[5]Shih R H, Wang C Y, Yang C M. NF-kappaB Signaling Pathways in Neurological Inflammation: A Mini Review[J]. Front Mol Neurosci, 2015, 8: 77.
[6]Rahman I, Gilmour P S, Jimernez L A,etal.Oxidative stress and TNF-alpha induce histone acetylation and NF-kappaB/AP-1 activation in alveolar epithelial cells: potential mechanism in gene transcription in lung inflammation[J ]. Mol Cell Biochem,2002,234-235(1/2):239-248.
[7]Aggarwal B B. Nuclear factor-kappaB: the enemy within[J]. Cancer Cell, 2004, 6(3): 203-208.
[8]Tilstra J S, Robinson A R, Wang J,etal. NF-κB inhibition delays DNA damage-induced senescence and aging in mice[J]. J Clin Invest, 2012, 122(7): 2601-2612.
[9]Yakovleva T, Bazov I, Watanabe H,etal. Transcriptional control of maladaptive and protective responses in alcoholics: A role of the NF-κB system[J]. Brain, Behavior, and Immunity, 2011, 25: S29-S38.
[10] Yamada Y, Takeuchi S, Yoneda M,etal. Atorvastatin reduces cardiac and adipose tissue inflammation in rats with metabolic syndrome[J]. Int J Cardiol, 2017, 240: 332-338.
[11] Taylor E W, Andrade D V, Abe A S,etal. The unequal influences of the left and right vagi on the control of the heart and pulmonary artery in the rattlesnake, Crotalus durissus[J]. J Exp Biol, 2009, 212(Pt 1): 145-151.
[12] Ewen T, Qiuting L, Chaogang T,etal. Neuroprotective effect of atorvastatin involves suppression of TNF-α and upregulation of IL-10 in a rat model of intracerebral hemorrhage[J]. Cell Biochem Biophys, 2013, 66(2): 337-346.
[13] 姜晓锋. 阿托伐他汀对永久性大鼠局灶性脑缺血的保护作用及其对脑eNOS表达的影响[D]. 成都:四川大学, 2004:24-26.
[14] 孟令丽. 阿托伐他汀阻抑实验性脑出血大鼠脑内NF-κB介导的继发性炎症损伤[D].石家庄:河北师范大学, 2014:21-32.
TheEffectofAtorvastatinontheExpressionofNF-κB,TNF-αandIL-1βintheRatswithIntracerebralHemorrhage
WuYu1,ZouXianwei2△,ChengRunxia3.
1.ChengduMedicalCollege,SichuanKeyLaboratoryofDevelopmentandRegeneration,Chengdu610500,China;2.TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China;3.SouthwestMedicalUniversity,Luzhou646000,China
ObjectiveTo observe the effect of atorvastatin on the expression of NF-κB, TNF-α and IL-1β in the tissues around the hematoma of the rats with intracerebral hemorrhage and explore the protective effect of atorvastatin on the brain of the rats with intracerebral hemorrhage and its possible mechanism.MethodsA total of120SD rats were randomly divided into the sham group, intracerebral hemorrhage group and treatment group. Both the intracerebral hemorrhage and treatment groups were given the intracerebral injection of autologous blood to establish the models of intracerebral hemorrhage, while the sham group was given the injection with0.9% sodium chloride at the same site. The treatment group was given intragastric administration of atorvastatin at doses of10mg/kg2hours after operation. The rats were sacrificed and their brain tissues were taken in each group after12hours,1,2,3and5days respectively. Immunohistochemistry and Western blot were used to detect the protein expression of TNF-α, IL-1β, and NF-κB in the brain tissue of rats in each group.ResultsCompared with the sham group, the intracerebral hemorrhage group had significant increase in the expression of NF-κB, TNF-α and IL-1β (P<0.05), and the expression began to increase steadily after12hours, reached the peak on the3rd day, and lasted for5days. Compared with the intracerebral hemorrhage group, the expression of NF-κB, TNF-α and IL-1β decreased significantly in the treatment group (P<0.05).ConclusionThe high expression of NF-κB, TNF-α and IL-1β is involved in the tissues around the hematoma of the rats with intracerebral hemorrhage. Atorvastatin has a protective effect on the brain by reducing the expression of NF-κB signaling molecules, the production of inflammatory cytokines and the inflammatory response of brain tissues.
Atorvastatin; Intracerebral hemorrhage; NF-κB;TNF-α;IL-1β
http://kns.cnki.net/kcms/detail/51.1705.R.20170719.1840.008.html
10.3969/j.issn.1674-2257.2017.04.016
四川省教育厅重点项目(No:17ZA0314)
:邹显巍 E-mail:chinazxw002@163.com
R743.3
A
△
