鼠李糖乳杆菌对过敏性鼻炎小鼠模型的免疫调节作用*
2017-09-15黄朝平
黄 石,朱 力,陈 嘉,黄朝平
成都医学院第一附属医院 耳鼻咽喉头颈外科(成都 610500)
·论著·
鼠李糖乳杆菌对过敏性鼻炎小鼠模型的免疫调节作用*
黄 石,朱 力△,陈 嘉,黄朝平
成都医学院第一附属医院 耳鼻咽喉头颈外科(成都 610500)
目的探讨鼠李糖乳杆菌(lactobacillus rhamnosus GG,LGG)对卵清蛋白(ovalbumin,OVA)诱导过敏性鼻炎(allergic rhinitis,AR)小鼠模型的免疫调节作用。方法6~8周龄BALB/c小鼠,随机分为阴性对照组、LGG组及AR组,每组各10只。采用Luminex法检测各组血清IL-4 、IL-10和IFN-γ水平。ELISA测血清OVA特异性IgE(OVA-sIgE)水平,采用流式细胞术检测脾细胞悬液中CD4+CD25+T细胞比例。结果与AR组比较,LGG可明显降低血清IL-4、IL-10及OVA-SIgE水平(P<0.05),提高脾细胞悬液中CD4+CD25+T细胞比例(P<0.05);LGG组血清IFN-γ水平与AR组比较,差异无统计学意义(P=0.215)。结论LGG能通过抑制Th2细胞反应及增强CD4+CD25+T细胞活性发挥抗过敏作用。
过敏性鼻炎;益生菌;调节性T细胞;Th1/Th2细胞因子
近年来,过敏性鼻炎(allergic rhinitis,AR)的发病率呈上升趋势,是世界性卫生问题,其发病机制主要是由免疫调节异常导致,主要表现为机体对各种变应原的免疫应答向Th2型偏移,即Th1型细胞反应受到抑制,Th2型细胞反应增强。Th1细胞分泌的IFN-γ及IL-12减少,相反Th2细胞分泌的IL-3、 IL-4和IL-5等增多,刺激B细胞产生IgE增多,嗜酸性粒细胞活化、增殖及释放各种促炎性介质[1],引起打喷嚏、鼻痒、鼻分泌亢进和鼻阻等症状。调节性T细胞(Tregs)是一种抑制性T细胞,其中,CD4+CD25+T细胞是Tregs家族中最重要的一员,通过协助抑制自身反应性T细胞以及外周树突状细胞(dendritic cell,DC),下调T辅助细胞的促炎症反应,而且能阻止初始T细胞(Th0)早期的活化阶段向Th2阶段分化转变[2]。IL-10是Tregs发挥免疫调节作用过程中的关键因子,其可诱导抗原提呈细胞(antigen presenting cell, APC),促进Th0向Tregs分化,而Tregs又可分泌IL-10,调节Th0向Th1方向分化[3],从而进一步增强Tregs活性。
益生菌来源于希腊文,适量可对宿主有益,是一种活的微生物。大量动物实验[4-5]证实,益生菌对哮喘及食物过敏、过敏性皮炎等动物模型有免疫调节作用。目前,一些临床研究[6-7]证实,应用益生菌制剂可缓解AR患者鼻部症状,提高其生活质量,但却缺乏实验研究证据来支持该措施进一步应用和推广。本实验将通过建立AR动物模型,给予鼠李糖乳杆菌(lactobacillus rhamnosus GG,LGG)灌胃处理,分析LGG对AR动物模型的免疫调节作用。
1 材料与方法
1.1实验动物
30只6~8周龄雌性BALB/c小鼠(购自成都医学院动物实验室),体质量(20.0±2.0)g, SPF级。经过1周检疫期后,饲养于成都医学院动物中心。饲养条件:塑料鼠笼,室温(24±1)°C,湿度55%,光照周期12 h/12 h,自由进食水,不含卵清蛋白(ovalbumin,OVA)。动物饲养和试验许可均按照成都医学院实验动物管理委员会制定的条例执行。
1.2AR小鼠模型建立和LGG干预
小鼠随机分为3组,每组10只。实验分组和干预方式如下:1)阴性对照组:采用生理盐水腹腔注射和鼻腔激发后,给予生理盐水灌胃至56 d。2)AR组:采用OVA(美国sigma公司)腹腔注射致敏和OVA滴鼻进行鼻腔激发后,给予生理盐水灌胃至56 d;3)LGG组:采用OVA腹腔注射致敏和OVA滴鼻进行鼻腔激发后,给予每只小鼠LGG(上海交通大学昂立生物研究所), 0.1 mL(1×109cfu),1 次/d,灌胃至56 d。
造模主要步骤[8]如下:AR组分别于第0天和第7天经腹腔注射,20 μg OVA连同2 mg氢氧化铝凝胶混合于200 μL PBS中,行腹腔注射致敏;从14 d开始接受为期6 周,1 次/d的鼻部激发,以200 μg OVA溶于20 μL PBS中,使用微量加样器滴于小鼠前鼻孔,10 μL/侧,由其自主吸入鼻腔。
1.3标本的制备
鼻腔激发完毕后,麻醉小鼠,摘眼球取静脉血,1 200×g(4 ℃),离心10 min,收集血清,置于-80 ℃冰箱保存,用于检测血清免疫球蛋白及细胞因子。静脉血收集完毕后,颈椎脱臼法处死小鼠,取出完整的脾脏后,使用研磨棒轻轻研磨,加PBS悬浮细胞,并通过网孔直径为40 μm的滤网过滤,制成细胞悬液,用于检测脾脏中CD4+CD25+T细胞比例。
1.4血清OVA特异性IgE(OVA-sIgE)水平检测
采用ELISA试剂盒(美国Biolegend公司)检测血清OVA-sIgE的浓度水平。首先将反应孔板使用包被液及终止液包被,按试剂盒说明配置标准品,并使用去离子水稀释血清标本(OVA-sIgE:样本稀释2倍)。将50 μL标准品和稀释好的样本分别加入相应的反应孔中,室温下摇床上孵育2 h,倒出反应孔中的液体并洗孔。再加入100 μL生物素化的二抗,室温下摇床上孵育1 h,弃液并洗孔。接着加入100 μL辣根过氧化物酶标记的亲和素,室温下反应30 min,弃液并洗孔,每孔加入100 μL底物溶液,避光反应15 min,最后每孔加入100 μL终止液。使用Bio-Rad680在450 nm处读取OD值,并通过系统计算出对应孔中的浓度。
1.5血清细胞因子检测
本研究使用Luminex试剂盒(美国R&D公司),检测血清中IL-4和IL-10的浓度。具体步骤如下:洗板后各反应孔分别加入50 μL相应因子的微粒混合物及50 μL配置好的标准品和稀释好的血清样本(所有样本均稀释2倍),室温下振荡器上孵育3 h。采用真空抽吸装置自孔底吸出液体后洗板,再每孔加入50 μL生物素化的抗体,室温下振荡器上孵育1 h。抽吸反应孔中液体并洗板,接着加入50 μL PE标记的链亲和素,反应30 min。最后,洗板后加入100 μL清洗液并使用Luminex读数。
1.6检测脾细胞悬液CD4+CD25+T细胞比例
采用流式细胞技术检测脾细胞悬液中CD4+CD25+T细胞的比例。将准备好的脾细胞悬液,采用细胞计数法定量细胞浓度在106个/mL, 取1 mL细胞悬液,1 500 ×g(4 ℃),离心5 min,去上清液,再使用50 μL PBS重悬,接着加入1 μL FITC标记的抗小鼠CD4抗体和1 μL PE标记的抗鼠CD25抗体(美国eBioscience公司),4 ℃下,避光孵育30 min,再加入1 mL Fixation/Permeabilization 缓冲液(溶质和溶剂按1∶2比例配置),震荡后,4 ℃,孵育30 min。接着加入3 mL Permeabilization缓冲液(溶质和溶剂按1∶9比例配置),震荡后离心去上清液。清洗并重悬细胞,上机检测。检测的数据使用FlowJo软件进行分析。
1.7统计学方法
2 结果
2.1血清OVA-sIgE、IL-4、IFN-γ及IL-10水平比较
血清OVA-sIgE:AR组血清OVA-sIgE水平较LGG组及阴性对照组血清升高,差异有统计学意义(P<0.05),但LGG组小鼠血清OVA-sIgE水平与阴性对照组比较,差异无统计学意义(P=0.399);血清IL-4水平比较:AR组血清IL-4水平较阴性对照组及LGG组血清IL-4水平升高,差异有统计学意义(P<0.05); LGG组小鼠血清IL-4水平较阴性对照组有下降趋势,但差异无统计学意义(P=0.655);血清IFN-γ水平比较:AR组与阴性对照组、AR组与LGG组及阴性对照组与LGG组间血清IFN-γ水平差异无统计学意义(P=0.456、0.215、0.641);血清IL-10水平比较:AR组血清IL-10水平较阴性对照组及LGG组血清IL-10水平升高,且差异有统计学意义(P<0.05); LGG组小鼠血清IL-10水平较阴性对照组血清IL-10水平有降低趋势,但差异无统计学意义(P=0.405)(表1)。
2.2脾细胞悬液CD4+CD25+T细胞比例
AR组脾细胞悬液中CD4+CD25+T细胞比例较阴性对照组降低(P<0.05);LGG组脾细胞悬液中CD4+CD25+T细胞比例较AR组及阴性对照组脾细胞悬液中CD4+CD25+T细胞比例均升高,差异有统计学意义(P<0.05)(表1)。
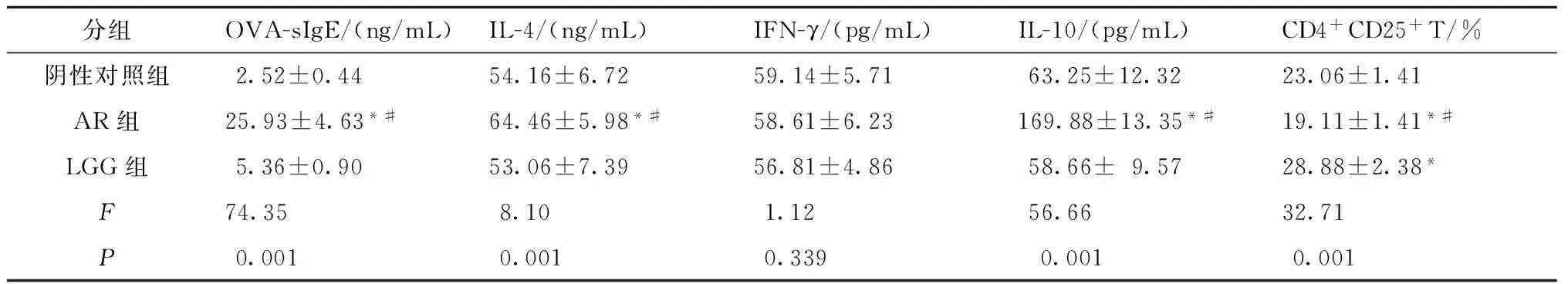
表1 血清细胞因子水平及脾细胞悬液CD4+CD25+T细胞比例(x±s,n=10)
注:与阴性对照组比较,*P<0.05;与LGG组比较,#P<0.05
3 讨论
AR是具有过敏性体质的个体接触致敏原后,由IgE介导的,以炎性介质释放为开端的,有免疫活性细胞、促炎细胞以及细胞因子等参与的鼻黏膜Ⅰ型变态反应性疾病。辅助性T细胞在这一过程中发挥关键作用,表现为Th2细胞型反应增强,分泌大量Th2代表因子IL-4, 而IL-4可促使B细胞分化为浆细胞,并产生IgE,引起鼻黏膜高度充血水肿、腺体增生、黏膜下淋巴细胞和嗜酸粒细胞浸润增加[9]。正常个体血清IgE水平极低,而AR患者血清中IgE水平较高[10]。本研究采用OVA作为致敏原,对雌性Balb/c小鼠进行致敏,血清OVA-sIgE水平较阴性对照组明显升高,表明建模成功;经LGG灌胃干预后,血清OVA-sIgE水平明显降低,表明LGG干预可减少OVA-sIgE产生,缓解Ⅰ型变态反应。
辅助性T淋巴细胞亚群按产生细胞因子的类型和生物学的功能的不同,可分为Th1和Th2两类,Th1细胞主要分泌IL-2、IL-12及IFN-γ 等,通常称为Th1类细胞因子,其中,IFN-γ 是其特征因子,参与细胞免疫。Th2细胞主要分泌IL-4、IL-5等,统称为Th2类细胞因子,其中,IL-4是其特征因子,主要参与体液免疫,引起I型变态反应。AR除体内特异性IgE升高外,还存在Th1/Th2型免疫失衡,具体表现为Th2反应过强,Th1反应受抑制。益生菌刺激可维持Th1/Th2平衡,但具体机制现在还未达成共识。本研究结果显示,LGG组Th2代表因子IL-4较AR组明显降低,而Th1代表因子IFN-γ与AR组差异无统计学意义(P>0.05),提示LGG可能主要是通过抑制Th2型反应来达到Th1/Th2平衡的,此过程没有明显促进Th1型免疫应答。
脾作为全身免疫器官,是淋巴细胞接受抗原刺激,发生特异性免疫应答的场所。CD4+CD25+T细胞是Tregs家族中最主要的一群细胞,可以通过细胞间直接接触的方式,抑制其他效应性免疫细胞,从而维持机体的免疫平衡,CD4+CD25+T细胞数量和功能的异常可导致多重自身免疫性疾病的发生[11]。本实验中,AR组CD4+CD25+T比例较阴性对照组明显减少,证实CD4+CD25+T数量下降可诱发过敏反应。IL-10作为CD4+CD25+T细胞分泌的调节性细胞因子,调节初始T细胞向Th1方向分化,从而调节免疫平衡。成熟的APC分泌IL-2,使Th0向Thl细胞发育,不成熟的或经IL-10/TGF-β诱导的APC,促进初始T细胞向Tregs分化,而Tregs进一步产生大量IL-2、IL-10,抑制Thl/Th2细胞,反馈性下调APC功能,从而全面抑制免疫反应。研究[5]发现,益生菌可通过TLR9传递信息给APC,诱导产生IL-10,促进Tregs细胞分化。然而,益生菌能否刺激IL-10的分泌还存在争议,Hougee等[12]及Ghadimi等[13]研究却发现,益生菌刺激不但不能刺激IL-10的分泌,反而可使其降低。相似的结果也出现在Huang等[14]的研究结果中。本实验中,LGG组小鼠血清IL-10水平较AR组明显降低,这可能是被增加的IL-10受体结合[15],导致血清游离IL-10减少所致。
综上所述,LGG能通过抑制Th2型细胞反应及增强Tregs活性,从而起到防治过敏性鼻炎发生的作用。
[1]Sokol C L, Barton G M, Farr A G,etal. A mechanism for the initiation of allergen-induced T helper type 2 responses[J]. Nat Immunol, 2008, 9(3): 310-318.
[2]Russell S L, Gold M J, Hartmann M,etal. Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma[J]. EMBO Rep, 2012, 13(5): 440-447.
[3]Shida K, Nanno M, Nagata S. Flexible cytokine production by macrophages and T cells in response to probiotic bacteria: a possible mechanism by which probiotics exert multifunctional immune regulatory activities[J]. Gut Microbes, 2011, 2(2): 109-114.
[4]Lee J, Bang J, Woo H J. Effect of orally administered Lactobacillus brevis HY7401 in a food allergy mouse model[J].J Microbiol Biotechnol, 2013, 23(11):1636-1640.
[5]Jang S O, Kim H J, Kim Y J,etal. Asthma Prevention by Lactobacillus Rhamnosus in a Mouse Model is Associated With CD4(+)CD25(+)Foxp3(+) T Cells[J]. Allergy Asthma Immunol Res, 2012, 4(3): 150-156.
[6]Miraglia Del Giudice M, Indolfi C, Capasso M,etal. Bifidobacterium mixture (B longum BB536, B infantis M-63, B breve M-16V) treatment in childrenwith seasonal allergic rhinitis and intermittent asthma[J].Ital J Pediatr, 2017,43(1):25.
[7]Zajac A E, Adams A S, Turner J H. A systematic review and meta-analysis of probiotics for the treatment of allergic rhinitis[J]. Int Forum Allergy Rhinol, 2015, 5(6):524-532.
[8]Ren J J, Yu Z, Yang F L,etal. Effects of Bifidobacterium Breve Feeding Strategy and Delivery Modes on Experimental Allergic Rhinitis Mice[J]. PLoS One, 2015, 10(10): e0140018.
[9]Buckner J H, Ziegler S F. Regulating the immune system: the induction of regulatory T cells in the periphery[J]. Arthritis Res Ther, 2004, 6(5): 215-222.
[10] Shek L P, Soderstrom L, Ahlstedt S,etal. Determination of food specific IgE levels over time can predict the development of tolerance in cow's milk and hen's egg allergy[J]. J Allergy Clin Immunol, 2004, 114(2): 387-391.
[11] Nouri-Aria K T, Durham S R. Regulatory T cells and allergic disease[J]. Inflamm Allergy Drug Targets, 2008, 7(4): 237-252.
[12] Hougee S, Vriesema A J, Wijering S C,etal. Oral treatment with probiotics reduces allergic symptoms in ovalbumin-sensitized mice: a bacterial strain comparative study[J]. Int Arch Allergy Immunol, 2010, 151(2): 107-117.
[13] Ghadimi D, F lster-Holst R, de Vrese M,etal. Effects of probiotic bacteria and their genomic DNA on TH1/TH2-cytokine production by peripheral blood mononuclear cells (PBMCs) of healthy and allergic subjects[J]. Immunobiology, 2008, 213(8): 677-692.
[14] Huang J, Zhong Y, Cai W,etal. The effects of probiotics supplementation timing on an ovalbumin-sensitized rat model[J]. FEMS Immunol Med Microbiol, 2010, 60(2): 132-141.
[15] Winkler B, Bolwig C, Sepp l U,etal. Allergen-specific immunosuppression by mucosal treatment with recombinant Ves v 5, a major allergen of Vespula vulgaris venom, in a murine model of wasp venom allergy[J]. Immunology, 2003, 110(3): 376-385.
ImmunomodulatoryEffectofLactobacillusRhamnosusGGontheBALB/cMicewithAllergicRhinitis
HuangShi,ZhuLi△,ChenJia,HuangChaoping.
TheDepartmentofOtorhinolaryngology,HeadandNeckSurgery,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
ObjectiveTo investigate the immunomodulatory effect of Lactobacillus rhamnosus GG (LGG) on the BALB/c mice with allergic rhinitis (AR) induced by ovalbumin (OVA).MethodsThe BALB/c mice aged from6to8weeks were divided randomly into the control group, LGG group and AR group, and each group consisted of10mice. The Luminex method was used to detect the levels of IL-4, IL-10and IFN-γ in each group, the ELISA method was adopted to detect the level of OVA-specific IgE (OVA-sIgE), and the flow cytometry assay was used to examine the splenic percentage of CD4+CD25+Tregs.ResultsCompared with the AR group, LGG significantly reduced the levels of serum IL-4, IL-10and OVA-specific IgE respectively (P<0.05) and increased the splenic percentage of the CD4+CD25+Tregs (P<0.05). There were no significant differences in the level of IFN-γ between the LGG group and the AR group (P=0.215).ConclusionsLGG exerts the anti-allergic effect by inhibiting the Th2immune response and inducting the activity of CD4+CD25+Tregs.
Allergic rhinitis; Probiotics; Regulatory T cells; Th1/Th2cell factor
http://kns.cnki.net/kcms/detail/51.1705.R.20170613.1606.002.html
10.3969/j.issn.1674-2257.2017.04.012
四川省科技厅应用基础计划项目(No:2015JY0256)
:朱力,E-mail:1968403299@qq.com
R392.8
A
△