杨木自水解液中溶解木质素和胶体木质素的结构特征
2017-09-15傅英娟王兆江张凤山
王 鹏, 秦 影, 傅英娟*, 王兆江, 张凤山
(1.齐鲁工业大学 制浆造纸科学与技术教育部重点实验室,山东 济南250353;2.华泰集团有限公司,山东 东营 257335)
杨木自水解液中溶解木质素和胶体木质素的结构特征
王 鹏1, 秦 影1, 傅英娟1*, 王兆江1, 张凤山2
(1.齐鲁工业大学 制浆造纸科学与技术教育部重点实验室,山东 济南250353;2.华泰集团有限公司,山东 东营 257335)
对不同水解强度下杨木预水解液中溶解木质素和胶体木质素(DCL)进行了分离、纯化和结构表征。结果表明:随着自水解温度的增加(Tmax>170 ℃),杨木预水解液中DCL的缩合程度明显增加,与残留在杨木自水解木片中的木质素相比,预水解液中的DCL组分含有更少的脂肪族羟基、更多的缩合型酚羟基和非缩合型酚羟基,以及更高的 S-OH/G-OH 比率,表明预水解液中的木质素更易发生侧链脂肪族羟基的脱水反应、β-O-4的水解反应和木质素分子间的缩合反应。
杨木;自水解;溶解木质素和胶体木质素;结构表征;木质素缩合
石油资源消耗需求的不断增长与石油资源日益匮乏的矛盾,使得人类开始寻求能够替代化石的资源用以生产日常所需的燃料和化学品[1]。近年来,人们对生物质精炼给予了越来越多的关注,尤其是联合林产生物质精炼技术(IFBR)可在获得传统纸浆的基础上生产高附加值的化学品和材料[2]。自水解预处理是一种破除木质纤维素原料阻抗性,分离出半纤维素组分的有效而又环保的方法[3]。自水解过程中,聚糖的O-乙酰基解离生成乙酸,使得抽提液的pH值降为3~4[4],从而使得半纤维素水解后以寡糖的形式溶出,并进一步降解成单糖或其它降解产物。另一方面,木质素芳基醚键的断裂导致木质素碎片化而溶于预水解液中[5]。与此同时,自水解过程中也会发生木质素的再聚合作用[6],尤其是在较高自水解强度下,木质素会形成正碳离子,从而进一步生成新的C—C连接而发生缩合反应。通常,从木片解离到预水解液中的木质素以两种形式存在,即溶解的木质素和胶体木质素,可统称为溶解木质素与胶体木质素(DCL)。预水解液中的DCL组分与预处理条件和原材料种类有关[7]。自水解过程中木质素的反应性能和结构会影响糖化、木质素的高值化应用[8]、制浆过程[9]以及预水解液中低聚糖的分离和纯化[10]。木材水解液中由于含有一系列的木质素衍生而成的小分子杂质,从而使得从预水解液中提取低聚糖具有挑战性[11]。研究发现,这些木质素类杂质的存在对低聚糖的分离和纯化产生极大的负面影响,必须采取多种分离技术才能获得所需纯度和得率的低聚糖[10-12]。目前,人们对于水解液中低相对分子质量的木质素成分进行了较多的分析[13]。然而,对于预水解液中木质素大分子在自水解过程中的结构变化知之甚少。本研究利用红外(FT-IR)、氢谱(1H NMR)、碳谱(13C NMR)、二维异核单量子相关谱2D HSQC NMR、磷谱(31P NMR)及绝对分子量凝胶色谱(GPC-MALLS)技术对从水解液中分离纯化的DCL进行了表征,旨在阐明自水解强度与DCL大分子结构的关系,为预水解液中木质素的高值化利用和低聚糖的有效分离提供理论依据。
1 实 验
1.1 材料
速生杨107(Populuseuramericana‘Neva’)木片,取自于山东华泰纸业股份有限公司。木片尺寸为:长2.0~3.5 cm、 宽1.2~2.0 cm、 厚约0.5 cm。经过洗涤风干后,木片置于密封袋中,于 -25 ℃ 的冰箱中储存备用。
二氧六环、二氯甲烷、吡啶、乙酸酐、无水乙酸、石油醚和乙醚,皆为市售分析纯。
DZF-6020冷冻干燥机;EYELA旋转蒸发仪;TAL-5-A离心机;傅里叶红外光谱仪IR Prestige-21,日本岛津公司;核磁共振波谱仪AVANCE II 400,Bruker公司;激光光散射仪DAWN HELEOS,Wyatt公司。
1.2 自水解实验
自水解在15 L的电加热且配有自动恒温控制的旋转蒸煮器中进行。每次自水解所用的杨木木片为1 000 g(绝干),所采用的固液比为1 ∶6(g:mL)。自水解的最高温度(Tmax)范围是140~180 ℃,到达最高温度所用的时间约为25 min,在最高温度下保温60 min。自水解完成后,放气,并降温到大约75~77 ℃后过滤,除去大于180 μm的杂质,滤液放入冰箱中用于后续分析。
1.3 溶解木质素和胶体木质素(DCL)的分离与纯化
1.3.1 分离 将自水解液在3000 r/min条件下离心分离10 min,然后用96%的二氧六环对离心后的沉淀进行抽提,抽提时的固液比为1 ∶20(g ∶mL),连续抽提两次。将两次的抽提液混合,并用旋转蒸发仪将混合液蒸发浓缩至大约50 mL后进行冷冻干燥,得到粗制的DCL。
1.3.2 纯化 将粗制的DCL溶于5 mL的90%乙酸中,然后逐滴加入到500 mL去离子水中形成沉淀。离心后的沉淀进行冷冻干燥,即得纯化的DCL木质素样品。在不同的Tmax(140、150、160、170和180 ℃)条件下获得的纯化DCL样品分别标记为DCL140、DCL150、DCL160、DCL170、和 DCL180。
杨木原料中的磨木木质素(MWL)的制备按相关文献[14]操作。
1.4 分析与测定
1.4.1 FT-IR分析 将大约1 mg的DCL样品与100 mg的KBr充分混合和碾磨,以减小粒子尺寸,实现样品的均匀分散,制成圆片后进行红外光谱测定。测试参数为:扫描次数10次、频率范围500~4000 cm-1、分辨率0.5 cm-1。光谱图中,指纹区的范围是750~1900 cm-1。
1.4.2 NMR分析
1.4.2.11H NMR和13C NMR DCL的(1H NMR和13C NMR)的测定在Bruker AVIII 400-MHz上于室温下进行,仪器配备有直径为5 mm的核磁管和Z方向的梯度场。采用二甲基亚砜(DMSO-d6)为溶剂。根据文献[15],在5 mm核磁管中,加入60 mg木质素,并用0.5 mL的DMSO-d6溶解。1H NMR的参数为:扫描次数最少为8,扫描宽度为400 MHz,收集时间为2 s,松弛的延迟时间为3 s。13C NMR的参数为:扫描次数最少为20000,扫描宽度为400 MHz,收集时间为0.4 s,松弛的延迟时间为1.5 s。
1.4.2.2 2D HSQC NMR 2D HSQC NMR采用标准的Bruker HSQC脉冲信号(hsqcetgpsi2)。木质素中连接键含量的衡量方法为半定量法,该方法利用2D HSQC中相应谱图的积分面积来计算:IC9单元=0.5IS2,6+IG2,其中IS2,6是S2,6的积分,S2,6包括S和S′,IG2是G2的积分。IC9代表了芳香环的积分值[15-16]。根据内标(IC9),Ix的量计算公式:Ix=Ix/IC9× 100%,其中Ix代表的是β-O- 4、β-β和β-5键的α位上的积分。
1.4.2.331P NMR 根据文献中的方法[17-18],对木质素样品进行了定量31P NMR分析。首先,在5 mm核磁管中,用650 μL的无水吡啶/CDCl3(1.6 ∶1,体积比,下同)溶解40 mg木质素样品。然后分别加入50 μL的内标溶液(N-羟基-萘二甲酰亚胺溶于无水吡啶/CDCl3,1.6 ∶1,质量浓度为80 g/L)和50 μL的弛豫剂(乙酰基丙酮络酸铬溶于无水吡啶/CDCl3,1.6 ∶1,质量浓度为11 g/L)。然后,将100 μL的磷化试剂2-氯- 4,4,5,5-四甲基-1,3,2-二氧磷杂戊环(TMDP)加入到核磁管中并使其在溶剂中反应10 min。磷化后木质素的磷谱分析采用的扫描宽度为81521.74 Hz,收集时间和松弛时间分别为1.5和2.0 s。
1.4.3 相对分子质量测定 在100 mL锥形瓶中加入60 mg木质素和3 mL的吡啶/醋酸酐溶液(体积比1 ∶2),并在锥形瓶中通入氮气以除去其中的空气。该混合溶液在常温避光下反应72 h,期间需要不时摇晃,以确保木质素反应充分。反应结束后,混合液逐滴加到40 mL的无水乙醚中,沉淀析出后进行离心分离,并将沉淀用乙醚洗涤3次。最后,乙酰化的木质素在40 ℃的真空干燥器中干燥 24 h。将乙酰化木质素溶于四氢呋喃(THF)中,并用GPC-MALLS系统测定木质素样品的平均相对分子质量和多分散系数。样品的质量浓度为5~10 g/L。仪器的激光源为50 MW的砷化镓灯源,波长为658 nm。
2 结果与讨论
2.1 FT-IR分析
图1为从水解液中提取的DCL样品的指纹区FT-IR图谱。木质素的典型官能团振动带如下:酯基中羰基的振动(1735 cm-1),共轭/非共轭的羧基/酯基或非共轭的β-酮类羧基基团(1709 cm-1)[18],共轭的苯环羰基振动(1657 cm-1),芳香族骨架振动(1608、1510和1427 cm-1),愈创木基(G)单元(1268、1217和1034 cm-1),及紫丁香基(S)单元(1328和1121 cm-1)[19-20]。由图1可见,杨木自水解液中DCL的FT-IR谱图与杨木原料木片中MWL非常相似,表明在自水解条件下,所溶出的木质素的化学结构未发生明显的改变。同时,也证明了实验所采用的分离和纯化DCL的方法在去除碳水化合物等杂质方面是可行和有效的。然而,在不同的自水解条件下的DCL的吸收峰强度有些许差别。随着自水解温度的提高,DCL在1735 cm-1处的酯键吸收峰消失,证明自水解条件下木质素中的酯键易被水解;在1657 cm-1处的共轭苯环羰基振动的逐渐消失以及在1709 cm-1处的非共轭β-酮类羧基基团吸收峰的逐渐形成,表明在自水解过程中木质素β-O-4连接键的断裂。此外,在1328 cm-1处的S单元和在 1268 cm-1的G单元的C—O振动强度的减弱也证明了木质素中醚键的断裂。
2.21H NMR和13C NMR 分析
对不同水解强度下获得的溶解木质素和胶体木质素(DCL)进行了1H NMR和13C NMR分析,并与前期研究的残留在预水解木片中的木质素[21]进行了对比。相应峰的归属[18,22]见图2。从图2(a)可见,δ6.4~7.2为G型和S型木质素单元苯环氢的信号,随着自水解温度由140增至180 ℃,G型木质素单元(δ6.8~7.2)的质子强度信号逐渐减小,可能是由于G型单元在高自水解强度下进一步降解为香草醛以及木质素分子间发生C—C键缩合所致。此外,β-O- 4链接键的质子对应的强度信号(δ4.1~4.8)也有减弱的趋势,表明了木质素中β-O- 4键的断裂。
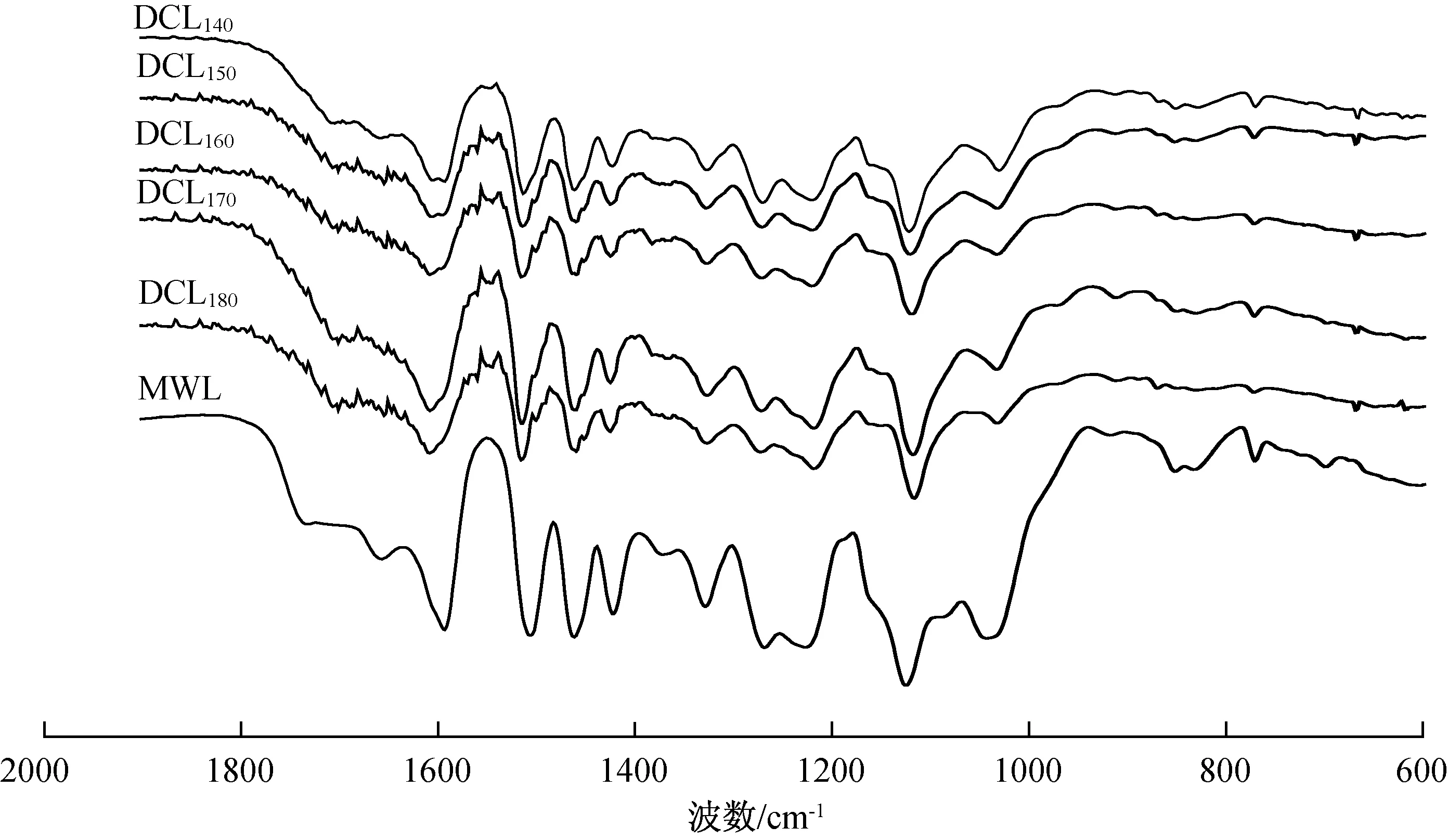
图1 不同自水解温度下杨木水解液中DCL的FT-IR图谱

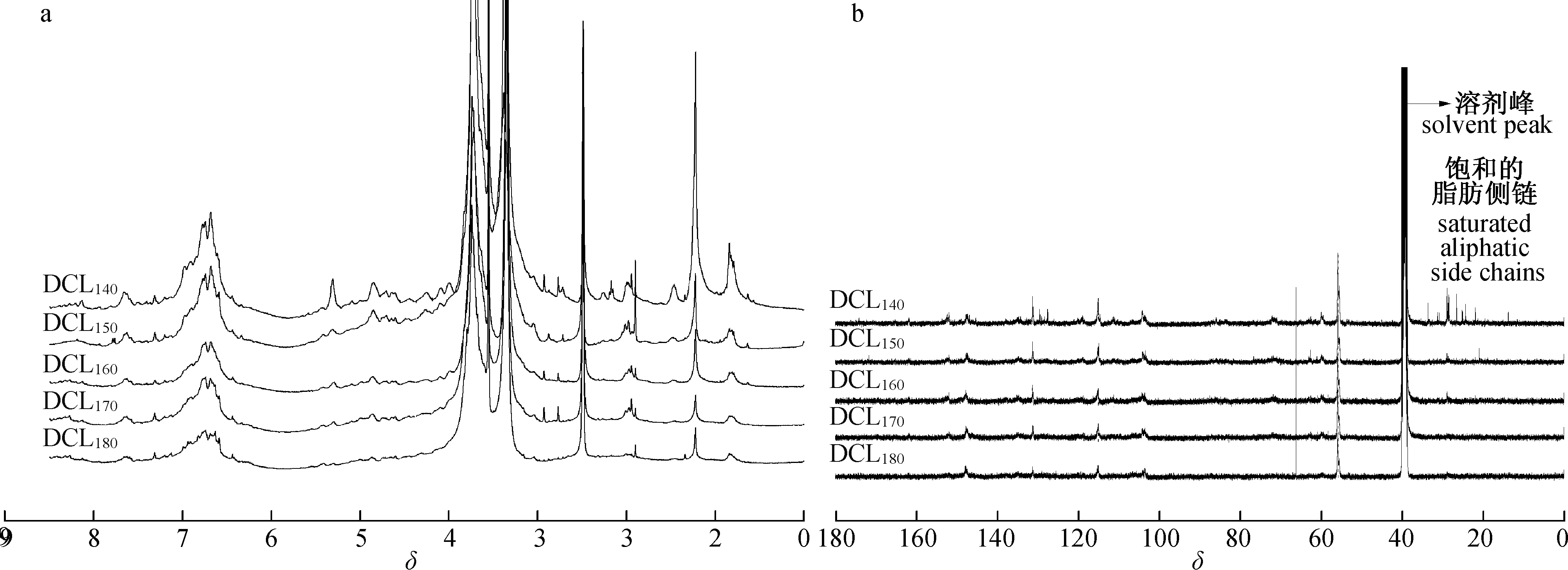
图2 不同自水解温度下杨木水解液中DCL的 1H NMR (a)和 13C NMR(b)图谱
为了进一步明确杨木预水解液中溶解木质素和胶体木质素(DCL)的结构特征,对样品DCL140、DCL150、DCL170和DCL180进行了2D HSQC NMR分析,如图3所示。其中图3(a)为木质素的芳香区域,木质素中愈创木基苯丙烷单元的G2、G5和G6所对应的δC/δH分别为111.0/7.0、115.1/6.9和119.2/6.8;紫丁香基苯丙烷单元S2,6和带有氧化的α-酮基团的S’2,6对应的δC/δH分别为104.0/6.7和106.3/7.2;对羟基苯甲酸结构单元PB2,6对应的δC/δH为131.3/7.7。图3(b)为木质素的侧链区域,木质素结构中的甲氧基(OMe)、β-芳基醚键(β-O-4,A)、松脂酚(β-β,B)、β-5(C)和β-1(D)对应的位移δC/δH分别为55.6/3.7 (OMe)、71.9/4.9(Aα)、83.6/4.3(Aβ)、59.6/3.6(Aγ)、84.8/4.7(Bα)、53.4/3.1(Bβ)、71.0/4.2和70.8/3.8(Bγ)、87.2/5.5(Cα)、62.3/3.9(Cγ)和55.4/3.1(Dβ)。


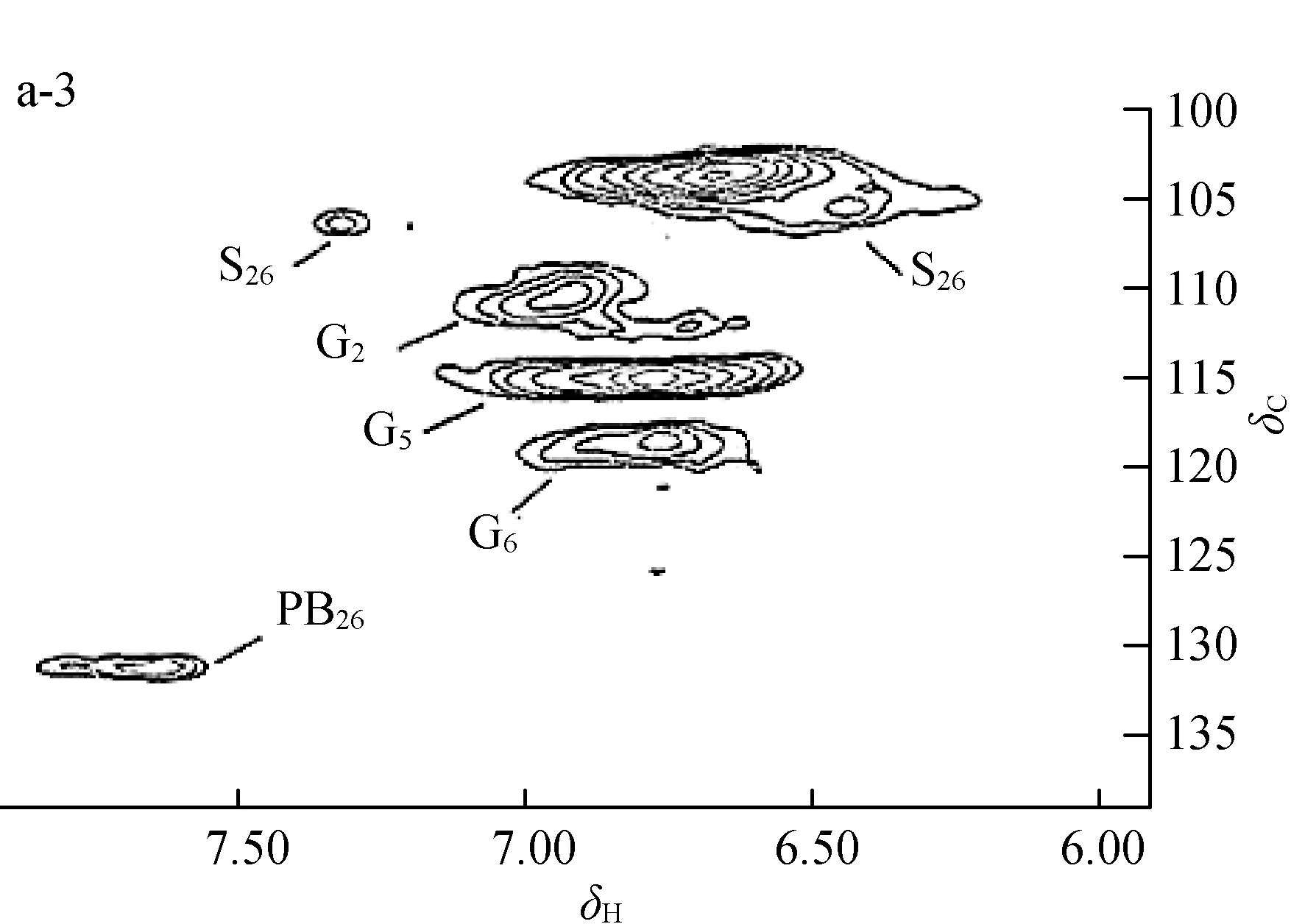
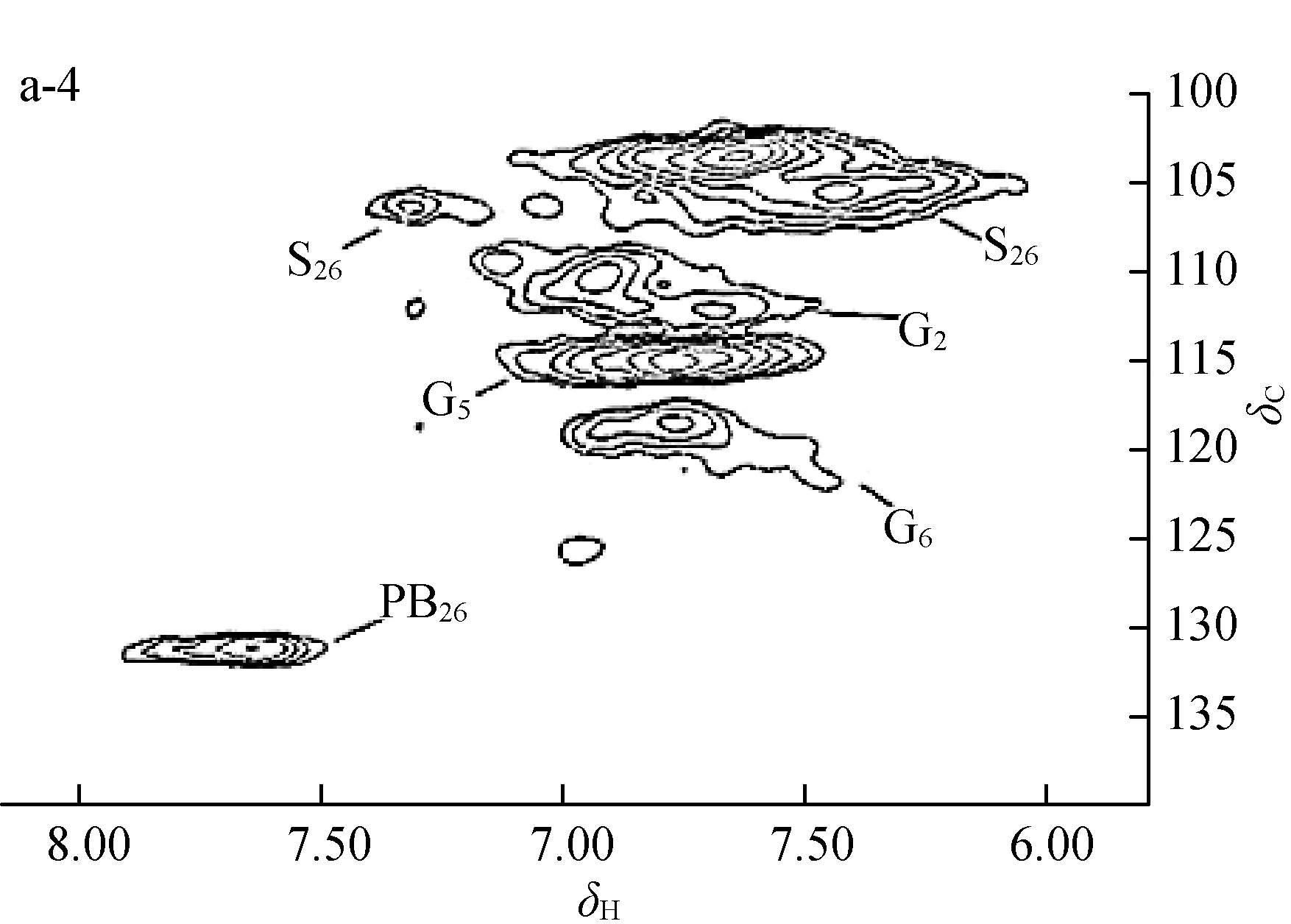
OMe:甲氧基methoxyl groups; A:β-O- 4芳基醚键β-O- 4 ether; B:β-β松脂酚resinol; C:β-5松脂酚phenylcoumararan;D:β-1松脂酚spirodienone; S:紫丁香基苯丙烷单元syringyl units; S′:含氧化的α-酮基团的紫丁香基苯丙烷单元syringyl units with oxidizedα-ketone ; G:愈创木基苯丙烷单元guaiacyl units; PB:对羟基苯甲酸结构单元p-hydroxybenzoate units
a-1,b-1:DCL140;a-2,b-2:DCL150;a-3,b-3:DCL170;a-4,b-4:DCL180
a. 芳香环区域aromatic area; b. 侧链区域side chain area
图 3 DCL的 2D HSQC 图谱
Fig.3 2D HSQC spectra of DCL
表1为杨木DCL中甲氧基、单元间连接键以及芳香族C的定量数据。可以看出,随着自水解温度的增加,预水解液中木质素的甲氧基逐渐降低,β-O-4连接明显减少,而缩合度和β-5连接有显著的增加(尤其是Tmax>170 ℃时)。例如,Tmax由140 ℃增至170 ℃,甲氧基(以100个苯环计,下同)由DCL140的60降为DCL170的55;β-O-4连接由27.6降为14.1;β-5连接由6.8增至7.8;而缩合度则由0.92增至1.27。可见,自水解温度的增加会促进预水解液木质素中甲氧基的脱除、β-O-4连接的水解和C—C键的缩合。而预水解液中的木质素与残余在水解木片中的木质素,在缩合反应和水解反应的程度上有较大的差异,表现在相同自水解温度下,预水解液中的木质素发生甲氧基脱除和β-O-4水解反应更为彻底,发生β-5等缩合反应更为严重,从而使得水解液中DCL具有更高的缩合度。例如,自水解温度170 ℃时,水解液中DCL含甲氧基、β-O-4、β-5连接和木质素缩合度分别为55、 14.1、 7.8和1.27,而残余在水解木片木质素中的相应量则分别为62、 51.1、 5.4和1.00[21]。预水解液中DCL具有较高缩合度,应归于在水解液体系中木质素大分子之间具有较高的碰撞几率和较小的空间位阻。尽管随着水解温度的增加,木质素β-β连接有所增加,但仍远低于原料MWL。这可能是由于不同类型的木质素在水解液中溶解差异所致。含有β-β连接的木质素大分子难以在自水解条件下溶于预水解液中。此外,木质素分子的缩合反应可能发生在富电子的碳原子上,如G和S单元中的C2和C6,尤其是G单元中的C5。

表1 通过定量13C NMR和 2D HSQC NMR所获得的预水解液中DCL中的连接键数量1)
1) *:缩合度=(苯环C上连接的C+苯环C上连接的O)/苯环C上连接的H condensation degree=(C-substituted aromatic C+O-substituted aromatic C)/H-substituted aromatic C;2) 以100个苯环为基数based on 100 aromatic unit
2.3 预水解液DCL中羟基的变化
表2为利用定量13P NMR技术测得的杨木自水解液DCL中脂肪族羟基、酚羟基和羧基的含量。可见,在相对较低的温度(<160 ℃)下DCL中的羟基主要为脂肪族羟基。自水解温度超过160 ℃,酚羟基含量则超过脂肪族羟基,这与自水解木片中残余木质素有所不同[21]。显然,随着自水解温度的增加,脂肪族羟基含量逐渐减少,而酚羟基含量明显增加。脂肪族羟基的减少应归因于脂肪族侧链酸催化脱除所导致的脱水反应[24]。而随着温度的增加,G和S型木质素酚羟基的增加则应归因于木质素芳醚键断裂所导致的木质素解聚[19]。提高Tmax,会增加缩合型酚羟基的含量,表明较高温度下的自水解会促进酚羟基木质素单元间的缩合反应。此外,S型酚羟基的增加速度远高于G型,表明S型木质素中β-O-4连接的断裂远比G型单元容易。例如,温度140 ℃时,S/G型酚羟基比率为0.81;而180 ℃时,比率则上升到1.51。G型酚羟基单元的增加可能归因于β-O-4连接的断裂或S型单元的脱甲基反应[25]。另一个可能是更多的G单元和p-羟基酚单元由于C5处较强的反应活性而发生了缩合反应。可见,随着自水解温度的增加,自水解液中木质素的酚羟基增多、脂肪族羟基减少、S/G羟基比增加。而且,与自水解木片中的木质素相比[21],自水解液中DCL含有更少的脂肪族羟基、更多的酚羟基尤其是缩合型酚羟基和S型非缩合酚羟基,表明水解液中木质素的脂肪族侧链发生的脱水反应,β-O-4连接的水解反应更为彻底,而木质素单元间的缩合反应更为严重。从表2中还可以看出,水解温度的增加并未使DCL中羧基含量有所变化,尽管DCL中羧基含量远高于原料中MWL的含量。这也表明,较低的自水解温度(140 ℃)下即可使原料木质素中的酯键水解,支持了FT-IR所检测到的结果。
表2 自水解液中DCL和原料中MWL的羟基含量

Table 2 Hydroxyl group contents of the DCL in autohydrolysis liquor and MWL in aspen wood chips mmol/g
2.4 自水解液中DCL相对分子质量的变化
表3为GPC-MALLS所测定的杨木自水解液中木质素的重均相对分子质量(Mw)、数均相对分子质量(Mn)及其多分散性(Mw/Mn)。可见,即使在较低的水解温度(140 ℃)下,杨木自水解也可显著增加水解液中DCL的相对分子质量。例如,在140 ℃条件下,杨木水解液中DCL的相对分子质量为杨木原料中MWL的3.7倍。自水解温度超过170 ℃,水解液中DCL的相对分子质量又有显著的增加,应归因于水解液中DCL更多的缩合反应。与残留在水解杨木木片中的木质素相比[21],相应水解液中木质素的相对分子质量更高,表明在水解液中木质素单元更易发生缩合反应,支持了核磁共振的分析结果。

表3 自水解液中DCL的重均相对分子质量(Mw)、数均相对分子质量(Mn)和多分散性(Mw/Mn)
3 结 论
3.1 研究了杨木自水解液中溶解木质素和胶体木质素(DCL)的结构特征。结果表明:提高自水解温度会促进木质素中甲氧基的脱除、β-O-4连接的水解和C—C键的缩合。而在相同自水解温度下,水解液中的木质素发生甲氧基脱除和β-O-4水解反应更为彻底,发生β-5等缩合反应更为严重,导致水解液中DCL具有更高的缩合度。
3.2 即使较低温度的自水解也可显著增加水解液中DCL的相对分子质量。随着自水解温度的增加,自水解液中DCL的酚羟基增多、脂肪族羟基减少、紫丁香基(S)与愈创木基(G)羟基比增加。与水解木片中的残余木质素相比,水解液中DCL含有更少的脂肪族羟基、更多的酚羟基,尤其是缩合型酚羟基和非缩合型酚羟基,进一步表明水解液中木质素的脂肪族侧链发生脱水反应、β-O-4连接的水解反应和木质素单元间的缩合反应程度更高。
[1]DEUTSCHMANN R,DEKKER R F H.From plant biomass to bio-based chemicals:Latest developments inxylan research[J].Biotechnology Advances,2012,30(6):1627-1640.
[2]VAN HEININGEN A.Converting akraft pulp mill into an integrated forest biorefinery[J].Pulp and Paper Canada,2006,107(6):38-43.
[3]YU G,YANO S,INOUE H,et al.Pretreatment of rice straw by a hot-compressed water process for enzymatic hydrolysis[J].Applied Biochemistry and Biotechnology,2010,160(2):539-551.
[4]BRASCH D J,FREE K W.Prehydrolysis-Kraft pulping ofPinusradiatagrown in New Zealand[J].Tappi Journal,1965,48(4):245-248.
[5]LESCHINSKY M,ZUCKERSTTTER G,WEBER H K,et al.Effect of autohydrolysis ofEucalyptusglobuluswood on lignin structure.Part 1:Comparison of different lignin fractions formed during water prehydrolysis[J].Holzforschung,2008,62(6):645-652.
[6]LI J B,GELLERSTEDT G.Improved lignin properties and reactivity by modifications in the autohydrolysis process of aspen wood[J].Industrial Crops and Products,2008,27(2):175-181.
[8]ZHU J Y,PAN X J.Woody biomass pretreatment for cellulosic ethanol production:Technology and energy consumption evaluation[J].Bioresource Technology,2010,101(13):4992-5002.
[9]WEN J L,SUN S L,XUE B L,et al.Quantitative structures and thermal properties of birch lignins after ionic liquid pretreatment[J].Journal of Agricultural and Food Chemistry,2013,61(3):635-645.
[10]WANG Z J,JIANG J G,WANG X J,et al.Selective removal of phenolic lignin derivatives enables sugars recovery from wood prehydrolysis liquor with remarkable yield[J].Bioresource Technology,2014,174:198-203.
[11]WANG Z J,WANG X J,FU Y J,et al.Colloidal behaviors of lignin contaminants:Destabilization and elimination for oligosaccharides separation from wood hydrolysate[J].Separation and Purification Technology,2015,145:1-7.
[12]WANG X J,ZHUANG J S,JIANG J G,et al.Separation and purification of hemicellulose-derived saccharides from wood hydrolysate by combined process[J].Bioresource Technology,2015,196:426-430.
[13]CASTRO E,CONDE E,MOURE A,et al.Antioxidant activity of liquors from steam explosion ofOleaeuropeawood[J].Wood Science and Technology,2008,42(7):579-592.
[14]EL HAGE R,BROSS N,CHRUSCIEL L,et al.Characterization of milled wood lignin and ethanol organosolv lignin from miscanthus[J].Polymer Degradation and Stability,2009,94(10):1632-1638.
[15]WEN J L,SUN S L,XUE B L,et al.Recent advances in characterization of lignin polymer by solution-state nuclear magnetic resonance (NMR) methodology[J].Materials,2013,6(1):359-391.
[16]SETTE M,WECHSELBERGER R,CRESTINI C.Elucidation of lignin structure by quantitative 2D NMR[J].Chemistry-A European Journal,2011,17(34):9529-9535.
[17]GUO Y Z,ZHOU J H,WEN J L,et al.Structural transformations of triploid ofPopulustomentosaCarr.lignin during auto-catalyzed ethanol organosolv pretreatment[J].Industrial Crops and Products,2015,76(15):522-529.
[18]WANG K,JIANG J X,XU F,et al.Effects of incubation time on the fractionation and characterization of lignin during steam explosion pretreatment[J].Industrial and Engineering Chemistry Research,2012,51(6):2704-2713.
[19]SUN S N,LI H Y,CAO X F,et al.Structural variation of eucalyptus lignin in a combination of hydrothermal and alkali treatments[J].Bioresource Technology,2015,176:296-299.
[20]XIAO L P,SHI Z J,XU F,et al.Characterization of MWLs fromTamarixramosissimaisolated before and after hydrothermal treatment by spectroscopical and wet chemical methods[J].Holzforschung,2012,66(3):295-302.
[21]WANG P,FU Y J,SHAO Z Y,et al.Structural changes to aspen wood lignin during autohydrolysis pretreatment[J].Bioresources,2016,11(2):4086-4103.
[22]KIM J Y,SHIN E J,EOM I Y,et al.Structural features of lignin macromolecules extracted with ionic liquid from poplar wood[J].Bioresource Technology,2011,102(19):9020-9025.
[23]LESCHINSKY M,ZUCKERSTTTER G,WEBER H K,et al.Effect of autohydrolysis of Eucalyptus globulus wood on lignin structure.Part 2:Influence of autohydrolysis intensity[J].Holzforschung,2008,62(6):653-658.
[24]EL HAGE R,CHRUSCIEL L,DESHARNAIS L,et al.Effect of autohydrolysis ofMiscanthus×giganteuson lignin structure and organosolv delignification[J].Bioresource Technology,2010,101(23):9321-9329.
[25]RAUHALA T,KING A W T,ZUCKERSTTTER G,et al.Effect of autohydrolysis on the lignin structure and the kinetics of delignification of birch wood[J].Nordic Pulp and Paper Research Journal,2011,26(4):386-391.
Structural Character of Dissolved and Colloidal Lignin in Hydrolysatefrom Poplar Woodchips Autohydrolysis
WANG Peng1, QIN Ying1, FU Yingjuan1, WANG Zhaojiang1, ZHANG Fengshan2
(1.Key Laboratory of Pulp & Paper Science and Technology of the Ministry of Education,Qilu University ofTechnology, Jinan 250353, China; 2.Huatai Group Corp. Ltd., Dongying 257335, China)
The dissolved and colloidal lignin (DCL) under different autohydrolysis levels were isolated and purified from the poplar woodchips autohydrolysis liquor, and their structural features were characterized by series of instrumental analysis, i.e. Fourier transform infrared (FT-IR),1H,quantitative13C, 2D HSQC, and31P nuclear magnetic resonance (NMR) spectroscopies, and gel permeation chromatography/multi-angle laser light scattering (GPC-MALLS). The condensation of DCL in the poplar autohydrolysis liquor remarkably increased with increasing autohydrolysis temperature (Tmax>170 ℃). Comparing with functional groups of the lignin in the autohydrolyzed poplar woodchips, the DCL had less aliphatic-OH groups, containing more condensed phenolic-OH and more non-condensed phenolic-OH groups, and appearing with higher syringyl OH/guaiacyl OH ratios. These results indicated that DCL underwent more sufficient dehydration of side-chain aliphatic-OH, hydrolysis reaction ofβ-O-4 linkages, and condensation reaction between each lignin units.
poplar; autohydrolysis; dissolved and colloidal lignin; structure characterization; condensation of lignin
2016- 11- 09
国家自然科学基金资助项目 (31540009;31370581);山东省自主创新和成果转化项目(2014CGZH0302)
王 鹏(1990— ), 男, 山东维坊人,硕士,主要从事生物质精炼技术研究工作
*通讯作者:傅英娟,教授,博士生导师,研究领域为生物质精炼技术;E-mail: fyingjuan@163.com。
10.3969/j.issn.0253-2417.2017.04.009
TQ35;TS71
A
0253-2417(2017)04-0059- 08
王鹏,秦影,傅英娟,等.杨木自水解液中溶解木质素和胶体木质素的结构特征[J].林产化学与工业,2017,37(4):59-66.
