海藻酸钠的提取与功能化改性研究进展
2017-09-15黄攀丽沈晓骏陈京环吴玉英孙润仓
黄攀丽, 沈晓骏, 陈京环,2, 吴玉英, 孙润仓*
(1.北京林业大学 材料科学与技术学院,林木生物质化学北京市重点实验室,北京 100083;2.中国制浆造纸研究院 制浆造纸国家工程实验室,北京 100102)
海藻酸钠的提取与功能化改性研究进展

HUANG Panli
黄攀丽1, 沈晓骏1, 陈京环1,2, 吴玉英1, 孙润仓1*
(1.北京林业大学 材料科学与技术学院,林木生物质化学北京市重点实验室,北京 100083;2.中国制浆造纸研究院 制浆造纸国家工程实验室,北京 100102)
海藻酸钠作为一种天然高分子物质广泛应用于各领域,它的研究和开发对人类生存环境的可持续发展具有重要意义。系统回顾了近年来国内外对海藻酸钠提取工艺的相关研究,主要包括酸凝-酸化法、钙凝-酸化法、钙凝-离子交换法、酶解法和超滤法,简述了温度、pH值等因素对提取率的影响,并对比分析了各提取工艺的优势以及存在的问题。在此基础上,综述了海藻酸钠结构中羟基以及羧基的功能化改性及其改性化合物的潜在应用,包括氧化、磺化、共聚、酯化等新进展。最后,展望了海藻酸钠提取工艺的发展方向以及改性的发展前景。
海藻酸钠;提取;改性;应用
石油基高分子材料在各个领域内的广泛应用所带来的污染问题严重影响人类的生存环境,而天然生物高分子材料性能独特对环境友好,使之成为当今新材料的研究热点。其中,海藻酸钠作为一种优良的具有生物相容性、无毒及可生物降解的物质,目前已被广泛应用于食品业、农业、医药工业、日用品行业等领域[1-4]。在自然界中,海藻酸钠是褐藻细胞壁的主要组分,其在海带中高达30%~40%,是一类丰富的可再生资源。它是由β-D-甘露糖醛酸(M)和其差向异构体α-L-古罗糖醛酸(G)这两种单体以直线连接组成的多糖类生物高分子[5-8]。整个大分子链由L-古罗糖醛酸残基的均聚区(GG区)、D-甘露糖醛酸残基的均聚区(MM区)以及两种糖醛酸残基的杂聚区(GM区)这3种排列方式经β-1,4和α-1,4糖苷键连接而成[9-11]。海藻酸钠纯品为白色或淡黄色粉末,几乎无臭无味,易溶于水,不溶于酸(pH值<3)和乙醇等有机溶剂[1],海藻酸钠水溶液在pH值6~11范围内稳定性最好,pH值低于6时易形成海藻酸凝胶析出,而pH值高于11时又会凝聚。当pH值为7时海藻酸钠水溶液的黏度最大,且黏度随温度的升高显著降低[12-13]。此外,海藻酸钠含有的GG片段可与钙、铁、铅等二价以上的金属离子络合生成“锯齿型结构”,又称“蛋壳结构”的不溶性凝胶[14-15]。每年工业上分离提取得到的海藻酸钠为 3万吨,还不到自然界生物合成海藻酸钠总量的10%。据统计,国内外每年大约需要高纯度海藻酸钠 1000 多吨。因此,高效地提取海藻酸钠可为海藻酸钠的应用提供有力的保障。生化技术的发展为海藻酸钠衍生物中单糖序列、位置以及取代基的改性创造了良好的机会。因此,自2000年以来,海藻酸钠越来越受到研究者的重视,作者就近年来海藻酸钠提取方法的研究进展进行了综述,并根据海藻酸钠结构中羟基以及羧基的不同改性条件和反应机理等,介绍了国内外在海藻酸钠功能化改性方面的应用[16-19],并针对当前技术和未来应重点关注的新路线等提出建议和展望。
1 海藻酸钠的提取
1.1 海藻酸钠提取的主要影响因素
目前,在海藻酸钠提取工艺中,降解是一个最关键的不利因素。席国喜等[20]对海藻酸钠进行热解动力学研究表明:当温度高于60 ℃时,海藻酸钠水溶液或者含水的海藻酸钠降解速率明显加快,而提取温度低于60 ℃,海藻酸钠结构稳定,不易降解,因此,整个提取工艺温度应保持在60 ℃以下。除温度外,溶液酸碱性也会影响海藻酸钠的降解和提取率。大量研究发现:在弱酸或者中性条件下海藻酸钠的结构较稳定,降解速率较慢;而在过酸或过碱条件下,海藻酸钠分子内的糖苷键很不稳定,容易断裂,降解速率明显加快,在强酸条件下海藻酸钠溶液还会出现胶凝现象,其结构不稳定且发生降解形成小分子,产率和黏度都较低,此外,常用的脱色剂会造成海藻酸钠结构不稳定,其长链中部分结构发生氧化降解,令提取得到的海藻酸钠产品相对分子质量减小、纯度也有所下降,同时提取率降低[21-23]。
1.2 海藻酸钠提取前的预处理
由于褐藻中含多种色素及蛋白质,提取的海藻酸钠常带有颜色,使产品品质下降。因此,在提取海藻酸钠前一般都会对原料进行脱色处理,主要是通过在有机体系或水体系中长时间浸渍原料来脱除色素。侯振建等[24]采用次氯酸钠以及双氧水对海藻酸钠进行漂白。Sellimi等[25]在室温下将海带在丙酮-甲醇-氯仿混合溶液(体积比7 ∶6 ∶3)中浸泡24 h来脱除色素,最终提取得到了纯度较高的海藻酸钠。目前,实验室和工业提取中大多采用2%的甲醛水溶液来使海带中色素富集至表面而脱除色素[26-29]。然而,脱色处理过程中所使用溶剂的处理与排放会对环境造成危害,因此,Rioux等[30]和Lorbeer等[31]采用乙醇这类无害有机溶剂对原料进行预处理,去除了海带中的色素和蛋白质,提高了海藻酸钠产品的质量。
1.3 海藻酸钠的提取工艺
由于褐藻种类繁多,组成成分和性质各异,加大了海藻酸钠的提取难度,因此,海藻酸钠的提纯步骤相对繁琐。目前,国内外主要采用的是酸凝-酸化法、钙凝-酸化法、钙凝-离子交换法等传统工艺,近年来又出现了酶解法、超滤法等新工艺。
1.3.1 酸凝-酸化法 首先将原料用水洗净,去除其中的无机盐等水溶性杂质,晾干后再用甲醛浸泡固色。随后用去离子水洗涤,将其切成小块,用碳酸钠进行消化,该过程先将原料中不同形式的海藻酸盐统一转化为水溶性的海藻酸钠,反应方程式如下:
2M(Alg)n+nNaCO3→2nNaAlg+M2(CO3)n
M为Ca、Fe等金属离子,Alg代表海藻胶。消化后加去离子水稀释,过滤去除溶液中的颗粒,随后,缓慢加入稀酸将可溶性的海藻酸钠转化为絮状的海藻酸凝块,调节pH值至1~2,静置过夜,反应方程式如下:

之后,将沉淀分离得到的海藻酸洗涤后,加入一定量的NaCO3中和,静置4~6 h,使其完全转化生成海藻酸钠并进行分离提纯,反应方程式如下:
最后,通过醇沉、烘干、粉碎得到海藻酸钠成品[1],海藻酸钠结构见图1。

图1 海藻酸钠结构图Fig.1 Structure of sodium alginate
Fertah等[26]通过优化褐藻颗粒大小以及提取温度来提高海藻酸钠的得率,研究发现:当褐藻颗粒在 1 mm 以下且提取温度为 40 ℃ 时,得率最高能达到51.8%,制得海藻酸钠的β-D-甘露糖醛酸/α-L-古罗糖醛酸(M/G)(图1)为1.12,可用于制备柔软且有弹性的凝胶。同时,还发现由褐藻制得的海藻酸钠聚合电解质由于黏度较低可用于药物输送微粒以及纳米粒的生产。此外,研究表明酸凝-酸化法制得的海藻酸钠与商用的乳化剂一样具有良好的乳化性能以及优异的抗氧化性能,可用作食品的天然添加剂[25]。
然而,酸凝-酸化法还存在2个突出问题: 1)酸凝的沉降速度相当缓慢,需要8~12 h,而且胶状沉淀粒径非常小,难过滤[32]; 2)充分酸凝需要添加大量的酸使溶液的pH值降至3以下,生成的中间产物海藻酸在此条件下不稳定,易降解,而随后在加入大量碳酸钠中和剩余的酸时又会引起海藻酸钠的碱性降解,因此,最终所得海藻酸钠产品的收率低于其它提取方法,且纯度不高。
1.3.2 钙凝-酸化法 钙凝-酸化法是目前我国工业上常用的提取工艺,其原理与酸凝-酸化法基本相似,只是后面的凝固工序略有不同,即过滤后的消化液是在弱酸下加入一定量浓度的氯化钙溶液形成海藻酸钙沉淀;之后水洗去除沉淀物中残留的无机盐,酸化,将其转化为海藻酸凝块;再用碱液通过液相法或者固相法转化成海藻酸钠,最后经过滤、干燥、粉碎获得海藻酸钠成品。此提取工艺中钙析的速度较快,沉淀颗粒的粒径也比较大。
Gomez等[33]对比了3种不同的海藻酸钠制备方法,相比乙醇沉淀法和酸凝-酸化法,钙凝-酸化法制得的海藻酸钠纯度最高,流变性以及黏弹性也最好。Chee等[34]对钙凝-酸化法进行了改进,采用冷法和热法对4种不同的褐藻进行提取,结果表明:马尾藻类海藻对提取温度非常敏感,所得海藻酸钠的相对分子质量随着提取温度的升高而迅速降低,而其他种属的海藻则变化不明显。因此,可利用该特性制备出不同相对分子质量的海藻酸钠,以满足工业应用需求。
钙凝-酸化法跟酸凝-酸化法均采用酸液洗脱脱钙的方式,大量盐酸的加入使得生成的海藻酸结构很不稳定,极易降解,导致最终海藻酸钠的提取率低。另外,该方法还存在工艺繁琐、生产成本较高的问题[35-36]。
1.3.3 钙凝-离子交换法 该方法与钙凝-酸化法基本相同,不同之处是在钙凝之后采用了离子交换脱钙,即加入一定量的氯化钠来交换脱钙得到海藻酸钠。离子交换过程可用柱层析的方式完成,也可通过在间歇式反应釜中反应来实现。利用离子交换生成的海藻酸钠,由于盐析作用仍为絮状凝胶,经过滤、干燥、粉碎后即可得到成品的海藻酸钠。在脱钙过程中采用离子交换脱钙缩短了提取时间,产品收率明显提高,此外还避免了大量酸、碱的加入,避免了海藻酸钠的降解。然而,由于离子交换脱钙是可逆反应,为提高海藻酸钠的产量,需适当提高氯化钠溶液的浓度,另外,在离子交换前需用去离子水洗涤海藻酸钙胶块,以提高海藻酸钠的纯度。张善明等[37]在15~20 ℃下将海带消化,再通过离子交换脱钙制备了海藻酸钠,最终得率达22.6%,黏度大于 2 500 mPa·s,且每吨生产成本降低了1 800多元。此外,对海藻酸钠储存稳定性的测试表明:在40 ℃温水中储存6 d后其黏度仅下降了0.7%,远好于目前工业产品胶(下降率为10%~30%)。王孝华等[23]优化了钙凝-离子交换法的消化工艺,在3%的Na2CO3溶液中,50 ℃的消化温度下消化3 h,得到的海藻酸钠黏度高达 28 400 mPa·s,平均得率为42.6%。
1.3.4 酶解法 酶解法是近年来提取海藻酸钠的新工艺。该法与钙凝-酸化法基本相同,只是在消化步骤前采用纤维素酶溶液酶解原料的细胞壁,促进海藻胶的溶出以提高海藻酸钠得率[38]。杨红霞等[39]优化了酶解法提取海藻酸钠的工艺,得到最佳的酶解条件为:缓冲溶液55 mL,pH值5.0,反应温度45 ℃,时间18 h,纤维素酶用量为90FPU/g,在该条件下得率可达到50%左右。在此基础上,宋彦显等[38]采用正交试验法进一步考察了各影响因素与产率的关系,结果发现pH值对产率的影响最大。杜冰等[40]以纤维素酶提取法为对照,设计了用复合酶(褐藻酸裂解酶和纤维素酶)提取海藻酸钠的方法,结果显示当2种酶用量为2 ∶1时溶液黏度最大,且提取率最高;各项指标分析结果显示,由复合酶法提取的海藻酸钠色泽、品质良好,水分、灰分及水不溶物含量均较低,显示了复合酶法的优势。然而,由于酶解法提取海藻酸钠的成本高、能耗大、提取周期长且条件苛刻,目前尚未实现大规模工业生产。
1.3.5 超滤法 超滤法是将膜分离技术应用于海藻酸钠提取工艺中,以降低提取工艺的能耗、去除杂质,提高海藻酸钠产品质量。袁秋萍等[35]在酸凝-酸化法的基础上采用超滤法得到了海藻酸钠,其工艺流程与1.3.1节中酸凝-酸化法一致,只是在最后用碳酸钠中和得到海藻酸钠溶液后采用截留相对分子质量为3 000醋酸纤维素膜的超滤法将溶液中的海藻酸钠分离,随后再次采用醇沉得到海藻酸钠产品。实验结果发现:采用膜分离技术分离后可得到高纯度、较好色泽以及高黏度的海藻酸钠产品,尤其是黏度显著高于一般市售海藻酸钠,但是,由于海藻酸钠自身具有良好的增稠性和成膜性等特点,在使用膜分离技术时极易因膜通量衰减和分离特性的不可逆变化等而对超滤膜产生严重污染,影响了膜分离技术的可行性和经济成本[41]。为此,曾淦宁等[42]采用由聚丙烯腈(PAN)、季胺化的丙烯腈-甲基丙烯酸N,N-二甲基氨基乙酯共聚物(PAN-CO-DMAEMA)、二甲基甲酰胺(DMF)等混合溶液制备的荷电耐污染超滤膜来进行纯化,浓差极化和膜污染现象均得到改善,海藻酸钠得率从5.8%提高到9.8%。因此,荷电耐污染超滤技术在实现海藻酸钠大规模工业分离、提纯方面极具发展前景。
2 海藻酸钠的功能化改性
海藻酸钠结构中含有大量的羟基和羧基,是一个非常理想的化学功能化原料。通过对海藻酸钠结构中羟基和羧基的改性,使其溶解性、疏水性以及一些物理化学性能发生改变,形成海藻酸钠衍生功能化合物,可拓宽其应用领域。目前,对于海藻酸钠羟基以及羧基的改性主要有氧化、磺化、酯化、酰胺化和接枝共聚等。
2.1 羟基的化学改性
2.1.1 氧化 由于氧化后的海藻酸钠具有更多的活性基团并且能快速降解,可用于药物控制释放,因此,近年来海藻酸钠的氧化受到越来越多关注。
氧化工艺中海藻酸钠在高碘酸钠催化下,糖基单元上C2—C3断裂,对应的两个羟基氧化生成醛基(图2)。在这个氧化反应中海藻酸钠骨架上形成更大的转动自由度以及生成新的反应官能团,反应过程应避光以防止副反应发生,同时可以通过改变氧化剂的浓度来控制海藻酸钠的氧化度。
Gong等[16]在室温避光条件下采用不同浓度的高碘酸钠氧化海藻酸钠,反应4 h后得到氧化度不等的氧化海藻酸钠,由于六元环中C2—C3和六元环联结键(糖苷键)的断裂,使得氧化海藻酸钠链具有较好的柔性(图2),研究发现:氧化海藻酸钠溶液在中性条件下发生降解,通过动力学数据证明该降解符合一级动力学方程,同时随着氧化度的上升,氧化海藻酸钠的降解速率增加,这为控制海藻酸钠降解提供了理论基础。Dalheim等[43]采用丙醇作为游离基清除剂,将高碘酸钠加入海藻酸钠溶液后低温避光反应48~72 h制得氧化海藻酸钠,实验发现:获得的氧化海藻酸钠与缩氨酸等活性分子通过还原胺化交联得到取代度非常高并且取代位置单一的改性氧化海藻酸钠,且没有其他副产物,该反应路线可很好地替代传统的碳化二亚酰胺化学路线。此外,Dalheim等[43]还将生物活性肽替换缩氨酸与氧化海藻酸钠偶合交联得到具有生物活性的改性海藻酸钠活性肽。

图2 海藻酸钠的氧化
2.1.2 磺化 磺化海藻酸钠结构与肝素非常相似,因此具有很高的血液相容性,已在抗凝血疗法中应用了60多年[9]。Ma等[17]报道了在甲酰胺溶液中海藻酸钠与氯磺酸反应制备海藻酸钠磺酸酯(图3),工艺流程为: 将5 g海藻酸钠和10 g二环己基碳二亚胺(DCC)溶于硫酸/二甲基甲酰胺溶液中,室温下搅拌并反应2 h。反应终止后,除去沉淀物,再添加三倍的DCC形成二次沉淀;将二次沉淀物溶于 0.5 mol/L 的NaOH溶液中并静置30 min,随后再次过滤除去DCC-尿素沉淀物;最后将混合液透析并冻干得到海藻酸钠磺酸酯(SASs)。合成的SASs进行血液凝结时间、血小板黏附/活化、补体激活测试,研究表明:SASs具有极好的抗凝血作用,并且该作用与磺化度密切相关,同时SASs还能促进细胞生长以及增值扩散。因此,SASs在血液相关的临床方面具有非常好的应用前景。

图3 海藻酸钠的磺化
Pluemsab等[44]通过接枝共聚反应将α-环糊精引入到海藻酸钠长链上,得到的接枝产物具有良好的包络性,研究中为了活化六元环上的羟基,促进其与α-环糊精的耦合反应,先将海藻酸钠的羟基与溴化氰(CNBr)反应生成—OCN后,再进一步与α-环糊精反应(图5),合成流程为:将0.1 g的海藻酸钠溶于100 mL水,与60 mg的溴代腈反应1 h,反应期间通过加入NaOH调节pH值在 10~11 范围内。随后用超滤膜过滤,筛选相对分子质量1 000以上的CN—改性的海藻酸钠。将其与6-氨基-α-环糊精反应2d后便得到环糊精与海藻酸钠的接枝化合物,在氯化钙溶液中滴加接枝化合物,发现海藻酸钙凝胶球非常稳定,并且包络性非常好。这种合成材料可作为细菌包络应用于环境修复领域。

图4 海藻酸钠的聚合反应

图5 α-环糊海藻酸钠的合成
2.2 羧基的化学改性
2.2.1 酯化 酯化反应是一种将烷基连接在分子上的最常见的反应。很多研究者已采用该方法成功将海藻酸钠酯化,用来提高其疏水性[19, 45-47]。天然海藻酸钠在催化剂条件下可直接与醇发生酯化,为了提高海藻酸酯化率,醇必须过量(图6)。在过去几十年中,已工业化的海藻酸酯只有海藻酸丙烯乙二醇酯。

图6 海藻酸钠的酯化反应Fig.6 Esterification of alginate and alcohol
近年来,Yang等[47]成功合成了一类新型无毒疏水性大分子海藻酸十二醇酯,合成工艺是将部分质子化的海藻酸钠溶解于混有对甲苯磺酸的甲酸/二甲基酰胺混合液中,在恒温55 ℃下搅拌30 min后,在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐催化作用下与十二醇反应,最终生成海藻酸十二醇酯。
Amri等[45]为了提高海藻酸钠的生物兼容性,促进其在生物医药方面的应用,将海藻酸钠与聚乙烯醇在40 ℃下酸催化酯化1 h制备了海藻酸钠聚乙烯醇酯(PVA-Alg)。研究表明:PVA-Alg的拉伸强度比纯海藻酸钠高,其疏水性也有一定程度的提高,而对钙离子的吸附有所降低;与纯海藻酸钠膜相比,改性后的PVA-Alg膜具有更好的血小板黏附以及更低的蛋白吸附,对于尿素以及肌酸酐具有极好的透析作用,能清除50%尿素和45%肌酸酐。因此,该海藻酸酯可替代醋酸纤维素用于血液透析。
Yang等[48]成功合成了一类新型水溶性两亲性海藻酸胆固醇酯,将质子化海藻酸钠上的羧酸与胆固醇上的羟基在偶联剂(N,N′-二环己基碳酰亚胺)和催化剂[4-(N,N-二甲基氨基)吡啶的作用下反应24 h。研究结果表明:由于其分子内以及分子间的疏水作用,海藻酸胆固醇酯能够自组装成更稳定、致密的纳米聚合物。
此外,还有文献报道海藻酸钠可与卤代烷烃酯化生成海藻酸酯[46],过程是先将羧酸根离子质子化,再与四丁铵反应生成相应的海藻酸四丁铵盐,最后在二甲基亚砜等有机体系中与卤代烷烃酯化,最终得到海藻酸酯(图7)。这类海藻酸酯在有机体系中溶解度较高,有利于药物固体分散传输体系的设计。另外,该海藻酸酯在非凝胶金属阳离子溶液或者钙螯合剂试剂中非常稳定。
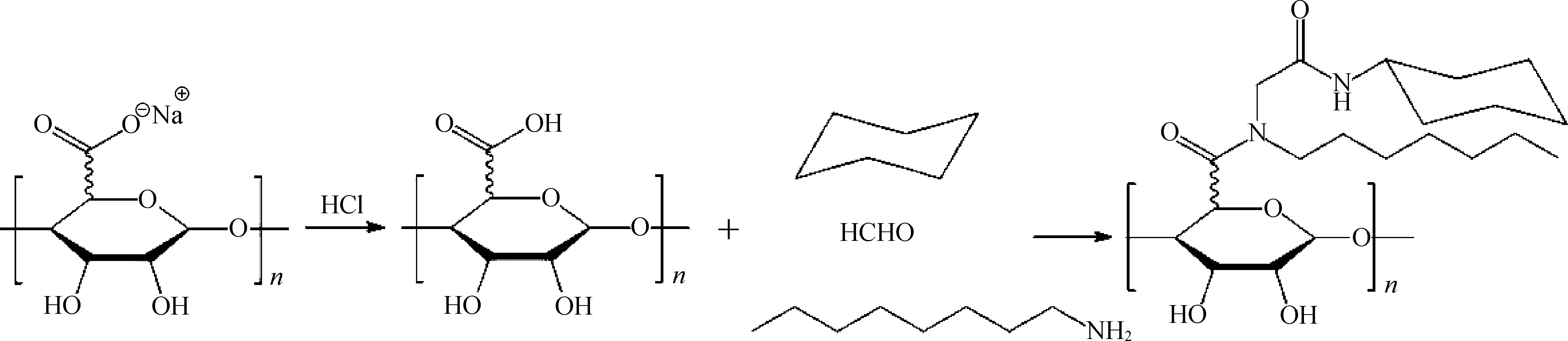
图7 海藻酸钠与溴代烷烃的酯化反应
2.2.2 乌吉反应 在有机化学中,乌吉(Ugi)反应是由1 mol醛或酮、1 mol胺、1 mol异腈以及1 mol羧酸缩合生成α-酰胺基酰胺的多组分反应[49]。由于总反应只生成副产物1 mol水,且反应产率一般较高,具有较高的原子经济性,因此在组合化学中是一类重要的化学反应。近年来,大量研究报道了通过乌吉多组分缩合反应来制备疏水性海藻酸钠(图8)[14, 50-53],反应过程为:将小分子海藻酸钠溶解于水中,搅拌过夜得到均相溶液;再将溶液pH值调节至3.6,达到乌吉反应的条件[51],将辛胺、环己基异腈和甲醛加入到溶液中,在温室下搅拌24 h得到均相组分;最后透析去除未反应的单体以及小分子片段得到改性的疏水性海藻酸钠。合成的Ugi-海藻酸钠具有良好的动力学性能、流变性能以及表面活性,同时并未改变海藻酸钠的生物兼容性,这些性能使得乌吉反应合成的疏水性海藻酸钠在药物缓释以及细胞组织工程学方面具有潜在的应用。
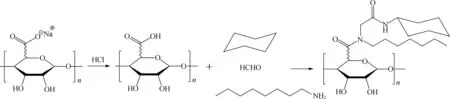
图8 海藻酸钠的乌吉反应
2.2.3 酰胺化 Chen等[53]采用1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC-HCl)偶联剂对海藻酸钠进行疏水改性,合成了酰胺海藻酸钠(图9)。通过引入酰胺键对海藻酸钠进行修饰在其他文献中也有报道[54-56]。酰胺化反应过程大致如下:通过加入HCl调节海藻酸钠溶液pH值至3.4,随后添加适量EDC-HCl,反应10 min后,加入辛胺并室温反应24 h,将反应后混合液醇沉,并透析、冻干后转化为目标产物。

图9 海藻酸钠的胺化Fig.9 Amidation of alginate
Abu-Rabeah等[9]采用了相同的方法将N-(3-氨基丙基)吡咯与海藻酸钠偶联形成酰胺键,研究发现:取代度在30%以上时,吡咯-海藻酸钠复合物能有效的进行电聚合,可作为具有生物相容性的主体基质,并通过凝胶化和电化学交联在基质中保留酶分子,在生物传感器以及生物反应容器领域具有潜在的应用前景。
3 结语与展望
海藻酸钠作为一种海洋中大量存在的可再生资源,基于其结构、性质的特殊性,在药物输送、组织工程等领域有广阔的潜在应用价值。尽管海藻酸钠提取及功能化利用的技术路线已经取得了可喜的进展,但仍面临着诸多问题: 提取工艺繁杂、生产成本高、降解严重、平均收率普遍较低、产品的黏度和色泽等质量指标欠佳。因此,深入了解海藻酸钠在提取过程中的反应机制以及降解机理,对海藻酸钠的精炼以及提取工艺的简化具有理论指导意义。
尽管海藻酸钠的化学功能改性已经受到越来越多的关注,然而只有很少一部分实现了工业化应用,主要原因在于:海藻酸钠在有机体系下几乎不溶;海藻酸钠在过酸、过碱、还原以及高温条件下极易发生降解,造成产品相对分子质量不均一;改性试剂对海藻酸钠结构中—OH和—COOH的化学选择性以及对M片段或者G片段上C2、C3位上—OH区域选择性较差。
针对当前研究进展以及上述问题,根据改性试剂修饰、改性过程设计的理念,结合海藻酸钠自身的结构特点,采用分子设计等手段开发新型海藻酸钠溶剂有机体系,以及通过对反应介质、改性剂等因素的选择实现海藻酸钠官能团的定向功能化改性,将是海藻酸钠高效综合利用技术的重要发展方向。此外,对海藻酸钠中化学键合方式及其演变规律、特征化学键的活化与断裂方式的阐述,并由此获得改性机理、动力学行为的研究将是未来海藻酸钠工业改性研究的重要方向之一。
[1]王孝华. 海藻酸钠的提取及应用研究[D]. 重庆: 重庆大学硕士学位论文,2004. WANG X H.Study on extraction and application of sodium alginate[D].Chongqing: Master Degree Thesis of Chongqing University, 2004.
[2]ABBAR S, AMOAH B, SCHILLING M W, et al. Efficacy of selected food: Safe compounds to prevent infestation of the ham mite, tyrophagus putrescentiae (Schrank)(Acarina∶Acaridae), on southern dry-cured hams[J]. Pest Management Science,2016,72(8):1604-1612.
[3]KIRDPONPATTARA S, PHISALAPHONG M. Bacterial cellulose-alginate composite sponge as a yeast cell carrier for ethanol production[J]. Biochemical Engineering Journal,2013,77:103-109.
[4]AHMADI A, MOGHADAMTOUSI S Z, ABUBAKAR S, et al. Antiviral potential of algae polysaccharides isolated from marine sources: A review[J/OL]. BioMed Research Internationd, 2015, 2015: 1-10[2015- 06-15]http:∥dx.doi.org/10.1155/2015/825203.
[5]GRASDALEN H, LARSEN B, SMISROD O.13C NMR studies of monomeric composition and sequence in alginate[J]. Carbohydrate Research,1981,89(2):179-191.
[6]SIDDHANTA A K, SANANDIYA N D, CHEJARA D R, et al. Functional modification mediated value addition of seaweed polysaccharides: A perspective[J]. RSC Advances,2015,5(73):59226-59239.
[7]KHAN F, AHMAD S R. Polysaccharides and their derivatives for versatile tissue engineering application[J]. Macromol Biosci,2013,13(4):395-421.
[8]TURCO G, DONATI I, GRASSI M, et al. Mechanical spectroscopy and relaxometry on alginate hydrogels: A comparative analysis for structural characterization and network mesh size determination[J]. Biomacromolecules,2011,12(4):1272-1282.
[9]ABU-RABEAH K, POLYAK B, IONESCU R E, et al. Synthesis and characterization of a pyrrole:Alginate conjugate and its application in a biosensor construction[J]. Biomacromolecules,2005,6(6):3313-3318.
[10]MATSUMOTO T, KAWAI M, MASUDA T. Influence of concentration and mannuronate/guluronate ratio on steady flow properties of alginate aqueous systems[J]. Biorheology,1992,29(4):411-417.
[11]PAWAR S N, EDGAR K J. Alginate derivatization: A review of chemistry, properties and applications[J]. Biomaterials,2012,33(11):3279-3305.
[12]YANG J, ZHAO J, FANG Y. Calorimetric studies of the interaction between sodium alginate and sodium dodecyl sulfate in dilute solutions at different pH values[J]. Carbohydrate Research,2008,343(4):719-725.
[13]KANG H A, JEON G J, LEE M Y, et al. Effectiveness test of alginate-derived polymeric surfactants[J]. Journal of Chemical Technology & Biotechnology,2002,77(2):205-210.
[14]YANG J S, XIE Y J, HE W. Research progress on chemical modification of alginate: A review[J]. Carbohydrate polymers,2011,84(1):33-39.
[15]BORGOGNA M, SKJÅK BRK G, PAOLETTI S, et al. On the initial binding of alginate by calcium ions: The tilted egg-box hypothesis[J]. Journal of Physical Chemistry B,2013,117(24):7277-7282.
[16]GONG Y, HAN G T, ZHANG Y M, et al. Research on the degradation performance of the lotus nanofibers-alginate porous materials[J]. Polymer Degradation & Stability,2015,118(1):104-110.
[17]MA L, CHENG C, NIE C X, et al. Anticoagulant sodium alginate sulfates and their mussel-inspired heparin-mimetic coatings[J]. Journal Materials Chemistry B,2016,4(19):3203-3215.
[19]NILSEN-NYGAARD J, HATTREM M N, DRAGET K I. Propylene glycol alginate (PGA) gelled foams: A systematic study of surface activity and gelling properties as a function of degree of esterification[J]. Food Hydrocolloids,2016,57:80-91.
[20]席国喜,田圣军,成庆堂,等. 海藻酸钠的热分解研究[J]. 化学世界,2000,41(5):254-258. XI G X, TIAN S J, CHENG Q T, et al. Study on pyrolysis of sodium alginate[J]. Chemical World,2000,41(5):254-258.
[21]马成浩,彭奇均.海藻酸钠生产工艺降解情况研究[J].中国食品添加剂,2004,2:17-19. MA C H, PENG Q J. The degradation of sodium alginate in producing procedure[J]. China Food Additives,2004,2:17-19.
[22]寇伟蛟,刘军海. 海藻酸钠提取工艺的研究进展[J]. 化工科技市场,2009,32(3):14-16. KOU W J, LIU J H. Progress in extraction technology of sodium alginate[J]. Chemical Technology Market,2009,32(3):14-16.
[23]王孝华. 海藻酸钠的提取及应用[J]. 重庆工学院学报:自然科学版,2007,21(9):124-128. WANG X H. Extraction and application of sodium alginate[J]. Journal of Chongqing Institute of Technology :Natural Science Edition,2007,21(9):124-128.
[24]侯振建,王峰,刘婉乔. 马尾藻海藻酸钠漂白的研究[J]. 海洋科学,2001,25(5):10-11. HOU Z J, WANG F, LIU W Q. Studies on the bleach of alginate extracted from Sargassum[J]. Ocean World,2001,25(5):10-11.
[25]SELLIMI S, YOUNES I, AYED H B, et al. Structural, physicochemical and antioxidant properties of sodium alginate isolated from a Tunisian brown seaweed[J]. International journal of biological macromolecules,2015,72:1358-1367.
[26]FERTAH M, BELFKIRA A, DAHMANE E M, et al. Extraction and characterization of sodium alginate from MoroccanLaminariadigitatabrown seaweed[J/OL]. Arabian Journal of Chemistry, 2014:S3707-S3714[2014- 05-17] http://dx.doi.org/10.1016/j.arabjc.2014.05.003.
[27]FENORADOSOA T A, ALI G, DELATTRE C, et al. Extraction and characterization of an alginate from the brown seaweedSargassumturbinarioidesGrunow[J]. Journal of Applied Phycology,2010,22(22):131-137.
[28]CAMACHO O, HERNNDEZ-CARMONA G. Phenology and alginates of twoSargassumspecies from the Caribbean coast of Colombia[J]. Ciencias Marinas,2012,38(2):381-393.
[29]EL ATOUANI S, BENTISS F, REANI A, et al. The invasive brown seaweed Sargassum muticum as new resource for alginate in Morocco: Spectroscopic and rheological characterization[J]. Phycological Research,2016,64(3):185-193.
[30]RIOUX L E, TURGEON S L, BEAULIEU M. Characterization of polysaccharides extracted from brown seaweeds[J]. Carbohydrate Polymers,2007,69(3):530-537.
[31]LORBEER A J, LAHNSTEIN J, BULONE V, et al. Multiple-response optimization of the acidic treatment of the brown algaEckloniaradiatafor the sequential extraction of fucoidan and alginate[J]. Bioresource Technology,2015,197:302-309.
[32]陈瑶君. 食品添加剂[J]. 中国食品卫生杂志,2006,18(1):93-95. CHEN Y J. Food additives[J]. Chinese Journal of Food Hygiene,2006,18(1):93-95.
[33]GOMEZ C G, LAMBRECHT M V P, LOZANO J E, et al. Influence of the extraction-purification conditions on final properties of alginates obtained from brown algae (Macrocystispyrifera)[J]. International Journal of Biological Macromolecules,2009,44(4):365-371.
[34]CHEE S Y, WONG P K, WONG C L. Extraction and characterisation of alginate from brown seaweeds (Fucales, Phaeophyceae) collected from Port Dickson, Peninsular Malaysia[J]. Journal of Applied Phycology,2011,23(2):191-196.
[35]袁秋萍,朱小兰. 海藻酸钠提取新工艺研究[J]. 食品研究与开发,2005,26(5):98-100. YUAN Q P, ZHU X L. Study on extraction technology of sodium alginate[J]. Food Research and Development, 2005, 26(5): 98-100.
[36]高晓玲,廖映枌. 从海藻中提取海藻酸钠条件的研究[J]. 四川教育学院学报,1999,(增刊2):104-105. GAO X L, LIAO Y F. Study on extraction of sodium alginate[ J]. Journal of Sichuan College of Education, 1999 (Z2): 104-105.
[37]张善明,刘强,张善垒. 从海带中提取高粘度海藻酸钠[J]. 食品工业科技,2002,86(3):86-87. ZHANG S M, LIU Q, ZHANG S L. Extraction of sodium alginate from kelp[J]. Science and Technology of Food Industry, 2002, 86(3): 86-87.
[38]宋彦显,闵玉涛,张秦,等. 海带中海藻酸钠的提取及纯化工艺优化[J]. 食品科技,2015,40(6):289-293. SONG Y X, MIN Y T, ZHANG Q, et al. Extraction and purifi cation technology optimization of sodium alginate fromLaminariajaponica[J]. Food Science and Technology, 2015, 40(6): 289-293.
[39]杨红霞,李博,窦明. 酶解法提取海藻酸钠研究[J]. 安徽农业科学,2007,35(12):3661-3662. YANG H X, LI B, DOU M. Research on the technological process of calcium alginate extraction[J]. Journal of Anhui Agricultural Sciences,2007,35(12):3661-3662.
[40]杜冰,郑来久. 褐藻降解菌群筛选及其复合酶固定化研究[J]. 工业微生物,2013,43(6):39-42. DU B, ZHENG L J. Study on screening in alginate degradation flora and immobilization of composite enzyme[J]. Industrial Microbiology,2013,43(6):39-42.
[41]吴春金,李磊,焦真,等. 耐污染超滤膜的研究进展及其在环境工程中的应用展望[J]. 水处理技术,2007,33(7):1-5. WU C J, LI L, JIAO Z, et al. Progress in reseatches on fouling resistance UF membrane and its application in environmental engineering[J]. Technology of Water Treatment,2007,33(7):1-5.
[42]曾淦宁,沈江南,洪凯,等. 荷电耐污染超滤膜分离、纯化海藻酸钠的研究[J]. 海洋通报,2010,29(1):96-100. ZENG G N, SHEN J N, HONG K, et al. Separation and purification of sodium alginate by using charged fouling resistance ultra filtration membrane[J]. Marine Science Bulletin,2010,29(1):96-100.
[43]DALHEIM M Ø, VANACKER J, NAJMI M A, et al. Efficient functionalization of alginate biomaterials[J]. Biomaterials,2016,80:146-156.
[44]PLUEMSAB W, SAKAIRI N, FURUIKE T. Synthesis and inclusion property ofα-cyclodextrin-linked alginate[J]. Polymer,2005,46(23):9778-9883.
[45]AMRI C, MUDASIR M, SISWANTA D, et al.Invitrohemocompatibility of PVA-alginate ester as a candidate for hemodialysis membrane[J]. International Journal of Biological Macromolecules,2015,82:48-53.
[46]PAWAR S N, EDGAR K J. Alginate esters via chemoselective carboxyl group modification[J]. Carbohydrate Polymers,2013,98(2):1288-1296.
[47]YANG J, HE W. Synthesis of lauryl grafted sodium alginate and optimization of the reaction conditions[J]. International Journal of Biological Macromolecules,2012,50(2):428-431.
[48]YANG L, ZHANG B, WEN L, et al. Amphiphilic cholesteryl grafted sodium alginate derivative: Synthesis and self-assembly in aqueous solution[J]. Carbohydrate Polymers,2007,68(2):218-225.
[49]UGI D I. Theα-addition of immonium ions and anions to isonitriles accompanied by secondary reactions[J]. Angewandte Chemie International Edition,1962,1(1):8-21.
[50]YAN H Q, CHEN X Q, LI J C, et al. Synthesis of amidic alginate derivatives modified silica nanoparticles via Ugi multicomponent reaction[J]. Chemical Journal Chinese Universities,2016,37(5):1018-1024.
[51]SEHLINGER A, OCHSENREITHER K, BARTNICK N, et al. Potentially biocompatible polyacrylamides derived by the Ugi four-component reaction[J]. European Polymer Journal,2015,65:313-324.
[52]SEHLINGER A, MEIER M A R. Passerini and Ugi Multicomponent Reactions in Polymer Science[M]∥THEATO P. Multi-Component and Sequential Reactions in Polymer Synthesis. Berlin: Springer-Verlag Berlin,2015:61-86.
[53]CHEN X Q, YAN H Q, SUN W, et al. Synthesis of amphiphilic alginate derivatives and electrospinning blend nanofibers: A novel hydrophobic drug carrier[J]. Polymer Bulletin,2015,72(12):3097-3117.
[54]HU W T, LI J C, HOU H W, et al. Preparation and characterization of hydrophobic alginate derivative nanocapsules entrapping lambda-cyhalothrin[J]. Asian Journal of Chemistry,2013,25(17):9904-9908.
[55]BARTHELEMY B, DEVILLERS S, FONDER G, et al. Chitosan and alginate layer-by-layer assembly on phynox (Co-Cr alloy) surface modified by alkyl carboxy licam monium phosphonate derivatives[J]. Journal of the Electrochemical Society,2013,160(11):H820-H828.
[56]SCHLEEH T, MADAU M, ROESSNER D. Two competing reactions of tetrabutylammonium alginate in organic solvents: Amidation versus gamma-lactone synthesis[J]. Carbohydrate Polymers,2016,138(4):244-251.
Research Advances in Extraction and Functionalization of the Sodium Alginate
HUANG Panli1, SHEN Xiaojun1, CHEN Jinghuan1,2, WU Yuying1, SUN Runcang1
(1.Beijing Key Laboratory of Lignocellulosic Chemistry, Beijing Forestry University, Beijing 100083, China; 2.China NationalPulp and Paper Research Institute National Engineering Lab. for Pulp and Paper, Beijing 100102, China)
Sodium alginate as a natural polymer has been widely used in various research fields. This paper reviewed systematically recent advances in several extraction technologies in sodium alginate, mainly including acid coagulation-acidification, calcium coagulation-acidification, calcium coagulation-ion exchange, enzymolysis, ultrafiltration. The advantages and shortcomings of these techniques were comparatively analyzed. On this basis, the functionalization of hydroxyl group and carboxyl group in sodium alginate were summarized, and the potential application of sodium alginate derivative was also discussed. Furthermore, we present the suggestions and outlooks concerning on the further development directions towards key researches based on the existing problems in the current extraction and functionalization of sodium alginate.
sodium alginate; extraction; functionalization; application
2016- 10- 24
国家自然科学基金重点项目资助 (31430092)
黄攀丽 (1992— ), 女, 浙江绍兴人,硕士生,主要从事生物质海藻酸钠提取及其高值化利用研究工作
*通讯作者:孙润仓,教授,博士生导师,研究领域为生物质炼制及转化为材料、新能源和化学品;E-mail: rcsun3@bjfu.edu.cn。
10.3969/j.issn.0253-2417.2017.04.002
TQ929;P745;Q539
A
0253-2417(2017)04-0013-10
黄攀丽,沈晓骏,陈京环,等.海藻酸钠的提取与功能化改性研究进展[J].林产化学与工业,2017,37(4):13-22.
