异海松基水杨酰腙的合成及细胞毒性评价
2017-09-15刘娟娟卢言菊陈玉湘赵振东
刘娟娟, 卢言菊,2, 陈玉湘,2, 赵振东,2*
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京100091)
异海松基水杨酰腙的合成及细胞毒性评价

LIU Juanjuan
刘娟娟1, 卢言菊1,2, 陈玉湘1,2, 赵振东1,2*
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京100091)
以水杨醛和异海松酸为原料,合成了异海松基水杨酰腙,通过IR,1H NMR和HR-TOF-MS对产物结构进行了鉴定,采用噻唑蓝(MTT)比色法研究了目标化合物对癌细胞及正常细胞的细胞毒性,并进一步对比了其与阳性药物紫杉醇的细胞毒性。结果表明:异海松基水杨酰腙对人体肝癌细胞HepG-2和前列腺癌细胞PC-3具有显著的细胞毒性,半数抑制浓度(IC50)值分别为6.50和9.25 μmol/L,高于或接近于对照物紫杉醇(IC5012.14和6.48 μmol/L)的细胞毒性,同时异海松基水杨酰腙对人体正常的肝细胞L-02具有较低的细胞毒性,IC50值为68.01 μmol/L,远远低于对照品紫杉醇(IC504.02 μmol/L)。抑制率和细胞形态变化分析表明,异海松基水杨酰腙对细胞增殖的抑制活性与剂量有关。
酰腙;异海松酸;异海松基水杨酰腙;细胞毒性
酰腙类化合物是一类特殊的席夫碱类化合物,具有较强的配位能力和多样的配位方式,广泛用于催化、生化反应、分析试剂和螯合剂等方面。此外,酰腙类化合物因含有氮和氧原子,与生物环境接近,具有良好的抑菌[1]、抗癌[2-3]、抗病毒[4]、抗炎[5]和降压[6]等生物活性,在医药和农药领域备受关注。关于水杨酰腙衍生物的生物活性研究报道较多,如邻羧基苯甲醛水杨酰腙对大肠杆菌具有良好的抑菌活性[7]; 4-羟基-3-羧基苯甲醛水杨酰腙对金黄色葡萄球菌、大肠埃希菌和枯草芽孢菌的生长具有抑制作用[8]。水杨酰腙化合物也极易与金属配位形成配合物,形成的配合物大多也具有良好的生物活性,如呋喃甲醛水杨酰腙稀土配合物对辣椒疫霉菌和烟草赤星菌有明显的抑制活性[9];铜(Ⅱ)与2-羰基丙酸水杨酰腙的配合物对辣椒疫霉菌具有100%的抑制作用,对烟草赤星菌有66%的抑制作用[10]。此类酰腙化合物是医药和农药领域极具潜力的生物活性药物。近年来,将酰腙结构引入到天然产物中来,开发新型、广谱、高效、环保的生物活性制品引起了研究者们的极大兴趣,相关的研究报道包括:根皮素异烟酰腙化合物表现出显著的抗氧化活性[11],骆驼蓬碱和去氢骆驼蓬碱类酰腙衍生物大多具有良好的抗烟草花叶病毒(TMV)活性[12],蒎酸酰腙衍生物具有除草活性[13],马来松香酸酰腙化合物对多种植物病原菌具有显著的抑制活性[14],去氢枞酸羧基改性的酰腙衍生物对金黄色葡萄球菌和大肠杆菌等表现出明显的抑制活性[15]等等。本研究将天然松香中的一种重要的海松酸型树脂酸——异海松酸,与水杨醛反应合成了异海松基水杨酰腙,并对它的细胞毒性进行了探讨,为研究开发新的抗癌药物提供基础数据。
1 实 验
1.1 试剂与仪器
异海松酸,根据文献[16]方法自制;其他药品和试剂均为市售化学纯和分析纯。人体肝癌细胞(HepG-2), 前列腺癌细胞(PC-3)和人体正常肝细胞(L-02),紫杉醇,南京凯基生物有限公司。
Nicolet IS10傅里叶变换红外光谱仪,美国尼高力公司;WRS-1B型数字熔点仪(使用前温度未经校正),上海申光仪器仪表有限公司;Bruker AV-300核磁共振波谱仪,美国Bruker公司;Agilent 6520 Accurate-Mass Q-TOF LC/MS质谱仪,美国Agilent公司;SW-CJ-1FD超净工作台,苏州净化设备有限公司;XD-101型CO2培养箱,日本SANYO公司;IX51生物倒置显微镜,日本OLYMPUS公司。
1.2 异海松基水杨酰腙的合成
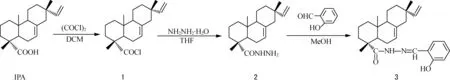
1.2.1 异海松酰氯(1)的合成 在50 mL的三口烧瓶中加入1 g (3.3 mmol) 异海松酸(IPA)和5 mL 无水二氯甲烷,搅拌溶解。在N2保护下,向上述溶液中逐滴滴加0.34 mL(3.96 mmol)草酰氯和5 mL二氯甲烷(DCM)的混合溶液,滴加完毕后常温反应3 h。反应结束后,减压蒸除溶剂和过量的草酰氯,得到淡黄色的异海松酰氯(1)。
1.2.2 异海松酰肼(2)的合成 将异海松酰氯(1)溶于5 mL四氢呋喃(THF)中,冰浴下缓慢滴加到含有0.18 mL(3 mmol)85 % 水合肼、0.5 mL(3.6 mmol)三乙胺和10 mL四氢呋喃的混合溶液中,滴加完毕,常温反应2 h,TLC监测反应进程。反应结束,过滤除去沉淀,滤液用去离子水洗涤3次,每次 20 mL,收集有机层,减压除去溶剂,粗品用乙醇重结晶,得到白色固体异海松基酰肼(2),得率76.2 %,熔点210.6~212.7 ℃。
1.2.3 异海松基水杨酰腙(3)的合成 0.95 g(3 mmol)异海松酰肼和0.32 mL(3 mmol)水杨醛在20 mL无水甲醇中,回流反应,TLC跟踪反应。结束反应后,将反应液冷却到室温,减压蒸除部分溶剂析出白色针状结晶,粗品用甲醇重结晶,得白色针状的异海松基水杨酰腙(3)。
合成反应途径如下:
1.3 细胞毒性测试
采用噻唑蓝(MTT)比色法[17]对异海松基水杨酰腙的细胞毒性进行测试,并以紫杉醇为阳性对照。取对数生长期的人体癌细胞(HepG-2和PC-3)和人体正常肝细胞(L- 02)悬浮于含10%牛血清、10 mg/L青霉素和10 mg/L链霉素的细胞培养基(RPMI-1640)培养液中,接种于96孔板中,每孔大约 3×104个细胞,于37 ℃,5% CO2下培养24 h后,分别加入不同浓度的供试化合物,各组设平行的3孔,同时设阴性对照组(生理盐水)和阳性对照组(紫杉醇)。加药后,96孔板继续置于二氧化碳培养箱中培养48 h,然后每孔加入20 μL MTT(5 g/L)液进行染色,在培养箱中继续培养4 h。弃去上清液,每孔加入150 μL二甲亚砜(DMSO),摇匀后,择定每孔在490 nm处的吸光度(OD)值,按如下公式计算生长抑制率:抑制率=(1-实验组OD/阴性对照组OD)× 100%。然后以各药物浓度对数值对各种浓度下的抑制率做线性回归曲线,从所得剂量-效应方程计算出供试化合物对实验细胞的半数抑制浓度(IC50)。
1.4 细胞形态观察
待测HepG-2细胞经1.3节步骤中常规消化、传代,给药接种培养48 h后,置于倒置显微镜下放大100倍观察细胞形态变化,并拍照。
2 结果与讨论
2.1 异海松基水杨酰腙的结构表征


2.2 对癌细胞及正常细胞增殖的抑制率分析
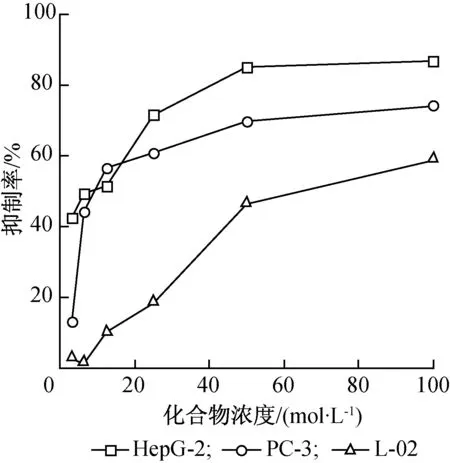
图1 异海松基水杨酰腙对细胞增殖的抑制率Fig.1 Inhibitory rates of isopimaric-based salicylhydrazoneagainst human cancer and normal cells
考察了异海松基水杨酰腙(3)在3.13、 6.25、 12.50、 25.00、 50.00和100.00 μmol/L浓度下对两种人体癌细胞(HepG-2和PC-3)和一种人体正常肝细胞(L-02)的抑制率,结果见图1。由图1可知,增殖抑制率随着药物浓度的增大而增强,且在3.13~50.00 μmol/L浓度范围内,随着浓度增大,药物对细胞增殖抑制率增加的速度也较大,从50.00到100.00 μmol/L时,药物对细胞增殖的抑制率变化较小,逐渐趋于平缓,说明异海松基水杨酰腙以剂量依赖的方式抑制细胞的增殖。由图1还可以看出,化合物3对两种癌细胞的增殖抑制率明显大于对正常细胞的增值抑制率,这说明化合物3对癌细胞具有显著的毒性,而对正常细胞具有较低的毒性,也说明了化合物3对癌细胞具有更好的选择性。对比化合物3对HepG-2和PC-3 细胞的增值抑制率可知,化合物3对HepG-2细胞的抑制作用更强。
2.3 细胞形态变化分析
HepG-2细胞经异海松基水杨酰腙(3)处理48 h后,在倒置显微镜下进行细胞形态学观察,如图2所示。对照组细胞形态呈现较规则的形状,细胞排列密集连成片呈增殖状态(图2(a))。药物处理后的细胞随着给药浓度的增大,细胞形态萎缩变形的程度也逐渐增大,给药量6.25 μmol/L时,细胞数量和密度略微减少和降低,细胞形态不一,出现少部分长条形细胞(图2(b));在给药量12.25 μmol/L时,细胞数量明显减少,密度也明显降低,长条形细胞明显增多(图2(c));给药量25.00 μmol/L时,细胞密度更小,细胞之间空隙更大,基本看不到完整的细胞形态,绝大多数细胞裂解为碎片,产生凋亡小体(图2(d))。由此,也说明化合物3以剂量依赖的方式抑制细胞的增殖。

图2 不同给药浓度下HepG-2细胞形态的变化
2.4 对癌细胞及正常细胞的IC50值
异海松基水杨酰腙(3)对癌细胞及正常细胞的抑制率测试结果表明该化合物具有非常大的应用价值,因此对比了其与紫杉醇对实验细胞的IC50值,结果见表1。IC50值越大,说明化合物对细胞的毒性越

表1 异海松基水杨酰腙对HepG-2、PC-3和L-02的IC50值
小;IC50值越小,则说明化合物对细胞的毒性越大。由表1可知,异海松基水杨酰腙对HepG-2、PC-3和L-02细胞的IC50值分别为6.50、9.25和68.01 μmol/L,也证实了上述对细胞抑制率的分析结果,即异海松基水杨酰腙对癌细胞具有更强的细胞毒性,对正常细胞的毒性较小。另外,异海松基水杨酰腙对HepG-2癌细胞的IC50值低于紫杉醇的IC50值(12.14 μmol/L),说明异海松基水杨酰腙对HepG-2细胞的抗癌活性高于紫杉醇的抗癌活性;而异海松基水杨酰腙对PC-3癌细胞的IC50值略高于紫杉醇的IC50值(6.48 μmol/L),说明异海松基水杨酰腙对PC-3细胞的抗癌活性略低于紫杉醇,但已经很接近紫杉醇了。从表1中也发现,紫杉醇对正常细胞L-02的细胞毒性远远高于异海松基水杨酰腙对L-02的细胞毒性(约45倍)。据此分析,可以适当提高异海松基水杨酰腙的用量约1.5倍于紫杉醇的量则就可以达到紫杉醇对PC-3的抑制效果,且不至于对正常细胞造成很大毒性。综上分析,异海松基水杨酰腙是一种非常有潜力的抗癌药物。
3 结 论
3.1 以异海松酸和水杨醛为原料,合成了异海松基水杨酰腙(3),并通过IR、1H NMR和HRMS鉴定结构,确定合成了目标产物。
3.2 采用噻唑蓝(MTT)比色法对比了化合物3对人体癌细胞HepG-2和PC-3及人体正常细胞L- 02增殖的抑制作用。随着浓度增大,化合物3对细胞的增值抑制率变大,表明化合物的细胞毒性与其剂量有关;利用倒置显微镜对不同给药量下细胞的形态变化进行了观察,细胞萎缩变形程度随给药量增大而增大,也表明了化合物3对细胞的抑制作用与其剂量有关。
3.3 通过对化合物3抑制细胞增殖的半数抑制浓度(IC50)值的分析表明:化合物3对两种癌细胞HepG-2和PC-3都表现出显著的抑制活性,IC50分别为6.50和9.25 μmol/L,对HepG-2的IC50高于对照物紫杉醇(IC5012.14 μmol/L),对PC-3的IC50接近于紫杉醇(IC506.48 μmol/L);而对正常细胞L-02具有较低的细胞毒性,表明3是一种具有应用前景的抗癌候选化合物。
[1]叶英,赵志刚,刘兴利,等. 吲哚-6-酰腙类化合物的微波合成及其抗菌活性研究[J]. 有机化学,2009,29(6):993-997. YE Y, ZHAO Z G, LIU X L, et al. Microwave-assisted synthesis of indole-6-acylhydrazone and their antibacterial activities[J]. Chinese Journal of Organic Chemistry,2009,29(6):993-997.
[2]YE X P, ZHU T F, WU W N, et al. Syntheses, characterizations and biological activities of two Cu(Ⅱ) complexes with acylhydrazone ligand bearing pyrrole unit[J]. Inorganic Chemistry Communications,2014,47:60-62.
[3]XING M, ZHAO T T, REN Y J, et al. Synthesis, biological evaluation, and molecular docking studies of pyrazolyl-acylhydrazone derivatives as novel anticancer agents[J]. Medicinal Chemistry Research,2014,23(7):3274-3286.
[4]YONEDA J D, ALBUQUERQUE M G, LEAL K Z, et al. Docking of anti-HIV-1 oxoquinoline-acylhydrazone derivatives as potential HSV-1 DNA polymerase inhibitors[J]. Journal of Molecular Structure,2014,1074:263-270.
[5]TIAGO FERNANDES D S, WALFRIDO B J, MAGNA SUZANA A M, et al. Novel orally active analgesic and anti-inflammatory cyclohexyl-N-acylhydrazone derivatives[J]. Molecules,2015,20(2):3067-3088.
[6]边占喜,李保国,乌云. 二茂铁甲酰腙稀土配合物的合成与表征[J]. 稀土,2002,23(1):6-10. BIAN Z X, LI B G, WU Y. Synthesis and characterization of rare earth complexes of ferrocenycarbonylhydrazone[J]. Chinese Rare Earths, 2002,23(1):6-10.
[7]梁蓓,刘向荣,张鹏辉. 邻羧基苯甲醛水杨酰腙的合成及性质研究[J]. 有机化学,2010,30(10):1580-1583. LIANG B, LIU X R, ZHANG P H. Synthesis and properties of o-carboxybenzaldehyde salicyloylhydrazone[J]. Chinese Journal of Organic Chemistry,2010,30(10):1580-1583.
[8]马兴铭,雒艳萍,麻宝成,等. 4-羟基-3-羧基苯甲醛水杨酰腙及其配合物抑菌活性初步研究[J]. 兰州大学学报:医学版, 2003,29(3):3-4. MA X M, GE Y P, MA B C, et al. Studies on bacteriostasis activities of 3-carboxyl-4-hydroxybenzaldehyde salcyloyl hydrazone and their complexes[J]. Journal of Lanzhou University:Medical Sciences,2003,29(3):3-4.
[9]李恒欣,李卓,田忠,等. 呋喃甲醛水杨酰腙稀土配合物的合成及抑菌活性[J]. 化学工程,2013,41(1):5-8. LI H X, LI Z, TIAN Z, et al. Syntheses and antibacterial activity of furan formaldehyde salicyloyl hydrazone rare earth complexes[J]. Chemical Engineering,2013,41(1):5-8.
[10]何水样,曹文凯,陈军利,等. 铜(Ⅱ)与2-羰基丙酸水杨酰腙配合物的合成、晶体结构和抑菌活性[J]. 高等学校化学学报,2002,23(6):991-995. HE S Y, CAO W K, CHEN J L, et al.Synthesis, crystal structure and antibacterial activity of copper (Ⅱ) complexes with 2-oxo-propionic acid sal icyloyl hydrazone[J]. Chemical Journal of Chinese Universities,2002,23(6):991-995.
[11]李静,余燕影,曹树稳. 根皮素异烟酰基腙的合成、表征及抗氧化活性研究[J]. 天然产物研究与开发,2011,23(5):824-827. LI J, YU Y Y, CAO S W. Synthesis,characterization,and antioxidant activity of phloretin isonicotinyl hydrazone[J]. Nature Products Research Development,2011,23(5):824-827.
[12]宋红健. 天然产物骆驼蓬碱和去氢骆驼蓬碱及其衍生物的合成、生物活性和构效关系研究[D]. 天津:南开大学博士学位论文, 2014. SONG H J. Synthesis, biological activity and structure activity relationship of natural products of camel and its derivatives[J]. Tianjin: Doctoral Dissertation of Nankai University,2014.
[13]林桂汕, 邹荣霞, 段文贵,等. 新型蒎酸基双酰腙类化合物的合成及其除草活性[J]. 合成化学,2013,21(5):513-517. LIN G S, ZOU R X, DUAN W G, et al. Synthesis and herbicidal activities of novel pinic acid-based diacylhydrazone compounds[J]. Chinese Journal of Synthetic Chemistry,2013,21(5):513-517.
[14]许雪棠, 冷芳, 段文贵,等. 马来松香酸酰腙类化合物的合成及杀菌活性[J]. 农药学学报,2012,14(3):253-259. XU X T, LENG F, DUAN W G, et al. Synthesis and fungicidal activity of maleated rosin acid acylhydrazone compounds[J]. Chinese Journal of Pesticide Science,2012,14(3):253-259.
[15]GU W, WU R, QI S, et al. Synthesis and antibacterial evaluation of new N-acylhydrazone derivatives from dehydroabietic acid[J]. Molecules,2012,17(4):4634-4650.
[16]李兴迪,毕良武,赵振东,等. 异海松酸分离制备的新方法[J]. 林产化学与工业,2008,28(5):21-25. LI X D, BI L W, ZHAO Z D, et al. New process for isolation and preparation of isopimaric acid[J]. Chemistry and Industry of Forest Products,2008,28(5):21-25.
[17]TANG Q, ZHANG G, DU X, et al. Discovery of novel 6,7-disubstituted-4-phenoxyquinoline derivatives bearing 5-(aminomethylene)pyrimidine-2,4,6-trione moiety as c-Met kinase inhibitors[J]. Bioorganic & Medicinal Chemistry,2014,22(4):1236-1249.
Synthesis and Cytotoxicity of Isopimaric-based Salicyloylhydrazone
LIU Juanjuan1, LU Yanju1,2, CHEN Yuxiang1,2, ZHAO Zhendong1,2
(1.Institute of Chemical Industry of Forest Product,CAF;National Engineering Lab. for Biomass Chemical Utilization;Key and Open Lab. of Forest Chemical Engineering,SFA;Key Lab. of Biomass Energy and Material,Jiangsu Province,Nanjing 210042, China; 2.Research Institute of Forestry New Technology,CAF, Beijing 100091, China)
Isopimaric-based salicylhydrazone was synthesized by the reaction of isopimaric acid (IPA) and salicylaldehyde, and characterized by IR,1H NMR and HRMS. The cytotoxicities of target compound were evaluated against two human cancer cells (hepatoma cell HepG-2 and prostatic carcinoma cell PC-3) and a human normal liver cell L-02invitrousing MTT method, which were compared with that of the positive drug taxol. The results showed that cytotoxic activity of isopimaric-based salicylhydrazone was similar or higher than that of taxol (IC50, 12.14 and 6.48 μmol/L) against HepG-2 and PC-3 cell lines, with IC50values 6.50 and 9.25 μmol/L, respectively. Moreover, isopimaric-based salicylhydrazone displayed hypotoxicity to L- 02 cell, with IC50value 68.01 μmol/L, which was much lower than that of taxol (IC50, 4.02 μmol/L). The inhibitory rates and cell morphological changes showed that isopimaric-based salicylhydrazone significantly inhibited the cell proliferation in a dose-dependent manner.
acylhydrazone; isopimaric acid; isopimaric-based salicyloylhydrazone; cytotoxic
2016- 11- 25
中国林科院中央级公益性科研院所基本科研业务费专项资金(CAFYBB2017QA018);国家自然科学基金资助项目(31370575)
刘娟娟 (1984— ), 女,安徽阜阳人,博士生,从事萜类化学利用的研究
*通讯作者:赵振东,研究员,博士,博士生导师,主要从事天然产物利用,应用化学等领域的研究;E-mail: zdzhao@189.cn。
10.3969/j.issn.0253-2417.2017.04.005
TQ351
A
0253-2417(2017)04-0035-05
刘娟娟,卢言菊,陈玉湘,等.异海松基水杨酰腙的合成及细胞毒性评价[J].林产化学与工业,2017,37(4):35-39.
