采用分散固相萃取-超高效液相色谱-串联质谱法同时测定鹌鹑蛋及肉中多种喹诺酮类药物残留
2017-09-13杨盛茹姚喜梅丁长河
杨盛茹,姚喜梅,丁长河,张 煌,邹 建*
(1.河南牧业经济学院 食品工程学院,河南 郑州 450046;2.中国标准化协会,北京 100048;3.河南工业大学 粮油食品学院,河南 郑州 450001)
采用分散固相萃取-超高效液相色谱-串联质谱法同时测定鹌鹑蛋及肉中多种喹诺酮类药物残留
杨盛茹1,姚喜梅2,丁长河3,张 煌1,邹 建1*
(1.河南牧业经济学院 食品工程学院,河南 郑州 450046;2.中国标准化协会,北京 100048;3.河南工业大学 粮油食品学院,河南 郑州 450001)
应用分散固相萃取-超高效液相色谱-串联质谱建立鹌鹑蛋及肉中22种喹诺酮类药物残留的检测方法。样品经过酸化乙腈提取,以氨丙基硅胶为净化剂进行基质分散固相净化,经Acquity UPLC BEH Shield RP18(100 mm×2.1 mm,1.7 μm)分离,以甲醇和 0.1%甲酸水溶液为流动相进行梯度洗脱,双通道MRM信号采集模式,22种喹诺酮类药物能在9 min内快速分离,方法的最低定量限均低于10.0 μg/kg,在10.0~50.0 μg/kg范围内,22种喹诺酮类药物线性良好,相关系数均在0.99以上;对10、20、50 g/kg 3个水平的加标回收试验表明,鹌鹑蛋中喹诺酮类药物残留的回收率在60.3%~113%,RSD值为0.750%~12.7%,鹌鹑肉中喹诺酮类药物残留的回收率在64.9%~111%,RSD值为0.450%~10.1%。该方法前处理简单,结果准确可靠,能全面筛查和确证鹌鹑蛋及肉中多种喹诺酮类药物残留,对防范非法添加,保障消费者食品安全具有一定的参考价值。
鹌鹑蛋;组织;喹诺酮类;分散固相萃取;UPLC-MS/MS
0 前言
鹌鹑肉味甘、性平,可补中益气、清利湿热。鹌鹑蛋含有蛋白质、脂肪、碳水化合物、多种维生素和钙、磷、铁等矿物质,其丰富的卵磷脂和脑磷脂,具有健脑的作用,适宜婴幼儿、孕产妇、老人、病人及身体虚弱的人食用,但鹌鹑养殖具有饲养密度大、饲养周期短、疾病传染快的特点,为预防和治疗大肠杆菌类疾病,首选使用喹诺酮类药物,而养殖过程中喹诺酮类药物的不规范使用,导致动物产品中残留喹诺酮类药物,长期食用还会产生细菌耐药性问题,尤其对婴幼儿、孕产妇和年老体弱者存在极大安全隐患[1]。
欧盟规定动物肌肉、肝脏和肾脏中达氟沙星、二氟沙星、恩诺沙星(环丙沙星与恩诺沙星量之和)、麻保沙星、沙拉沙星等的最大残留量为0.01~1.9 mg/kg;美国禁止在食用动物养殖中使用FQNs(氟喹诺酮类);2002年我国农业部第235号公告中对动物性食品中兽药最高残留限量进行了要求,其中对喹诺酮药物在动物性食品中残留限量进行了规定,2015年农业部第2292号公告决定在食品动物中停止使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4种兽药,随着对喹诺酮类药物禁用药物范围的扩大,新型喹诺酮药物用于动物生产的风险也越来越大。目前鸡蛋和鸡肉中喹诺酮类药物残留检测文献较多[2-6],但药物种类较少,未涵盖吉米沙星、加雷沙星等新型喹诺酮类药物,还未见鹌鹑肉和蛋中多种喹诺酮类药物残留同时检测的报道,因此建立适用于鹌鹑蛋及肉中多种喹诺酮类药物残留同时检测的方法势在必行。
笔者建立鹌鹑蛋及肉中22种喹诺酮类药物的超高效液相串联质谱检测方法,方法灵敏度高,稳定性好,22种喹诺酮类药物能在9 min内快速分离,方法最低定量限均低于10.0 μg/kg,方法可满足鹌鹑蛋及肉中多种喹诺酮类药物残留同时检测的要求。
1 材料与方法
1.1 试剂与耗材
加雷沙星 (Garenoxacin), 曲伐沙星(Trovafloxacin),莫西沙星(Moxifloxacin),奥比沙星(Orbifloxacin),吉米沙星(Gemifloxacin),加替沙星(Gatifloxacin),氟罗沙星(Fleroxacin),马波沙星(Marbofloxacin),那氟沙星(Nadifloxacin),氟甲喹(Flumequine), 诺氟沙星 (Norfloxacin), 吡哌酸(Pipemidic acid),萘啶酸(Nalidixic acid),培氟沙星(Pefloxacin),环丙沙星(Ciprofloxacin),氧氟沙星(Ofloxacin),恩诺沙星(Enrofloxacin),达氟沙星(Danofloxacin),洛美沙星(Lomefloxacin),二氟沙星(Difloxacin),司帕沙星(Sparfloxacin spara),沙拉沙星(Sarafloxacin)购于德国 Dr.Ehrenstorfer公司,纯度均在97%以上;乙腈、甲醇、乙酸、甲酸、正己烷等有机溶剂均为色谱纯,购自美国Fisher公司;净化剂:PSA、C18、GCB、氨丙基硅胶、弗罗里硅土等净化剂购自博纳艾杰尔科技公司;滤膜:两款Syringe Filter,PTFE,0.2 μm分别购于美国 Waters公司和Agilent公司,0.22 μm有机尼龙膜和聚醚砜膜购于天津津腾实验设备有限公司。
将标准品及内标用甲醇配成单标母液,并配制10 μg/mL混合储备液于-20℃保存,使用时现配成系列标准工作液;鹌鹑蛋及肉购于农贸市场,经LC-MS/MS分析确认为阴性样本。
1.2 仪器设备
超高效液相色谱仪(Acquity UPLC)配三重四级杆质谱仪(quattro premier XE):美国Waters公司;3K15型离心机:美国Sigma公司;纯水仪:美国Millipore公司。
1.3 试验方法
1.3.1 前处理过程
准确称取经匀质的鹌鹑蛋或肉样5 g于50 mL离心管中,加入15 mL 2%甲酸乙腈(肉样需加入5 mL水),3 g无水硫酸镁和1 g无水乙酸钠,振荡混合5 min,超声10 min,9 500 r/min离心5 min,准确量取6 mL上清液加入200 mg氨丙基硅胶基质填料作为净化剂(肉样需加入1.5 g无水硫酸镁),振荡 10 min,9 500 r/min离心 5 min。准确量取上清液3 mL,50℃氮气吹至近干,1 mL初始流动相定容,0.22 μm滤膜过滤待上机测定。
1.3.2 液相条件
色谱柱:Acquity UPLC BEH Shield RP18(100 mm×2.1 mm,1.7 μm);流速:0.25 mL/min;流动相A:甲醇,B:0.1%甲酸水溶液,0~5 min,10%A 线性变化至 35%;5~8 min,35%A 线性变化至 90%;8~8.5 min,90%A 保持不变;8.5~8.6 min,90%A 线性变化至10%;8.6~9 min,10%A保持不变。
1.3.3 质谱条件
电离模式:ESI+;毛细管电压:3.0 kV;萃取锥孔电压:3 V;RF透镜电压:0.5 V;源温:110 ℃;脱溶剂温度:350℃;锥孔气流速:50 L/h;脱溶剂气流速:550 L/h;碰撞气流速:0.18 mL/min;采集模式:双通道MRM;各种药物优化母离子和子离子及对应聚焦电压和碰撞电压值见表1。
2 结果与讨论
2.1 不同滤膜对喹诺酮类药物的吸附研究
影响回收率的因素贯穿整个前处理过程,而上机前过滤是保护仪器、去除杂质的关键步骤,因此滤膜的选择对整个前处理过程至关重要。考察了Waters PTFE膜、Agilent PTFE膜、津腾聚醚砜膜和有机尼龙膜4种适用于绝大多数有机溶剂和水溶液的滤膜对20 μg/L混合标准溶液的吸附影响,结果见图1。由图1可见,有机尼龙膜和Aglient PTFE滤膜对那氟沙星吸附较为严重,聚醚砜膜比Waters PEFT膜滤过性能更好,药物吸附更少,因此试验选取聚醚砜膜作为试验用过滤膜。
2.2 不同净化材料对喹诺酮类药物的吸附研究
分散固相萃取常用的净化剂主要有N-丙基乙二胺(PSA)、C18、GCB、氨丙基硅胶、弗罗里硅土等,其中PSA和氨丙基硅胶能有效去除样品基质中的有机酸、色素和糖类杂质;C18具有良好的除脂能力;而GCB和弗罗里硅土可吸附提取液中的色素成分。本试验选取上述5种吸附净化剂,对其净化效果进行了考察,结果见图2。由图2可以看出,GCB和弗罗里硅土对喹诺酮类药物的吸附尤其严重,除萘啶酸和氟甲喹外,其他药物吸附率均在90%以上,C18对喹诺酮类药物的吸附也较为严重,吸附率高于40%,相比之下,氨丙基硅胶吸附率最小、净化效果最好。
试验选择 50、100、200、500 mg 4 个水平对氨丙基硅胶吸附净化剂的用量进行优化,结果表明,200 mg的氨丙基硅胶作吸附净化剂时,提取液颜色较浅,回收率最佳。
2.3 样品前处理过程优化
喹诺酮类药物易溶于极性和水溶性有机溶剂、酸、碱等溶液,动物性食品中喹诺酮类药物提取剂有有机溶剂、酸性有机溶剂和缓冲盐溶液[7-9]。本文通过在空白样品添加10 μg/kg喹诺酮类混标溶
液,分别选取甲醇、乙腈和2%甲酸乙腈为提取溶剂处理样品,结果表明:当甲醇为提取剂时,蛋白沉淀差,样品整体较为浑浊,回收率较低;而乙腈及酸化乙腈为提取剂时,蛋白沉淀较完全,且酸化乙腈比纯乙腈提取效率更好,原因主要为酸性条件有助于喹诺酮类药物的溶解,因此选取2%甲酸乙腈作为最终提取溶剂,不同提取条件下的回收率见图3。
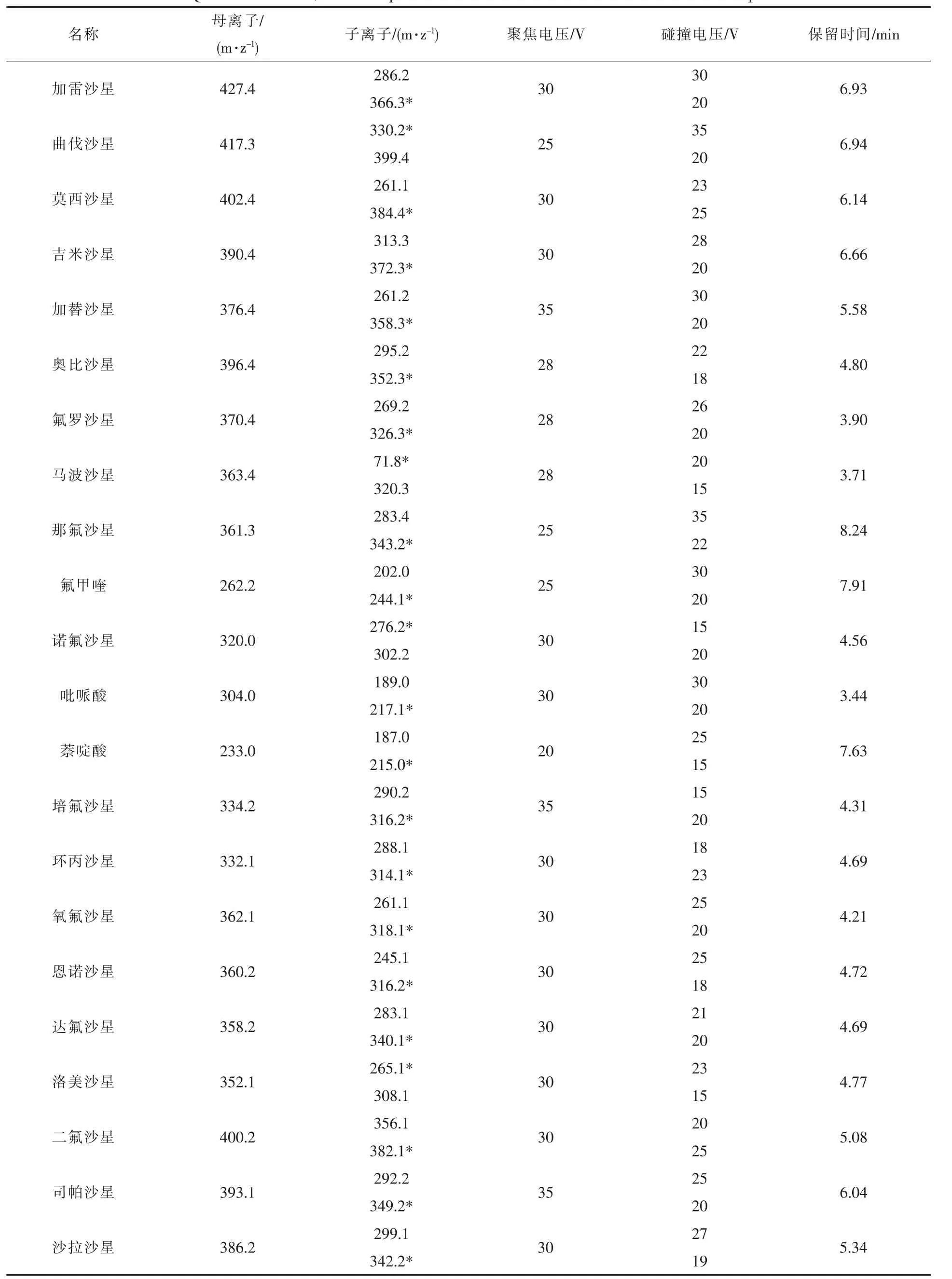
表1 22种喹诺酮类药物的检测离子、对应质谱参数及保留时间Table 1 Qualitative ions,relevant parameters and retention time of 22 kinds of quinolones
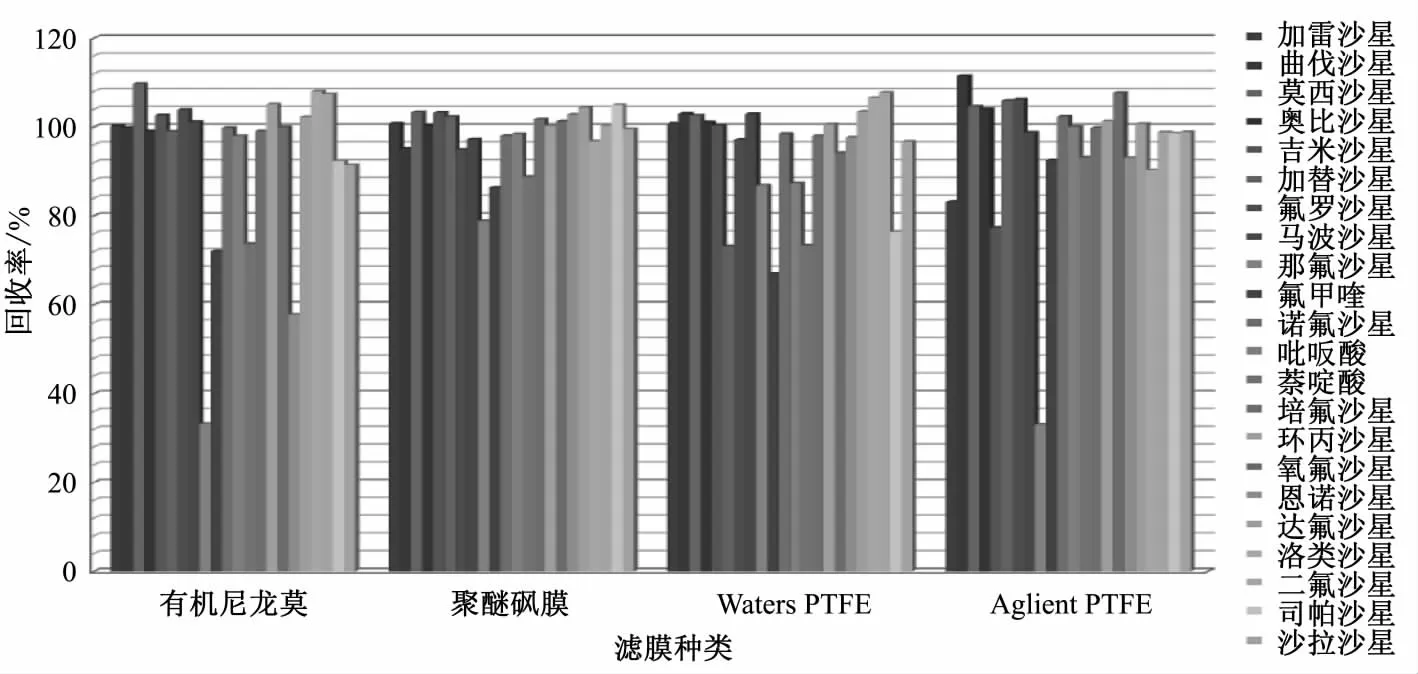
图1 不同滤膜过滤时的回收率Fig.1 Recoveries were obtained by different filtration membranes
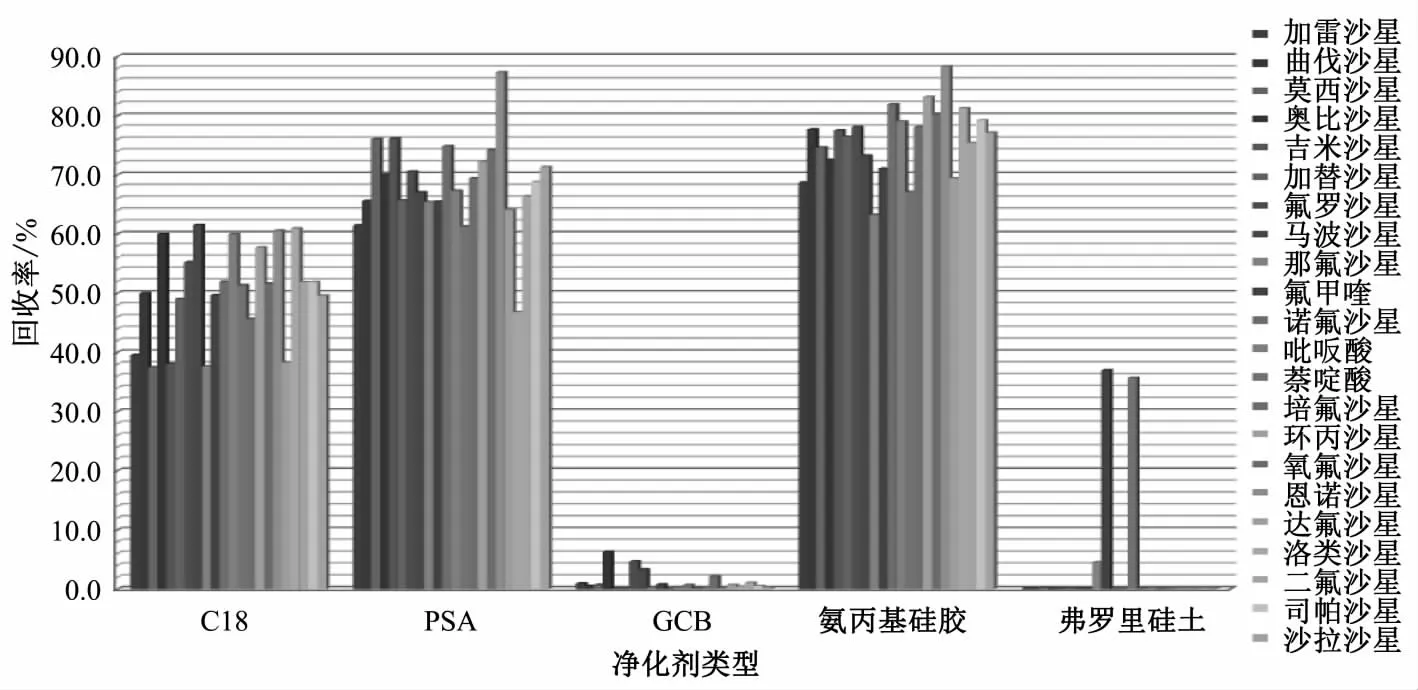
图2 不同净化条件下的回收率Fig.2 Recoveries under different purification conditions
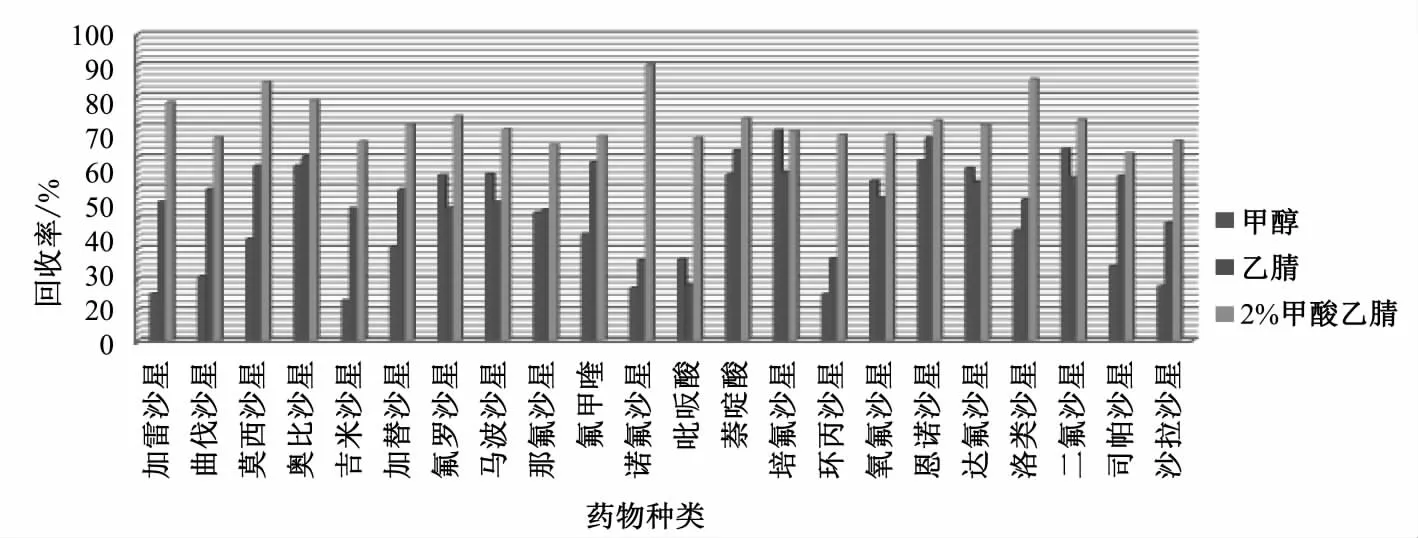
图3 不同提取溶剂的提取回收率Fig.3 Recoveries of different extraction solvents
试验表明,针对鹌鹑肉样本,需在加入提取液前,加入5 mL水,更有利于肉样组织分散,使提取更为充分,在净化过程中加入200 mg氨丙基硅胶的同时加入1.5 g无水硫酸镁以便除去提取液中剩余的水分。
2.4 基质效应研究
鹌鹑蛋样本含有更多的卵磷脂、脑磷脂和核黄素,基质成分复杂,因此设计基质效应对照试验,按照1.3.1方法处理空白鹌鹑蛋和鹌鹑肉样本,制成含有20 μg/kg混合标准溶液的基质加标溶液,与溶剂加标溶液进行比较,结果见图4。由图4可见,22种药物均存在不同程度的基质抑制作用,鹌鹑蛋中抑制率在4.1%~39.7%,鹌鹑肉中抑制率在6.2%~36.5%。因此在检测过程中应采用基质加标溶液来消除基质效应的影响,不同药物基质抑制程度见图4。
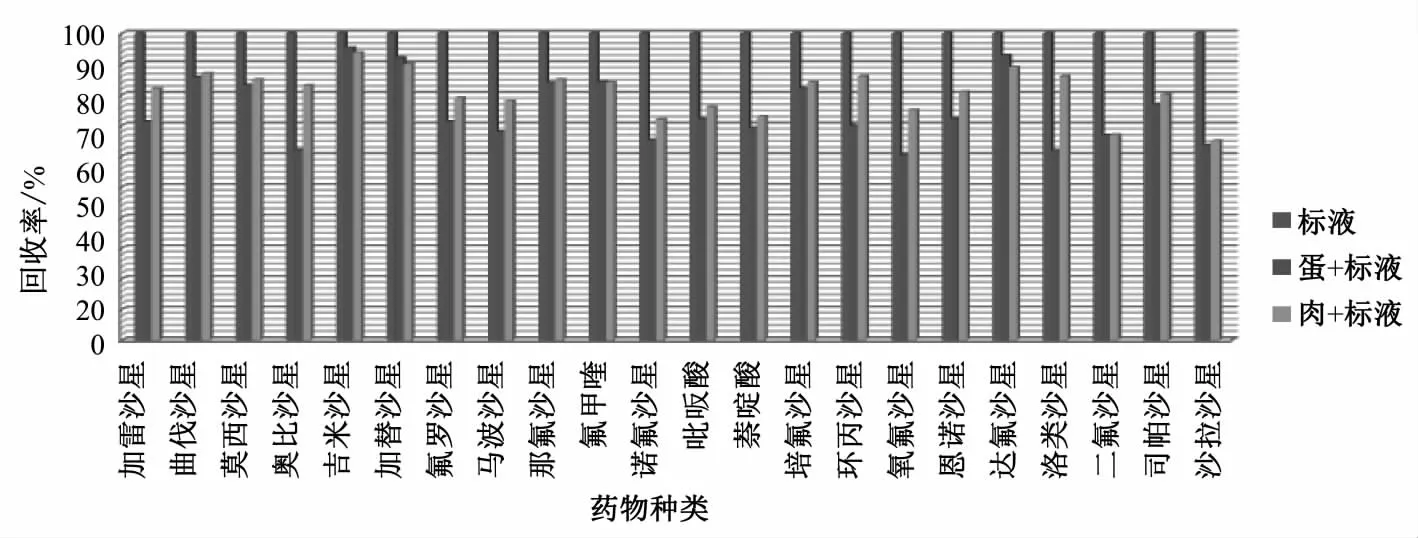
图4 基质效应Fig.4 Matrix effect in quail eggs and tissues
2.5 线性方程及灵敏度考察
采用鹌鹑蛋及肉样品经1.3.1方法处理,在5~50 μg/kg范围内分别添加喹诺酮类药物混标溶液,配制梯度系列基质加标溶液,依次进样,以色谱峰面积为纵坐标,化合物含量为横坐标做标准曲线,将处理好的空白鹌鹑蛋及肉样品逐级稀释标准溶液,按10倍信噪比确定方法的定量限(LOQ),结果见表 2。结果表明在 10~50 μg/kg范围内线性良好,相关系数均大于0.99。
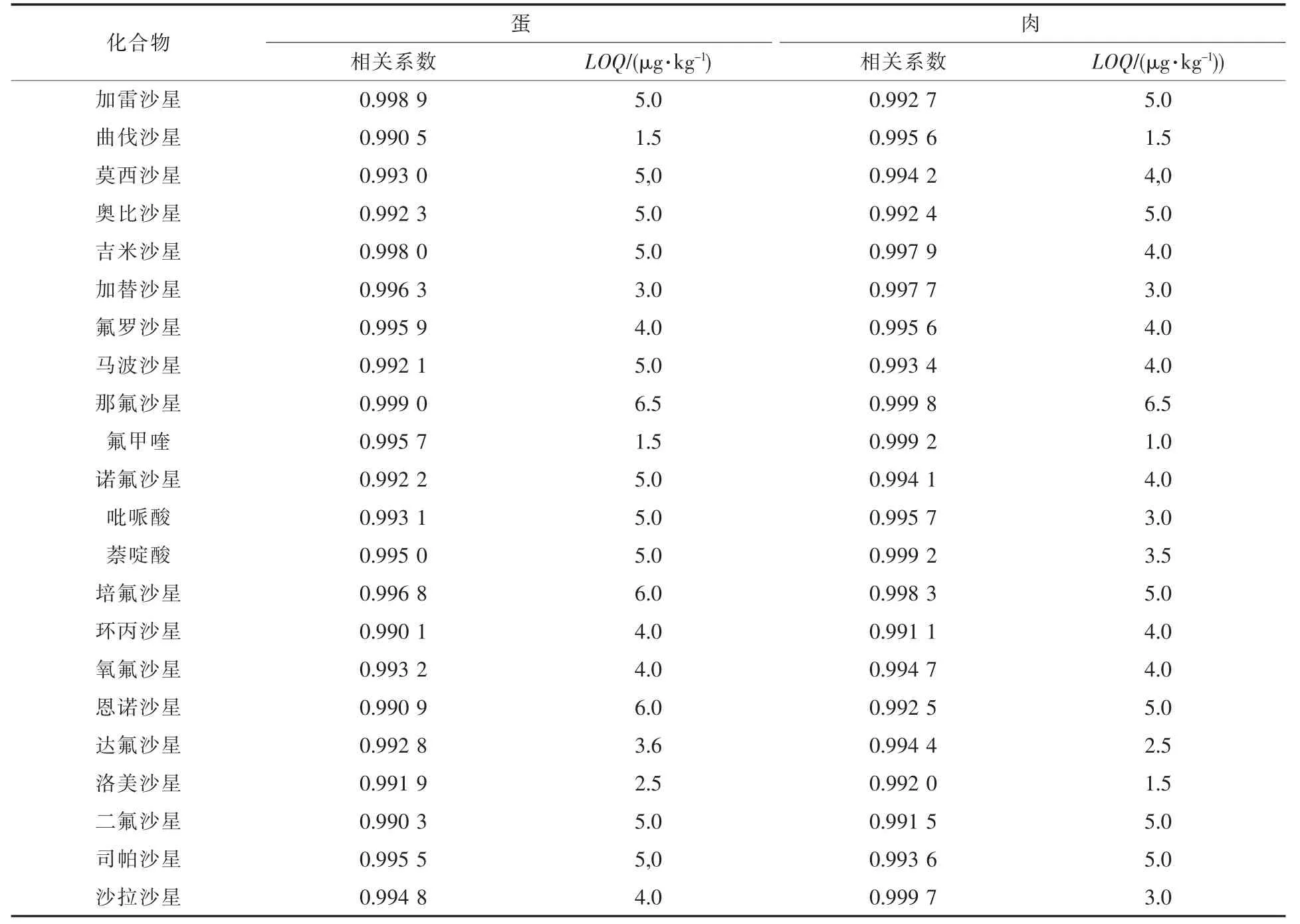
表2 鹌鹑蛋及肉中22种喹诺酮类药物线性系数及定量限值Table 2 Linear coefficients and the limits of quantitation of 22 quinolones in quail eggs and tissues
2.6 回收率试验
取空白鹌鹑蛋及肉样品,药物添加量为10、20、50 μg/kg 3个水平的混标溶液,每组做6个平行,按1.3.1方法进行添加回收率试验,结果见表3。鹌鹑蛋中回收率为 0.3%~113%,RSD值为0.750%~12.7%,鹌鹑肉中回收率为64.9%~111%,RSD值为0.450%~10.1%。
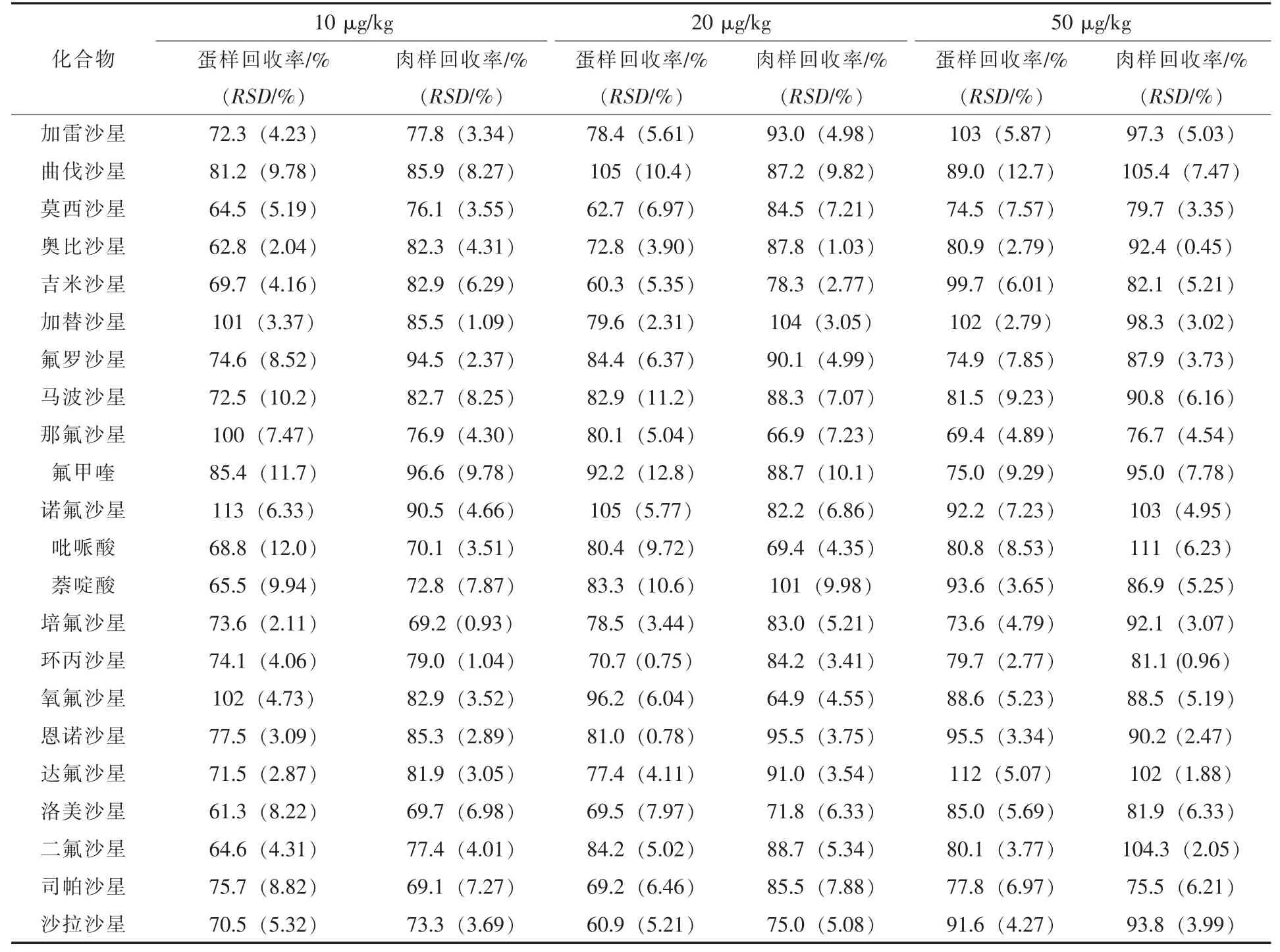
表3 鹌鹑蛋及肉中22种喹诺酮类药物添加回收率和RSD值Table 3 Spiked recoveries and RSD of 22 kinds of quinolones in Quail eggs and tissues(n=6)
2.7 实际样品检测
使用建立的方法对全国农贸市场抽检的18份鹌鹑蛋和肉样品进行测定,其中1份鹌鹑蛋样品检出恩诺沙星 21.4 μg/kg,检出率为 5.56%。表明该方法适用于鹌鹑蛋及肉中喹诺酮类药物的检测,同时也表明鹌鹑蛋及肉中兽药残留安全隐患不容忽视。
3 结论
本试验针对鹌鹑蛋及肉样本,建立了包括吉米沙星、加雷沙星等新型喹诺酮药物在内的22种喹诺酮类药物同时检测的UPLC-MS/MS检测方法。该方法操作简单,稳定性好,能够满足鹌鹑蛋及肉中喹诺酮类药物残留检测要求,为保障鹌鹑制品的食品安全提供了技术参考。
[1] 董书云,陈慧慧,王琼,等.喹诺酮类药物的严重不良反应及临床合理应用[J].中华全科医学,2014,12(12):1998-2000.
[2] GIGOSOS P G,REVESADO P R,CADAHÍA O.Determination of quinolones in animal tissuess and eggs by high-performance liquid chromatography with photodiode-array detection[J].Journal of Chromatography A,2000,871(1):31-36.
[3] 彭涛,雍炜,安娟,等.反相高效液相色谱/质谱法同时测定鸡肉中5种喹诺酮药物残留[J].分析化学,2006(S1):10-14.
[4] CHRISTODOULOU E A,SAMANIDOU V F,PAPADOYANNIS I N.Validation of an HPLC-UV method according to the European Union Decision 2002/657/EC forthe simultaneous determination of10 quinolones in chicken muscle and egg yolk[J].Journal of Chromatography B,2007,859(2):246-255.
[5] GAJDA A,POSYNIAK A,ZMUDZKI J,et al.Determination of(fluoro)quinolones in eggs by liquid chromatography with fluorescence detection and confirmation by liquid chromatography-tandem mass spectrometry [J].Food Chemistry,2012,135(2):430-439.
[6] JIMÉNEZV,COMPANYÓ R,GUITERASJ.Validation of a method for the analysis of nine quinolones in eggs by pressurized liquid extraction and liquid chromatography with fluorescence detection [J].Talanta,2011,85(1):596-606.
[7] 杨方,庞国芳,刘正才,等.液相色谱-串联质谱法检测水产品中15种喹诺酮类药物残留量[J].分析试验室,2008,27(12):27-33.
[8] 张元,周伟娥,李绍辉,等.动物源性食品中喹诺酮类残留前处理及分析方法的研究进展[J].食品工业科技,2016,37(5):378-383.
[9] 陈涛,陈安珍,杨钊.超高效液相色谱-串联质谱法测定动物源产品中11种喹诺酮类药物残留 [J]. 药物分析杂志,2010,30(6):1086-1089.
SIMULTANEOUS DETERMINATION OF QUINOLONES RESIDUES IN QUAIL EGGS AND TISSUE BY DISPERSIVE SOLID-PHASE EXTRACTION AND ULTRA PERFORMANCE LIQUID CHROMATOGRAPHY COMBINED WITH TANDEM MASS SPECTROMETRY
YANG Shengru1,YAO Ximei2,DING Changhe3,ZHANG Huang1,ZOU Jian1
(1.College of Food Engineering,Henan University of Animal Husbandry and Economy,Zhengzhou 450046,China;2.China Association for Standardization,Beijing 100018,China;3.School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
A method for simultaneously detecting 22 kinds of quinolones in quail eggs and tissues was established by using dispersive solid-phase extraction and ultra performance liquid chromatography combined with tandem mass spectrometry (UPLC -MS/MS).Samples were extracted with acidified acetonitrile,then subjected to matrix dispersion solid -phase purification using aminopropyl silica gel as purifier,separated by Acquity UPLC BEH Shield RP18(100 mm×2.1 mm,1.7 μm),and eluted gradiently in the presence of methanol and 0.1 formic acid solution as the mobile phase,wherein signals were acquired by a dual-channel MRM signal acquisition mode.Results showed that the 22 kinds of quinolones could be separated rapidly in 9 minutes;the limit of quantification was less than 10 μg/kg;and the 22 kinds of quinolones had good linearity within 10.0 to 50.0 μg/kg,with correlation above 0.99.Recovery tests of 10,20 and 50 μg/kg showed that the recovery of quinolones in quail eggs was 60.3%to 113%,RSD 0.75%to 12.7%;and the recovery of quinolones in quail tissues was 64.9%to 111%,RSD 0.45%~10.1%.The method was simple in pretreatment,reliable in results,and can detect multiple kinds of quinolones residues in quail eggs and tissues completely,thereby providing reference for preventing illegal addition and ensuring food safety.
quail eggs;tissues;quinolones;dispersive solid-phase extraction;UPLC-MS/MS
TS207.3
:B
1673-2383(2017)04-0057-07
http://kns.cnki.net/kcms/detail/41.1378.N.20170828.0857.022.html
网络出版时间:2017-8-28 8:57:20
2016-12-14
河南省科技攻关项目(142102110178)
杨盛茹(1988—),女,河南商丘人,硕士,主要从事食品质量安全研究。
*通信作者
