大豆分离蛋白和浓缩蛋白乳液体系稳定性的比较
2017-09-13李慧娜田少君章绍兵
李慧娜,田少君,章绍兵
(河南工业大学 粮油食品学院,河南 郑州 450001)
大豆分离蛋白和浓缩蛋白乳液体系稳定性的比较
李慧娜,田少君*,章绍兵
(河南工业大学 粮油食品学院,河南 郑州 450001)
用正交试验法研究大豆分离蛋白(SPI)和浓缩蛋白(SPC)乳状液的最佳制备工艺条件,探讨了不同蛋白质量浓度、油体积分数、剪切时间、均质强度等条件对体系稳定性的影响。结果表明:在蛋白质量浓度为5 g/100 mL、油体积分数为25%、剪切时间为30 s、均质强度为200 Pa时SPI乳状液稳定性系数最高为91.66%;在蛋白质量浓度为4 g/100 mL、油体积分数为15%,剪切时间为120 s、均质强度为500 Pa时SPC乳状液稳定性系数最高为60.17%。分析两种乳液体系的稳定性及储藏期间的絮凝情况,结果发现任意蛋白质量浓度SPI乳液4℃储藏16 d均无乳析分层、絮凝现象,蛋白质量浓度低于3 g/100 mL时SPC乳液开始发生不同程度的分层、絮凝现象,且蛋白质量浓度越低乳液絮凝越严重;相同蛋白质量浓度时,SPI乳液粒径均小于SPC,最佳制备工艺条件下SPI乳液粒径为281.2 nm,zeta电位为-33.9 mV,SPC乳液粒径为600.2 nm,zeta电位为-26.2 mV,较小的粒径和较大的电位绝对值是SPI乳状液稳定性高于SPC的主要原因。
大豆蛋白乳液体系;正交试验设计;稳定性分析
0 引言
大豆分离蛋白(SPI)和浓缩蛋白(SPC)是食品体系中常用的两种天然乳化剂,含有大量对人体有益的必需脂肪酸、磷脂和钙、磷等矿物质以及8种必需氨基酸,其氨基酸组成与动物蛋白接近,且消化利用率高达90%以上,具有较高的营养价值,是为数不多的可替代动物蛋白的优质植物蛋白[1]。临床研究表明,大豆蛋白具有良好的生理保健功能,在降低血液胆固醇、防止骨质疏松、治疗肾脏病、抗高血压等方面具有显著功效[2]。
大豆蛋白不仅营养价值高,且乳化性和凝胶性能良好,被用于制备乳状液体系[3]。以脱脂大豆蛋白、油、水制得的乳状液营养价值丰富、无豆腥味且方便人们食用,在食品体系如沙拉酱、蛋黄酱等调味酱中应用广泛。
目前,国内外已经有部分学者开展了以脱脂后的粉状植物蛋白为原料制备乳状液的研究,普遍存在的问题是乳液稳定性较差,在储藏期间容易出现分层、絮凝等现象,导致产品货架期短,限制了其在食品领域的推广应用[4]。乳液的制备工艺对其稳定性具有决定性的作用,因此本研究对两种大豆蛋白乳液的制备工艺进行了探索,采用正交试验优选出最佳制备条件,并进一步测定比较两种乳液体系的稳定性,包括粒径、电位以及储藏期间的乳析、絮凝状态,旨在为乳液的制备及应用提供客观的实验依据。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
大豆分离蛋白、大豆浓缩蛋白:市售(其中蛋白含量分别为90.51%、68.59%),大豆油:山东万德福实业集团有限公司。
十二烷基硫酸钠(SDS)、叠氮钠、磷酸盐缓冲液等:分析纯,天津市科密欧试剂有限公司。
1.1.2 仪器
高速剪切乳化机:德国FLUKO流体机械制造公司;ATS-Basic高压均质机:德国ATS仪器公司;磁力搅拌器:上海维诚仪器有限公司;恒温水浴振荡器:金坛华峰仪器有限公司;高速离心机:上海安亭科学仪器厂;722S可见分光光度计:上海仪电分析仪器有限公司;激光粒度仪:英国Malvern Instruments Ltd.;BT-1600图像颗粒分析仪:丹东市百特仪器有限公司。
1.2 试验方法
1.2.1 大豆蛋白乳状液制备工艺流程
大豆蛋白→加水调节蛋白质量浓度→室温下磁力搅拌2 h→70℃恒温水浴振荡40 min→4℃水化过夜→加大豆油→高速剪切→高压均质。
1.2.2 试验设计
在两种大豆蛋白乳状液的制备过程中,很多因素影响其稳定性,经单因素试验,选定蛋白质量浓度、剪切时间、均质强度、油的体积分数为主要影响因素。每种因素选择3个水平,采用L9(34)正交试验设计方案制备大豆蛋白乳状液。测定最佳工艺条件下制备的两种大豆蛋白乳状液的稳定性以及储藏期间的絮凝状态,包括乳液的粒径、zeta电位、乳析指数以及微观结构。
1.2.3 乳状液稳定性指标测定
1.2.3.1 乳状液稳定系数
在2 mL圆底离心管中准确加入2 mL乳状液,以4 000 r/min离心30 min,在距离心管底部1 cm处取样,采用浊度法测定吸光度(A500nm)[5]。

式中:A0为离心前乳状液吸光度;At为离心后乳状液吸光度。
1.2.3.2 粒径
采用激光粒度仪测定乳液粒径,根据Chanamai等[6]的方法,略有改动。吸取10 μL大豆蛋白乳液样品,以蒸馏水将乳液稀释至质量分数0.05%,以乳液粒度分布和平均粒径为指标记录实验结果,每个样品重复测量3次取平均值。
1.2.3.3 zeta电位
将乳液用蒸馏水稀释至质量分数0.05%,根据Chanamai等[6]的方法,略有改动。采用激光粒度仪测定乳液油滴的电位大小。测定温度为25℃,每个样品重复测量3次取平均值。
1.2.3.4 乳析指数
乳析指数根据Soleimanpour等[7]的方法,略有改动。取50 mL新制乳液于平底试管中,密封储存于4℃,观察并记录乳液在14 d内乳液析出清液的高度(Ht)以及乳液总高度(H),每个样品重复测量3次取平均值。乳析指数(CI)计算公式如下:
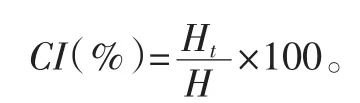
1.2.3.5 微观结构
将新制备的乳状液储存于4℃,16 d后取出一定量的乳状液,用蒸馏水稀释1 000倍,用图像颗粒分析仪放大400倍,观察并分析乳状液的颗粒分布。
2 结果与讨论
2.1 两种大豆蛋白乳液体系制备单因素试验
2.1.1 蛋白质量浓度对乳液稳定性的影响
在油体积分数为20%、剪切时间为30 s、均质强度为300 Pa下,考察蛋白质量浓度对两种乳液体系稳定性的影响,结果见图1。
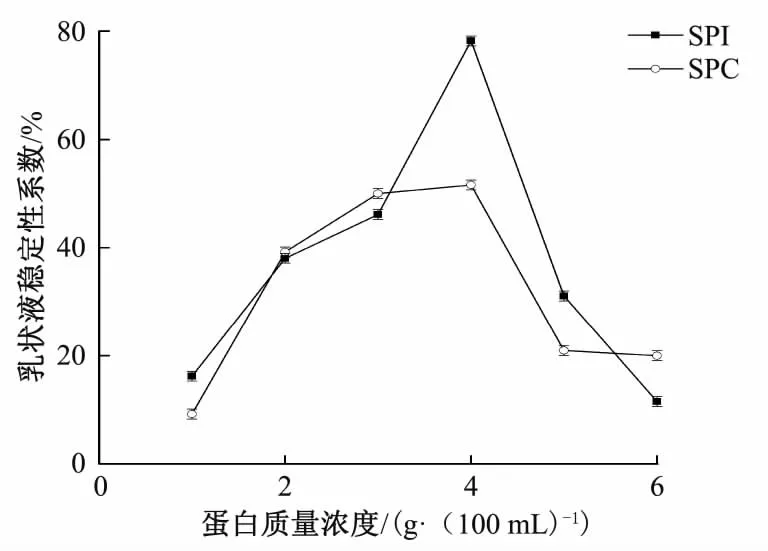
图1 蛋白质量浓度对乳液稳定性的影响Fig.1 Effect of protein mass concentration on emulsion stability
由图1可看出,随着蛋白质量浓度的增加,大豆浓缩蛋白和分离蛋白乳状液的稳定性呈先上升后下降的趋势,二者均在蛋白用量为4 g/100 mL时,乳状液稳定性系数达到最大,因此选择4 g/100 mL为制备乳状液的最佳蛋白添加量。蛋白用量是影响乳状液稳定性的重要因素之一,在乳状液的形成过程中,蛋白质迅速吸附在油水界面,降低两相的界面张力,促进乳状液液滴的形成,并起到油滴保护膜的作用,防止油滴被破坏,使乳状液处于稳定状态[8]。因此随蛋白质量浓度的增加,乳状液稳定性增加,但当达到蛋白的饱和浓度后,多余的蛋白由于彼此间的电荷排斥反而会破坏乳状液的稳定性[9]。SPI较SPC乳液离心稳定性更高,主要因为后者含有更多的非蛋白组分(不溶性碳水化合物),这些不溶物影响SPC溶解性导致乳液稳定性下降;且醇法制备SPC过程也导致其功能性较差。
2.1.2 均质强度对乳液稳定性的影响
在蛋白质量浓度为4 g/100 mL、油体积分数为20%、剪切时间为30 s下,考察均质强度对两种乳液体系稳定性的影响,结果见图2。
由图2可看出,随着均质强度的增加,SPI乳状液的稳定性呈上升趋势,但当均质强度达到300 Pa以后对稳定性的影响变小,乳状液稳定性系数趋于不变或轻微下降。而SPC乳状液则在500 Pa时达到最大,同时考虑到均质强度的增加将带来热能消耗以及对设备要求的提高,因此选择300和500 Pa分别为SPI和SPC乳状液制备的最佳均质强度。高压均质制备的乳状液具有较高的稳定性,一方面,可以归因于高压均质将乳液充分打散成小液滴,降低了乳液的粒径,并为液滴提供足够的排斥阻力,防止乳液的聚集;另一方面,杨盛楠等[10]研究发现,高压能改善SPI乳液的稳定性,但均质压力过高时,稳定性不再发生较大变化,因为适度的高压处理能促进大豆蛋白结构展开,但均质压力过高反而会使疏水基团暴露,导致蛋白质发生一定程度的聚集。
2.1.3 剪切时间对乳液稳定性的影响

图2 均质强度对乳液稳定性的影响Fig.2 Effect of homogeneous strength on emulsion stability
在蛋白质量浓度为4 g/100 mL、油体积分数为20%、均质强度为300 Pa下,考察剪切时间对两种乳液体系稳定性的影响,结果见图3。
由图3可看出,随着剪切时间的增加,乳状液的稳定性呈先上升后下降趋势,SPI和SPC乳状液稳定性系数分别在1 min和2 min时达到最大。油水两相在高速剪切作用下使油滴碰撞,油滴分散和聚结同时发生,适度的剪切能将油滴充分分散开来,但剪切时间过长则会使分散好的油滴再度聚集,从而使乳状液稳定性下降[11]。因此选择1 min和2 min分别为制备SPI和SPC乳状液的最佳剪切时间。
2.1.4 油体积分数对乳液稳定性的影响
在蛋白质量浓度为4 g/100 mL、剪切时间为30 s、均质强度为300 Pa下,考察油体积分数对两种乳液体系稳定性的影响,结果见图4。
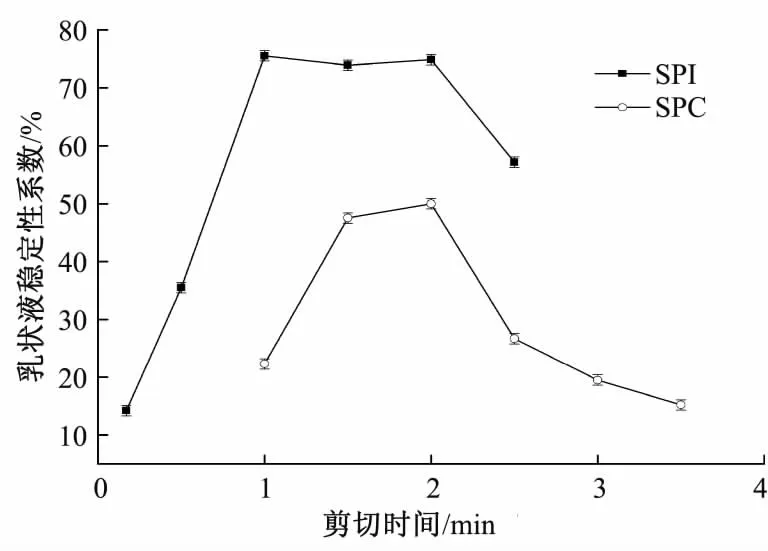
图3 剪切时间对乳液稳定性的影响Fig.3 Effect of shear time on emulsion stability
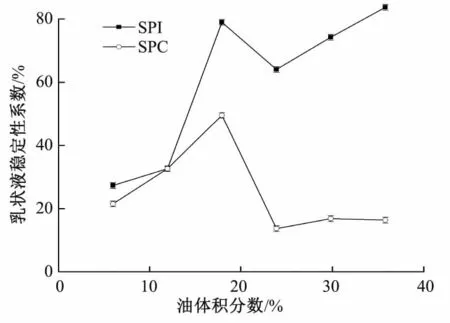
图4 油体积分数对乳液稳定性的影响Fig.4 Effect of oil volume fraction on emulsion stability
由图4可看出,随着油体积分数即油水比例的增加,SPI体系稳定性整体呈上升趋势,SPC乳液稳定性则先上升后下降,二者均在油体积分数为20%时达到最大值。体系中的水相对乳状液品质的影响是极为不利的,水相的稀释作用导致乳液黏度降低,液滴更容易聚合,乳液稳定性下降。而油体积分数的增加,体系黏度增大,有利于蛋白质稳定油水界面,能起到防止油滴聚集,提高乳状液稳定性的作用[12]。当油体积分数高于20%时,SPC乳液稳定性下降较为严重,这主要是因为SPC溶解性较差,水中溶解的蛋白不足以稳定过多的油脂。油体积分数达到20%以后,SPI乳液离心稳定性增加不明显或略有波动,因此选择20%为油最佳添加量。
2.2 正交试验确定乳状液制备的最佳条件
以上讨论了各单因素的影响,但在实际操作中,还要考虑它们之间的相互交叉影响,因此为了全面考察影响因素,设计四因素三水平正交试验,结果见表1、表 2。
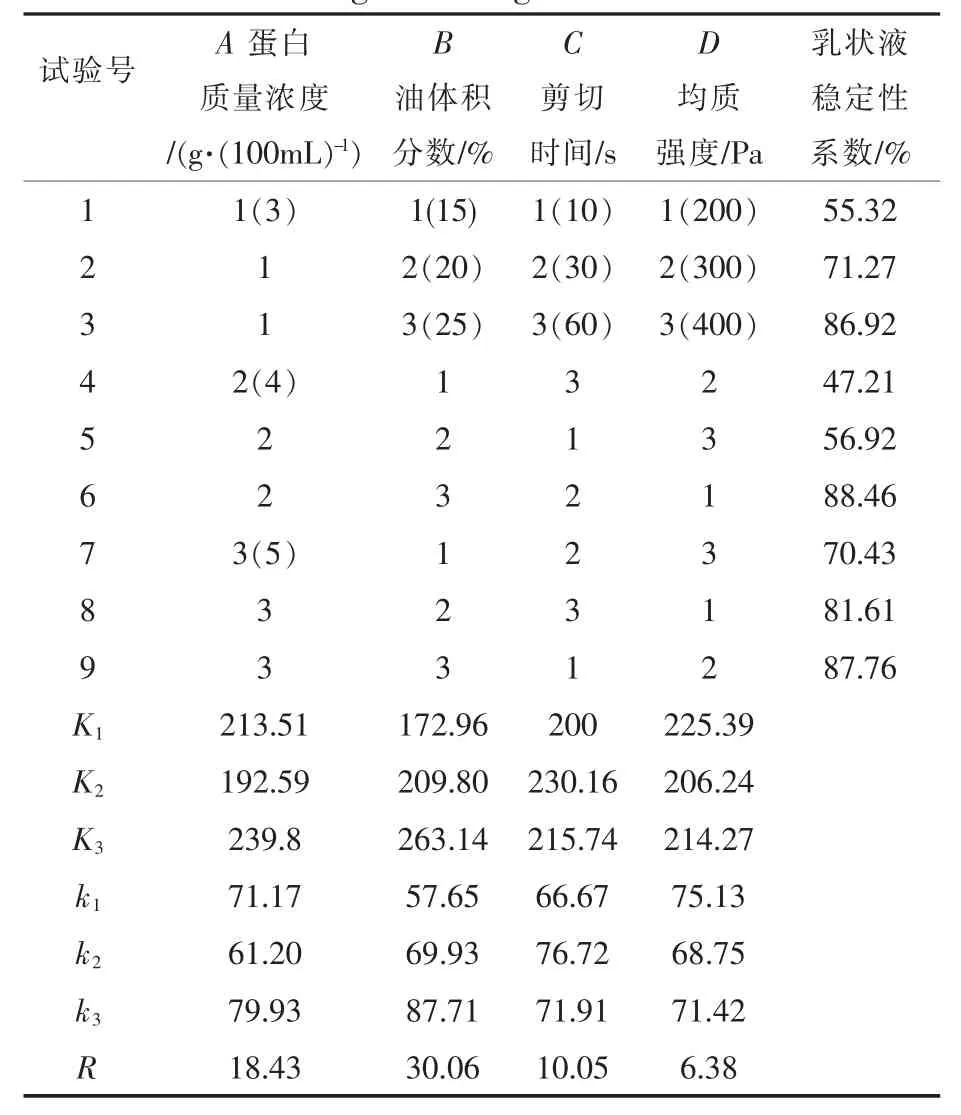
表1 SPI正交试验设计与结果Table 1 Orthogonal design and results of SPI
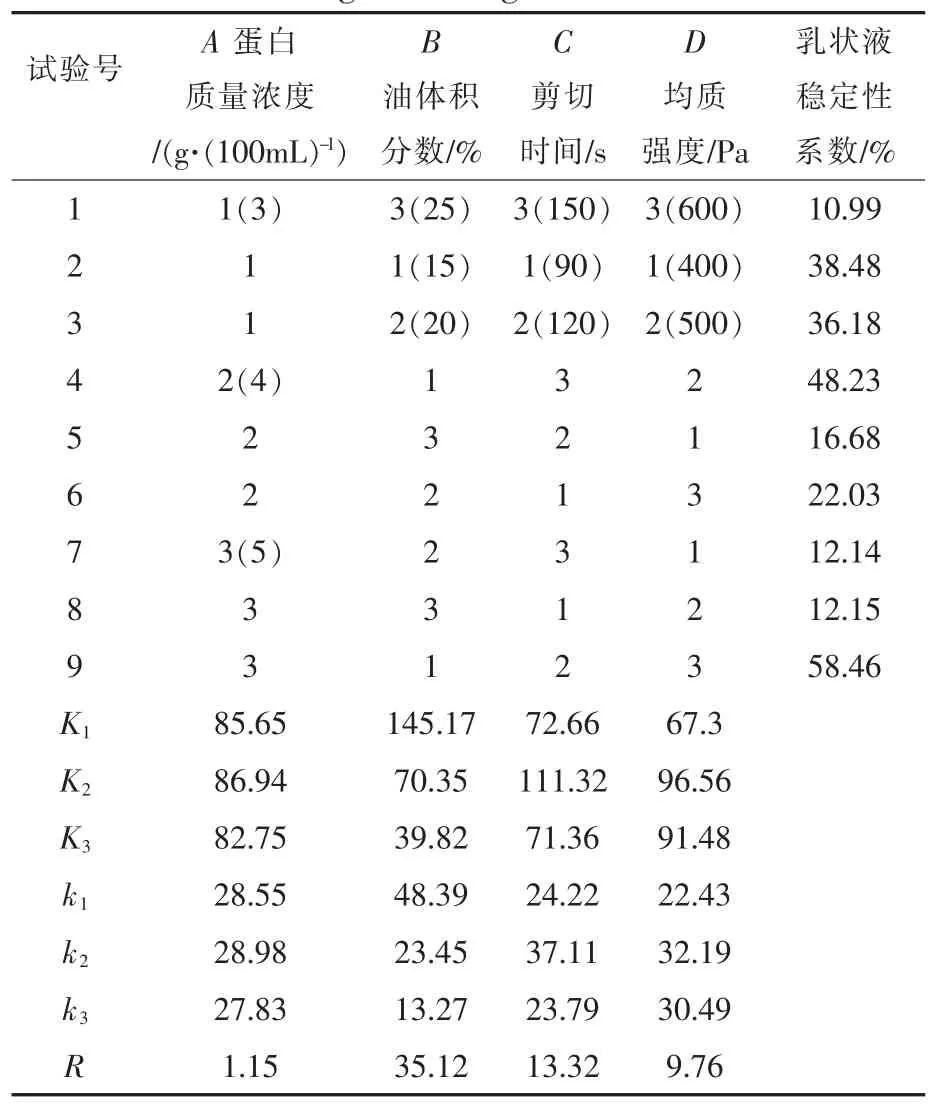
表2 SPC正交试验设计与结果Table 2 Orthogonal design and results of SPC
通过正交试验和数据处理,结果表明,影响SPI乳状液稳定性的因素主次顺序为B>A>C>D,即油体积分数对乳状液的稳定性影响最大,蛋白质量浓度和剪切时间影响次之,均质强度影响较小。考察A、B、C、D四因素在3个水平上的变化,得出SPI乳状液最佳制备条件为A3B3C2D1,即蛋白质量浓度5 g/100 mL、油体积分数为25%、剪切时间为30 s、均质强度为200 Pa时SPI乳状液稳定性最高。影响SPC乳状液稳定性的因素主次顺序为B>C>D>A,即油体积分数对乳状液的稳定性影响最大,剪切时间和均质强度影响次之,蛋白质量浓度影响较小。考察A、B、C、D四因素在3个水平上的变化,得出最佳制备条件为A2B1C2D2,即蛋白质量浓度4 g/100 mL、油体积分数为15%、剪切时间为120 s、均质强度为500 Pa时制得的乳状液稳定性最高。
经验证,最佳条件下SPI和SPC乳状液的稳定性系数分别为91.66%和60.17%。
2.3 两种大豆蛋白乳液体系的稳定性分析
2.3.1 粒径对乳液稳定性的影响
由表3与图5可看出,随着蛋白质量浓度的增加,SPI乳液粒径逐渐减小,SPC乳液粒径整体呈先减小后增大趋势,粒径显著高于SPI。结合图1,随蛋白质量浓度的增加,两种乳液体系稳定性系数均先增加后减小,且单因素试验中SPC乳液稳定性普遍低于SPI,表明乳液的粒径与其稳定性有一定的相关性。Masuda等[13]在研究蛋白质量浓度对其乳状液稳定性的影响时发现,乳液平均粒径随蛋白质量浓度的增高逐渐减小,乳状液的稳定性随之得到了明显的改善,这与本实验研究结果一致。粒径是影响乳状液稳定性的重要因素,油滴越小,乳析速度越慢,乳状液越稳定。与SPI相比,任意浓度SPC乳状液粒径均较大,分析原因,可能是醇法SPC在浸出时由于醇溶液的变性、沉淀作用,蛋白质分子发生了重新构造,伴随自聚集循环在熵变的驱动下形成了蛋白质聚集微粒,使得SPC溶解性和疏水性较低,不利于蛋白质在油/水界面的扩散和分布,乳液油滴表面吸附的蛋白含量有限[14]。油滴之间的排斥作用主要是靠界面吸附蛋白间的静电斥力,故SPC乳状液液滴之间的排斥力较弱,乳液粒径较大,液滴易聚集,这是SPC乳状液稳定性差于SPI的主要原因,且蛋白质量浓度越低、乳液粒径越大,越易发生絮凝,这在后面的实验中也得到了印证。
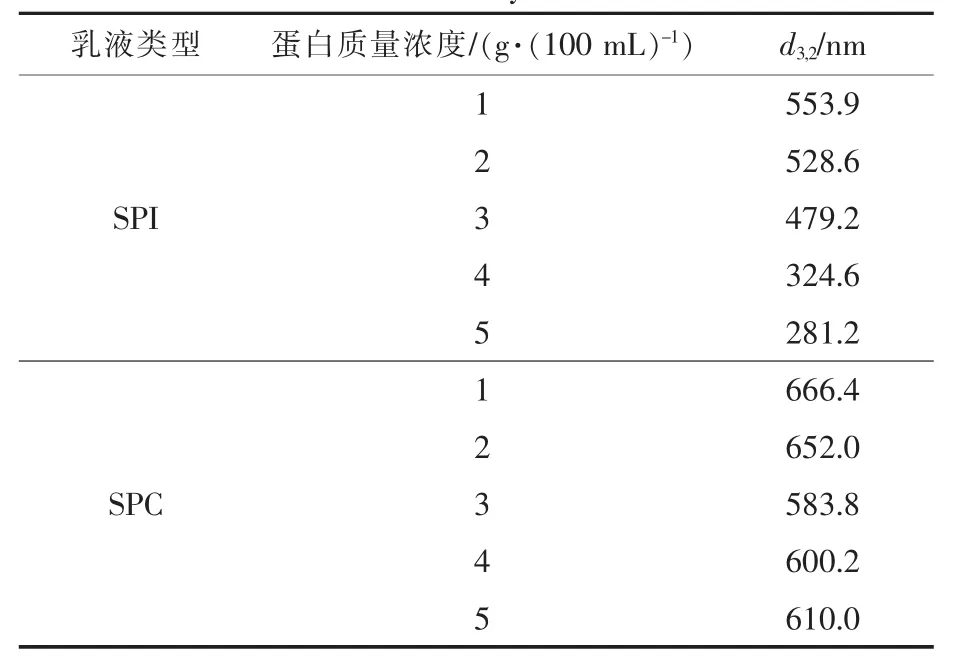
表3 两种乳液体系的平均粒径分布Table 3 Average particle size distribution of the two emulsion systems
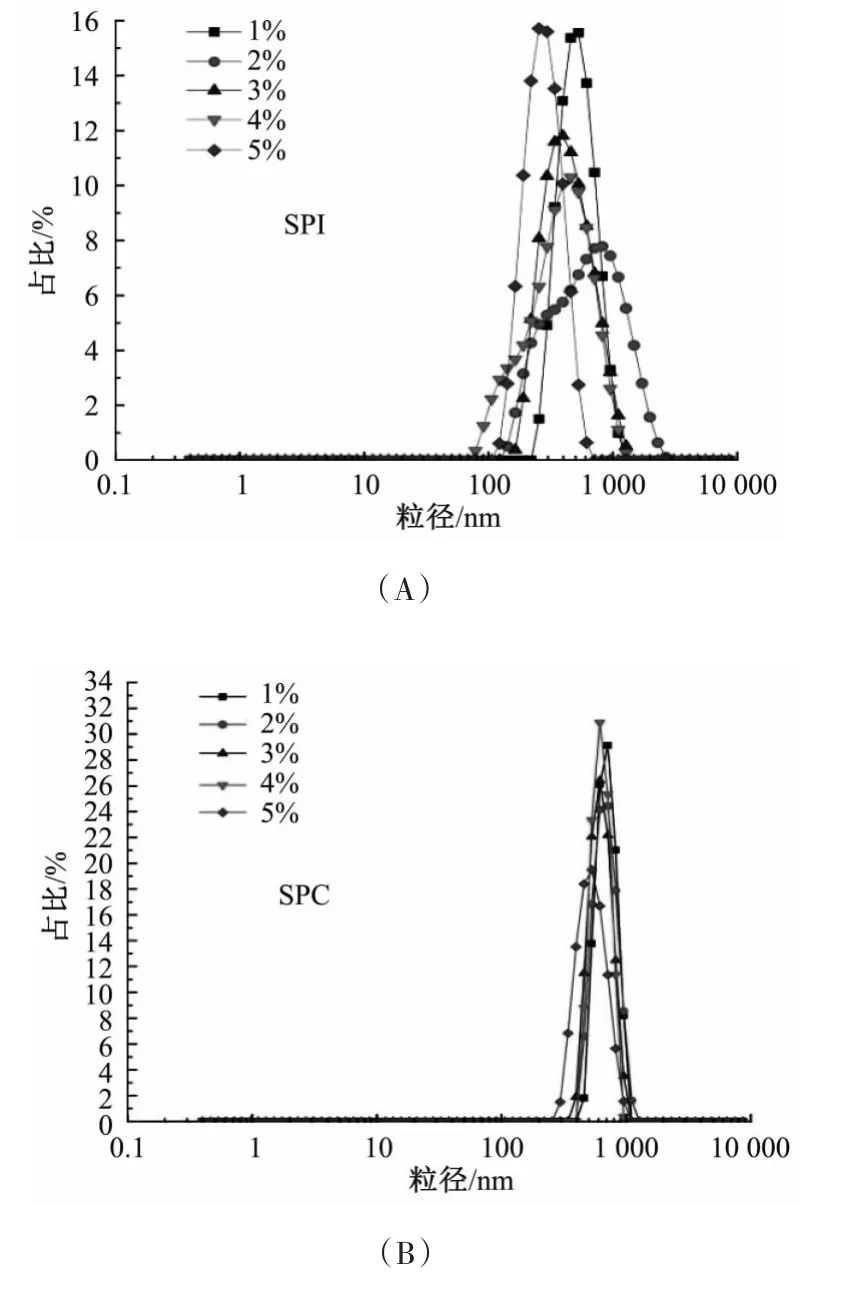
图5 两种乳液体系粒度分布Fig.5 Particle size distribution of the two emulsion systems
2.3.2 zeta电位对乳液稳定性的影响
由图6可看出,随着蛋白质量浓度的增加,SPI乳液zeta电位绝对值逐渐增大,最大为33.9 mV。结合图1与图5(A),表明乳液稳定性与粒径、电位具有一定的联系,粒径越小、电位绝对值较大时乳液更容易保持稳定。SPC乳液电位绝对值在蛋白质量浓度为1~4 g/100 mL时无显著差异,在5 g/100 mL时最小,为26.2 mV。此外,SPI与SPC乳液的zeta电位无显著差别。一般地,天然蛋白质分子自身均带有可电离的基团,当处于pH高于其等电点的体系中时,蛋白质带负电,低于其等电点时带正电。从图6可看出,中性pH条件下两种乳液体系的zeta电位均为负值,与其理论带有的电荷种类一致。通常认为电位大于+30 mV或小于-30 mV时,液滴是稳定的,电位大小主要取决于液滴界面物质所带电荷的多少,而SPI与SPC在其乳液体系中均充当乳化剂的作用,经剪切乳化和高压均质后吸附于液滴表面,是主要的界面物质,因此两种乳液体系的电位受界面蛋白含量影响,界面蛋白含量越多,液滴之间的静电斥力越强,乳液电位的绝对值越大,分子之间的排斥挤压作用使液滴粒径减小,有效阻止了液滴的聚集[15]。

图6 蛋白质量浓度对乳液zeta电位的影响Fig.6 Effect of protein mass concentration on zeta potential of emulsion
2.4 两种大豆蛋白乳液体系的储藏稳定性
在剪切时间为30 s(120 s)、油体积分数为20%(15%)、均质强度为 200 Pa(500 Pa)下,记录不同质量浓度的SPI、SPC乳状液在4℃条件下16 d内的乳析情况,并观察16 d后乳液的微观絮凝情况。
2.4.1 乳析指数
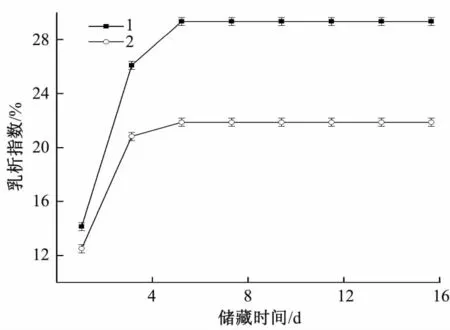
图7 SPC蛋白质量浓度对乳液乳析指数的影响Fig.7 Effect of protein mass concentration on SPC emulsion creaming index
由图 7可看出,SPC添加量为 1、2 g/100 mL时制得的乳状液在第2天开始出现絮凝,在4 d之后发生明显的絮凝,结合前面实验结果,这两种乳状液粒径普遍高于其他组,液滴间静电斥力较弱,易发生聚集,添加3、4 g/100 mL SPC的体系较稳定,无明显分层现象。而SPI乳状液在实验浓度下均未发生分层现象,保持了良好的稳定性。从SPI与SPC的制备工艺来看,二者是以脱脂豆粕为原料,均脱除了其中的可溶性碳水化合物,区别在于SPI又进一步通过离心去除了豆粕中的不溶性碳水化合物(cotyledon fibers:子叶纤维)[16]。这些不溶物质一方面会影响SPC的溶解性,另一方面,有研究发现一些带电多糖以及许多非离子多糖不能与蛋白质结合成复合物,被蛋白覆盖的液滴会因未被吸附多糖的排斥作用而发生排斥絮凝和相分离,而纤维素是主要的非离子多糖之一,推测这些不溶性碳水化合物的存在可能是SPC比SPI乳状液稳定性较差的原因之一[17]。
2.4.2 微观结构
由图8和图9可看出,低质量浓度SPC(1 g/100 mL)制得的乳状液在16 d后发生明显絮凝,乳液不再是颗粒分明的状态,而是彼此聚集粘连成一团,SPC蛋白质量浓度为4 g/100 mL时,乳液基本保持稳定,有少量液滴发生聚集现象。添加SPI的乳液体系相对稳定,蛋白质量浓度即使为1 g/100 mL,乳液也能呈现颗粒分明的状态,只有少量液滴出现聚集、粘连现象,当质量浓度达到4 g/100 mL时,乳液体系尤为稳定,液滴分散均匀,大小均一,未发生聚集现象,这与乳液的乳析分层指数结果一致,从微观角度证实了前面蛋白质量浓度越高乳液越稳定的结论,以及SPI比SPC乳液更稳定的原因。Delahaije等[18]认为界面蛋白质分子的性质,如暴露的疏水性和电荷大小对乳液稳定性起关键作用,此外,界面吸附层(吸附量和界面面积)对乳液的聚集、絮凝稳定性也有重要影响,完全覆盖的界面能确保乳液稳定,防止聚结、絮凝。蛋白质量浓度较高时,油滴被蛋白充分覆盖,蛋白分子间的静电排斥、空间排斥等作用,促使形成的液滴粒径较小,阻止液滴聚集,提高了乳状液的储藏稳定性。
3 结论

图8 16 d后SPC乳液絮凝情况Fig.8 SPC emulsion flocculation after 16 days
利用正交试验设计对大豆蛋白乳状液的制备工艺进行了优化,得到了SPI乳状液的最佳制备条件为蛋白质量浓度5 g/100 mL,油体积分数为25%,剪切时间为 30 s,均质强度为 200 Pa,以及SPC乳状液的最佳条件为蛋白质量浓度4 g/100 mL,油体积分数为15%,剪切时间为120 s,均质强度为500 Pa。经过验证可知,最佳条件下SPI和SPC乳状液的稳定性系数可达到91.66%和60.17%。并深入探究了两种大豆蛋白乳状液的物化性质及储藏稳定性的差异,发现了粒径、电位与乳液稳定性有一定的相关性,较小的粒径(281.2 nm)和较大的电位绝对值(33.9 mV)是SPI乳状液更稳定的主要原因,乳析指数和微观结构证实了在储藏期间SPC乳液较SPI更容易发生絮凝,但当超过一定的添加量(4 g/100 mL)时,SPC乳状液也能保持较好的稳定性,仅发生轻微的絮凝。与SPI相比,SPC蛋白含量(70%左右)并不低,且价格低廉、制备工艺简单,对环境无污染,但由于功能性较差,目前多被用于制作幼畜代乳品和宠物饲料等,造成了资源浪费。下一步研究工作,可运用物理化学改性技术提高SPC乳液的稳定性,为扩大SPC的应用领域作出努力。
[1] 王欣,乔玲.大豆分离蛋白的营养、功能特性及应用研究[J].农业科技与装备,2013(5):55-56.
[2] 杨娟,王成根,彭捷,等.富含大豆异黄酮的大豆蛋白功能特性研究[J].现代食品科技,2014,30(7):98-102,178.
[3] TANG C H.Emulsifyingpropertiesofsoy proteins:a critical review with emphasis on the role of conformational flexibility [J].Critical Reviews in Food Science&Nutrition,2017,57(12):2636-2679.
[4] MAO L,MIAO S.Structuring food emulsions to improve nutrient delivery during digestion[J].Food Engineering Reviews,2015,7 (4):439-451.
[5] 张芬芬,曾茂茂,何志勇,等.大豆分离蛋白乳状液稳定性的几种分析方法比较[J].食品科学,2012,33(17):44-47.
[6] CHANAMAIR,MCClEMENTSDJ.Comparison ofgum arabic,modified starch,and whey protein isolate as emulsifiers:influence of pH,CaCl2and temperature[J].Journal of Food Science,2010,67(1):120-125.
[7] SOLEIMANPOURM,KOOCHEKA,KADKHODAEE R.Influence ofmain emulsion components on the physical properties of corn oil in water emulsion:Effect of oil volume fraction,whey protein concentrate and Lepidium perfoliatum,seed gum [J].Food Research International,2013,50(1):457-466.
[8] SHI J,TEXT A T F.Effects of protein concentration and oil-phase volume fraction on the stability and rheology of soybean oil-inwater emulsions stabilized by flaxseed mucilage protein concentrate.[J]. Journal of Food Engineering,2010,91(3):392-401.
[9] BOS M A,VAN V T.Interfacial rheological properties of adsorbed protein layers and surfactants:a review [J].Advances in Colloid&Interface Science,2001,91(3):437-471.
[10] 杨盛楠,翟爱华.高压均质对大豆分离蛋白功能性质的影响[J].中国酿造,2014,33(12):89-93.
[11] 汪鸿.焙烤专用脱模剂的制备及特性研究[D].郑州:河南工业大学,2012.
[12] LU X Y.The effect of oil components and homogenization conditions on the physicochemical properties of zedoary turmeric oil submicron emulsions[J].Journal of Dispersion Science and Technology,2009,31(11):1535-1540.
[13] MASUDA T,CHINEN H,FUKADA K.Effects of protein concentration and pH on oil droplet size in O/W emulsions stabilized by bovine serum albumin [J]. Chemistry Letters,2014,43(5):598-600.
[14] 樊永华.改性醇法大豆浓缩蛋白结构与功能性的相关性分析 [J].中国油脂,2016,41(7):29-32.
[15] LI P H,LU W C.Effects of storage conditions on the physicalstability ofd-limonene nanoemulsion [J]. Food Hydrocolloids,2016,53:218-224.
[16] LEE Y J.Manufacturing soy-protein concentrates and isolates by membrane technology.[J]. International Journal of Agriculture Innovations&Research,2015,3 (4):1150-1158.
[17] 蔡志宁,赵谋明.蛋白质乳浊液体系稳定性研究进展 [J].食品与发酵工业,2005,31(2):73-77.
[18] DELAHAIJE R J,GRUPPEN H,GIUSEPPIN M L,et al.Towards predicting the stability of protein-stabilized emulsions[J].Advances in Colloid&Interface Science,2015,219:1-9.
COMPARATIVE STUDY ON STABILITY OF SOYBEAN PROTEIN ISOLATE AND SOYBEAN PROTEIN CONCENTRATE EMULSION SYSTEMS
LI Huina,TIAN Shaojun,ZHANG Shaobing
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
The paper studied the optimum preparation conditions of SPI(soybean protein isolate)and SPC(soybean protein concentrate)emulsion through orthogonal tests,and discussed the effects of protein mass concentration,oil volume fraction,shear time and homogenization strength on the system stability.Results showed that the SPI emulsion had the highest stability coefficient(91.66%)under the conditions of protein mass concentration 5 g/100 mL,oil volume fraction 25%,shear time 30 s,and homogenization strength 200 Pa;and the SPC emulsion had the highest stability coefficient(60.17%)under the conditions of protein mass concentration 4 g/100 mL,oil volume fraction 15% ,shear time 120 s,and homogenization strength 500 Pa.Results of stability and flocculation analysis of SPI and SPC emulsions showed that creaming and flocculation occurred in SPC emulsion when the protein mass concentration was lower than 3 g/100 mL,and flocculation increased with the decrease of protein mass concentration;the particle size of SPI emulsion was smaller than that of SPC emulsion under the same protein mass concentration;under the optimum conditions,the particle sizes of SPI and SPC emulsion were 281.2 nm and 600.2 nm,and zeta-potentials were -33.9 mV and -26.2 mV,respectively;and the stability of SPI emulsion was higher than that of SPC emulsion due to its smaller particle size and larger absolute value of zeta-potential.
soybean protein emulsion system;orthogonal test;stability analysis
TS201.2
:B
1673-2383(2017)04-0006-08
http://kns.cnki.net/kcms/detail/41.1378.N.20170828.0857.004.html
网络出版时间:2017-8-28 8:57:11
2017-03-29
国家自然科学基金项目(31671887)
李慧娜(1991—),女,河南周口人,硕士研究生,研究方向为粮食、油脂与蛋白工程。
*通信作者
