蒜氨酸酶与凝集素的分离纯化及质谱鉴定分析
2017-09-13谢岩黎
王 威,谢岩黎
(河南工业大学 粮油食品学院,河南 郑州450001)
蒜氨酸酶与凝集素的分离纯化及质谱鉴定分析
王 威,谢岩黎*
(河南工业大学 粮油食品学院,河南 郑州450001)
对大蒜中的蒜氨酸酶和凝集素分离纯化并进行质谱分析。首次采用DEAE-Sepharose Fast Flow阴离子交换层析法对大蒜中蒜氨酸酶和凝集素进行了分离纯化,并采用SDS-PAGE电泳、MALDI-TOF/MS质谱法对目标蛋白进行了鉴定。结果表明:以Tris-HCl作为浸提液,经DEAESepharose Fast Flow柱纯化的蒜氨酸酶和凝集素可达到电泳纯,质谱结果表明,所分离目标物质为蒜氨酸酶和大蒜凝集素,其分子质量分别为54.147 ku和12.152 ku。
蒜氨酸酶;大蒜凝集素;分离纯化;质谱分析
0 引言
大蒜原产于西亚、中亚,与洋葱、葱、韭菜等属于百合科葱属植物(Allium tuberosum)。大蒜味辛性温,风味独特,是常见的饮食调味品,其营养组分多样,种类较为齐全,含有大量对人体健康有益的物质,如维生素、氨基酸、微量元素、含硫有机物、肽类和苷类等,具有很好的药理活性和丰富的营养价值[1]。
凝集素(lectin)是一类能够使细胞凝集的糖蛋白,具有高度的糖结合专一性,是生命科学和临床科学常用的研究工具,广泛应用于刺激淋巴细胞分裂、肿瘤治疗、艾滋治疗等分子与细胞、细胞与细胞相互作用中[2]。据Smeets等[3]报道大蒜凝集素的等电点为4.94。
蒜氨酸酶(Alliinase)在自然状态下,稳定地存在于细胞液泡中,与在葱[4]、洋葱[5]、韭菜[6]中发现的蒜氨酸酶具有较高的同源性,风味物质蒜素(Alliin)是经大蒜组织破裂后,液泡中的蒜氨酸酶进入细胞质中,作用于其中的蒜氨酸而形成的。且蒜素对环境较敏感,易分解,从大蒜中直接分离蒜素十分困难。因此有学者考虑通过从大蒜中分离蒜氨酸酶和蒜氨酸生产纯品蒜素以保持其生物活性,Kao等[7]在磷酸盐缓冲体系中采用 HiTrap Q Sepharose离子交换法,分离纯化蒜氨酸酶,N端氨基酸测序为 KMTWTMKAAEEAEAVAN。据 Rabimkov等[8]的报道,蒜氨酸酶的等电点为6.35。为此笔者以Tris-HCI为浸提液提取大蒜粗蛋白溶液,利用DEAE-Sepharose Fast Flow树脂做进一步的分离纯化,并通过SDS-PAGE电泳和MALDITOF/MS质谱法对蒜氨酸酶和凝集素进行鉴定。
1 材料与方法
1.1 材料与试剂
大蒜产自河南中牟;DEAE-Sepharose Fast Flow、SDS-PAGE试剂盒、低分子质量蛋白质Marker(14.4~97 ku)、考马斯亮蓝 R250、G250、Tris购自索莱宝(Solarbio);溴酚蓝、甘氨酸等购自天津科密欧;石油醚、盐酸、SDS、β-巯基乙醇等均为分析纯。
1.2 仪器与设备
LGT-10C真空冷冻干燥机:北京四环科学仪器厂;KDC-160HR高速冷冻离心机:安徽中科中佳科学仪器有限公司;B13-3型智能恒温定时磁力搅拌器:上海司乐仪器有限公司;DHL-2电脑恒流泵、HD-9707电脑紫外检测仪、DBS-160F 电脑自动部分收集器:上海精科实业有限公司;UV-6100双光束紫外分光光度计:上海美谱达仪器有限公司;EPS-300电泳仪、VE 180微型垂直电泳槽、Tanon 2500全自动数码凝胶成像分析系统:上海天能科技有限公司;5800 MALDI-TOF/TOF串联飞行时间质谱仪:美国AB SCIEX公司。
1.3 方法
1.3.1 大蒜脱脂
将新鲜大蒜剥皮、洗净、切薄片。真空冷冻干燥后粉碎,用石油醚脱脂。
1.3.2 蛋白浸提
将脱脂大蒜粉末与Tris-HCl缓冲液(50 mmol/L,pH7.2)料液比为 1∶5混合,4℃磁力搅拌 4 h后,4℃,6 000 g离心 40 min,沉淀部分用 Tris-HCl缓冲液(50 mmol/L,pH7.2)反复浸提 2次。
1.3.3 蒜氨酸酶和凝集素的纯化
采用阴离子交换树脂 DEAE-Sepharose Fast Flow(Φ1.0 cm×30 cm)分离纯化,用 Tris-HCl缓冲液(50 mmol/L,pH7.2)平衡柱子,待柱子洗脱平衡后,添加15 mL大蒜粗蛋白溶液,并用Tris-HCl缓冲液(50 mmol/L,pH7.2)进行洗脱,洗脱至基线;然后用含 0~0.2 mol/L NaCl的 Tris-HCl缓冲液(50 mmol/L,pH7.2)连续梯度洗脱,流速为 1.5 mL/min,6 mL/管,紫外吸收法(A280nm)在线检测。
1.3.4 SDS-PAGE分离蛋白
采用不连续SDS-PAGE电泳法分离蒜氨酸酶和凝集素,将收集到的蛋白溶液对应收集峰分别取样,浓缩胶含量为12%,分离胶含量为5%,胶厚为1.7 mm。
1.3.5 质谱鉴定
将目标蛋白条带从电泳胶中切下,转移到离心管中,加入400 μL NH4HCO3/30%ACN脱色液,多次清洗,直至将目标蛋白条带的颜色洗至透明,弃去脱色液,加入100 mmol/L NH4HCO3,室温下孵育15 min。弃去上清液,真空冷冻干燥后,加入 5 μL 10 ng/μL测序级 Trypsin溶液,37℃反应过夜。酶解液转入新的离心管中,原管中加入100 μL 60%ACN/0.1%TFA,超声15 min,合并酶解液,冻干。
取2 μL 20%乙腈加入到酶解样品中,复溶。取1 μL复溶样品,点样于样品靶上,溶剂自然干燥后,再取0.5 μL过饱和CHCA基质溶液(溶剂为50%ACN 0.1%TFA)点至对应靶位上并自然干燥、氮气吹净。放入串联飞行时间质谱仪分析。
质谱检测条件设置为正离子检测、反射模式,一级质谱肽段扫描范围设置为800~4 000。使用Data Explorer软件将所得的一级质谱数据和二级质谱数据进行分析,将分析结果与Mascot数据库中的数据进行比对,鉴定蛋白质。
2 结果与分析
2.1 离子交换层析分离纯化蒜氨酸酶和凝集素
在本试验中,以Tris-HCl作为浸提液、DEAESepharose Fast Flow阴离子交换层析法从大蒜粗蛋白溶液中分离纯化蒜氨酸酶和凝集素,其层析曲线见图 1(A),电泳鉴定结果见图 1(B)。
电泳泳道1(对应图1(A)中收集峰)中的杂蛋白为在pH 7.2的条件下带正电荷,与DEAESepharose Fast Flow树脂无亲和力而被Tris-HCl缓冲液直接洗脱下来。
将NaCl浓度增大到0.05 mol/L时,出现洗脱峰2。从SDS-PAGE电泳图中发现洗脱峰2对应的蛋白液中含有一条高纯度的蛋白条带(图1泳道2),分子质量约 54 ku,这与 Rabimkov等[8]报道的蒜氨酸酶分子质量数据相吻合,灰度扫描该蛋白纯度大于90%,将通过质谱做进一步的鉴定。
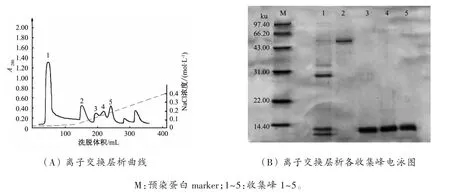
图1 阴离子交换层析法分离纯化蒜氨酸酶和大蒜凝集素Fig.1 Anion-exchange chromatography on DEAE-Sepharose Fast Flow of garlic alliinase and lectin
继续加大NaCl浓度,出现洗脱峰3,收集该蛋白液,其中发现纯度较高且分子质量为12 ku的蛋白,即为大蒜凝集素,与Smeets等[3]报道的大蒜凝集素分子质量数据相吻合,灰度扫描该蛋白纯度大于95%,将通过质谱做进一步的鉴定。
2.2 蒜氨酸酶质谱分析
将图2泳道2的目标条带切下,对目标条带进行酶解,将酶解后所得的肽段使用美国AB SCIEX公司的MALDI-TOF-TOF串联飞行时间质谱仪进行分析,得到一级质谱数据(图 2(A)),再根据该质谱图的信号源,选择其中信号较强的一个肽段再次进行分析,获得二级质谱数据,将所获得的一级质谱数据和二级质谱数据与NCBInr蛋白质数据库的数据进行检索比对,发现本试验纯化所得的蛋白与数据库中蒜氨酸酶(序列号ACN78838.1)蛋白相匹配。匹配度为100%(图略),分子质量为54.147 ku。而根据二级质谱图(1 402.8 u信号源),所得氨基酸序列VVAHAPFYPVFR与Kao等[7]所报道蒜氨酸酶序列196~207相同。

图2 蒜氨酸酶质谱图Fig.2 The MALDI-TOF/MS spectrum of alliinase
2.3 大蒜凝集素的质谱鉴定
操作同2.2,鉴定图1(B)泳道3中的分子质量约为12 ku的目标蛋白,发现与NCBInr数据库中大蒜凝集素(序列号AAA32643.1)蛋白相匹配。匹配度为100%(图略),分子质量12.152 ku。而根据二级质谱图(1 839.9 u信号源),所得氨基酸序列AVLQSDGNFVVYDAEGR与Smeets等[3]所报道蒜氨酸酶55~71序列相同。

图3 凝集素质谱图Fig.3 The MALDI-TOF/MS spectrum of lectin
3 讨论
试验结果表明,以Tris-HCl缓冲液(50 mmol/L,pH7.2)作为浸提液浸提大蒜粗蛋白溶液,利用DEAE-Sepharose Fast Flow阴离子交换层析法、SDS-PAGE电泳鉴定进一步分离粗蛋白溶液中的蒜氨酸酶和大蒜凝集素,具有较高的纯度,分别达到了90%、95%,均达到电泳纯,目标蛋白条带经质谱分析、软件分析所得一级质谱数据与二级质谱数据与NCBInr数据库进行比对,进一步鉴定经此方法分离的蛋白质为蒜氨酸酶和大蒜凝集素,蒜氨酸酶分子质量为54.147 ku,大蒜凝集素分子质量为12.152 ku。
[1] LANZOTTI V.The analysis of onion and garlic[J].Journal of Chromatography A,2006,1112(1-2):3-22.
[2] SHARON N,LIS H.History of lectins:from hemagglutinins to biological recognitionmolecules [J].Glycobiology,2004,14(11):53R-62R.
[3] SMEETS K,VAN DAMME E J,VERHAERT P,et al.Isolation,characterization and molecular cloning of the mannose-binding lectins from leaves and roots of garlic(Allium sativum L.)[J].Plant Molecular Biology,1997,33(2):223-234.
[4] VAN DAMME E J,SMEETS K,TORREKENS S,et al.Isolation and characterization of alliinase cDNA clones from garlic(Allium sativum L.) and related species[J].European Journal of Biochemistry,1992,209 (2):751-757.
[5] LANCASTER J E,SHAW M L,JOYCE M D P,et al.A novel alliinase from onion roots.Biochemical characterization and cDNA cloning.[J].Plant Physiology,2000,122(4):1269-1279.
[6] MANABE T,HASUMI A,SUGIYAMA M,et al.Alliinase 〔S-alk(en)yl-L-cysteine sulfoxide lyase〕 from Allium tuberosum(Chinese chive)purification,localization,cDNA cloning and heterologous expression [J].European Journal of Biochemistry,1998,257(1):21-30.
[7] KAO S H,HSU C H,SU S N,et al.Identification and immunologic characterization of an allergen,alliin lyase,from garlic (Allium sativum)[J].Journal of Allergy and Clinical Immunology,2004,113(1):161-168.
[8] RABIMKOV A,ZHU X Z,GRAFI G,et al.Alliin Lyase (Alliinase) from garlic(Allium sativum) [J]. Applied Biochemistry and Biotechnology,1994,48(3):149-171.
THE PURIFICATION OF ALLIINASE AND LECTIN AND MASS SPECTROMETRY SPECTROMETRY IDENTIFICATION
WANG Wei,XIE Yanli
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
In this study,alliinase and lectin were extracted and purified from garlic and their mass spectrometry identification was also investigated.Garlic alliinase and lectin was isolated by Sepharose Fast Flow ion exchange chromatography,and the target proteins were identified by SDS-PAGE and MALDI-TOF/MS.The results indicated that the purity of alliinase and lectin reached 90%and 95%respectively and was qualified for electrophoresis analysis by DEAE-Sepharose Fast Flow column purification using Tris-HCl (50 mmol/L,pH7.2) as an extract.The results of mass spectrometry showed that the target substances were alliinase and lectin with molecular weight of 54.147 ku and 12.152 ku respectively.
alliinase;lectin of garlic;isolation and purification;mass spectrometry
TS201.2
:B
1673-2383(2017)04-0020-04
http://kns.cnki.net/kcms/detail/41.1378.N.20170828.0857.008.html
网络出版时间:2017-8-28 8:57:13
2017-01-14
国家重点研发计划专项课题(2016YFD0400203)
王威(1993—),男,河南周口人,硕士研究生,研究方向为食品营养与安全。
*通信作者
