新疆伊犁河不同生境大型底栖动物群落及其影响因素
2017-09-12帅贾娜尔阿汗张振兴李昆孙东东杨海军
于 帅贾娜尔·阿汗张振兴李 昆孙东东杨海军
(1. 东北师范大学生命科学学院, 长春 130000; 2. 伊犁师范学院生物与地理科学学院, 伊宁 835000)
新疆伊犁河不同生境大型底栖动物群落及其影响因素
于 帅1贾娜尔·阿汗2张振兴1李 昆1孙东东1杨海军1
(1. 东北师范大学生命科学学院, 长春 130000; 2. 伊犁师范学院生物与地理科学学院, 伊宁 835000)
于2014和2015年7月对新疆伊犁河支流喀什河和巩乃斯河共14个采样点的大型底栖无脊椎动物进行了调查研究, 比较分析了自然、受损、坝下和保护区4种生境的大型底栖动物群落结构特征。共采集大型底栖动物14435头, 属10目39科81属(种), 其中水生昆虫、软体动物、寡毛类分别占93.8%、2.5%和3.7%。对不同生境大型底栖动物群落结构特征进行了分析比较, 结果表明: 自然生境在物种数、优势物种数、EPT物种数、密度和物种多样性方面均高于其他3种生境, 而坝下生境均最低, 保护区生境底栖动物群落结构优于受损生境和坝下生境。冗余分析(RDA)结果共解释了物种数据累计方差的54.1%, 流速、电导率、水温和海拔是影响伊犁河底栖动物分布的主要因素(F=2.28—4.34, P<0.05)。
伊犁河; 底栖动物; 人为活动; 环境因子; 水电开发
河流是自然环境中重要的生态系统之一, 为人类提供各种各样的生态系统服务[1]。但近年来由于人类活动加剧, 使河流受到严重破坏, 这种破坏势必会对河流生物产生不利的影响。大型底栖动物作为河流生态系统的重要组成部分, 处于食物链的中间环节, 其类群组成决定了河流中的物质循环和能量流动方式, 且能很好地指示河流的环境状况[2,3],对底栖动物群落结构的研究有助于了解河流生态系统的结构、功能与健康状况[4]。
生境是影响底栖动物群落的重要环境因素, 目前针对生境与底栖动物群落间关系的研究大多集中在沿海地区[5—7]。新疆伊犁河是流经中国和哈萨克斯坦的一条国际河流, 对新疆伊犁地区的农业发展和电力供应起着重要作用[8]。近年来伊犁河第二大支流喀什河人为活动加剧, 河道采砂和梯级水电开发严重影响了河流的自然生境。然而, 目前对于伊犁河水生生物群落和多样性的研究相对较少, 且主要集中在鱼类方面[9,10]。韦丽丽等[11]于2013年对伊犁河周丛藻类进行了调查, 并基于此对伊犁河水质进行了生物学评价。王军[12]于2012—2014年期间对伊犁河的底栖动物群落进行了简单的调查, 但仅在本文研究区域布设3个样点, 缺乏整体性的研究, 且以上研究均无人为活动对水生生物群落干扰的分析。本研究以大型底栖动物为研究对象, 分析了伊犁河4种生境下底栖动物群落结构特征的差异。以期为喀什河河流现状的评估和管理提供科学数据支撑。
1 研究区域概况与研究方法
1.1 研究区域概况
研究区域位于新疆伊犁哈萨克自治州伊犁河流域, 流域面积5.6×104km2。该流域位于欧亚大陆腹地新疆天山山地西部, 属大陆性中温带干旱气候,流域年平均气温10.4℃, 年均降水量417.6 mm[8]。伊犁河发源于哈萨克斯坦境内的汗腾格里峰北坡,流经中国与发源于中国境内的第二、三大支流喀什河和巩乃斯河汇集, 最后注入巴尔喀什湖, 全长1236.5 km, 国内主源流长442 km。其中, 喀什河全长297 km, 海拔高程690—5000 m, 河床平均坡降6.8%, 多年平均径流量38.7×108m3, 平均含沙量0.41 kg/m3;巩乃斯河全长258 km, 海拔高程800—4000 m, 河床平均坡降0.7%, 多年平均径流量15.9×108m3, 平均含沙量0.34 kg/m3[13,14]。伊犁河上共建有9座水电站, 其中有7座不同等级的大、中型梯级水电站分布于喀什河上(图 1)。另外, 喀什河上游的河道采沙活动导致吉林台一级水电站上游河段河流生境严重破坏。喀什河下游分布有国家级自然保护区小叶白蜡自然保护区, 占地面积91.03 km2, 是我国唯一的小叶白蜡天然林。
1.2 样点设置与生境划分
共设置14个采样点, 于喀什河上游至下游设置9个采样点, 依次命名为K01—K09。巩乃斯河上游在海拔、河流比降等河流属性上同喀什河较为相近, 且基本处于自然状态, 故仅在上游(至那拉提段)选取5个样点, 依次命名为G01—G05(图 1)。喀什河各采样点中, K01、K02、K03、K05主要受到河道采砂和水电开发的影响, 为受损生境; K04、K06分别位于吉林台二级水电站和托海水电站出水口的正下方, 受到水电站的影响最为严重, 故单独划分为坝下生境; K07—K09位于小叶白蜡自然保护区内,受到人为干扰较小, 为保护区生境; 巩乃斯河采样点G01—G05位于基本无人为干扰的巩乃斯河上游,为自然生境。
1.3 样本采集、处理与功能摄食类群划分
分别于2014和2015年7月对伊犁河14个样点的大型底栖动物进行定量采集。采用0.09 m2的索伯网(Surber sampler)于每个调查断面依据不同生境比例进行5次重复采样。采集到的样本分别装入塑封袋标号, 带回实验室于白瓷盘中挑拣。将挑拣出的底栖动物装入50 mL的标本瓶中, 加入75%的酒精溶液保存, 在解剖镜和显微镜下分类鉴定、计数。底栖动物的鉴定主要依照Morse、Merritt and Cummins等[15—17], 鉴定水平基本达到属级, 部分鉴定到科或种。功能摄食类群的划分则参照Barbour和Merritt等的划分方法[16,18,19]。将采集到的底栖动物划分为5个主要功能摄食类群, 分别为收集者(Gather-collectors, GC)、捕食者(Predators, PR)、刮食者(Scrapers, SC)、撕食者(Shredders, SH)和滤食者(Filter-collectors, FC)。
1.4 环境指标测定
于各采样位点测量水体的pH、水温(WT)、流速(CV)、溶解氧(DO)、电导率(CON)和水深(WD)。水体pH (pH)、水温(WT)用HANNA HI 8424便携式防水型测定仪现场测定, 流速(CV)采用LS300-A便携式流速仪在每个采样点0.6倍水深处进行测定, 溶氧(DO)、电导率(CON)采用Hach SenION 156便携式多参数测定仪测定, BOSCH GLM 80 professional激光测距仪测定河宽, 带有刻度的木棍测定水深, 同时采用Garmin MAP 60 CSX型定位仪对各断面进行标记, 获得各样点的经纬度及海拔数据。
1.5 数据处理

图 1 样点布设及水电站分布图Fig. 1 Location of sampling sites and hydropower plants
对2次采样数据做平均处理。底栖动物的密度、物种数、EPT物种数及多样性指数差异性检验使用SPSS19.0进行单因素方差分析(ANOVA), 若差异显著, 用Duncan法进行多重比较; 若方差不齐,选用非参数Kruskal-Wallis单因素ANOVA检验。采用Canoco 5.0分析底栖动物与环境因子间的关系,对物种数据进行去趋势分析(DCA), 如果4个轴中的最大梯度长度大于4, 采用单峰模型典范对应分析(CCA); 如果小于3, 采用线性模型冗余分析(RDA); 介于3和4之间两者方法均可。环境因子的筛选采用向前引入法(Forward selection), Monte carlo检验确定各环境因子对物种数据解释的方差值的显著性。文中采用的公式有: Shannon-Wiener指数[20]:改进的Shannon-Wiener指数[21]:Simpson指数[22]:式中, i为第i个物种, S为总物种数, Pi为第i个物种个体数占样本总个体数N的比例。McNaughton优势度指数[23]:其中, fi为第i种在各样点中出现的频率, ni为第i种的个数, 以Y>0.02确定优势种[24,25]。

表 1 伊犁河不同生境大型底栖动物物种组成Tab. 1 The composition of macroinvertebrates at different habitats in Ili River
2 结果
2.1 伊犁河大型底栖动物物种组成及优势种
物种组成 本次研究共采集到大型底栖动物14435头, 隶属于10目39科81(属)种。其中水生昆虫76种, 占总物种数的93.8%; 软体动物2种, 寡毛类3种, 分别占总物种数的2.5%和3.7%。伊犁河流域大型底栖动物水生昆虫主要由EPT物种(E. 蜉蝣目Ephemeroptera; P. 襀翅目Plecoptera; T. 毛翅目Trichoptera)和双翅目组成。常见种有似动蜉(Cinygmina sp.)、四节蜉(Baetis sp1.)、同襀(Isoperla sp.)、短石蛾(Brachycentrus sp.)、截脉沼石蛾(Apatania sp.)、朝大蚊(Antocha spp.)和粗腹摇蚊(Pelopia sp.)等。
不同生境物种丰富度差异 平均物种数在4种生境类型中差异极显著(P<0.01), 其中, 物种数最高的生境类型为自然生境, 其次是保护区, 坝下的物种数最低(图 2)。各种生境类型的EPT物种数分析, 仍显示出相同的规律, 即自然>保护区>受损>坝下。
递阶层次结构分为三个层次,分别为目标层、准则层和方案层。目标层只包含一个要素,一般是分析问题的预定目标或期望实现的结果;准则层包括了实现目标所涉及的中间环节,由若干层次组成,包括所需考虑的准则、子准则等;方案层表示为实现目标可供选择的方案、措施[5]。
不同生境的优势种组成 就整个流域而言,似动蜉(Cinygmina sp.)、假蜉(Iron sp.)、截脉沼石蛾(Apatania sp.)和粗腹摇蚊(Tanupus sp.)为优势物种。一般认为, 优势种种类越多且优势度越小, 则群落结构越为复杂、稳定[26]。各生境类型优势物种数从高到低依次为: 自然(9种)>保护区(6种)>受损(5种)>坝下(2种)。其中, 自然生境优势种多为EPT物种, 而坝下生境的优势种仅有颤蚓科的2种(表 2)。
2.2 不同生境大型底栖动物密度和生物量

图 2 伊犁河不同生境大型底栖动物物种数及EPT物种数
对4种生境类型的底栖动物密度分析发现(图 3): 自然生境底栖动物密度最高, 达到2004 ind./m2,保护区次之, 二者差异不显著(P>0.05); 坝下生境底栖动物密度最低, 为164 ind./m2, 与受损生境差异不显著(P>0.05), 且两者均与自然生境和保护区生境差异显著(P<0.05)。自然生境生物量显著高于其他3种生境(P<0.01), 均值为7.13 g/m2, 其中G02样点达到10.94 g/m2。受损生境、坝下生境和保护区生境平均生物量分别为3.17、0.78和2.53 g/m2, 三者之间差异不显著(P>0.05)。
2.3 物种多样性
采用Shannon-Wiener、改进的Shannon-Wiener和Simpson多样性指数对四种生境类型的底栖动物生物多样性进行分析(图 4)。3种多样性指数表现出的规律一致, 即自然生境的生物多样性最高,分别为2.05、8.36和0.79, 保护区样点生物多样性值次之, 坝下样点生物多样性最低, 为0.81、2.93和0.26。经one-way ANOVA检验, 3种指数除受损生境与保护区生境差异不显著(P>0.05)外, 其他生境间均差异显著(P<0.05)。
2.4 功能摄食类群
在采集到的大型底栖动物中, 捕食者26种、收集者24种、撕食者和刮食者各13种、滤食者6种,分别占总物种数的32.10%、29.63%、16.05%、16.05%和6.17%。其中, 坝下生境仅有收集者、捕食者和刮食者, 而滤食者与对干扰敏感的撕食者缺失, 其他3种生境类型功能摄食类群完整。就整个流域而言, 收集者占比最高, 达57.01%; 撕食者占比最低, 仅为2.30%。不同生境各功能摄食类群相对丰度组成有所不同(图 5), 其中受损生境和自然生

表 2 各采样点优势种及优势度Tab. 2 Dominant species and dominance (Y) of macroinvertebrates among sites
注: – 该生境类型采样点内不为优势种
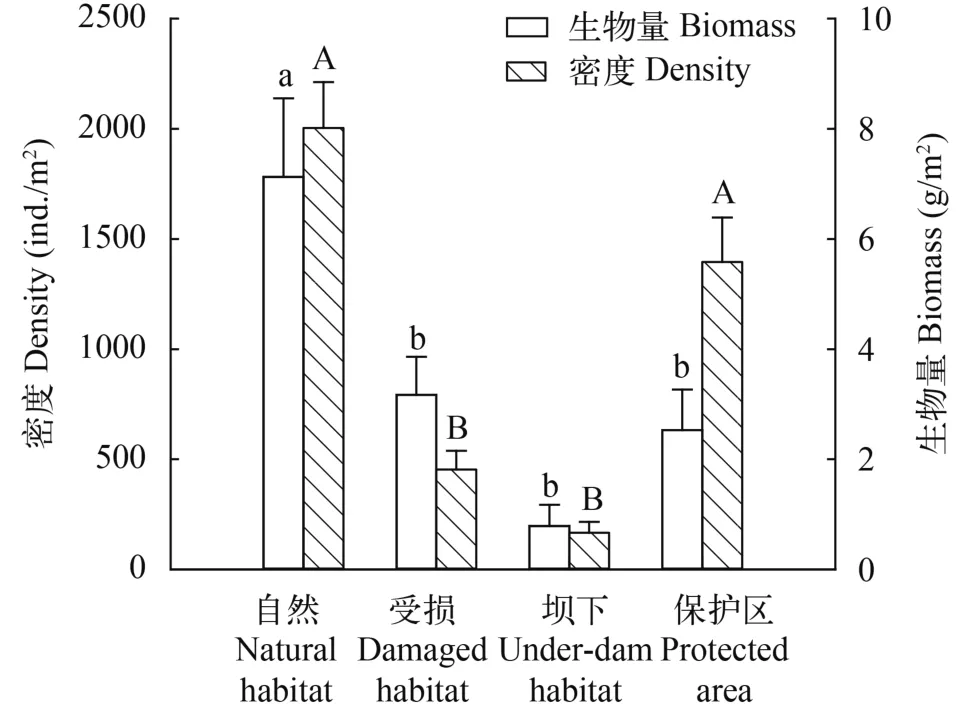
图 3 伊犁河不同生境大型底栖动物密度及生物量

图 4 伊犁河不同生境大型底栖动物生物多样性
Note: – non-dominant species in the habitat境最为接近。各功能摄食类群密度在4种生境中均为自然生境>保护区生境>受损生境>坝下生境(图 6)。
2.5 底栖动物群落与环境因子的关系
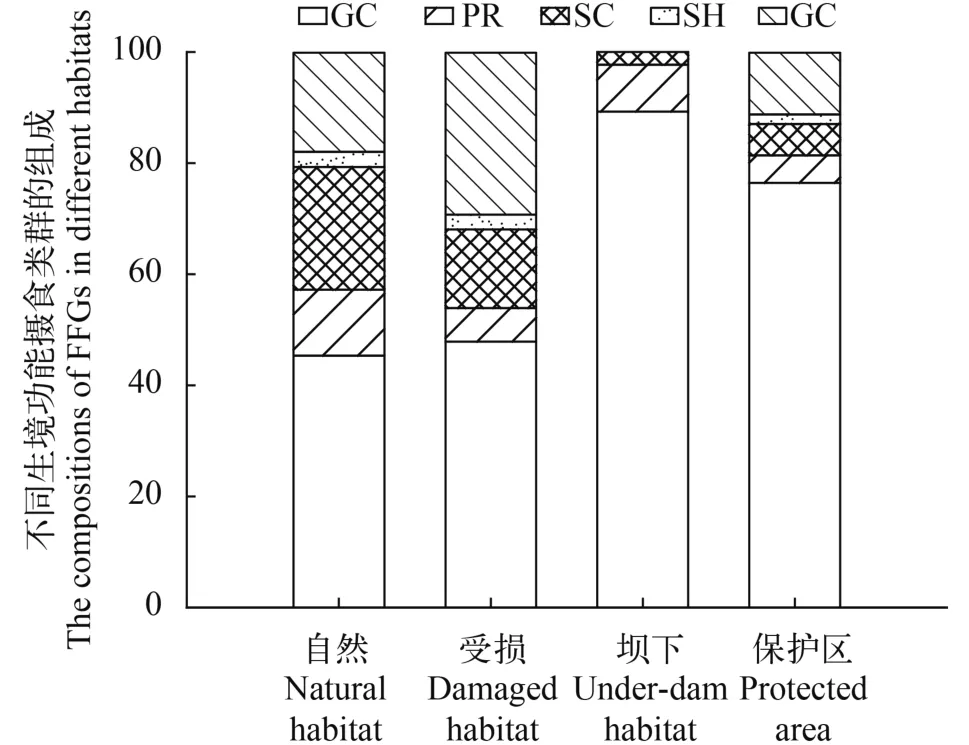
图 5 不同生境功能摄食类群变化
对伊犁河物种数据进行除趋势对应分析(DCA) (图 7), 排序轴最大梯度长度为2.342 (SD<3), 表明采用线性模型RDA更合适, 蒙特卡罗置换检验筛选出和底栖动物相关的环境因子有流速(CV)、电导率(CON)、水温(WT)和海拔(ALT)。第一轴和第二轴的特征值分别为0.283(F=3.55, P=0.016)和0.153,共解释了物种数据累计方差的43.6%, 所有轴的解释度为54.1%, 达到极显著水平(F=2.65, P=0.002),流速、水温主要贡献于第一轴, 相关系数为–0.87、0.66。海拔、电导率主要贡献于第二轴, 相关系数分别为0.62、–0.52。环境因子的筛选采用向前引入法(Forward selection), Monte carlo置换检验表明,在伊犁河各采样点中, 流速是影响底栖动物分布的主要环境因子(F=4.34, P=0.002), 其次是电导率、水温和海拔(F=2.95, P=0.018; F=2.72, P=0.022; F=2.28, P=0.034), 其他环境因子与底栖动物的分布关系不显著(P>0.05)。
3 讨论
就伊犁河4种生境而言, 自然生境状态下底栖动物物种丰富度、密度、生物多样性均最高, 且优势种也多为能够指示良好生境的EPT物种。该生境采样点(G01—G05)处于河流的上游河段, 海拔较高, 水质清洁, 底质异质性较高, 受到人为干扰较少,基本保持了河流的原始状态。有研究者认为[27], 高海拔地区能够支撑更高的生物多样性, 原因是高海拔生境往往具有较高的植被覆盖和外源物质输入,能够为底栖动物提供丰富的食物来源, 且较为多样的栖境能够支持不同生活类型的底栖动物。对于以枯枝落叶、粗颗粒有机物质为食的撕食者群落,也十分适宜。而王强等[28]则研究表明, 随着海拔的升高(1350—1716 m), 水生昆虫的Shannon-Wiener指数、Margalef指数和Pielou指数逐渐降低。也有研究表明底栖动物物种丰富度与海拔是一种可以用中域效应假说(Mid-domain effect)解释的单峰模型关系[29]。
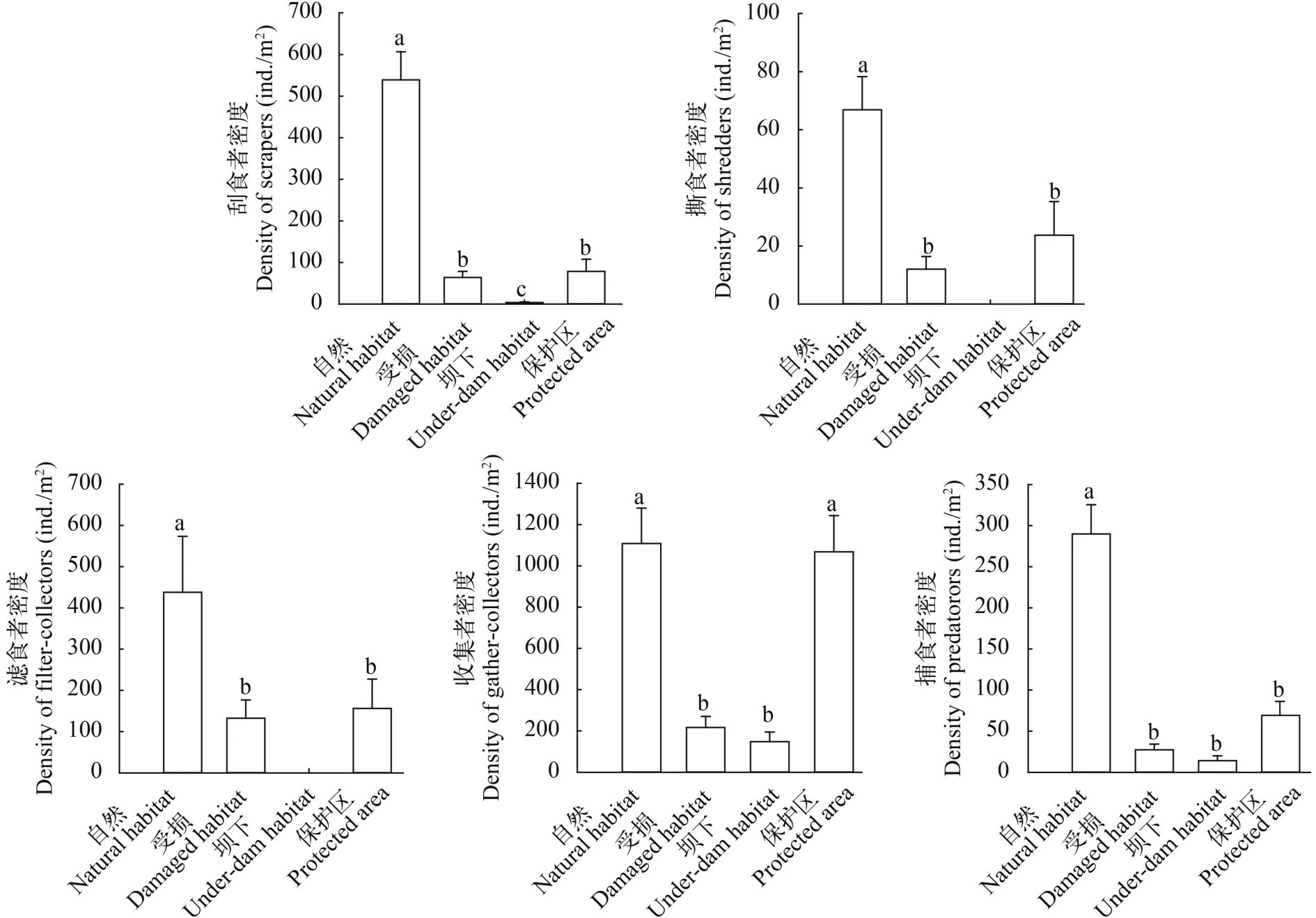
图 6 不同生境底栖动物功能摄食类群密度变化Fig. 6 Density of Functional Feeding Groups of macroinvertebrates in different habitats

图 7 冗余分析结果Fig. 7 Results of Redundancy analysis
保护区物种丰富度、密度和生物多样性均高于受损生境和坝下生境, 这表明保护区生境较另外两种生境更适合底栖动物的生存, 这一结果也突出了保护区对于河流恢复的积极作用。但从功能摄食类群结构上来看, 受损生境更接近自然生境。这可能因为受损生境和自然生境样点处于上游河段,而保护区位于下游河段, 其功能摄食类群组成由河流连续统理论[30]解释, 即随着河流自上而下的纵向变化, 河流的功能摄食类群随之发生变化, 上游河段各功能摄食类群均占有一定比例, 其中以撕食者和收集者占优, 而下游则收集者占有绝对优势, 撕食者和刮食者则占比非常小。
受损生境和坝下生境物种组成相对简单, 其原因是受水电开发和河道采砂的影响。河道采砂改变了河流的物理结构, 特别是底质, 使底栖动物筑巢、繁衍的栖息地遭受破坏, 同时河流的泥沙携带量等相关指标均发生变化, 对河流生物造成了严重的负面影响[31]。水电开发造成了河道生境的不稳定性, 流速、水温等相关指标受到影响[32,33]。从本研究结果来看, 这种影响对于坝下河流生物来说甚至是毁灭性的。坝下生境滤食者消失, 可能是坝下生境不能提供给滤食者需要用于传输食物的充分水量, 导致滤食者食物匮乏[34]。
流速、海拔和水温是影响伊犁河底栖动物分布的主要因素, 其中以流速为最主要影响因素。相关研究也表明流速是影响底栖动物群落形成的主要因素[35]。Beacger的研究结果显示: 底栖动物群落物种丰度、EPT丰度和密度在流速为0.3—1.2 m/s时最大[36]。在本研究中, 自然生境的流速普遍高于其他三种生境, 平均流速0.59 m/s。坝下生境流速最小, 平均流速仅为0.24 m/s。目前, 很多研究都已证明海拔对底栖动物群落结构存在影响, 本研究认为伊犁河较高的海拔(1581—2259 m)能够支持更为复杂的底栖动物群落结构。由于采样时间的不同可能会导致水温的测量值存在差异, 所以这点在实际分析中值得商榷。另外, 由于实验条件的限制,没有监测与河道采砂有关的透明度指标, 这将在进一步的工作中加以研究探讨。
本研究主要分析了不同生境条件下的底栖动物群落变化, 4种生境条件下的底栖动物群落结构和分布差异较为明显, 这也表明底栖动物群落结构能够很好地指示环境变化对河流生态系统的影响。研究结果也初步表明, 河道采砂和梯级水电开发对河流底栖动物群落结构产生的消极影响明显,特别是水电开发对大坝下方的底栖动物产生了毁灭性的影响, 伊犁河下游的保护区对底栖动物群落的恢复起到了积极的作用。
[1]Zhang Z M, Liu J G, Shen B F, et al. Evaluation of ecosystem services of the Yongding River in Beijing [J]. Acta Scientiae Circumstantiae, 2011, 31(9): 1851—1857 [张振明, 刘俊国, 申碧峰, 等. 永定河(北京段)河流生态系统服务价值评估. 环境科学学报, 2011, 31(9): 1851—1857]
[2]Shen H, Shi P L, Wu Y, et al. Macroinvertebrate community structure and water quality bioassessment of the Liangtang River [J]. Acta Hydrobiologica Sinica, 2016, 40(1): 203—210 [沈宏, 石彭灵, 吴耀, 等. 梁塘河大型底栖动物群落及其水质生物学评价. 水生生物学报, 2016, 40(1): 203—210]
[3]Giorgio A, Bonis D S, Guida M. Macroinvertebrate and diatom communities as indicators for the biological assessment of river Picentino (Campania, Italy) [J]. Ecological Indicators, 2016, 64: 85—91
[4]Yoshimura C, Tockner K, Omura T, et al. Species diversity and functional assessment of macroinvertebrate communities in Austrian rivers [J]. Limnology, 2006, 7(2): 63—74
[5]Ren P, Fang P F, Bao Y X, et al. Variation in mac-robenthic community characteristics among different types of wetlands in Xuanmen Bay [J]. Acta Ecologica Sinica, 2016, 36(18): 1—14 [任鹏, 方平福, 鲍毅新, 等.漩门湾不同类型湿地大型底栖动物群落特征比较研究.生态学报, 2016, 36(18): 1—14]
[6]Li H H, Jiang K, Bao Y X, et al. Biodiversity of macrobenthic communities in different habitats of Maoyan Island [J]. Chinese Journal of Ecology, 2015, 34(3): 765—772 [李海宏, 江旷, 鲍毅新, 等. 茅埏岛不同生境大型底栖动物生物多样性. 生态学杂志, 2015, 34(3): 765—772]
[7]Peng Z H, He X B, Feng W S, et al. Macrozoobenthic community structure in different types of habitat, Zhenjiang reach, the Yangtze River, China [J]. Resources and Environment in the Yangtze Basin, 2013, 22(4): 433—438 [彭增辉, 何雪宝, 冯伟松, 等. 长江镇江段不同生境类型底栖动物群落结构研究. 长江流域资源与环境, 2013, 22(4): 433—438]
[8]Sun H L, Li W H, Chen Y P, et al. Response of ecological services value to land use change in the Ili River Basin [J]. Acta Ecologica Sinica, 2010, 30(4): 887—894 [孙慧兰, 李卫红, 陈亚鹏, 等. 新疆伊犁河流域生态服务价值对土地利用变化的响应. 生态学报, 2010, 30(4): 887—894]
[9]Ren M L, Guo Y, Zhang Q L, et al. Fisheries Resources and Fishery of River Ili [M]. Harbin: Heilongjiang Science & Technology Press. 1998, 76—80 [任慕莲, 郭焱,张清礼, 等. 伊犁河鱼类资源及渔业. 哈尔滨: 黑龙江科学与技术出版社. 1998, 76—80]
[10]Niu Y J, Ren D Q, Chen S A, et al. Growth characteristics of Gymnodiptychus dybowskii Kessler in three tributaries of Ili River in Xinjiang, China [J]. Journal of Hydroecology, 2015, 36(6): 59—65 [牛玉娟, 任道全, 陈生熬, 等. 伊犁河三支流新疆裸重唇鱼的生长特性研究.水生态学杂志, 2015, 36(6): 59—65]
[11]Wei L L, Zhou Q, Xie C X, et al. Community structure of periphyton and biological assessment of water quality in the Yili River, Xinjiang Uyghur Autonomous Region [J]. Journal of Hydroecology, 2015, 36(6): 29—38 [韦丽丽,周琼, 谢从新, 等. 新疆伊犁河周丛藻类群落结构及其水质生物学评价. 水生态学杂志, 2015, 36(6): 29—38]
[12]Wang J. Studies on the community structure of macrozoobenthos and water quality assessment in the Ili River and Irtysh River, Xinjiang [D]. Thesis for Master of Science, Huazhong Agriculture University, Wuhan. 2015 [王军. 新疆伊犁河与额尔齐斯河大型底栖动物的群落结构及其水体健康评价. 硕士学位论文, 华中农业大学,武汉. 2015]
[13]Xu Y J, Yang Y H, Chen Y N. A preliminary study on vertical distribution pattern of vegetation in Yili River Basin [J]. Xinjiang Agricultural Science, 2008, 45(S3): 21—24 [徐远杰, 杨玉海, 陈亚宁, 等. 伊犁河流域植被垂直分布格局的初步研究. 新疆农业科学, 2008, 45(S3): 21—24]
[14]Wang Y Q. Ecology environment evaluation and protection countermeasure study for wetland of Yili Xinjiang [D]. Thesis for Master of Science, Northwest A&F University, Yangling, 2005 [王逸群. 新疆伊犁湿地生态环境评价与保护对策研究. 硕士学位论文, 西北农林科技大学, 杨凌. 2005]
[15]Morse J C, Yang L F, Tian L X. Aquatic Insects of China Useful for Monitoring Water Quality [M]. Nanjing: Hohai University Press. 1994, 110—531
[16]Merritt R W, Cummins K W, Berg M B. An Introduction to the Aquatic Insects of North America (4th edition) [M]. Dubuque: Kendall Hunt Publishing. 2008, 181—771
[17]Dalian Fisheries University. Freshwater Biology [M]. Beijing: China Agriculture Press. 1982, 181—346 [大连水产学院. 淡水生物学. 北京: 中国农业出版社. 1982, 181—346]
[18]Duan X H, Wang Z Y, Xu M Z. Benthic Mcroinvertebrate and Application in the Assessment of Stream Ecology [M]. Beijing: Tsinghua University Press. 2010, 49—53 [段学花, 王兆印, 徐梦珍. 底栖动物与河流生态评价. 北京: 清华大学出版社. 2010, 49—53]
[19]Barbour M T, Gerritsen J, Snyder B D, et al. Rapid Bioassessement Protocols for Use in Streams and Wadeable River: Periphyton, Benthic Macroinvertebrates and Fish (2nd edition) [M]. Washington, DC: US EPA, Office of Water. 1999, B1–B50
[20]Shannon C E, Weaver W J. The Mathematical Theory of Communication [M]. Urbana: University of Illinois. 1949, 117
[21]Wang S B. A question on the traditional biodiversity index [J]. Journal of Fudan University (Natural Science), 2003, 42(6): 867—868 [王寿兵. 对传统生物多样性的质疑. 复旦大学学报(自然科学版), 2003, 42(6): 867—868]
[22]Simpson E H. Measurement of diversity [J]. Nature, 1949, 163: 688
[23]McNaughton S J. Relationship among functional prosperities of California grassland [J]. Nature, 1967, 216: 168—169
[24]Xu C Y, Yu Q J, Xu F J, et al. Niche analysis of phytoplankton’s dominant species in Dianshan Lake of East China [J]. Chinese Journal of Applied Ecology, 2012, 23(9): 2550—2558 [徐春燕, 俞秋佳, 徐凤洁, 等. 淀山湖浮游植物优势种生态位. 应用生态学报, 2012, 23(9): 2550—2558]
[25]Wang J, Li B, Feng J, et al. Characteristic of algal flora and community in the southwestern Tibet [J]. Acta Hydrobiologica Sinica, 2015, 39(4): 837—844 [王捷, 李博,冯佳, 等. 西藏西南部湖泊浮游藻类区系及群落结构特征. 水生生物学报, 2015, 39(4): 837—844]
[26]Chen J Z, Meng S L, You Y, et al. Characteristic ofphytoplankton community in Lake Wuli, Lake Taihu [J]. Ecology and Environmental Science, 2009, 18(4): 1358—1367 [陈家长, 孟顺龙, 尤洋, 等. 太湖五里湖浮游植物群落结构特征分析. 生态环境学报, 2009, 18(4): 1358—1367]
[27]Li Q, Yang L F, Wu H, et al. Canonical correspondence analysis between EPT community distribution and environmental factors in Xishaoxi River, Zhejiang, China [J]. Acta Ecologica Sinica, 2006, 26(11): 3817—3825 [李强,杨莲芳, 吴璟, 等. 西苕溪EPT昆虫群落分布与环境因子的典范对应分析. 生态学报, 2006, 26(11): 3817—3825]
[28]Wang Q, Yuan X Z, Liu H. Community and bioassessment of aquatic insects attached on the stones in upland headwater stream of Yudu stream of southern China: a case study of Yudu stream in Chongqing [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 887—892 [王强, 袁兴中,刘红. 西南山地源头溪流附石性水生昆虫群落特征及多样性—以重庆鱼肚河为例. 水生生物学报, 2011, 35(5): 887—892]
[29]Wang J J, Soininen J, Zhang Y, et al. Contrasting patterns in elevational diversity between microorganisms and macroorganisms [J]. Journal of Biogeography, 2010, 38(3): 595—603
[30]Vannote R L, Minshall G W, Cummins K W, et al. The river continuum concept [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1): 130—137
[31]Zhang Z L, Huang L Z. Influence of quarrying in Poyang Lake on the ecological environment [J]. Jiangxi Hydraulic Science & Technology, 2008, 135(1): 7—10 [张子林,黄立章. 浅析鄱阳湖采砂对生态环境的影响. 江西水利科技, 2008, 135(1): 7—10]
[32]Fantin-Cruz I, Pedrollo O, Girard P, et al. Changes in river water quality caused by a diversion hydropower dam bordering the pantanal floodplain [J]. Hydrobiologia, 2016, 768(1): 223—238
[33]Jia X H, Jiang W X, Li F Q, et al. Impacts of large hydropower station on benthic algal communities [J]. Chinese Journal of Applied Ecology, 2009, 20(7): 1731—1738 [贾兴焕, 蒋万祥, 李凤清, 等. 大型水电站对河流底栖藻类群落的影响. 应用生态学报, 2009, 20(7): 1731—1738]
[34]Holt C R, Pfitzer D, Scalley C, et al. Longitudinal variation in macroinvertebrate assemblages below a large-scale hydroelectric dam [J]. Hydrobiologia, 2015, 755(1): 13—26
[35]Nelson S M. Response of stream macroinvertebrate assemblages to erosion control structures in a wastewater dominated urban stream in the southwestern U.S. [J]. Hydrobiologia, 2011, 663(1): 51—69
[36]Beauger A, Lair N, Reyes M P, et al. The distribution of macroinvertebrate assemblages in a reach of the river Allier (France), in relation to river bed characteristics [J]. Hydrobiologia, 2006, 571: 63—76
COMMUNITY STRUCTURE AND ENVIRONMENTAL DETERMINANTS OF MACROINVERTEBRATES IN ILI RIVER
YU Shuai1, JIA Na-Er2, ZHANG Zhen-Xing1, LI Kun1, SUN Dong-Dong1and YANG Hai-Jun1
(1. School of Life Science, Northeast Normal University, Changchun 130000, China; 2. Institute of Chemical and Biological Science, Yili Normal University, Yining 835000, China)
To investigate the community structure of macroinvertebrates in the Ili River, fourteen sampling sites were selected representing four habitat types, i.e., natural habitat, damaged habitat, under-dam habitat and protected area in July 2014 and 2015. A total of 81 macroinvertebrate taxa were collected, belonging to 39 families and 10 orders, of which, 75 species (93.8%) were aquatic insects, and 2 species (2.5%) were mollusks, and 3 species (3.7%) were oligochaete. The natural habitat had higher density, species richness, EPT richness and biodiversity of macroinvertebrates than others, and the under-dam habitat displayed the lowest values. Results of Redundancy Analysis (RDA) explained 54.1% of the cumulative variance of species data. Monte Carlo permutation tests for the first axis and overall canonical ordination were significant, indicating that distribution of macroinvertebrates were mainly regulated by flow rate, conductivity, water temperature and altitude (F=2.28—4.34, P<0.05).
Ili River; Macroinvertebrate; Human activity; Environmental factor; Hydropower development
145+.2
A
1000-3207(2017)05-1062-09
10.7541/2017.133
2016-08-27;
2016-12-23
国家自然科学基金(U1303182)资助 [Supported by the National Natural Science Foundation of China (U1303182)]
于帅(1990—), 男, 江苏徐州人; 硕士; 主要研究方向为河流底栖动物生态学。E-mail: yus742@nenu.edu.cn
贾娜尔·阿汗, 女, 教授; 主要研究领域为湿地生态学。E-mail: jiana0999@126.com
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
