氧化鱼油对黄颡鱼黑色素合成酶及内分泌激素的影响
2017-09-12程炜轩许国焕张丽韩木兰陈金涛魏逸峰
程炜轩许国焕张 丽韩木兰陈金涛魏逸峰
(1. 广东省微生物研究所, 广州 510070; 2. 广东省菌种保藏与应用重点实验室, 广州 510070; 3. 广东省微生物应用新技术公共实验室, 广州 510070; 4. 省部共建华南应用微生物国家重点实验室, 广州 510070; 5. 广东碧德生物科技有限公司, 广州 510663)
氧化鱼油对黄颡鱼黑色素合成酶及内分泌激素的影响
程炜轩1,2,3,4,5许国焕1,5张 丽1,5韩木兰1,5陈金涛5魏逸峰5
(1. 广东省微生物研究所, 广州 510070; 2. 广东省菌种保藏与应用重点实验室, 广州 510070; 3. 广东省微生物应用新技术公共实验室, 广州 510070; 4. 省部共建华南应用微生物国家重点实验室, 广州 510070; 5. 广东碧德生物科技有限公司, 广州 510663)
实验模拟自然氧化条件制备氧化鱼油, 替代普通鱼油加入饲料中, 研究其对黄颡鱼(Pelteobagrus fulvidraco)表皮黑色素、酪氨酸酶活力、血清与脑内分泌激素含量的影响。处理组分别为未替代组(C组)、50%氧化鱼油替代组(Y50组)和100%氧化鱼油替代组(Y100组), 结果表明: 随着氧化鱼油替代普通鱼油的比例提高, 黄颡鱼5级(黑色素占细胞面积80%以上)黑色素细胞比例上升; 酪氨酸酶活力上升, 但各组差异不显著(P>0.05); 皮质酮(CORT)在血清和脑组织中各组含量差异均不显著(P>0.05); 肾上腺皮质激素(ACTH)在脑组织中含量增加 (P<0.05), 而血清中Y50组含量高于C组及Y100组(P<0.05); 血清中促肾上腺皮质激素释放激素(CRH)含量降低, Y50与Y100组之间差异不显著(P>0.05), 而脑组织中各组差异不显著(P>0.05); 血清中α-黑素细胞刺激素(α-MSH)含量, Y100组高于其他组(P<0.05), 而脑组织中各组差异不显著(P>0.05)。上述结果表明,随着氧化鱼油替代普通鱼油的比例提高, 5级黑色素细胞比例上升, 黄颡鱼血清和脑组织中能互相转换的ACTH与α-MSH总量提高, 变化趋势与表皮黑色素含量和酪氨酸酶活性相一致。
黄颡鱼; 氧化鱼油; 黑色素; 酪氨酸酶; 内分泌激素
黄颡鱼(Pelteobagrus fulvidraco)属于鲶形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus Bleeker), 体色艳丽、肉质鲜嫩, 是一种优质名贵经济鱼类。在正常情况下, 体色呈古铜色。在人工养殖条件下, 由于饲料配方不合理及养殖条件恶化, 体色容易出现异常, 其中以黑体色异常的现象最为严重。据调查, 广东出现黑体色异常的黄颡鱼占了个体总数的10%—15%, 而个别养殖户, 体色异常率更是在30%—50%。体色异常, 从视觉上难以被消费者接受, 严重影响黄颡鱼的外观及商品价值, 给养殖户带来重大经济损失, 也给黄颡鱼的产业化发展造成障碍。
黑体色的实现与黑色素细胞、黑色素的迁移和运输密切相关。黑色素细胞的形成需要经过神经嵴分化、运输到表皮, 逐渐成熟为黑色素细胞,当黑色素细胞受到刺激, 如紫外线照射或内分泌激素升高时, 黑色素细胞中的酪氨酸酶活力增强, 催化黑色素细胞从血液中摄取的酪氨酸, 经高尔基复合体变成多巴, 通过合成途径合成黑色素[1]。在黑色素合成后, 黑色素细胞将黑色素通过细胞间的触角状连接转运至周边角质形成细胞, 使体色发黑。鱼类与陆生动物一样, 黑色素的作用主要是吸收光,起到光保护的作用。其次, 对于隐蔽自身、求偶等也起着重要作用[2]。黑色素的合成过程受到内分泌系统控制, 当内分泌系统受干扰时, 鱼类黑色体色也可能受到影响[3]。
海产鱼油富含ω-3系多不饱和脂肪酸(DHA和EPA), 而多种水产养殖品种自身不能合成多不饱和脂肪酸需要由饲料提供, 因此海产鱼油在水产养殖饲料中使用范围广, 使用量也较大。然而海产鱼油很容易氧化, 鱼油氧化后颜色加深, 透明度降低, 黏稠, 流动性差, 刺鼻味道强烈。随着饲料中鱼油氧化程度的提高, 可导致瓦氏黄颡鱼背部皮肤亮度呈下降趋势[4], 但是鱼油氧化对鱼黑体色的影响机制目前还不清楚, 本研究模拟自然氧化条件制作氧化鱼油, 替代普通鱼油加入饲料中, 研究其对黄颡鱼表皮黑色素细胞、酪氨酸酶、黑色素及相关激素的影响, 以期为氧化鱼油对黑体色影响的机制研究提供基础资料。
1 材料与方法
1.1 实验用鱼
挑选体重(97.2±2.2) g的黄颡鱼随机分为3组,对照组、50%鱼油替代组和100%鱼油替代组, 每组设3个重复, 共9个实验单元, 每单元投放鱼30尾。养殖环境为室内养殖, 先用对照组饲料驯化2周后开始实验, 每天07:00和18:00手工缓慢投喂至其表观饱食, 投喂量约为鱼体重的3%, 水温保持在25—30℃, pH 7.2—7.6, 溶解氧不低于6.0 mg/L。养殖时间为8周, 在投喂后2h取样, 确保饲料各组分充分消化吸收。
1.2 氧化鱼油制作
实验用油为未经精炼加工的鲭鱼油, 取自福建高龙饲料有限公司。鱼油运输及储存保持4℃以下。模拟天然氧化条件, 取出部分鱼油制作氧化鱼油[5], 制作过程为: 在鱼油中添加质量分数为1%的水, 充分混合后, 于25℃条件下搅拌氧化, 在7d后参考GB/T 5538-1995方法测定过氧化值。氧化鱼油过氧化值达到110.5 meq/kg。而未氧化鱼油过氧化值为3.7 meq/kg。
1.3 实验饲料
根据黄颡鱼营养需求, 制作软颗粒饲料[6,7](表 1), 按配比取料后, 干粉料先混合均匀, 鱼油使用量为饲料总质量的8%, 按0、50%和100%比例用氧化鱼油替代未氧化鱼油, 加适量水混合制成软颗粒饲料, 风干后–20℃冰箱中保存。各组饲料在制作完成后, 每饲料组取3个样品, 各10 g, 粉碎、用石油醚溶解后、过滤, 滤液在30—40℃中, 经过真空抽气泵回收石油醚后, 用于过氧化值检测, 检测方法与油脂过氧化值检测方法相同。对照组标记为C组, 实测该组饲料过氧化值为(2.0±0.1) meq/kg。50%氧化鱼油替代组标记为Y50, 实测该组饲料过氧化值为(8.9±0.2) meq/kg。100%氧化鱼油替代组标记为Y100, 实测该组饲料过氧化值为(15.3±0.2) meq/ kg。商品饲料在天然条件、未加入抗氧化剂的情况下, 51d过氧化值为9.22 meq/kg, 与Y50组相近[8]。使用凯氏定氮法检测饲料粗蛋白含量, 使用索氏抽提法检测粗脂肪含量, 使用直接滴定法检测淀粉含量, 每饲料组取3个样品进行检测, 结果显示, 对照组饲料营养成分含量: 蛋白质(32.7±0.4)%、脂肪(12.3±0.1)%、淀粉(31.0±0.2)%。Y50组, 蛋白质(3 2.3±0.5)%、脂肪(1 2.0±0.2)%、淀粉(30.3±0.2)%。Y100组, 蛋白质(32.4±0.2)%、脂肪(11.7±0.2)%、淀粉(31.4±0.1)%。
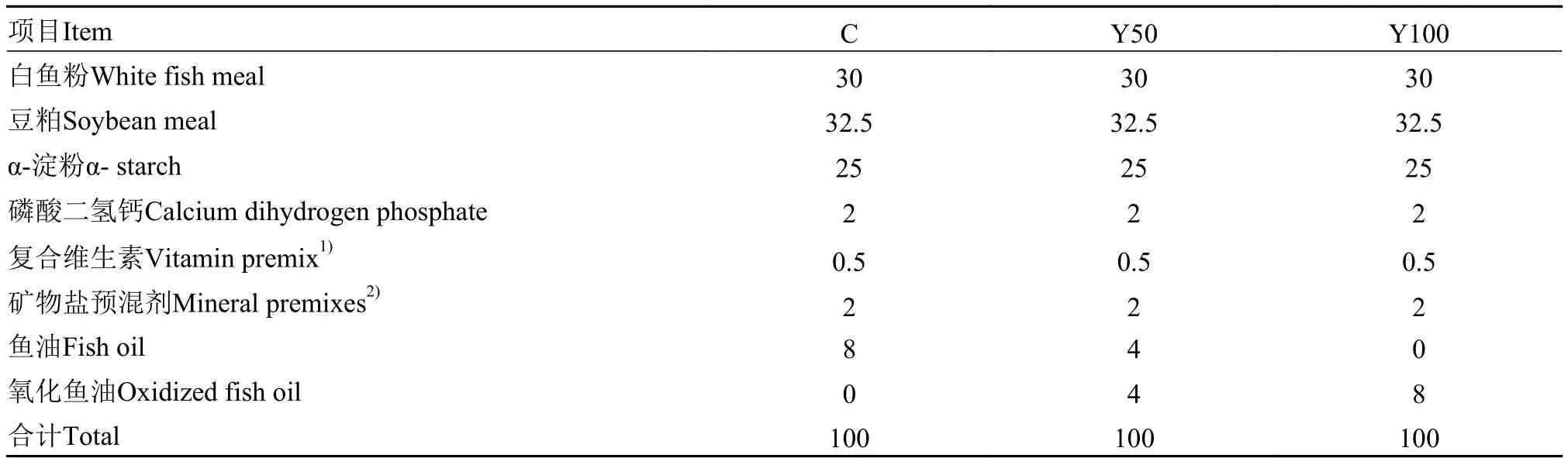
表 1 实验饲料组成Tab. 1 Composition of experimental diets (%)
1.4 皮肤、血液及脑组织取样
每个实验单元随机选择3尾鱼, 每组共计9尾鱼,检测黑色素、酪氨酸酶活力及黑色素合成相关的内分泌激素的含量。
取样前将实验鱼用MS222麻醉, 浓度为25 mg/ L, 时间为15—20min, 若鱼体呈正常游动状态, 保持静止不动, 有声响时仅尾部轻微摆动, 轻触头部时反应迟钝, 用手去抓时不能及时逃避, 表明麻醉成功。
皮肤组织取样, 将麻醉后的黄颡鱼, 用镊子小心剥取横向: 背鳍基部至侧线, 纵向: 头身连接处至第一背鳍基部末端垂直方向一块接近长方形的皮肤, 用手术刀片小心刮去皮肤表面黏液和下面银色薄膜, 干纱布吸去皮肤表面水分, 使皮肤样品透光,随即进行显微镜观察以及黑色素和酪氨酸酶的检测。
血液取样及处理, 迅速抽取麻醉后的黄颡鱼尾静脉血液至采血管中, 4000 r/min离心6min, 分离得到血清。
脑组织取样, 将麻醉成功的黄颡鱼于头盖骨末端处垂直向下迅速剪断, 剪取头部后, 用剪刀将头盖骨从中间剪开, 撑开头盖骨后取出脑组织。
1.5 皮肤中黑色素含量的测定
标准品乌贼黑色素(Sigma M-2649)购自Sigma公司, 采用分光光度法来检测[9], 其处理方法如下:在1.5 mL EP管中, 依次加入1 mL 1 mol/L NaOH、0.1 g黑色素标准品、10 μL 3% H2O2, 于沸水浴中煮30min, 混匀, 待黑色素标准品完全溶解后, 分别按0、5%、10%、15%、20%、30%和40%的比例稀释, 在402 nm处测定吸光度值, 绘制标准曲线。
剪刀配合眼科镊准确剪取约0.1000 g (精确到0.0001 g)皮肤。先用95%乙醇固定皮肤样品24h, 然后用1% HCl 60℃水浴1h以脱钙。脱钙后的皮肤样品用蒸馏水反复冲洗3次, 最后用0.2% NaOH沸水浴煮1h以提取黑色素。用紫外分光光度计测量上清液在402 nm处的吸光度值, 与标准曲线比对算出黑色素的浓度。
1.6 皮肤中酪氨酸酶活力的检测
参考诸葛燕等[10]的测定方法。准确称取约0.2000 g (精确到0.0001 g)皮肤, 用50 mmol/L磷酸缓冲液(pH 6.8)匀浆, 组织匀浆液4℃ 5000 r/mim离心20min, 将上清液取出并置于冰上用于检测酪氨酸酶含量。先将1 mL 0.5 mmol/L L-DOPA加入5 mL离心管, 再加入2 mL组织匀浆上清液并立即混匀,于475 nm测定吸光度值A0; 将此混匀液于28℃水浴中精确反应10min, 并于475 nm再次测定吸光度值A10, 计算两次吸光度值之差ΔA475=A10–A0。酪氨酸酶活力的计算方法为: 酪氨酸酶活力(U)=ΔA475/ (V×T×0.001), 式中: V为组织匀浆液的总体积(mL), T为反应时间(min), 酪氨酸酶活力的单位为U/g皮肤。
1.7 黑色素合成相关的内分泌激素含量检测
使用放射免疫方法检测促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)、皮质酮(CORT)、黑色素细胞刺激素(α-MSH)含量, 试剂盒购自北京华英生物技术研究所。取约3 mm3脑组织, 加到1 mL 100℃生理盐水中煮沸5min后迅速冷却, 再加0.5 mL 1 mol/L醋酸制成匀浆, 置4℃1—2h后, 2000 r/min离心15min, 取上清, 冷冻干燥后用RIA缓冲液进行复溶, 而血液激素方面的检测,则是取出50 μL血清, 进行内分泌激素含量测定。
测定方法: 采用平衡法, 分别在不同的聚苯乙烯管中加入样品、标准品、缓冲液和抗体。置4℃24h后, 加入含125I核素的标记抗原, 4℃放置24h后,加入分离剂, 震荡3min, 3000 r/min离心3min, 弃上清, 测沉淀放射性强度, 通过标准品的放射性强度制作标准曲线, 然后根据样品的放射性强度计算样品含量。
1.8 数据统计分析
采用SPSS 15.0对数据进行统计分析, 组间所有数据均以平均值±标准差(Mean±SD)表示, 统计学显著性水平为P<0.05, 统计学比较方法采用单因素方差分析(ANOVA), S-N-K, Duncan’s进行多重比较, 区分显著性差异水平。
2 结果
2.1 表皮黑色素细胞观察
将黑色素扩散范围占黑色素细胞的比例大小分为6级[11]: 0级, 无黑色素; 1级, 黑色素占黑色素细胞面积在0—20%; 2级, 黑色素占黑色素细胞面积在20%—40%; 3级, 黑色素占黑色素细胞面积在40%—60%; 4级, 黑色素占黑色素细胞面积在60%—80%; 5级, 黑色素占黑色素细胞面积在80%以上。表皮黑色素细胞镜检结果显示, C组3级、4级、5级黑色素细胞分别占黑色素细胞总数的30.8%、38.2%和31%; Y50组3级、4级、5级黑色素细胞分别占黑色素细胞总数的15.5%、30.3%和54.2%; Y100组4级、5级黑色素细胞分别占黑色素细胞总数的10.5%和89.5%, 3个组黑色素细胞排列较为均匀(图 1)。
2.2 黑色素含量
随着氧化鱼油替代普通鱼油的比例提高, 表皮黑色素含量有上升趋势, Y100组高于C组(P<0.05),而C组与Y50, Y50与Y100组之间差异不显著(P>0.05) (图 2)。

图 1 氧化鱼油不同替代比例对黄颡鱼表皮黑色素细胞的影响Fig. 1 Effects of different replacement ratios of dietary oxidized fish oil on epidermal melanin cellsA. C组, B. Y50组, C. Y100组, 标尺为100 μmA. C group, B. Y50 group, C. Y100 group, Rulers are 100 μm
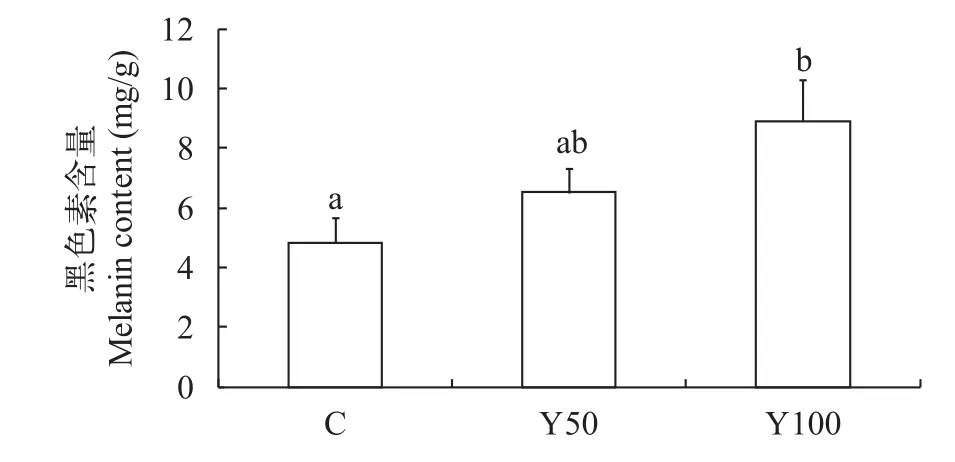
图 2 氧化鱼油不同替代比例对黄颡鱼表皮黑色素含量的影响Fig. 2 Effects of different replacement ratios of dietary oxidized fish oil on skin melanin content相同字母表示组间差异不显著, 不同字母表示组间存在显著性差异, 图 3同The presence of same superscripts indicate no significant difference between the groups, while different superscripts indicate significant differences, the same as Fig. 3
2.3 酪氨酸酶活力
随着氧化鱼油替代普通鱼油的比例提高, 表皮酪氨酸酶活力有上升趋势, 但各组差异不显著(P>0.05) (图 3)。
2.4 黑色素合成相关的内分泌激素含量
各组血清皮质酮(CORT)含量无显著差异(P>0.05), Y50组促肾上腺皮质激素(ACTH)含量显著高于C组及Y100组(P<0.05), Y50及Y100组促肾上腺皮质激素释放激素(CRH)含量均显著低于C组(P<0.05), α-黑素细胞刺激素(α-MSH)方面, Y100组显著高于C组和Y50组(P<0.05)(表 2)。
脑组织中各组α-MSH、CORT、CRH含量均无显著性差异(P>0.05), Y50及Y100组ACTH含量均显著高于C组(P<0.05), 而且Y100组也显著高于Y50组(P<0.05) (表 3)。
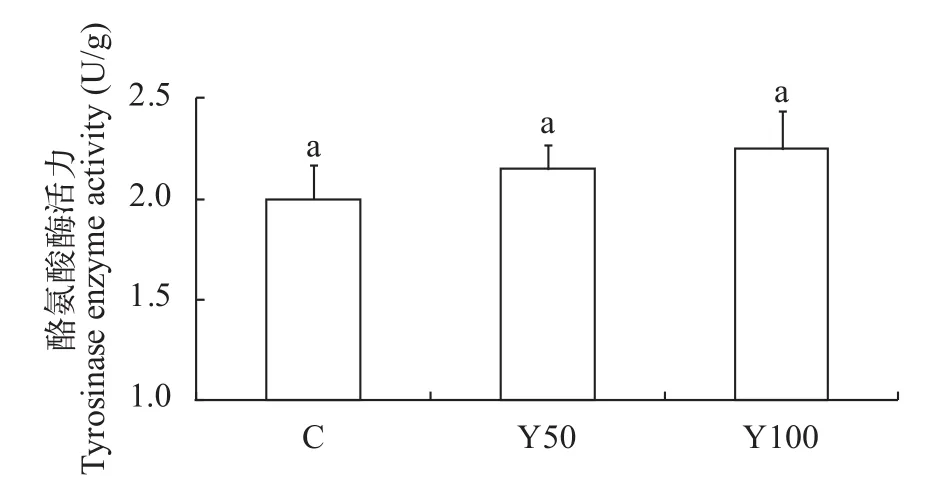
图 3 氧化鱼油不同替代比例对黄颡鱼表皮酪氨酸酶活力的影响Fig. 3 Effects of different replacement ratios of dietary oxidized fish oil on skin tyrosinase activity of P. fulvidraco
3 讨论
3.1 氧化鱼油对表皮黑色素细胞内黑色素分布的影响
黑色素细胞并不仅存在于表皮, 在毛囊中、眼睛也有大量分布, 而其他部位, 如脑膜、肛门处也有少量黑色素细胞存在。在黑色素细胞中, 黑色素颗粒如果以扩散的方式存在, 则鱼体色显黑[12]。黑色素镜检结果显示, 随着饲料中鱼油氧化程度的提高, 5级黑色素细胞, 即黑色素扩散至细胞面积76%以上的细胞, 其比例呈上升趋势, 体色发黑, 这与瓦氏黄颡鱼的研究结果相近[4]。而排列较为均匀说明氧化鱼油没有造成黑色素细胞数目减少。
3.2 氧化鱼油对表皮黑色素及合成酶的影响
黑色素在哺乳动物和鸟类有2种形式: 真黑色素, 显黑色或暗褐色和棕黑素, 显红色或黄色。大多数黑色素细胞不保留黑色素, 而是将黑色素颗粒沿着微管运输到树突, 然后转移到其他角质细胞。鱼的情况有所不同: 黑素细胞只能产生真黑素, 而且黑素颗粒能保存在黑色素细胞内[13]。酪氨酸酶(tyrosinase, TYR)是已知的作用于黑色素生物合成的关键酶, 它可有效地防止紫外线(UV)对皮肤的损伤。TYR催化黑色素细胞从血液中摄取酪氨酸, 在高尔基体内合成多巴及其氧化产物多巴醌, 从而合成真黑色素[1]。本实验结果显示, 酪氨酸酶活力随饲料的过氧化值的提高而有所提高, 但是组间差异不显著(P>0.05)。而表皮黑色素的合成量也有所提高, Y100组显著高于对照组, 说明氧化鱼油对黑色素的合成有促进作用。

表 2 氧化鱼油不同替代比例对黄颡鱼血清中内分泌激素的影响Tab. 2 Effects of different replacement ratios of dietary oxidized fish oil on plasma hormone concentrations of P. fulvidraco

表 3 氧化鱼油不同替代比例对黄颡鱼脑组织中内分泌激素的影响Tab. 3 Effects of different replacement ratios of dietary oxidized fish oil on brain hormone concentrations of P. fulvidraco
3.3 氧化鱼油对血清及脑组织中黑色素合成激素的影响
黑色素的合成受到多种激素的调节, 促肾上腺皮质激素释放激素(CRH)主要作用是促进腺垂体合成与释放促肾上腺皮质激素(ACTH), ACTH肽链的前13个氨基酸与促黑色素(MSH)的完全相同, 主要作用是促进糖皮质激素分泌, 可作为α-促黑激素(α-MSH)的前体, α-促黑色素(α-MSH)与黑色素细胞内的黑色素皮质素受体1(MC1R)结合后, 使与受体偶联的G蛋白由无活性的二磷酸鸟苷(GDP)型转变为有活性的三磷酸鸟苷(GTP)型, 激活膜上的腺苷酸环化酶系统, 三磷酸腺苷(ATP)转变为环腺苷酸(cAMP), cAMP进一步激活TYR, TYR促进真黑色素合成[1]。另外, 有资料表明α-MSH与ACTH对黑色素细胞有促其树突化的作用[14]。黑色素细胞树突化或树突的生长, 是黑色素转移到角质形成细胞的必需过程。然而, 由于血脑屏障的存在, 脑中α-MSH并不能很好促进黑色素合成[15]。皮质酮(CORT)属于肾上腺皮质激素, 受到ACTH调节, 血中CORT分泌过多时, 也能抑制ACTH的分泌[16]。而注射高剂量α-MSH也可以降低血浆CORT水平[17]。
在各组脑组织和血清中CORT均无显著性差异(P>0.05), 血清ACTH, Y50组高于C组及Y100组(P<0.05), 脑组织中Y50及Y100组均高于C组(P<0.05)。血清中α-黑素细胞刺激素(α-MSH)含量, Y100组高于其他组(P<0.05), 而脑组织中各组差异不显著。ACTH与α-MSH在血清与脑组织中的总量与皮肤黑色素含量相对应, 都是随氧化鱼油替代量增加而增加, 当中ACTH可能部分转换为α-MSH[18]。在脑组织中, ACTH的分泌量随饲料中氧化鱼油替代量增加而增加, 说明氧化鱼油造成的损伤也影响到黄颡鱼脑ACTH的分泌, 与ACTH防御或者修复氧化损伤的作用相关[19]。CRH、Y50及Y100组均低于C组(P<0.05)。各组脑组织中CRH均无显著性差异, 与脑中ACTH分泌量增加对CRH的分泌起到负反馈调节相关[20]。
上述结果表明, 随着氧化鱼油替代普通鱼油比例提高, 黄颡鱼血液和脑组织中ACTH与α-MSH总分泌量、表皮酪氨酸酶活力及黑色素含量, 三者均有所提高, 且变化趋势一致。氧化鱼油对黄颡鱼黑色素合成的有促进作用, 且可能是通过α-MSH-酪氨酸酶这一途径来实现。目前, 对黄颡鱼黑体色的调节方法仍有所欠缺, 主要是由于黑体色的实现涉及黑色素细胞成熟、迁移以及黑色素的合成和转运等多个方面, 且受到内分泌系统、神经系统的影响, 影响因素多且复杂。本研究针对饲料中氧化鱼油比例提高对鱼黑体色的影响, 从内分泌的角度阐述了其可能的机制, 对其黑体色的恢复起到一定的理论指导作用, 但是氧化鱼油对鱼体的影响是多方面多层次的, 不仅仅局限于内分泌系统。因此, 氧化鱼油对黄颡鱼黑体色的影响还需要进一步深入研究。
[1]Mueller K P, Neuhauss S C. Sunscreen for fish: cooption of UV light protection for camouflage [J]. PloS One, 2014, 9(1): e87372—e87372
[2]Gevertz A K, Oris J T. Microscopic examination of skin in native and nonnative fish from Lake Tahoe exposed to ultraviolet radiation and fluoranthene [J]. Aquatic Toxicology, 2014, 147(1): 151—157
[3]Xu J Y, Liu Y. Study on color modification of tilapia Oreochromis niloticus under environmental background and stress by computer vision [J]. Acta Hydrobiologica Sinica, 2009, 33(2): 164—168 [徐建瑜, 刘鹰. 基于计算机视觉的罗非鱼适应环境的体色变化研究. 水生生物学报, 2009, 33(2): 164—168]
[4]Xue J P. Effects of Melamine, Oxidized Fish Oil and Lipid on Growth and Skin Colour of Darkbarbel Catfish [D]. Thesis for PhD of Science. China Ocean University, Qingdao. 2011 [薛继鹏. 三聚氰胺、氧化鱼油和脂肪对瓦氏黄颡鱼生长和体色的影响. 博士学位论文. 中国海洋大学, 青岛. 2011]
[5]Dong X L, Dong G F, Zhu X M, et al. Dynamic variation of fish oil oxidation under different temperatures [J]. China Oils and Fats, 2012, 37(1): 36—40 [董小林, 董桂芳, 朱晓鸣, 等. 不同温度条件下鱼油氧化的动态变化.油脂化学, 2012, 37(1): 36—40]
[6]Li J W. Requirement of Protein, Energy, Calcium, Phosphorus and Fatty Acid in the Diet for Juvenile Pelteobagrus fulvidraco [D]. Thesis for Master of Science. Huazhong Agricultural University. Wuhan. 2007 [李敬伟. 黄颡鱼幼鱼对饲料中蛋白、能量、钙、磷和脂肪酸需要量. 硕士学位论文. 华中农业大学, 武汉. 2007]
[7]Sun T. Macronutrient composition of formulated diets for yellow catfish (Pelteobagrus fulvidraco Richardson) juvenile [D]. Thesis for Master of Science. Sichuan Agricultural University, Ya’an. 2008 [孙挺. 黄颡鱼幼鱼三大营养素需要量的研究硕士学位论文. 四川农业大学, 雅安. 2008]
[8]Xu S W, Guo S H. Determination of antioxidant capacity of antioxidants in feeds [J]. Chinese Feed, 2000, 1(7): 23—25 [徐燧伟, 郭赛华. 饲料中抗氧化剂抗氧化能力的测定. 中国饲料, 2000, 1(7): 23—25]
[9]Lin L Q, Chen W T. The physical and chemical properties of melanin extracted from silky fowl [J]. Taiwanese Journal of Agricultural Chemistry and Food Science, 2004, 42(5): 335—342 [林亮全, 陈维泰. 国产乌骨鸡黑色素萃取物的物理化学特性. 台湾农业化学与食品科学, 2004, 42(5): 335—342]
[10]Zhu G Y, Ye Y T, Gao Y L, et al. The comparison of pigment and tryosinase activity in seven species of freshwater fishes [J]. Journal of Shanghai Fisheries University, 2007, 16(5): 431—436 [诸葛燕, 叶元土, 高艳玲, 等. 七种淡水鱼类色素含量和醋氨酸酶活力的比较研究. 上海水产大学学报, 2007, 16(5): 431—436]
[11]Anna A, Wojciech J, Krzysztof R, et al. Melanin content in melanoma metastases affects the outcome of radiotherapy [J]. Oncotarget, 2016, 7(14): 17844—17853
[12]Adameyko I, Lallemend F, Aquino J B, et al. Schwann cell precursors from nerve innervation are a cellular origin of melanocytes in skin [J]. Cell, 2009, 139(2): 366—379
[13]McMenamin S K, Bain E J, McCann A E, et al. Thyroid hormone-dependent adult pigment cell lineage and pattern in zebrafish [J]. Science, 2014, 6202(345): 1358—1361
[14]Scott G A, Arioka M, Jacobs S E. Lysophosphatidylcholine mediates melanocyte dendricity through PKCzeta activation [J]. Journal of Investigative Dermatology, 2007, 127(3): 668—675
[15]Kanta M, Yuki K, Takeshi Y. Interrelation between melanocyte-stimulating hormone and melanin-concentrating hormone in physiological body color change: Roles emerging from barfin flounder Verasper moseri [J]. General and Comparative Endocrinology, 2013, 181(15): 229—234
[16]Garcia-igleslas B B, Mendoza-garrido M E, Gutierrezospina G, et al. Sensitization of restraint-induced corticosterone secretion after chronic restraint in rats: Involvement of 5-HT7 receptors [J]. Neurppharmacology, 2013, 71(2): 216—227
[17]Racca S, Spaccamigilo A, Esculapio P, et al. Effects of swim stress and alpha-MSH acute pre-treatment on brain 5-HT transporter and corticosterone receptor [J]. Pharmacology biochemistry and behavior, 2005, 81(4): 894—900
[18]Mousa M A, Ibrahim A A E, Hashem A M, et al. The effect of water quality on the immunoreactivity of stress-response cells and gonadotropin-secreting cells in the pituitary gland of Nile Tilapia, Oreochromis niloticus [J]. Journal of Experimental Zoology-Ecological Genetics and Physiology, 2015, 323(3): 146—159
[19]Abdel-mallek Z A, Knittel J, Kadekaro A L, et al. Limbic system mechanisms of stress regulation: Hypothalamopituitary-adrenocortical axis [J]. Photochenmistry and Photobiology, 2008, 84(2): 501—508
[20]Amano M, Mizusawa N, Okubo K. Cloning of corticotropin-releasing hormone (CRH) precursor cDNA and immunohistochemical detection of CRH peptide in the brain of the Japanese eel, paying special attention to gonadotropin-releasing hormone [J]. Cell and Tissue Research, 2014, 356(1): 243—251
EFFECTS OF DIETARY INCLUSION OF OXIDIZED FISH OIL ON MELANIN, MELANIN SYNTHETIC ENZYMES AND HORMONES OF PELTEOBAGRUS FULVIDRACO
CHENG Wei-Xuan1,2,3,4,5, XU Guo-Huan1,5, ZHANG Li1,5, HAN Mu-Lan1,5, CHEN Jin-Tao5and WEI Yi-Feng5(1. Guangdong Institute of Microbiology, Guangzhou 510070, China; 2. Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangzhou 510070, China; 3. Guangdong Open Laboratory of Applied Microbiology, Guangzhou 510070, China; 4. State Key Laboratory of Applied Microbiology, South China, Guangzhou 510070, China; 5. Bide biotechnology Co., Ltd. of Guangdong, Guangzhou 510663, China)
We investigated the effects of fish feed containing oxidized fish oil on epidermal melanin expression, tyrosinase activity, and hormone levels related to melanin synthesis in the serum and brain of Pelteobagrus fulvidraco. Fish oil was oxidized under natural conditions and substituted for normal fish oil in fish feed at concentrations of 100% (group Y100), 50% (group Y50), and 0 (group C). Level 5 melanin cells, in which melanin accounts for >80% of the cell area, increased in a dose-dependent manner with the amount of oxidized fish oil in the feed. There was a tendency for tyrosinase activity to increase with the amount of oxidized fish oil in the fish feed, but the increase was not statistically significant. Brain tissue adreno-cortico-tropic hormone (ACTH) increased with the amount of oxidized oil in feed, while it only increased significantly in the serum of the Y50 group. Serum corticotropin releasing hormone decreased significantly in both the Y50 and 100 treatment groups but showed no significant changes in brain tissues. Similarly, serum α-melanocyte stimulating hormone (α-MSH) in group Y100 was significantly elevated, but no significant differences were detected in brain tissues. In contrast, serum and brain tissue corticosterone levels showed no significant differences among the three groups. These results suggest that oxidized fish oil in fish feed was positively related to the proportion of level 5 melanin cells and epidermal tyrosinase activity. Such changes were related to the increase in ACTH and α-MSH in P. fulvidraco.
Pelteobagrus fulvidraco; Oxidized fish oil; Melanoma; Tyrosinase; Hormone
Q786
A
1000-3207(2017)05-1020-07
10.7541/2017.127
2016-09-23;
2017-01-16
广东省海洋渔业科技与产业发展专项科技攻关与研发项目 (A201401B05); 2015年广州市科技计划项目(一般项目) (201510010239); 广东省科学院引进高层次领军人才专项资金(2016GDASRC-0202)资助 [Supported by the Science and Technology Special Development Program for Guangdong Province Marine Fishy Science, Technology and Industrial Development (A201401B05); the Science and Technology Planning Project of Guangdong Province in 2015 (201510010239); the High-level Leading Talent Introduction Program of GDAS (2016GDASRC-0202)]
程炜轩(1981—), 男, 广东中山人; 博士; 主要从事水生动物营养学研究。E-mail: chan714@126.com
许国焕(1963—), 男, 湖北洪湖人; 硕士, 研究员; 主要从事水生动物营养学研究。E-mail: xghfish@163.com
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
