饲料中棕榈油替代鱼油和豆油对黄颡鱼生长和肌肉脂肪酸组成的影响
2017-09-12赵帅兵吴文俊代小芳朱凌盈陆裕肖吴天星
赵帅兵吴文俊代小芳朱凌盈陆裕肖吴天星
(1. 浙江大学理学院化学系, 杭州 310027; 2. 宁波天邦股份有限公司, 余姚 315400)
饲料中棕榈油替代鱼油和豆油对黄颡鱼生长和肌肉脂肪酸组成的影响
赵帅兵1,2吴文俊2代小芳2朱凌盈2陆裕肖2吴天星1,2
(1. 浙江大学理学院化学系, 杭州 310027; 2. 宁波天邦股份有限公司, 余姚 315400)
为研究不同棕榈油替代水平对黄颡鱼生长性能、肌肉脂肪酸组成、形体指标和肝脏组织结构的影响,实验采用5组等氮(400 g/kg)等脂(100 g/kg)等能(15.70 MJ/kg)饲料饲喂黄颡鱼[(16.15±0.04) g], 对照饲料以鱼油:豆油1:2混合为脂肪源, 实验饲料以棕榈油分别替代10、25、40和55 g/kg的混合脂肪源。经过8周的养殖实验, 结果表明棕榈油替代水平对黄颡鱼的摄食量、终末体重、特定生长率、饲料效率和蛋白沉积率未产生显著性的影响(P>0.05), 但是上述指标均呈现先升高后略微下降的趋势, 并在25 g/kg替代组达到最大值。背肌肌肉中亚油酸和n-3HUFA含量随着棕榈油替代水平的上升而显著下降(P<0.05), 但n-3/n-6比值随着棕榈油替代水平的上升而显著上升(P<0.05), 棕榈油替代水平对各组黄颡鱼的肥满度和脏体比未产生显著性的影响(P>0.05), 但是55 g/kg棕榈油替代水平组肝体比显著高于25 g/kg棕榈油添加组(P<0.05), 且55 g/kg棕榈油替代水平组黄颡鱼的肝脏组织出现细胞肿胀, 细胞核移位, 肝血窦和脂肪细胞数量明显增多等不良影响。据上所述: 对于黄颡鱼幼鱼, 棕榈油可以替代25 g/kg的混合脂肪源(鱼油:豆油=1:2)不影响鱼体生长性能并且在一定程度上改善了背肌肌肉脂肪酸组成。
棕榈油; 黄颡鱼; 生长; 饲料利用; 肌肉脂肪酸
鱼油因富含n-3HUFA, 所以一直作为水产配合饲料的主要脂肪源。至2012年水产养殖业所消耗鱼油已超过世界鱼油总产量的75%, 然而全球海洋渔业资源日渐枯竭, 1994—2009年, 全球鱼油总产量平均每年以2.6%的速度下降[1]。鱼油资源的短缺及持续上涨的价格促使植物油在水产养殖业被广泛使用。大量研究也表明在饲料中必需脂肪酸能够满足鱼体要求的情况下, 大豆油、菜籽油等植物油可以大量替代鱼油而不影响鱼体的生长性能[2—9]。Turchini等[9]认为当前用于水产饲料中的鱼油很可能有相当一部分是浪费的, 因为这部分可以被廉价且易获得的植物油替代。但是, 限制植物油等替代脂肪源大量使用的一个重要因素是植物油的使用对鱼体脂肪酸组成的影响, 尤其是大豆油的使用, 造成亚油酸在鱼片中的大量积累和n-3HUFA含量的下降, 研究表明饲料中的亚油酸可以快速地在鱼体肌肉中沉积并且很难通过末期鱼油饲料的恢复投喂实现有效清除[10,11], 因此理想的鱼油替代脂肪源应该是有竞争力的价格、易获得和较少的亚油酸含量。鉴于此, 棕榈油是一种比较有优势的鱼油替代脂肪源。在全球的植物油市场中,棕榈油的产量在2005年超过了大豆油, 成为世界产量最大的植物油[12], 与大豆油比较, 棕榈油的价格更加低廉且亚油酸含量约为豆油的1/5, 在大西洋鲑、虹鳟、鲶和攀鲈上的研究表明饲料中不同梯度棕榈油替代鱼油对生长性能没有明显的影响[3,5,13—15]。但是Bell等[3]的研究也表明与鱼油组比较, 棕榈油替代水平超过50%后会显著降低大西洋鲑EPA、DHA水平和(n-3)与(n-6)比值, 因此建议大西洋鲑饲料中棕榈油替代鱼油的水平不要超过50%, 并且在上市前可以恢复投喂鱼油饲料来改善脂肪酸组成, Ng等[5]认为棕榈油在大西洋鲑饲料中的使用可以有效减少因植物油替代所造成的亚油酸在肌肉中的积累。此外, 在饲料中使用棕榈油可以使得鱼体组织中的VE含量显著增加, 有效延长鱼肉的贮藏期, 降低了脂肪氧化风险[16,17]。
黄颡鱼(Pelteobagrus fulvidraco) 俗称黄姑鱼、黄腊丁等, 属鲶形目(Siluriformes)鲿科(Bagridae)黄颡鱼属(Pelteobagrus), 为东亚特有种, 是我国内陆淡水地区的名特鱼类之一。近年来已成为我国重要的淡水养殖鱼类。黄颡鱼幼鱼的最适脂肪添加水平为9%—12%[18—20]。目前饲料行业多采用鱼油与豆油的混合油作为黄颡鱼脂肪源, 因此本实验以黄颡鱼为实验对象, 研究棕榈油替代鱼油和豆油对鱼体生长性能的影响并且探讨棕榈油的替代使用是否可以改善鱼体肌肉脂肪酸组成, 为养殖实践提供科学的理论基础。
1 材料与方法
1.1 实验饲料
本实验以国产鱼粉、豆粕等为主要蛋白源, 以小麦面粉为碳水化合物源, 以鱼油、豆油、棕榈油和磷脂油为脂肪源, 配制5组等氮(400 g/kg)等脂(100 g/kg)等能(15.70 MJ/kg)饲料, 实验饲料配方及常规营养成分组成见表 1。对照组(P0)不添加棕榈油, 以鱼油:豆油=1:2的混合油为脂肪源, P1-P4组分别添加10、25、40和55 g/kg的棕榈油等比例替代P0组的混合油。所有原料粉碎后全部通过60目筛, 按照添加量从小到大的顺序逐级搅拌混匀。用颗粒饲料机(SLP-45, 中国水产科学研究院渔业机械仪器研究所)制成直径为2.0 mm的饲料, 40℃烘干后于4℃储存备用。实验饲料的脂肪酸组成如表2所示。
1.2 饲养管理
实验用鱼由浙江省湖州市菱湖黄颡鱼养殖场提供, 经消毒后在水泥池(8 m×8 m×3 m)中暂养, 实验于宁波天邦股份有限公司水产饲料研究所室内循环水养殖系统中进行, 实验开始前, 先用实验饲料等量混匀为暂养料于每天09:00和15:00点饱食投喂2次, 经暂养2周后, 实验鱼饥饿24h, 然后每缸选取40尾体质健康、规格均匀的个体[平均尾重(16.15± 0.04) g]统一称重后随机放入一套15个圆形塑料缸系统(直径100 cm、高度60 cm、水量200 L)中, 循环水养殖, 共5个处理, 每个处理3个平行, 各处理间体重无显著性差异(P>0.05), 生长实验持续8周, 2015年8月14日—10月9日。实验期间每天饱食投喂3次(06:30、12:30和18:30), 观察残饵量确保实验鱼表观饱食, 记录每餐的残饵数量以校正每天的摄食量。系统气流量和水体交换量分别为10.8和10.5 L/ min。水温范围24—26℃, 氨氮浓度<0.5 mg/L, 亚硝酸盐<0.06 mg/L, 溶氧≥6mg/L, pH约为7.9—8.5。光照周期为12 L:12 D, 光照时间为07:00到19:00, 水面光强约为250 lx。

表 1 实验饲料配方和基本组分(g/kg干物质)Tab. 1 Ingredients and proximate composition of experimental diets (g/kg in dry matter)
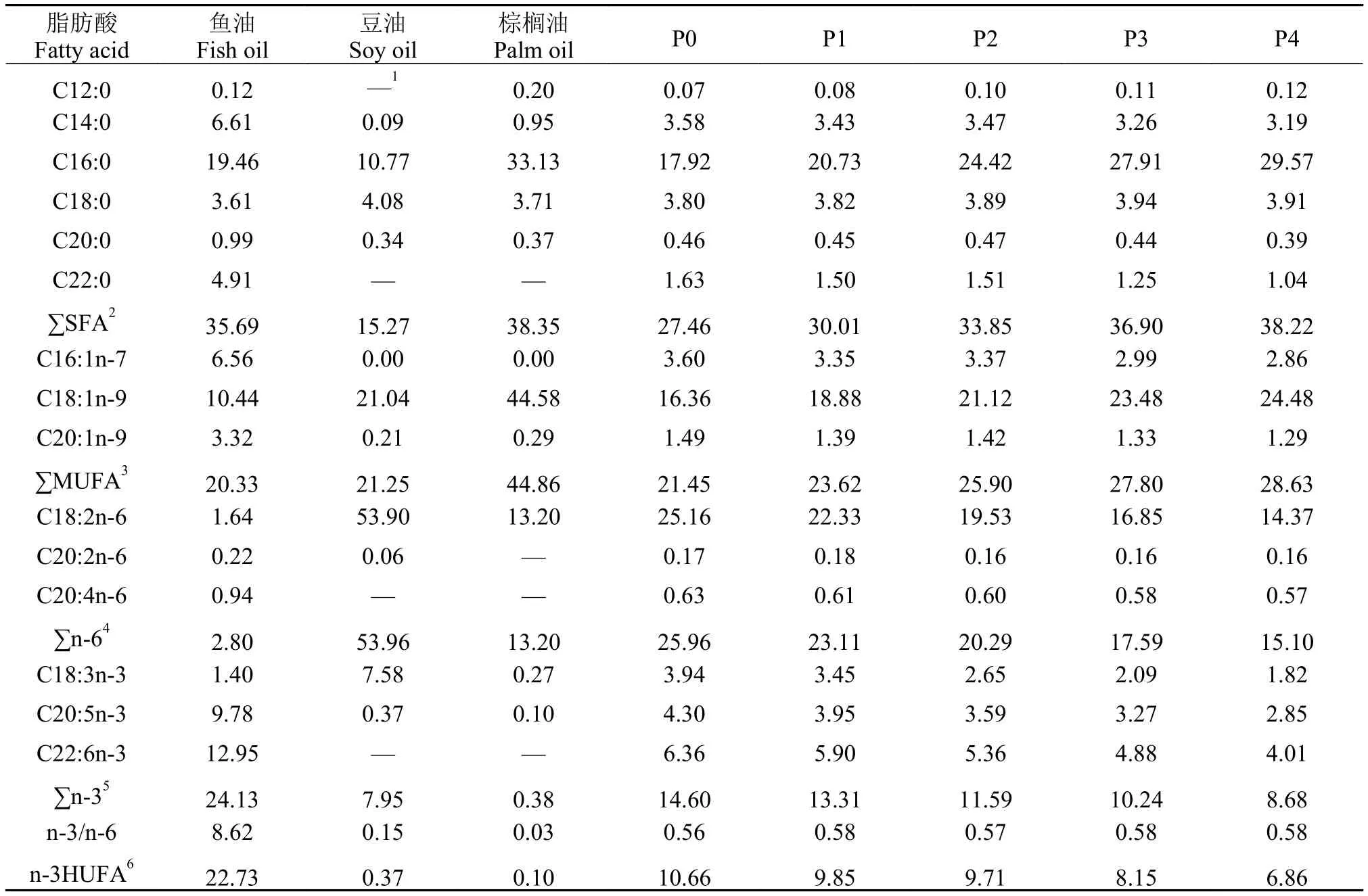
表 2 实验原料和饲料的脂肪酸组成(%总脂肪酸)Tab. 2 Fatty acid composition of experimental ingredients and feeds (% of total fatty acids)
1.3 取样与分析
在实验开始时, 随机选取20尾鱼, 分为3组, 称重后用作体成分分析。实验结束, 将实验鱼饥饿24h, 称总重, 每缸随机挑取3尾鱼称重后用于体成分分析, 并以总重计算特定生长率、饲料效率和蛋白沉积率。每缸另随机取5尾, 逐条称重并测量体长, 计算得出肥满度; 然后解剖分离出内脏和肝脏并称重, 计算得出脏体比和肝体比。最后, 每缸随机另取2尾鱼, 解剖取肝脏组织(3 mm×3 mm×3 mm),中性福尔马林固定液保存, 用于组织切片(H&E染色)病理检查; 取背部肌肉组织经液氮速冻后转入–20℃冰箱中, 用于组织脂肪酸组成分析。
1.4 样品分析方法
常规营养成分测定 实验饲料及鱼体生化组成测定参照AOAC[21]的方法在宁波天邦股份有限公司质检中心进行: 水分采用105℃烘干恒重法测定; 氮含量采用半自动定氮仪(KDN-204, 上海纤检仪器有限公司)测定, 粗蛋白由6.25×N含量计算出; 粗脂肪采用索氏抽提器(SZC-C, 上海纤检仪器有限公司)以乙醚为抽提液测定; 灰分通过马福炉(中国湖北英山县建力电炉制造厂)中550℃焚烧3h测定。
饲料及组织脂肪酸的测定 实验饲料、肌肉样的脂肪酸组成分析参照国家标准《动植物油脂脂肪酸甲酯制备》(GB/T 17376-2008)[22]和《动植物油脂脂肪酸甲酯的气相色谱分析》(GB/T 17377-2008)[23]的方法。甲酯化的脂肪酸由质检中心使用安捷伦7890A型气相色谱仪分析测定。以毛细管柱(60 m×0.25 mm×0.25 μm)采用程序升温(145℃:5min; 145—220℃:5℃/min; 220℃:20min)进行分离, 载气为氮气(流速43 mL/min), 检测器为氢离子火焰检测器。进样温度270℃, 检测器温度280℃, 内标为C11:0。
肝脏组织切片染色 肝脏组织切片制备采用常规梯度酒精脱水, 二甲苯透明, 石蜡包埋, Leica RM2145半自动切片机(Leica, Germany)连续切片,厚度为 5 μm, H&E染色, 脱水封片。使用光学显微镜及其配套软件观察和获取图片。
1.5 数据统计分析
原始数据经Excel2007初步整理后, 用SPSS 13.0对数据进行单因子方差分析(one-way ANOVA),显著水平为P<0.05, 若差异显著, 则用Duncan’s多重比较分析组间差异, 数据用平均值±标准差(Mean± SD)形式表示。
2 结果
2.1 生长性能
各实验组黄颡鱼成活率均为100%, 各实验组黄颡鱼终末体重、特定生长率、摄食量、饲料效率和蛋白沉积率均无显著差异(P>0.05), 但都呈现先升高后略微下降的趋势, 且各项指标均在P2组表现较好(表 3)。
2.2 鱼体成分及形体指标
不同处理组间鱼体粗脂肪、灰分和水分含量无显著差异(P>0.05), P4组鱼体粗蛋白含量显著低于其他各组(P<0.05, 表 4)。饲料中棕榈油不同替代水平对黄颡鱼肥满度和脏体比均无显著影响(P>0.05), 但各处理组肝体比呈现显著性差异, P4组肝体比显著高于P2组(P<0.05, 表 5)。
2.3 肌肉脂肪酸组成
表 6为饲料中棕榈油不同替代水平对黄颡鱼的肌肉脂肪酸组成的影响, 可以发现C16:0、C18:1n-9、SFA和MUFA的含量随着棕榈油替代水平的增加而显著上升(P<0.05), C18:2n-6和n-3HUFA含量随着棕榈油替代水平的增加显著降低(P<0.05), 但n-3/n-6比值随着棕榈油替代水平的增加而显著升高(P<0.05)。
2.4 肝脏组织结构
饲料中棕榈油不同替代水平对黄颡鱼肝脏组织结构产生明显的影响(图 1)。通过各处理组肝脏切片的观察比较, 对照组肝脏细胞中, 细胞边缘清晰, 细胞核明显, 高倍镜下可看到少量脂肪细胞(图1A), 随着棕榈油替代水平的升高, 肝脏细胞中, 肝血窦扩张充血(图 1C和1D), 在55 g/kg添加组出现肝脏细胞肿胀, 细胞核移位, 脂肪细胞较多, 肝血窦数量明显增多等不良现象(图 1E)。

表 3 饲料不同棕榈油添加水平对黄颡鱼生长性能的影响*Tab. 3 Effects of palm oil on growth performance of yellow catfish *

表 4 饲料不同棕榈油添加水平对黄颡鱼鱼体组成的影响*Tab. 4 Effect of palm oil on proximate composition of yellow catfish *

表 5 饲料不同棕榈油添加水平对黄颡鱼肥满度、脏体指数和肝体指数的影响Tab. 5 Effect of palm oil on condition factor, viscerasomatic index and hepatosomatic index of yellow catfish
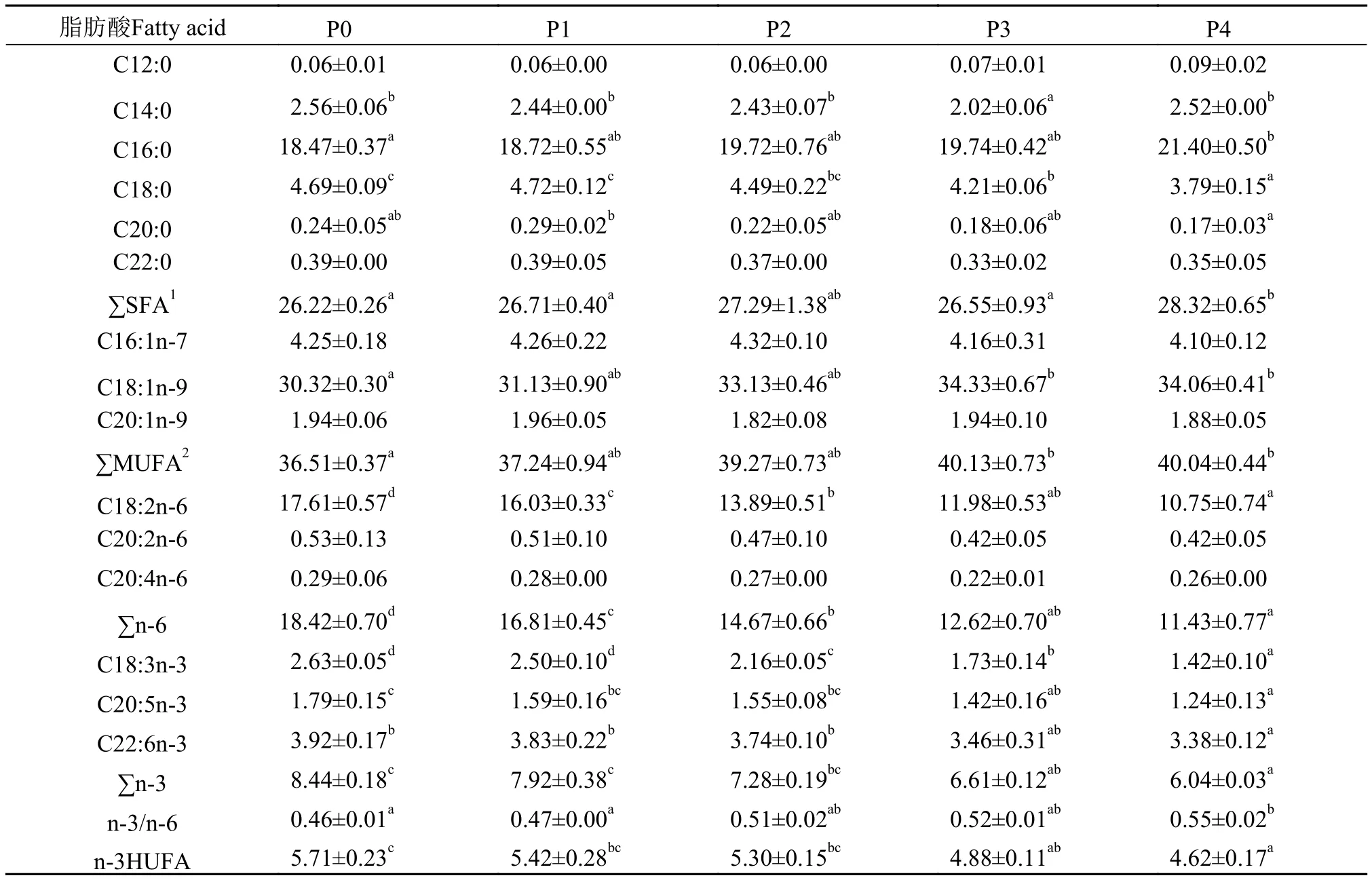
表 6 饲料不同棕榈油添加水平对黄颡鱼肌肉脂肪酸组成的影响(%总脂肪酸)Tab. 6 Effects of palm oil on muscle fatty acid composition of yellow catfish (% of total fatty acids)
3 讨论
3.1 棕榈油替代水平对黄颡鱼生长性能的影响
脂肪作为必需的营养物质, 为鱼类的生长发育提供能量和必需脂肪酸。本实验结果显示对于黄颡鱼, 棕榈油部分替代鱼油和豆油后, 各组摄食量和特定生长率与对照组没有显著差异, 在冷水肉食性鲑鳟鱼上的研究也表明棕榈油部分替代鱼油对大西洋鲑和虹鳟的生长性能没有显著的负面影响[2,3,5,13,24,25]。对于热水肉食性非洲鲶的研究表明, 在饲料中添加8%的棕榈油可以改善鱼体生长、蛋白质沉积和肌肉维生素E含量, 增强肌肉抗氧化能力[26]; 棕榈脂肪酸馏分油替代25%—50%的鱼油可以改善鱼体生长, 增强肌肉抗氧化能力, 并且在以鱼粉为主要蛋白源的饲料中, 棕榈脂肪酸馏分油可以完全替代鱼油[16,27]。在以上研究中, 饲料中均使用鱼粉为主要蛋白源, 鱼粉提供了0.5%—1.0%的n-3HUFA。在本实验中26%的鱼粉提供了0.59%的n-3HUFA, 因此, 如果饲料中必需脂肪酸可以满足鱼体生长, 尤其是在鱼粉为主要蛋白源的饲料中, 棕榈油可以部分或大量替代鱼油并且不影响鱼体生长性能。

图 1 光镜下黄颡鱼肝脏HE染色的石蜡切片图
对于棕榈油和豆油的比较, 消化率是一个很重要的方面, 虽然鱼类对各种油脂的普遍消化率在90%以上[28], 但是鱼类肠道对单个脂肪酸的吸收却和脂肪酸碳链长度、不饱和度以及碳链第一个双键的位置有关, 而这些又决定了油脂的熔点, 所以整体上表现出熔点与消化率成正相关, 豆油熔点较低, 在大西洋鲑和虹鳟上的研究都表明在低水温情况下豆油替代鱼油会增加脂肪的消化率, 然而对于棕榈油, Tortensen等[24]在大西洋鲑中的研究表明,当用棕榈油全部替代毛鳞鱼油(29.6 g/kg)后, 总体脂肪酸表观消化率显著低于葵花籽油和毛鳞鱼油,棕榈油组的生长性能也显著低于后两组。但是, Bell等[3]认为上述实验所得出棕榈油组结果较差的原因在于实验期间较低的水温[(8.0±0.4)℃]影响到了SFA和MUFA的消化率。Ng等[25]结合环境温度(11℃和6℃)与棕榈油在饲料中的含量(38 和95 g/kg)研究了大西洋鲑对脂肪酸的表观消化率, 该实验结果表明对于饲料中不同的棕榈油含量, 低温都倾向于降低饱和脂肪酸的表观消化率, 并且这种降低程度在饲料中含有较高水平的棕榈油时会更加明显,然而当饲料中棕榈油含量较低时(38 g/kg), 低温(6℃)时对脂肪酸消化率的影响微乎其微, 并且不会影响到能量的表观消化率和生长性能。在能量供应方面, Duan等[29]认为在n-3HUFA满足的情况下,与豆油相比, 棕榈油对于大黄鱼是一种更好的能源物质。棕榈油中的高含量18:1n-9能够更好满足鱼体能量需求, 适当地添加棕榈油会增加饲料中C16:0和C18:1n-9的含量, 鱼类细胞线粒体氧化能优先利用饱和脂肪酸和单不饱和脂肪酸产生能量满足能量需求[30]。对于本实验, 在水温范围24—26℃时, 棕榈油的添加并未影响到黄颡鱼的生长性能,是否棕榈油中高含量的C16:0和C18:1n-9会在能量供应中弥补消化率的差异, 从而使得整体能量表观消化率和生长性能不会因棕榈油的适量添加而受到影响, 这是一个值得进一步探讨的问题。
此外, 很多研究表明饲料中高水平的n-3HUFA也会对鱼体生长产生抗氧化负担等负作用[31—34], 而豆油中高含量的亚油酸也被证实会影响鱼体免疫细胞的脂肪酸组成, 改变花生酸的产量, 增加炎症相关基因的表达从而影响鱼体的健康[35], 因此在饲料中棕榈油的使用可以更好的平衡饲料的脂肪酸组成。
据上可推测, 本实验中棕榈油替代鱼油和豆油后黄颡鱼生长并没有受到影响的原因可以归结于: (1) 替代后形成的混合脂肪源以及饲料中的鱼粉可以满足黄颡鱼对n-3HUFA的需求; (2) 在水温24—26℃内, 棕榈油的替代水平对鱼体能量供应系统的影响并没有达到生长受阻的程度; (3) 棕榈油部分替代鱼油和豆油可以降低饲料中过量的n-3HUFA和亚油酸含量, 平衡油脂的脂肪酸组成。
3.2 棕榈油替代水平对黄颡鱼肝脏结构和形体指标的影响
植物油替代鱼油往往会造成脂肪在肝脏和肠道中积累, 甚至导致肝体指数上升[36,37]。覃川杰等[1]认为植物油替代鱼油导致饲料中高浓度的C16:0和C18:0降低了PUFA/SFA比例, 影响磷脂或脂蛋白的合成以及脂肪的转运和代谢, 因此长期饲喂植物油的鱼类会在肝细胞和肠道细胞中累积过量脂肪滴。很多研究表明植物油替代鱼油是否导致肝脏脂肪沉积与鱼体磷脂合成能力、水温以及替代脂肪源有关。刘飞[38]认为黄颡鱼幼鱼已具有较强的适应能力和较强的磷脂合成能力, 因此对饲料中磷脂添加多少并不敏感。对大西洋鲑的研究表明豆油替代鱼油会导致轻微的肝脏脂肪沉积, 但使用棕榈油替代鱼油却不会影响肝脏脂肪沉积[3,24], 并且在红杂交罗非鱼的研究也表明使用棕榈脂肪酸馏分油会降低肝脏脂肪含量, 这与本实验中低棕榈油替代水平组肝体比呈现下降的趋势相符。严晶[39]对大黄鱼的研究表明富含棕榈酸的油脂组大黄鱼肝脏CPT1(肉碱棕榈酰转移酶1)的表达量与鱼油组相比增加了5倍, 并认为饲料中相对较高水平的棕榈酸会部分降低大黄鱼肝脏脂肪含量与肝脏脂蛋白分泌和β-氧化能力增加有关; 然而Fountoulaki等[40]报道棕榈油替代69%的鱼油会使得过多的脂肪在金头鲷肝脏中沉积, 出现细胞肿胀、细胞核移位以及脂肪细胞增多的现象, 这与本实验中在最高替代水平组肝脏组织结构异常的现象相吻合。Tocher等[41]的研究表明用棕榈油替代鱼油在低水温(7℃)的条件下会导致虹鳟肝脏脂肪含量显著升高, 而当水温上升到11℃或者15℃时肝脏脂肪含量并不会发生明显变化。
3.3 棕榈油替代水平对黄颡鱼肌肉脂肪酸组成的影响
很多研究表明, 鱼类的肌肉脂肪酸组成均与饲料脂肪酸组成有着高度相关性[30,42—49]。在本实验中黄颡鱼经饲喂不同替代水平的棕榈油饲料8周后,随着饲料中鱼油和豆油的减少, 鱼体肌肉中亚油酸和n-3HUFA的含量逐渐减少。但是P4组与P0组相比鱼体肌肉中n-3HUFA的下降幅度(19.08%)要小于饲料中n-3HUFA的下降幅度(35.65%), 脂肪源的改变不可避免地影响了鱼体肌肉的脂肪酸组成, 但鱼体也仍然在控制脂肪酸的改变, 使之稳定在一定范围内[9,40,48,50], 因此鱼体脂肪酸的改变没有脂肪源中差异大。另一方面, 淡水鱼能够更有效地将18:3n-3转化为n-3HUFA并且对n-3HUFA存在保留机制[34]。饲料中的植物油能活化大多数鱼类肝脏细胞将脂肪酸去饱和及延长的能力, Bell等[3]的研究表明与100%鱼油组相比, 100%棕榈油组大西洋鲑的肝脏脂肪酸去饱和酶和链延长酶的活性提高了10倍。
Turchini等[9]认为豆油等富含亚油酸的植物油大量替代鱼油会导致鱼体肌肉中亚油酸的大量沉积, 而且很难通过后期的鱼油饲料将其移除, Fountoulaki等[40]的研究表明在上市前采用鱼油饲料恢复投喂金头鲷120d后, 豆油组金头鲷肌肉中的亚油酸含量仍为鱼油组的2倍, 而同期棕榈油组仅为鱼油组的约1.3倍。因此从营养和肉质的角度来评价,亚油酸是最为有害的脂肪酸, 富含亚油酸的植物油对鱼体肌肉脂肪酸组成的影响限制了植物油在水产饲料中的大量使用, 较为理想的鱼油替代脂肪源应该含有较高水平的SFA和MUFA以提供能量和较低水平的亚油酸以避免在鱼体肌肉中的过度沉积。虽然目前人们对亚油酸在人类饮食中的作用还存在巨大争议, 但大多研究认为亚油酸过剩对人体是有害的[51,52], NRC(2011)[50]表示基于这些考虑,在鱼体中避免亚油酸的过度沉积是必要的, 由于人类膳食含过多的亚油酸, 故建议高n-3/n-6比值的鱼肉是适合人类膳食营养。棕榈油中含有高水平的棕榈酸(45%)和油酸(39%), 少量的亚油酸(9.4%)。这与以亚油酸为主的大豆油形成鲜明的差别, 而且本研究表明饲料中使用棕榈油作为替代脂肪源可以较好地控制鱼体肌肉中亚油酸的含量, 鱼体肌肉n-3/n-6比值随着棕榈油替代水平的增加而显著升高。所以从营养角度评价, 棕榈油替代混合油在一定程度上改善了黄颡鱼的肌肉脂肪酸组成。
4 结论
本研究表明不同水平的棕榈油(0—55 g/kg)替代鱼油和豆油不会对黄颡鱼生长性能产生不良的影响, 并且在25 g/kg棕榈油添加水平组黄颡鱼获得比较好的生长表现和饲料利用效率, 但是在55 g/kg添加水平会造成黄颡鱼肝体比显著升高, 对肝脏组织产生不良影响。鱼体脂肪酸组成基本上反应了饲料脂肪酸组成, 亚油酸和n-3HUFA含量随着棕榈油替代水平的增加显著降低(P<0.05), 但n-3/n-6比值随着棕榈油替代水平的增加而显著升高(P<0.05)。据上所述: 对于黄颡鱼幼鱼, 棕榈油可以替代25 g/kg的混合脂肪源(鱼油:豆油=1:2)不影响鱼体生长性能并且在一定程度上改善了肌肉脂肪酸组成。
[1]Qin C J, Xie J, Wang Y M, et al. The effect of vegetable oil replacement of fish oil on lipid metabolism in fish [J]. Transactions of Oceanology and Limnology, 2013, 4: 89—100 [覃川杰, 颉江, 王永明, 等. 植物油替代鱼油影响鱼类脂肪代谢的研究进展. 海洋湖沼通报, 2013, 4: 89—100]
[2]Rosenlund G, Obach A, Sandberg M G, et al. Effect of alternative lipid sources on long-term growth performance and quality of Atlantic salmon (Salmo salar L.) [J]. Aquaculture Research, 2001, 32(suppl. 1): 323—328
[3]Bell J G, Henderson R J, Tocher D R, et al. Substituting fish oil with crude palm oil in the diet of Atlantic salmon (Salmo salar) affects muscle fatty acid composition and hepatic fatty acid metabolism [J]. Journal of Nutrition, 2002, 132(2): 222—230
[4]Tocher D R, Bell J G, Dick J R, et al. Polyunsaturated fatty acid metabolism in Atlantic salmon (Salmo salar) undergoing parrsmolt transformation and the effects of dietary linseed and rape seed oils [J]. Fish Physiology and Biochemistry, 2000, 23(1): 59—73
[5]Ng W K, Tocher R D, Bell J G. The use of palm oil in aquaculture feeds for salmonid species [J]. European Journal of Lipid Science and Technology, 2007, 109(4): 39—399
[6]Martins D A, Gomes E, Rema P, et al. Growth, digestibility and nutrient utilization of rainbow trout (Oncorhynchus mykiss) and European seabass (Dicentrarchus labrax) juveniles fed different dietary soybean oil levels [J]. Aquaculture International, 2006, 14(3): 285—295
[7]Izquierdo M S, Obach A, Arantzamendi L, et al. Dietary lipid sources for seabream and seabass: growth performance, tissue composition and flesh quality [J]. Aquaculture Nutrition, 2003, 9(6): 397—407
[8]Molnár T, Szabó A, Szabó G, et al. Effect of different dietary fat content and fat type on the growth and body composition of intensively reared pikeperch Sander lucioperca (L.) [J]. Aquaculture Nutrition, 2006, 12(3): 173—182
[9]Turchini G M, Torstensen B E, Ng W K. Fish oil replacement in finfish nutrition [J]. Reviews in Aquaculture, 2009, 1(1): 10—57
[10]Turchini G M, Francis D S, De Silva S S, et al. Modifica-tion of tissue fatty acid composition in Murray cod (Maccullochella peelii peelii, Mitchell) resulting from a shift from vegetable oil diets to a fish oil diet [J]. Aquaculture Research, 2006, 37: 570—585
[11]Turchini G M, Francis D S, De Silva S S. Finishing diets stimulate compensatory growth: results of a study on Murray cod, Maccullochella peelii peelii [J]. Aquaculture Nutrition, 2007b, 13(5): 351—360
[12]Basiron Y. Palm oil production through sustainable plantations [J]. European Journal of Lipid Science and Technology, 2007, 109: 289—295
[13]Fonseca-Madrigal J, Karalazos V, Campbell P J, et al. Influence of dietary palm oil on growth, tissue fatty acid compositions, and fatty acid metabolism in liver and intestine in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture Nutrition, 2005, 11(4): 241—250
[14]Ng W K, Tee M C, Boey P L. Evaluation of crude palm oil and refined palm olein as dietary lipids in pelleted feeds for a tropical bagrid catfish Mystus nemurus (Cuvier and Valenciennes) [J]. Aquaculture Research, 2000, 31(4): 337—347
[15]Varghese S, Oommen O V. Long-term feeding of dietary oils alters lipid metabolism, lipid peroxidation, and antioxidant enzyme activities in a teleost (Anabas testudineus Bloch) [J]. Lipids, 2000, 35(7): 757—762
[16]Ng W K, Wang Y, Ketchimenin P, et al. Replacement of dietary fish oil with palm fatty acid distillate elevates tocopherol and tocotrienol concentrations and increases oxidative stability in the muscle of African catfish, Clarias gariepinus [J]. Aquaculture, 2004, 233(1-4): 423—437
[17]Wang Y, Yuen K H, Ng W K. Deposition of tocotrienols and tocopherols in the tissues of red hybrid tilapia, Oreochromis sp., fed at ocotrienol-rich fraction extracted from crude palm oil and its effect on lipid peroxidation [J]. Aquaculture, 2006, 253(1-4): 583—591
[18]Han Q, Tian Z C, Xia W F. Optimal dietary lipid requirement of yellow catfish Pelteobagrus fulvidraco [J]. Fisheries Science, 2005, 24(7): 8—11 [韩庆, 田宗城, 夏维福,等. 黄颡鱼饲料脂肪的最适含量. 水产科学, 2005, 24(7): 8—11]
[19]Qin C J. The lipid metabolism-related gene from darkbarbel catfish, Pelteobagrus vachelli juvenile: cDNA cloning, characteration and mRNA expression pattern [D]. Thesis for Doctor of Science. Shanghai Normal University, Shanghai. 2010 [覃川杰. 黄颡鱼脂肪代谢相关基因cDNA的克隆及表达分析, 博士学位论文. 上海华东师范大学, 上海. 2010]
[20]Zheng K K, Zhu X M, Han D, et al. Effects of dietary lipid level on growth and lipoprotein lipase gene expression in Pelteobagrus vachell [J]. Acta Hydrobiological Sinica, 2010, 34(4): 815—821 [郑珂珂, 朱晓鸣, 韩冬,等. 饲料脂肪水平对黄颡鱼生长及脂蛋白脂酶基因表达的影响. 水生生物学报, 2010, 34(4): 815—821]
[21]AOAC. Official Methods of Analysis of Official Analytical Chemists, 16th edn [S]. Association of Official Analytical Chemists, Arlington, VA, USA. 1995
[22]General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China: Standardization Administration of the People’s Republic of China. GB/T 17376-2008 Animal and vegetable fats and oils-Preparation of methyl esters of fatty acids [S]. Beijing: China Standards Press. 2009 [中华人民共和国国家质量检验检疫总局, 中国国家标准化管理委员会. GB/T 17376-2008动植物油脂脂肪酸甲酯制备. 北京:中国标准出版社. 2009]
[23]General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China: Standardization Administration of the People’s Republic of China. GB/T 17377-2008 Animal and vegetable fats and oils-Analysis by gas chromatography of methyl esters of fatty acids [S]. Beijing: China Standards Press. 2009 [中华人民共和国国家质量检验检疫总局, 中国国家标准化管理委员会. GB/T 17377-2008动植物油脂脂肪酸甲酯的气相色谱分析. 北京: 中国标准出版社. 2009]
[24]Tortensen B E, Lie O, Froyland L. Lipid metabolism and tissue composition in Atlantic salmon (Salmo salar L.)-effects of capelin oil, palm oil and oleic acid-enriched sunflower oil as dietary lipid sources [J]. Lipids, 2000, 35(6): 653—664
[25]Ng W K, Sigholt T, Bell J G. The influence of environmental temperature on the apparent nutrient and fatty acid digestibility in Atlantic salmon (Salmo salar L.) fed finishing diets containing different blends of fish oil, rapeseed oil and palm oil [J]. Aquaculture Research, 2004, 35(13): 1228—1237
[26]Lim P K, Boey P L, Ng W K. Dietary palm oil level affects growth performance, protein retention and tissue vitamin E concentration of African catfish, Clarias gariepinus [J]. Aquaculture, 2001, 202(1-2): 101—112
[27]Ng W K, Lim P K, Boey P L. Dietary lipid and palm oil source affects growth, fatty acid composition and muscle α-tocopherol concentration of African catfish, Clarias gariepinus [J]. Aquaculture, 2003, 215(1-4): 229—243
[28]Hertrampf J W, Piedad-Pascual F. Handbook on Ingredients for Aquaculture Feeds [M]. Dordrecht: Kluwer Academic Publishers. 2000, pp 586—593
[29]Duan Q Y, Mai K S, Shentu J K, et al. Replacement of dietary fish oil with vegetable oils improves the growth and flesh quality of large yellow croaker (Larmichthyscrocea) [J]. Journal of Ocean University of China, 2013, 13(3): 445—452
[30]Henderson R J. Fatty acid metabolism in freshwater fish with particular reference to polyunsaturated fatty acids [J]. Archives of Animal Nutrition, 1996, 49(1): 5—22
[31]Satoh S, Poe W E, Wilson R P. Effect of dietary n-3 fatty acids on weight gain and polar lipid fatty acid composition of fingerling channel catfish, Ictalurus punctatus [J]. Journal of Nutrition, 1989, 119(1): 23—28
[32]Furuita H, Tanaka H, Yamamoto T, et al. Effects of high levels of n-3HUFA in broodstock diet on egg quality and egg fatty acid composition of Japanese flounder, Paralichthys olivaceus [J]. Aquaculture, 2002, 210(1): 323—333
[33]Lin Y H, Shiau S Y. Effects of dietary blend of fish oil with corn oil on growth and non-specific immune responses of grouper, Epinephelus malabaricus [J]. Aquaculture Nutrition, 2007, 13(2): 137—144
[34]Du Z Y. Consequences of fat feeding on growth and body lipids in a herbivorous fish (Grass carp, Ctenopharyngodon idella): mechanisms related to fatty acid oxidation [D]. Thesis for Doctor of Science. Zhongshan University, Zhongshan. 2005 [杜震宇. 草鱼对脂肪的利用和对脂肪酸β-氧化的研究. 博士学位论文, 中山大学, 中山. 2005]
[35]Montero D, Grasso B, Izquierdo M, et al. Total substitution of fish oil by vegetable oils in gilthead seabream (Sparus aurata) diets: effect on hepatic Mx expression and some immune parameters [J]. Fish and Shellfish Immunology, 2008, 24(2): 147—155
[36]Bransden M P, Carter C G, Nichols P D. Replacement of fish oil with sunflower oil in feeds for Atlantic salmon (Salmo salar L.): effect on growth performance, tissue fatty acid composition and disease resistance [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2003, 135(4): 611—625
[37]Piedecausa M A, Mazón M J, García B G, et al. Effects of total replacement of fish oil by vegetable oils in the diets of sharpsnout seabream (Diplodus puntazzo) [J]. Aquaculture, 2007, 263(1—4): 211—219
[38]Liu F. The effect of different oils and different levels of phospholipids on the growth and fatty acid composition of yellow catfish, Pelteobagrus fulvidraco [D]. Huazhong Agricultural University, Wuhan. 2004 [刘飞. 不同油脂、不同磷脂水平对黄颡鱼生长及其脂肪酸组成的影响.研究生学位论文, 华中农业大学, 武汉. 2004]
[39]Yan J. Effects of dietary lipid levels and fatty acids on lipid deposition in large yellow croaker (Larmichthys crocea) [D]. Thesis for Doctor of Science. Ocean University of China, Qindao. 2015 [严晶. 饲料脂肪水平和脂肪酸对大黄鱼脂肪沉积的影响. 博士学位论文, 中国海洋大学, 青岛. 2015]
[40]Fountoulaki E, Vasilaki A, Hurtado R, et al. Fish oil substitution by vegetable oils in commercial diets for gilthead sea bream (Sparus aurata L.); effects on growth performance, flesh quality and fillet fatty acid profile: Recovery of fatty acid profiles by a fish oil finishing diet under fluctuating water temperatures [J]. Aquaculture, 2009, 289(3—4): 317—326
[41]Tocher D R, Fonseca-Madrigal J, Dick J R, et al. Effects of water temperature and diets containing palm oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes of rainbow trout (Oncorhynchus mykiss) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2004, 137(1): 49—63
[42]Ng W K, Lim P K, Sidek H. The influence of dietary lipid source on growth, muscle fatty acid composition and erythrocyte osmotic fragility on hybrid tilapia [J]. Fish Physiology and Biochemistry, 2001, 25(4): 301—310
[43]Bahurmiz O M, Ng W K. Effects of dietary palm oil source on growth, tissue fatty acid composition and nutrient digestibility of red hybrid tilapia, Oreochromis sp. , raised from stocking to marketable size [J]. Aquaculture, 2007, 262(2): 382—392
[44]Teoh C Y, Turchini G M, Ng W K. Erratum to “Genetically improved farmed Nile tilapia and red hybrid tilapia showed differences in fatty acid metabolism when fed diets with added fish oil or a vegetable oil blend [J]. Aquaculture, 2011, 316(1): 144—154
[45]Li F J, Lin X, Lin S M, et al. Effects of dietary fish oil substitution with linseed oil on growth, muscle fatty acid and metabolism of tilapia (Oreochromis niloticus) [J]. Aquaculture Nutrition, 2016, 3(22): 499—508
[46]Ji H, Li J, Liu P. Regulation of growth performance and lipid metabolism by dietary n-3 highly unsaturated fatty acids in juvenile grass carp, Ctenopharyngodon idellus [J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2011, 159(1): 49—56
[47]Tan X Y. Nutrient physiology of lipid in yellow catfish Pelteobagrus fulvidraco[D]. Thesis for Doctor of Science. Huazhong Agricultural University, Wuhan. 2012 [谭肖英. 黄颡鱼脂类营养生理研究. 博士学位论文, 华中农业大学, 武汉. 2012]
[48]Li Xin, Yang R B, Qian X Q, et al. Effects of dietary vegetable oils when fed to genetically improved farmed tilapia strain of Nile tilapia [J]. Acta Hydrobiological Sinica, 2016, 40(4): 672—680 [李新, 杨瑞斌, 钱雪桥, 等.不同植物脂肪源对吉富罗非鱼生长性能、肌肉脂肪酸和生理生化指标的影响. 水生生物学报, 2016, 40(4): 672—680]
[49]Imanpoor M R, Asghari M, Asadi R. Requirements for n-3 highly unsaturated fatty acids in feeding juvenile Iranian sturgeon (Acipenser persicus) and its effects on growth, carcass quality, and fatty acid composition [J]. Aquaculture International, 2011, 19(6): 1035—1046
[50]National Research Council (NRC): Nuitrient Requirements of Fish and Shrimp [M]. Washington D. C.: The National Academies Press. 2011
[51]Whelan J. The health implications of changing linoleic acid intakes [J]. Prostaglandins Leukotrienes & Essential Fatty Acids, 2008, 79(3-5): 165—167
[52]Ramsden C E, Hibbeln J R, Lands W E. Letter to the Editor re: Linoleic acid and coronary heart disease. Prostaglandins Leukot. Essent. Fatty Acids (2008), by W. S. Harris [J]. Prostaglandins Leukotrienes & Essential Fatty Acids, 2009, 80(1): 77—78
EFFECTS OF SUBSTITUTING PALM OIL FOR FISH OIL AND SOY OIL IN FEED ON THE GROWTH PERFORMANCE AND MUSCULAR FATTY ACID COMPOSITION OF PELTEOBAGRUS VACHELLI
ZHAO Shuai-Bing1,2, WU Wen-Jun2, DAI Xiao-Fang2, ZHU Ling-Ying2, LU Yu-Xiao2and WU Tian-Xing1,2
(1. Department of Chemistry, College of Science, Zhejiang University, Hangzhou 310027, China; 2. Ningbo Tech-bank Co., Ltd, Yuyao 315400, China)
To investigate the effects of dietary replacement of fish-soy oil mixtures by palm oil on growth performance, feed utilization, muscular fatty acid composition, morphological index and liver tissue structure of yellow catfish (Pelteobagrus vachelli Richardson), five iso-proteic (400 g/kg), iso-lipidic (100 g/kg) and iso-energetic (15.70 MJ/kg) diets were formulated, in which the control group was supplemented with 1:2 fish-soy oil mixtures, and trial groups adopted different palm oil level (10 g/kg, 25 g/kg, 40 g/kg and 55 g/kg) to replace the mixture oil, respectively. For a 8-week trial. The results showed that dietary palm oil replacement had no significant effect on the feed intake, body weight, growth rate, feed efficiency, and protein retention efficiency (P>0.05). All the above parameters were increased with increasing dietary palm oil replacement level up to 25 g/kg, and then decreased. LA and n-3 HUFA concentrations in dorsal muscle significantly decreased with increasing dietary palm oil replacement level (P<0.05), while muscular n-3/n-6 significantly increased with increasing dietary palm oil replacement level (P<0.05). Furthermore, there were no significant difference in condition factor and viscerosomatic index among different groups (P>0.05). However, hepatosomatic index of 55 g/kg palm oil group was significantly higher than that of 25 g/kg palm oil group (P<0.05). The swelling hepatocytes with nuclei displacement and the increasing number of hepatic sinusoid and lipid cells were observed in 55 g/kg palm oil group. In conclusion, palm oil that replace 1:2 fish-soy oil mixtures up to 25 g/kg had no significant effect on the growth performance but improved the fatty acid profile of dorsal muscle.
Palm oil; Pelteobagrus vachelli; Growth performance; Feed utilization; Muscular fatty acids
S965.1
A
1000-3207(2017)05-1000-10
10.7541/2017.125
2016-10-08;
2016-12-28
浙江省博士后科研项目择优资助 [Supported by the Preferential Fund for Zhejiang Provincial Post-doctoral Scientific Research Projects]
赵帅兵(1989—), 男, 河南扶沟人; 博士; 主要从事鱼类营养与饲料学研究。E-mail: zhaosb@tianbang.com
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
