不结球白菜耐热相关基因BcPLDγ的克隆和表达分析
2017-09-12樊小雪袁希汉陈龙正
徐 海,宋 波,樊小雪,袁希汉,陈龙正
(江苏省农业科学院 蔬菜研究所,江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
不结球白菜耐热相关基因BcPLDγ的克隆和表达分析
徐 海,宋 波,樊小雪,袁希汉,陈龙正*
(江苏省农业科学院 蔬菜研究所,江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
以不结球白菜耐热自交系‘高华青’、‘苏州青’和热敏自交系‘矮脚黄’为试验材料,利用RACE技术克隆得到不结球白菜BcPLDγ基因,利用生物信息学方法对该基因进行信息学分析,并采用qRT-PCR 技术对热胁迫处理条件下不结球白菜叶片BcPLDγ基因的表达模式进行了研究.结果显示,BcPLDγ基因的cDNA全长为2736 bp,其中开放阅读框长度为1905 bp,共编码634个氨基酸.该蛋白不存在信号肽序列,预测相对分子量为71.59 kD,理论等电点为6.73.BcPLDγ蛋白的二级结构主要由α-螺旋、延伸直链、β-转角和无规则卷曲4种形式构成.该蛋白含有一个植物PLD特有的C2结构域和一个PLDc结构域.系统进化分析表明BcPLDγ蛋白与同属植物的进化关系相近,其中与甘蓝型油菜进化关系最近.热胁迫处理条件下,3份试验材料中BcPLDγ基因表达均显著上调,并于12 h时达到峰值,且上调趋势与试验材料的耐热性呈正相关.
不结球白菜;耐热;BcPLDγ;基因表达
磷脂酶D(Phospholipase D,简称PLD)是一种水解磷脂的酶类,普遍存在于各类植物中,可通过水解磷脂酰胆碱生成磷脂酸,在植物的新陈代谢和细胞信号转导过程当中扮演了不同的角色.已有研究表明,PLD参与了植物中细胞生长、细胞凋亡、细胞支架的改变、囊泡运输、根生长、生物胁迫应答和细胞氧化破裂等众多生命现象[1-7].植物中的PLD基因家族包括了多个基因,仅在拟南芥中就已被鉴定出12个PLD基因,根据基因的结构和它们编码的PLD的序列相似性、生化特性、域结构以及cDNA克隆的顺序,可将其分为6种类型:PLDα (3),PLDβ(2),PLDγ(3),PLDδ,PLDε和PLDζ(2)[8-10].目前,已经从拟南芥、甘蓝型油菜、小麦、花生和向日葵等植物中克隆到PLD基因[11-15],发现PLD对包括低温、干旱、盐、缺素和病害等各种胁迫和激素处理均有响应[16-22].
不结球白菜(Brassicarapassp.chinensis)是我国长江流域各地广泛栽培的一种大众化蔬菜,现占长江中下游大中城市蔬菜复种面积的30%~40%[23],其性喜冷凉,在平均气温18~20 ℃下生长最适,在高温环境下生育衰弱,短缩茎易伸长,叶片易变黄、变薄,死苗率高,苦味、纤维含量明显增加,食用品质也明显下降[24-26].所以,如何保证不结球白菜在高温环境下的生产能力便成为目前生产中亟待解决的首要问题.PLD参与植物热胁迫应答反应的研究相对较少.研究发现,高温下PA(磷脂酸)含量升高,其大部分来自PLD的水解产物,即高温激活PLD,促进水解产生PA和PIP2,进而调控离子通道和细胞骨架[27].Yang et al在高山离子芥中克隆了一个CbPLD基因,CbPLD能够被热胁迫所诱导并大量表达[28].这些研究结果说明PLD与植物热胁迫应答具有紧密联系.因此,研究PLD基因在不结球白菜热胁迫过程中的表达特性以及可能关联的信号转导途径对揭示其耐热机制和选育耐热品种具有重要意义.
1 材料与方法
1.1 材料
以不结球白菜耐热自交系‘高华青’、‘苏州青’和热敏自交系‘矮脚黄’为试验材料.选取籽粒饱满、整齐一致的种子经灭菌后播种于装有灭菌基质的穴盘中,在人工气候室25 ℃、光周期12 h/12 h条件下培养,待长至6~7叶期时移入人工气候箱进行热胁迫处理(38 ℃/28 ℃,昼/夜).
总RNA提取试剂Trizol(RK01-100),AL2000 DNA Marker(DM0101)购自南京钟鼎生物技术有限公司;RACE试剂盒(FirstChoice®RLM-RACE Kit,Part No. AM1700)购自invitrogen公司;GelStain(GS101-01)购自北京全式金生物技术有限公司;DEPC(D5758-25 ML)购自美国Sigma-Aldrich公司;Agarose(91622)购自西班牙Biowest公司;大肠杆菌DH10B购自南京钟鼎生物技术公司;载体pMD18-T购自大连TaKaRa公司,引物由南京钟鼎生物技术公司合成.
1.2 方法
1.2.1 热胁迫处理 选取苗龄6~7片叶的上述材料置于人工气候箱内进行高温处理,昼/夜温度设定为38 ℃/28 ℃,湿度控制在50%,光周期12 h/12 h(昼/夜),光照强度12 000 lx.分别于处理0、6、12、24、48、72、96和120 h取植株叶片各0.1 g,保存于-70 ℃冰柜中待测.每个处理设3次重复.
1.2.2 叶片中总RNA提取及cDNA合成 不结球白菜叶片RNA的提取采用Trizol法;用Prime Script RT reagent Kit将提取的RNA反转录成cDNA.
1.2.3 不结球白菜BcPLDγ基因全长cDNA获得 以‘高华青’叶片所提总RNA为材料,使用加有人工接头的CDSIII引物合成第一链cDNA,并且用逆转录酶在5’端加上d(C).在逆转录酶作用下,加上SMART Oligonucleotide,接着通过LD-PCR获得双链cDNA.根据前期RNA-Seq获得的PLD unigene[29](已具备完整的5’端序列)设计基因特异引物(PLD-3race-F1:5-TGTATCTCAAAGGTCTTGCT-3;PLD-3race-F2:5-ATGTCAATGGAAGGGTCAAG-3),以双链cDNA为模板,使用基因特异引物PLD-3race-F1以及3’的接头引物,进行3’序列的巢式PCR第一轮PCR,PCR反应条件为:94 ℃ 预变性5 min,94 ℃变性30 s,57 ℃复性30 s,68 ℃延伸90 s,35个循环,68 ℃延伸5 min,4 ℃终止.再以稀释50倍的第一轮PCR产物为模板,使用基因特异引物PLD-3race-F2以及3’的接头引物,进行3’序列巢式PCR的第二轮PCR.将回收到的目的片段与TAKARA公司的pMD18T载体16 ℃连接过夜,次日做转化,挑取单克隆菌液PCR检测,随机挑取其中的阳性克隆送至南京钟鼎生物技术公司进行测序.
1.2.4 生物信息学分析 利用DNAman6.0、NCBI blastp、MEGA5.0、TMpred、ProtParam和Signal P等生物学软件对本研究所克隆得到基因序列进行生物信息学分析[30].
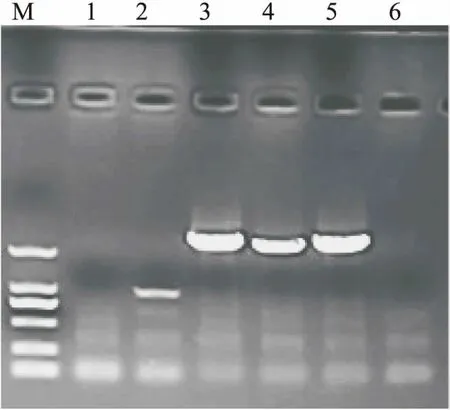
图1 RACE扩增的BcPLDγ基因Fig.1 Result of RACE amplification of BcPLDγ geneM:DNA MARKER 2000 bp;1-2:假阳性克隆;3-5:PLD基因3端RACE片段阳性克隆;6:阴性对照
1.2.5 不结球白菜BcPLDγ基因在热胁迫处理条件下的实时定量表达分析 根据BcPLDγ基因编码区序列,利用Beacon Designer v 7.9软件设计实时定量PCR引物(PLD-F:5′-GTGTTGAGTTTGGCTATTC -3′;PLD-R:5′-CAAGTTCTTTGCCTGTCTA -3′),扩增片段长度为252 bp.选取actin基因作为内参(actin-F:5′-GAATCCACGAAACAACTTACAACTC -3′;actin-R:5′-CTCTTTGCTCATACGGTCAGC-3′).反应采用20 μ L体系,包括2×Sybr Green Qpcr Mix 10 μL,上、下游引物各1 μL,cDNA模板1 μL,反应程序为:94 ℃ 30 s,94 ℃ 10 s,60 ℃ 12 s,72 ℃ 30 s,45个循环,每个反应设3次重复.
2 结果与分析
2.1 不结球白菜BcPLDγ基因的克隆及序列分析
通过RACE,获得了两个不同大小的PLD 3’-RACE的条带,根据与拟南芥基因组比对的结果选择了比较大的调控进行了克隆,获得的片段长度为2 148 bp(图1),与原始序列拼接后获得BcPLDγ基因全长2 736 bp,其中5’ 端非翻译区(5’UTR)长201 bp,3’端非翻译区(3’UTR)长630 bp,ORF长1 905 bp,编码634个氨基酸.

图2 不结球白菜PLD与其他植物PLD的氨基酸序列同源比对黑色背景一致性为100%,红色背景一致性≥75%,蓝色背景一致性≥50% Fig.2 An alignment comparison of non-heading Chinese cabbage PLD amino acid sequence homologous with other plants PLD Black background indicates 100% sequence homology,red background ≥75%,blue background ≥50%
从Gene Bank中检索与不结球白菜BcPLDγ蛋白相似性较高物种的氨基酸序列,通过序列比对发现该蛋白与甘蓝型油菜、拟南芥、琴叶拟南芥和甘蓝等植物有较高的同源性,其中与甘蓝型油菜PLD的同源性高达98%,与琴叶拟南芥PLDγ1和拟南芥PLDγ1同源性均为76%,与甘蓝PLDγ1的同源性为75%(图2).用MEGA5.0软件构建了不结球白菜PLD与其他11种植物的PLD的系统进化树,由图3可见12种植物的PLD蛋白具有较为相近的进化起源,不结球白菜与甘蓝型油菜在同一个小分支上,同源性最高,而同为芸薹属植物的拟南芥、琴叶拟南芥和甘蓝也与不结球白菜有较近的亲缘关系.

图3 不结球白菜及其他植物PLD的系统进化树Fig.3 Phylogenetic tree of PLD from non-heading Chinese cabbage and other species
2.2BcPLDγ基因的生物信息学分析
通过ProtParam(http://web.expasy.org/protparam/)在线软件预测BcPLDγ编码的蛋白分子式为C3200H4964N878O939S26,其分子量为71.59 kD,等电点为6.73,属于酸性蛋白质.负电荷氨基酸数(Asp+Glu)为77个;正电荷氨基酸(Arg+Lys)为74个,不稳定系数为38.00,属于稳定型蛋白(<40蛋白稳定),脂肪系数为81.47,平均亲水性(GRAVY)-0.350,预测该蛋白质为亲水性蛋白.
蛋白质高级结构的形成对其生物功能具有重要作用,而高级结构的预测则为了解蛋白质的功能奠定了基础.本研究利用NCBI 的Conserved Domains 分析发现,BcPLDγ蛋白中存在一个植物PLD特有的C2结构域,和一个PLDc结构域,与已知的蛋白质结构功能数据库中其他植物的PLD相似(图4).
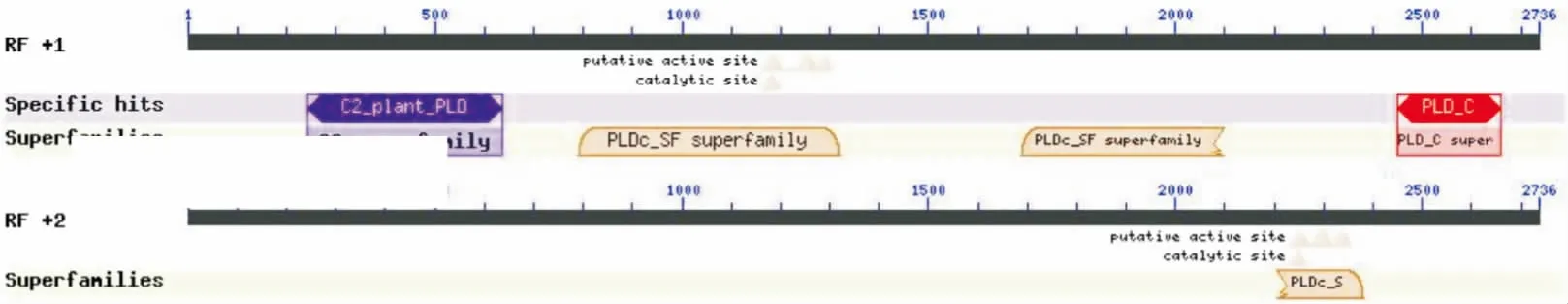
图4 不结球白菜BcPLDγ蛋白的结构域预测Fig.4 Domain prediction of BcPLDγ protein from non-heading Chinese cabbage

图5 不结球白菜BcPLDγ蛋白的信号肽预测Fig.5 Signal peptide prediction of BcPLDγ protein from non-heading Chinese cabbage
细胞膜蛋白与分泌蛋白都是以前体物质多肽的形式合成的,且其N末端均含有指导蛋白质跨膜转移(定位)的氨基酸序列,这种氨基酸序列被称为信号肽或信号序列,通常是由15~30个氨基酸所组成[31].利用Signal P(http://www.cbs.dtu.dk/services/SignalP/)程序对BcPLDγ编码的蛋白序列进行N端信号肽预测,结果表明(图5),该蛋白的Cmax值为0.209、Ymax值为0.223、Smax值为0.452、Smean值为0.262,前三个值的位点分别在28、28、4.该程序将Cmax值和Smean值均大于0.5的蛋白认定为具有信号肽.所以,BcPLDγ蛋白的信号肽预测结论为NO,说明该蛋白不存在信号肽,进而可推测该蛋白非分泌蛋白.
植物蛋白质的亚细胞定位是功能基因组学的重要内容,了解基因产物在亚细胞中的位置对判定这些基因产物的功能起到重要作用[32].用Target P server(http://www.cbs.dtu.dk/services/TargetP/)程序进行BcPLDγ蛋白的亚细胞定位,从表1中可以看出,该蛋白定位于线粒体和叶绿体的可能性较小,计算得分分别只有0.056和0.080,而有可能定位于细胞中的其它部位(得分为0.548).此外该蛋白也不大可能存在信号肽(得分只有0.231分),该结果也符合上文结构域预测的结果.

表1 BcPLDγ蛋白的亚细胞定位预测
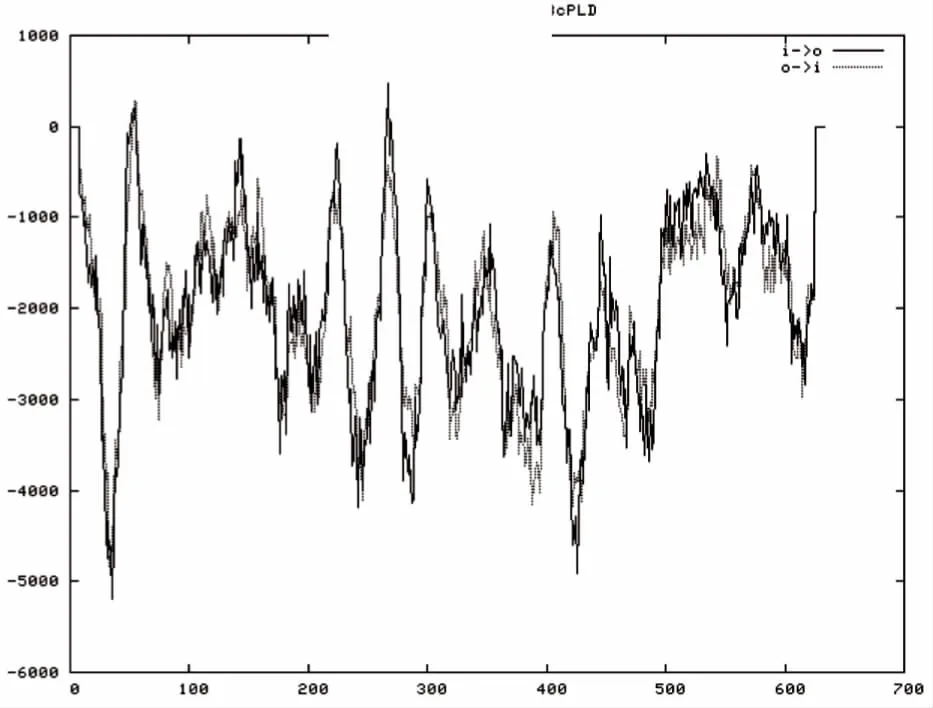
图6 不结球白菜BcPLDγ蛋白的跨膜螺旋区域预测Fig.6 Transmembrane domain prediction of BcPLDγ protein from non-heading Chinese cabbage
跨膜结构域是膜中蛋白与膜脂相结合的主要部位,一般是由20个左右的疏水氨基酸残基组成的,并形成α螺旋,与膜脂相结合.预测和分析蛋白质的跨膜结构域,对于认识其结构、功能、分类及其在细胞中的作用部位均具有重要意义[33].利用在线软件TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)预测本研究中BcPLDγ蛋白的跨膜螺旋区域,该软件预测得分超过500的区域则为可能的跨膜螺旋区域[34],而BcPLDγ蛋白预测得分最高的区域为260~276 aa处膜内向膜外的跨膜螺旋(图6),被赋予的分值为466,未超过500,说明该蛋白很可能没有跨膜区域.
利用在线软件SOPM(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html)对BcPLDγ蛋白的二级结构进行预测,结果表明,该蛋白由α-螺旋(Alpha helix)、延伸直链(Extended strand)、β-转角(Beta turn)和无规则卷曲(Random coil)4 种形式组成,其中α-螺旋包含171个氨基酸,占26.97% ;延伸直链包含163个氨基酸,占25.71% ;β-转角包含67个氨基酸,占10.57% ;无规则卷曲包含233个氨基酸,占36.75%.
2.3BcPLDγ在热胁迫处理下的表达分析

图7 不结球白菜热胁迫处理下BcPLDγ基因在叶片中的定量表达 Fig.7 The quantitative expression of BcPLDγ gene under heat stress in leaf of non-heading Chinese cabbage
利用qRT-PCR技术,分析了在热胁迫处理下耐热自交系‘高华青’、‘苏州青’和热敏自交系‘矮脚黄’中BcPLDγ基因在叶片中的表达模式.热胁迫处理前,BcPLDγ基因在3份材料中的表达量基本一致,均处于较低的水平;处理后3份材料的表达量均呈上调趋势,其中‘矮脚黄’中上调趋势较缓,而‘高华青’和‘苏州青’迅速显著上调,并于12 h时达到峰值,且均显著高于‘矮脚黄’.耐热性最强的‘高华青’中BcPLDγ基因峰值表达量约为中等耐热材料‘苏州青’的7倍,约为热敏材料‘矮脚黄’的31倍(图7).
3 讨论
PLD是植物体内催化磷脂降解的关键酶,已在多种植物中发现其参与细胞信号转导、生长发育、逆境应答以及细胞防御反应等多种生理过程[35-37],但目前对不结球白菜PLD的研究报道较为少见.本研究对不结球白菜进行PLD基因克隆,得到长为2736 bp,编码634个氨基酸的基因序列,其核苷酸及氨基酸序列与NCBI中已登录的其他植物PLDγ基因相似性很高,故将该基因命名为BcPLDγ.BcPLDγ基因编码的氨基酸序列具有植物PLD的典型保守结构域,包括一个C2结构域和一个PLDc结构域(图2、4),这也证明所克隆的BcPLDγ是植物PLD基因家族中的成员.
本研究中,热胁迫处理前,BcPLDγ基因在3份不结球白菜试验材料中的表达量基本一致,热胁迫处理后,3份材料中的BcPLDγ基因则均表达上调,且其上调幅度也与材料的耐热性正相关,可推断BcPLDγ基因的高转录水平是耐热材料较之热敏材料对热胁迫具有更强适应性的原因之一.未来应该研究不结球白菜BcPLDγ蛋白涉及的深层分子调控机制以及与其它抗性基因的协同作用.本研究结果为今后进一步开展不结球白菜BcPLDγ基因在热胁迫下的抗性作用研究奠定了基础.
[1] NAKANIS H,MORISHITA M,SWARTZ C L,et al.Phospho lipase D and the SNARE Sso1p are necessary for vesicle fusion during sporulation in yeast [J].J Cell Sci,2006,119(7):1406-15.
[2] YANG S,LU S H,YUAN Y J.Cerium elicitor-induced phosphatidic acid triggers poptotic signaling development in Taxus cuspidata cell suspension cultures[J].Chem Phys Lipids,2009,159(1):13-20.
[3] HAGA Y,MIWA N,JAHANGEER S,et al.Ct-BP1/BARS is an activator of phospholipase D1 necessary for agonist-induced macropinocytosis[J].EMBOJ,2009,28(9):1197-1207.
[4] YAMAGUCHI T,KURODA M,YAMAKAWA H M,et al.Suppression of a phospholipase D gene,OsPLDbeta1,activates defense responses and increases disease resistance in rice[J].Plant Physiol,2009,150(1):308-319.
[5] OHASHI Y,OKA A,RODRIGUES-POUSADA R,et al.Modulation of phospholipids signaling by GLABRA2 in root-hair pattern formation[J].Science,2003,300:1427-1430.
[6] POTOCKY M,ELIAS M,PROFOTOVA B,et al.Phosphatidic acid produced by phospholipase D is required for tobacco pollen tube growth[J].Planta,2003,217:122-130.
[7] WANG X.Regulatory functions of phospholipase D and phosphatidic acid in plant growth,development,and stress responses[J].Plant Physiol,2005,139:566-573.
[8] LISCOVITCH M,CZARNY M,FIUCCI G,et al.Phospholipase D molecular and cell biology of a novel gene family[J].Biochem J,2010,345:401-415.
[9] WANG X.Phospholipase D in hormonal and stress signaling[J].Curr Spin Plant Biol,2002,5:408-414.
[10] QIN C,WANG X.The Arabidopsis phospholipase D family.Characterization of a calcium-independent and phosphatidycholine-selective PLD with distinct regulatory domains[J].Plant Physiol,2002,128:1057-1068.
[11] NAKAZAWA Y,SATO H,UCHINO M,et a1.Purification,characterization and cloning of phospholipase D from peanut seeds[J].The Protein Journal,2006,25:212-223.
[12] MORENO-PEREZ A J,MARTINEZ-FORCE E,GARCES R,et a1.Phospholipase D alpha from sunflower (Helianthus annuus):Cloning and functional characterization[J].Journal of Plant Physiology,2010,167:503-511.
[13] URAJI M,KATAGIRI T,OKUMA E,et a1.Cooperative function of PLDδ and PLDα1 in abscisic acid-induced stomatal closure in Arabidopsis[J].Plant Physiol,2012,159:450-460.
[14] 李清,赵云,苏海峰,等.甘蓝型油菜2个BnPLDα基因的克隆与表达[J].西北植物学报,2014,34(6):1090-1098.
[15] 王俊斌,丁博,李明,等.小麦磷脂酶Dδ基因的克隆及表达分析[J].麦类作物学报,2015,35(7):888-895.
[16] WANG X M,XU L W,Zheng L.Cloning and expression of phosphatidylcholine-hydrolyzing phospholipase D from Ricinus communis L[J].The Journal of Biological Chemistry,1994,269:203l2-20317.
[17] TESTERINK C,MUNNIK T.Phosphatidic acid:A multifunctional stress signaling lipid in plants[J].Trends in Plant Science,2005,10:368-375.
[18] WANG X M.Regulatory functions of phosphdipase D and phosphatidic acid in plant growth,development,and stress responses[J].Plant Physiol,2005,139:566-573.
[19] MORENO-PEREZ A J,MARTINEZ-fORCE E,GARCES R,et a1.Phospholipase D alpha from sunflower (Helianthus annuus):Cloning and functional characterization[J].Journal of Plant Physiology,2010,167:503-511.
[20] 徐呈祥.提高植物抗寒性的机理研究进展[J].生态学报,2012,32(24):7966-7980.
[21] 朱晓晨,宋爱萍,刘鹏,等.菊花磷脂酶Dα基因的耐逆表达特性[J].生态学杂志,2014,33(7):1847-1850.
[22] URAJI M,KATAGIRI T,OKUMA E,et a1.Cooperative function of PLDδ and PLDα1 in abscisic acid-induced stomatal closure in Arabidopsis[J].Plant Physiology,2012,159:450-460.
[23] 侯喜林.不结球白菜育种研究新进展[J].南京农业大学学报,2003,26(4):111-115.
[24] 周伟华,黄贞,陈兴平.电导法鉴定小白菜耐热性初步研究[J].长江蔬菜,1999(7):30-32.
[25] 刘维信,曹寿春.夏季自然高温条件下不结球白菜品种评价及相关性状的研究[J].山东农业大学学报,1993,24(2):176-182.
[26] 胡俏强,陈龙正,张永吉,等.普通白菜苗期耐热性鉴定方法研究[J].中国蔬菜,2011(2):56-61.
[27] mISHKIND M,VERMEER J E M,DARWISH E,et a1.Heat stress activates phospholipase D and triggers PIP2 accnmulation at the plasma membrane and nucleus[J].The Plant Journal,2009,60:10-21.
[28] YANG N,YUE X L,CHEN X L,et a1.Molecular cloning and partial characterization of a novel phospholipase D gene from Chorispora bungeana[J].Plant Cell Tiss Organ Cult,2012,108:201-212.
[29] XU H,CHEN L Z,SONG B,et a1.De novo transcriptome sequencing of pakchoi (Brassica rapa L. chinensis) reveals the key genes related to the response of heat stress[J].Acta Physiol Plant,2016,38:252.
[30] 马景蕃,侯喜林,肖栋,等.不结球白菜抗芜菁花叶病毒蛋白BcTuRsO的生物信息学分析[J].江苏农业学报,2010,26(2):280-285.
[31] GAOA G,HAKIMI S M,MITTANCK C A,et a1.Fungal pathogen protection in potato by expression of a plant deteniton peptide[J].Nat Bioteehnol,2000,18(12):1307-1310.
[32] EMANUELSSON O,NIELSEN H,HEIJNE G.Predicting subcellular localization of proteins based on their amino acid sequence. Predicting Subcellular Localization of Proteins Based on their Amino Acid Sequence[J].Journal of Molecular Biology,2000,300(4):1005-1016.
[33] IKEDA M,ARAI M,LAO D M,et a1.Transmembrane to pology prediction methods are assessment and improvement[J].Silieo Biol,2002,2(1):19-33.
[34] HOFMANN K,STOFFEL W.TMbase-A database of membrane spanning proteins segments[J].Biological Chemistry Hoppe-Seyler,1993,374:166.
[35] WELTI R,LI W,LI M,et a1.Profiling membrane lipids in plant stress responses[J].Journal of Biological Chemistry,2002,277:31994-32002.
[36] JIA Y,TAO F,LI W,et a1.Lipid profiling demonstrates that suppressing arabidopsis phospholipase Dδ retards ABA-promoted leaf senescence by attenuating lipid degradation[J].Plos one,2013,8e65687.
[37] 李艳,田波,李唯奇.磷脂酶Dδ缺失加剧UV-B诱导的膜伤害[J].植物分类与资源学报,2011,33(3):299-305.
责任编辑:高 山
Clone and Expression Analysis of Heat Resistance Related GeneBcPLDγfrom Non-heading Chinese Cabbage
XU Hai,SONG Bo,FAN Xiaoxue,YUAN Xihan,CHEN Longzheng*
(Jiangsu Provincial Key Laboratory for Horticultural Crop Genetic Improvement,Institute of Vegetable Crops,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
In this study,taking non-heading Chinese cabbage heat resistant inbred "Gao Huaqing","Su Zhouqing"and susceptible inbred"Ai Jiaohuang"as experimental materials,we obtainedBcPLDγgene using RACE technology.A series of bioinformatics software was used to speculate acid sequence and its nucleotide sequence ofBcPLDγ.Under heat stress,gene expression patterns ofBcPLDγwere investigated by using qRT-PCR in leaves.The results showed that the full length CDS ofBcPLDγgene was 2736 bp,containing a 1905 bp open reading frame to encode a total of 634 amino acid residues.Meanwhile,theBcPLDγprotein from non-heading Chinese cabbage had no signal peptide sequence.Prediction of the relative molecular mass ofBcPLDγwas 71.59 KD with the theoretical isoelectric point of 6.73.The two-dimension structure ofBcPLDγprotein mainly consisted of α-helixes,extended straight chain,β-angle and random coils.BcPLDγprotein contains a C2 domain and a PLDc domain which belong to plant PLD superfamily. Homology analysis showed that the homologous species should mainly belong to the cruciferae,theBcPLDγfrom non-heading Chinese cabbage has a highly identity with that from Brassica napus.Under heat stress,gene expression ofBcPLDγin all experimental materials were up-regulated gradually and peaked at 12h,and the up-regulated trend was positively correlated with the heat resistance of the experimental materials.
non-heading Chinese cabbage;heat resistance;BcPLDγgene;gene expression
2017-05-05.
“十二五”农村领域国家科技计划(2013BAD01B04-11);公益性行业(农业)科研专项(201403032).
徐海(1981-),男,博士生,副研究员,主要从事蔬菜遗传育种的研究;*
陈龙正(1980-),男,博士,副研究员,主要从事蔬菜遗传育种的研究.
1008-8423(2017)03-0241-06
10.13501/j.cnki.42-1569/n.2017.09.001
TS210.1
A
