YWHAE表达沉默对胃癌MGC803细胞增殖的影响
2017-09-12黄幼生解娜张艺馨孙芳娇罗志飞薛逢贵
黄幼生,解娜,张艺馨,孙芳娇,罗志飞,薛逢贵
(海南医学院第一附属医院病理科,海南海口571101)
YWHAE表达沉默对胃癌MGC803细胞增殖的影响
黄幼生,解娜,张艺馨,孙芳娇,罗志飞,薛逢贵
(海南医学院第一附属医院病理科,海南海口571101)
目的探讨沉默YWHAE表达对胃癌细胞增殖的影响。方法实验分为三组,未转染组,构建YWHAE短发夹RNA(shRNA)表达载体及相应空载载体,慢病毒包装后分别感染胃癌MGC803细胞(干扰组,对照组),应用Western blot、RT-PCR方法检测YWHAE沉默效率;MTT技术观察YWHAE表达沉默前后细胞增殖变化;流式细胞术、细胞克隆实验检测细胞周期、凋亡及克隆形成变化情况。结果慢病毒包装YWHAE-shRNA后成功感染胃癌MGC803细胞;RT-PCR、Western blot检测结果显示,与对照组比较,干扰组MGC803细胞YWHAE基因表达明显降低,抑制效率为72.7%。MTT结果显示,干扰组细胞增长速率明显低于对照组细胞,72 h增长倍数分别为1.56、2.43,差异有显著统计学意义(P<0.01);细胞克隆实验结果显示,干扰组及对照组克隆形成率分别为6.24%、31.00%,差异有显著统计学意义(P<0.01)。流式细胞术检测显示,YWHAE基因表达沉默后,MGC803细胞凋亡率增加,由未消减前的3.23%增加到9.83%,差异有显著统计学意义(P<0.01);相比对照组细胞在G1期的比例(57.88%),干扰组G1期细胞比例明显增加(72.42%),差异有显著统计学意义(P<0.01)。结论沉默YWHAE表达能抑制胃癌MGC803细胞增殖,可能与诱导细胞周期阻滞,促进细胞凋亡有关。
YWHAE;胃癌;RNA干扰;细胞增殖;凋亡
胃癌是我国发病率及死亡率位居第二的恶性肿瘤,多数死于胃癌的转移、复发[1-2]。精准医疗概念的提出为晚期胃癌患者的治疗提供了方向。例如,曲妥珠单抗赫赛汀靶向治疗HER2扩增的胃癌患者能够提高患者3个月的生存期[3]。然而,特异性分子靶点研究有限,靶向药物开发较少,效果不理想。因而,探讨胃癌分子机制、寻找药物分子靶标对设计靶点药物及提高胃癌治疗水平具有重要意义。
14-3-3蛋白家族是一个由7个亚型(β、ε、η、γ、τ、ζ和σ)组成、普遍存在又高度保守的酸性蛋白家族,是在哺乳动物细胞中含量最丰富的蛋白之一[4-5]。YWHAE (tyrosine 3-monooxygenase/tryptophan 5-monooxygen-ase activation protein,epsilon polypeptide)基因编码的14-3-3ε蛋白是其家族中重要的成员之一[4]。目前研究发现在肝癌[6]、结肠癌[7]、胃癌[8]、肾癌[9]等恶性肿瘤中14-3-3ε存在高表达,高表达的14-3-3ε可以促进癌细胞增殖、迁移和抑制凋亡,其机制可能是14-3-3ε与CDC25、c-myc、RKIP等蛋白相互作用[8,10-11],促进细胞周期转换、抑制细胞凋亡等相关。YWHAE与胃癌的关系研究较少,且其在胃癌中的作用还存在争议,有学者认为,YWHAE在胃癌组织中高表达,是一个促癌基因[8];也有学者认为高表达的YWHAE具有抑制胃癌细胞生长的作用,是一个抑癌基因[12]。
为进一步探讨、甄别YWHAE与胃癌的关系,笔者应用RNA干扰技术沉默胃癌MGC803细胞YWHAE基因表达,观察YWHAE沉默前后癌细胞功能学变化,为阐明YWHAE基因与胃癌发生发展的分子机制奠定基础。
1 材料与方法
1.1 材料胃癌MGC803细胞系购自中国生物典型保藏中心;RPMI1640培养基,PVDF膜、聚丙烯酰胺为博士得产品;Gibco®胎牛血清购Thermofisher公司。YWHAE shRNA设计、GV248载体连接及慢病毒包装由上海吉凯生物技术有限公司完成,靶向的YWHAE基因序列为CTGAGTGAAGAAAGCTATA;YWHAE单克隆抗体、山羊抗鼠二抗均购自abcam公司,GAPDH单抗为博士得产品。Trizol试剂盒、RT-PCR相关试剂盒(FastQuant RT Kit(With gDNase),2×Taq Plus PCR MasterMix)为北京天根生物有限公司产品。蛋白裂解液、蛋白marker及BCA蛋白定量试剂盒为杭州碧云天产品。
1.2 方法
1.2.1 人胃癌细胞培养及转染胃癌MGC803细胞孵育在含10%小牛血清的RPMI1640培养基中,培养于37℃、5%CO2饱和湿度培养箱内。将处于对数生长期的MGC803细胞接种于6孔板,每孔接种5×104个细胞。在细胞融合度30%时进行转染,具体转染步骤按吉凯基因提供的说明书进行。简而言之,实验分为三组:未转染组、对照组、shRNA-YWHAE干扰组(干扰组)。去除旧培养基,磷酸盐缓冲液(PBS)洗涤2遍,将慢病毒包装的shRNA-YWHAE及其对照病毒与无血清及抗生素的培养基混合后分别加入6孔板各孔内孵育胃癌细胞。转染48 h后观察转染效率,待细胞融合度达80%时收取细胞进行下一步干扰抑制效率及功能试验检测。
1.2.2 RT-PCR检测提取各组细胞总RNA,提取方法参照Trizol试剂盒说明书进行操作;Primer 6.0引物设计软件设计YWHAE、GAPDH mRNA引物,mRNA序列从NCBI网站中获取,按软件评分选取最佳引物引物由上海生工公司合成。YWHAE上游引物:5'-TGCGGAGAACAGCCTAGTG-3',下游引物:5'-CCTAAGCGAATAGGATGCGTT-3';GAPDH(内参)上游引物:5'-TGACTTCAACAGCGACACCCA-3',下游引物:5'-CACCCTGTTGCTGTAGCCAAA-3'。逆转录及PCR反应按FastQuant RT Kit(With gDNase),2×Taq Plus PCR MasterMix试剂盒说明书进行。PCR反应条件为:预反应95℃2 min,变性30 s,60℃30 s,72℃延伸45 s,25个循环,循环终止后72℃延伸5min。将反应产物进行琼脂糖凝胶电泳、拍照、Tanon 5 000凝胶成像分析软件灰度扫描。
1.2.3 Western blot检测收集各组细胞,RIPA裂解细胞、溶解蛋白,BCA法定量。每个样品上样30 μg,12%聚丙烯酰胺胶电泳分离。4℃下转移固定蛋白于PVDF膜上,5%脱脂奶粉25℃下封闭2 h,转移膜至一抗孵育盒内,YWHAE(1:500)、GAPDH(内参)一抗(1:1 000)4℃孵育过夜。次日,TBST洗涤3遍,加入二抗(1:4 000)25℃下孵育1.5 h,TBST洗涤3遍,增强型ECL底物显色,Tanon 5200化学发光成像系统成像并分析其光密度。
1.2.4 MTT检测将各组细胞消化、吹打,调整细胞悬液浓度2×103/mL,每孔100 μL接种于96孔板,置37℃,5%CO2恒温箱中孵育,待贴壁0 h、24 h、48 h、72 h、96 h后每孔加入200 μL MTT溶液(5 mg/mL),继续培养4 h,离心,小心吸掉上清液,每孔加入100 μL二甲基亚砜,置摇床上低速振荡15 min,使结晶物充分溶解。在酶联免疫检测仪OD570处测量各孔的吸光值。以时间为横坐标,D值为纵坐标,绘制生长曲线。
1.2.5 细胞克隆实验将各组细胞消化、吹打、奇数,按每组800个细胞种植于6孔板中,每组三复孔,继续置37℃,5%CO2恒温培养箱中孵育,每隔3 d换新鲜培养液一次,15 d后或控制组大多数克隆细胞数大于50时终止培养,PBS洗涤2次、多聚甲醛固定、GIEMSA染色、拍照、计克隆数。
1.2.6 细胞周期及凋亡检测将各组癌细胞消化、吹打、PBS重悬,清洗2遍,去上清,预备细胞周期检测的细胞重悬于70%酒精中,4℃过夜,PI染色;预备细胞凋亡检测的细胞1×binding buffer洗涤细胞沉淀一次,1×staining buffer重悬细胞沉淀,采用Annexin V-APC染色;FACSCalibur流式细胞仪检测细胞周期及凋亡。
1.3 统计学方法应用SPSS18.0软件进行统计学分析,计量资料以均数±标准差()表示,组内比较均采用配对Student's t检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 YWHAE干扰效率检测本研究针对YWHAE基因设计了2对shRNA,连接GV248慢病毒质粒,慢病毒包装后感染胃癌细胞MGC803。转染48 h后观察转染效率,发现95%以上癌细胞出现荧光,表明感染效率在95%以上,满足进一步实验要求(图1)。随即,应用RT-PCR、Western blot验证YWHAE在基因及蛋白水平上的敲除效率。结果显示,相比对照组,干扰组1#、2#mRNA及蛋白表达率分别下降72.7%、53.6%及71.5%、55.2%(图2),表明2对YWHAE-shRNA均明显抑制YWHAE基因的表达,差异有显著统计学意义(P<0.01)。据此,本研究选择干扰组1#进行下一步实验。

图1 慢病毒转染48 h后白光及荧光图(×200)

图2 慢病毒介导YWHAE-shRNA转染胃癌细胞MGC803沉默效率检测
2.2 YWHAE表达沉默对胃癌MGC803细胞生长的影响为进一步观察YWHAE表达沉默对胃癌细胞MGC803生长的影响,MTT检测被应用去观察转染YWHAE-shRNA前后MGC803细胞生长速度的变化。结果显示,干扰组细胞的生长速度明显低于对照组及未转染组,呈现时间依赖性抑制,24 h、48 h、72 h抑制效率分别为18.9%,27.3%,44.5%(图3),干扰组细胞增长速率明显低于对照组细胞,72 h增长倍数分别为1.56、2.43,差异有显著统计学意义(P<0.01),未转染组及对照组差异无统计学意义(P>0.05),表明YWHAE表达沉默能抑制胃癌细胞MGC803的生长。
2.3 YWHAE表达沉默对胃癌细胞克隆形成的影响克隆性生长是癌细胞生长的一大特点,为探讨YWHAE表达沉默是否干扰肿瘤细胞的克隆形成,细胞克隆形成实验被应用。结果显示,抑制YWHAE基因表达后,癌细胞克隆形成率明显降低,干扰组、对照组及未转染组克隆形成率分别是6.24%、31.00%、31.95%,干扰组是对照组及未转染组克隆形成率的20.13%及19.53%,差异有显著统计学意义(P<0.01),两个控制组间比较差异无统计学意义(P>0.05),表明沉默YWHAE的表达能显著降低癌细胞肿瘤克隆形成率(图4)。
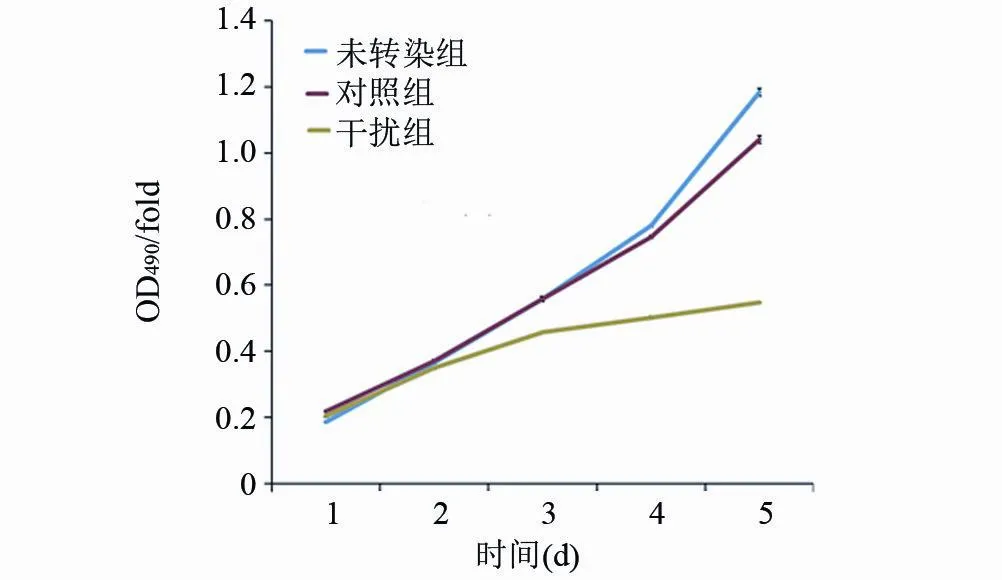
图3 YWHAE表达沉默对胃癌细胞MGC803细胞生长的影响(MTT检测法)
2.4 YWHAE表达沉默对胃癌细胞凋亡及细胞周期的影响为分析YWHAE表达沉默抑制胃癌细胞MGC803生长的原因,流式细胞术被应用去检测YWHAE基因表达沉默前后细胞凋亡及细胞周期变化。分析显示,YWHAE表达沉默后,细胞凋亡率明显增加,干扰组细胞在转染后3 d平均细胞凋亡率为9.83%,而对照组及未转染组细胞平均凋亡率分别为3.23%、2.90%,差异有显著统计学意义(P<0.01),对照组与未转染组间差异无统计学意义(P>0.05),见图5。
YWHAE表达沉默后,干扰组细胞处于细胞周期G1期者为72.4%,而对照组及未转染组细胞分别为57.9%及56.4%,差异有显著统计学意义(P<0.01),对照组与未转染组间差异无统计学意义(P>0.05),表明YWHAE在胃癌MGC803细胞中表达沉默能捕获细胞周期在G1期(图6、表1)。
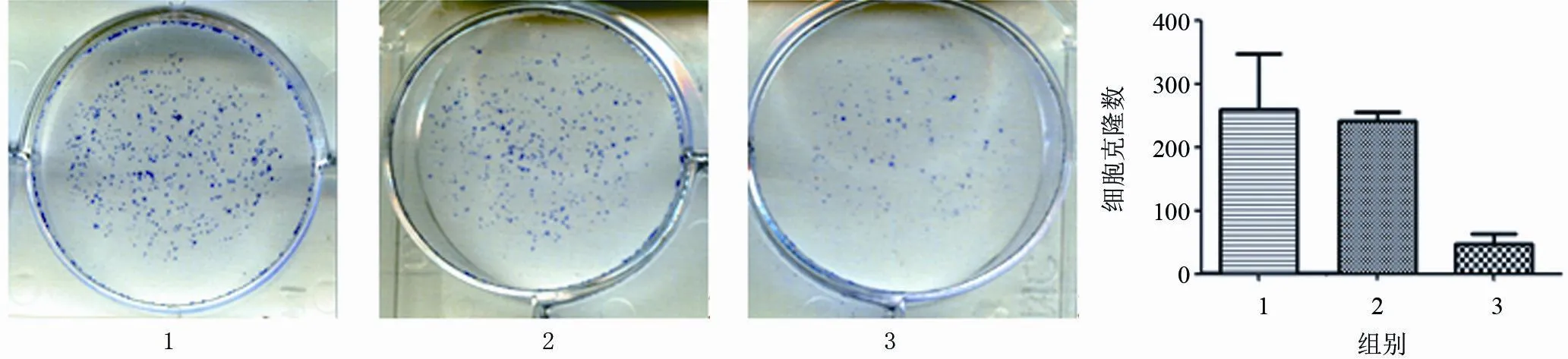
图4 细胞克隆形成图

图5 转染YWHAE-shRNA后,各组细胞凋亡数量统计流式图
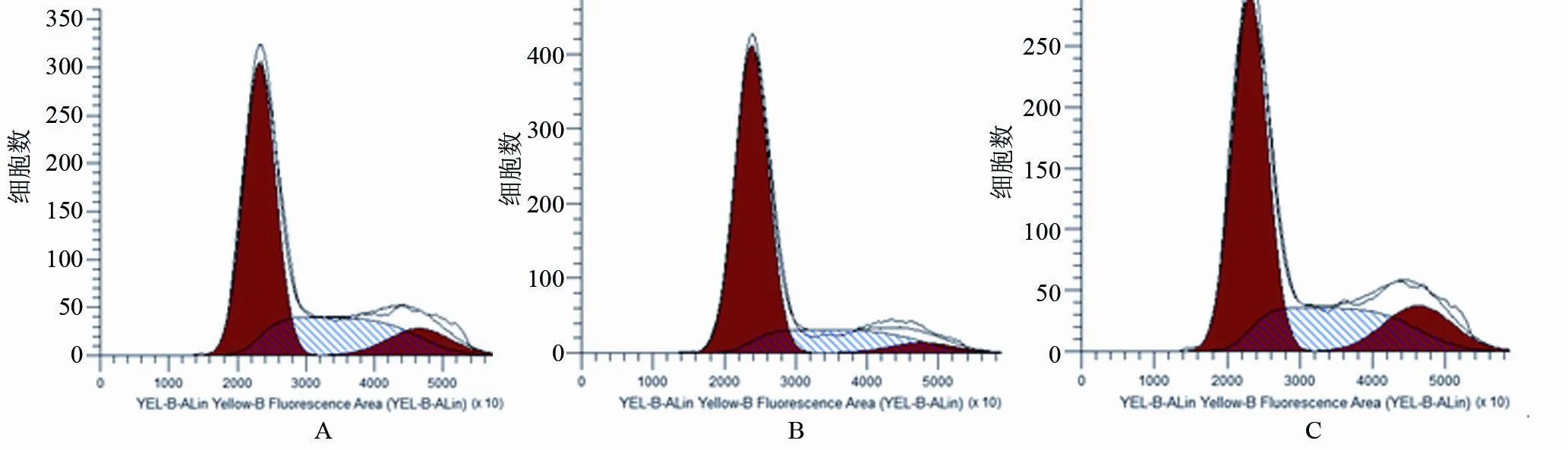
图6 转染YWHAE-shRNA后,各组细胞周期分布流式图
表1 转染YWHAE-shRNA后各组细胞周期变化比较()

表1 转染YWHAE-shRNA后各组细胞周期变化比较()
3 讨论
14-3-3家族基因定位于染色体17p13.3,其编码蛋白由苏氨酸及丝氨酸结合蛋白组成的7个亚基构成,在真核生物中普遍存在表达[4-5]。14-3-3蛋白具有多种生物活性功能,参与细胞凋亡、生长代谢调控、细胞周期及磷酸化依赖方式蛋白质转运过程等多种细胞生理活动[4-5]。近年来,发现多种肿瘤存在14-3-3蛋白异常表达,可能通过激活Ras-Raf及AKT/mTOR等多条信号通路参与肿瘤的发生发展[4-5,14-15]。
YWHAE是14-3-3家族中的重要成员之一,在多种恶性肿瘤组织中表达增高,包括肝癌[6,16]、胃癌[8]、肠癌[7],肾癌[9]等。研究发现,YWHAE在正常肝组织内表达缺失或弱表达,在肝癌组织内高表达,与癌上皮间质转化及侵袭转移相关,过表达YWHAE的肝癌患者预后不良[6,16]。Liang等[9]和Wang等[17]发现高表达的YWAHE与肾癌、结肠癌的预后不良相关。这些研究表明YWHAE在肿瘤发生发展中可能扮演着癌基因的角色。
在胃癌组织中,Yan等[8]认为,YWHAE存在高表达,与胃癌的分期及转移相关;抑制YWHAE表达,能降低胃癌细胞SGC7901细胞生长速度,捕获细胞周期在G1期,认为YWHAE在胃癌中是一个促癌基因。但也有学者发现,在胃癌组织中存在YWHAE基因低表达,沉默YWHAE表达,促进了胃癌细胞的生长及转移[12]。
笔者前期研究发现肠癌组织中,YWHAE存在过表达,与肠癌的淋巴结转移相关[7]。为进一步验证YWHAE基因表达与胃癌的关系,本研究应用RNA干扰技术沉默胃癌MGC803细胞YWHAE表达后,发现癌细胞生长速度呈时间依赖性降低,72 h抑制率为44.5%;克隆形成能力同样出现显著性降低,干扰组癌细胞克隆形成率是对照组的19.53%。表明沉默YWHAE基因表达能够降低胃癌细胞的生长,支持了Yan等[8]的实验结果。
目前研究发现在结直肠癌[7,17]、肝癌[6,16]、胃癌[8]和肾癌[9]等恶性肿瘤中,沉默YWHAE表达能够诱导癌细胞凋亡及细胞周期阻滞,从而抑制癌细胞生长。其机制可能是抑制14-3-3ε表达与减少胞内线粒体、降低cyclinE、c-myc表达相关。本项目发现,YWHAE表达沉默后,胃癌细胞MGC803凋亡率增加,细胞周期捕获在G1期,提示YWHAE可能通过促进胃癌细胞凋亡、诱导细胞G1周期阻滞的方式抑制胃癌细胞的生长。
综上所述,沉默YWHAE的表达能抑制胃癌细胞的生长,其机制可能与癌细胞G1周期捕获及诱导细胞凋亡相关,表明YWHAE的过表达可能与胃癌的发生有关。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015 [J].CACancer J Clin,2016,66(2):115-132.
[2]Tan P,Yeoh KG.Genetics and molecular pathogenesis of gastric adenocarcinoma[J].Gastroenterology,2015,149(5):1153-1162.
[3]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial [J].Lancet,2010,376(9742):687-697.
[4]Obsil T,Obsilova V.Structural basis of 14-3-3 protein functions[J]. Semin Cell Dev Biol,2011,22(7):663-672.
[5]Aghazadeh Y,Papadopoulos V.The role of the 14-3-3 protein family in health,disease,and drug development[J].Drug Discov Today, 2016,21(2):278-287.
[6]Liu TA,Jan YJ,Ko BS,et al.14-3-3ε overexpression contributes to epithelial-mesenchymal transition of hepatocellular carcinoma[J]. PLoS One,2013,8(3):e57968.
[7]解娜,黄幼生,罗志飞,等.YWHAE对结肠癌细胞增殖的影响及表达意义[J].世界华人消化杂志,2015,(29):4643-4651.
[8]Yan L,Gu H,Li J,et al.RKIP and 14-3-3ε exert an opposite effect on human gastric cancer cells SGC7901 by regulating the ERK/ MAPK pathway differently[J].Dig Dis Sci,2013,58(2):389-396.
[9]Liang S,Xu Y,Shen G,et al.Quantitative protein expression profiling of 14-3-3 isoforms in human renal carcinoma shows 14-3-3 epsilon is involved in limitedly increasing renal cell proliferation[J]. Electrophoresis,2009,30(23):4152-4162.
[10]Kapasi AA,Fan S,Singhal PC.Role of 14-3-3epsilon,c-Myc/Max, and Akt phosphorylation in HIV-1 gp 120-induced mesangial cell proliferation[J].Am J Physiol Renal Physiol,2001,280(2): F333-342.
[11]Telles E,Hosing AS,Kundu ST,et al.A novel pocket in 14-3-3epsilon is required to mediate specific complex formation with cdc25C and to inhibit cell cycle progression upon activation of checkpoint pathways[J].Exp Cell Res,2009,315(8):1448-1457.
[12]Leal MF,Ribeiro HF,Rey JA,et al.YWHAE silencing induces cell proliferation,invasion and migration through the up-regulation of CDC25B and MYC in gastric cancer cells:new insights about YWHAE role in the tumor development and metastasis process[J]. Oncotarget,2016,7(51):85393-85410.
[13]Huang YS,Xie N,Su Q,et al.Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J].Mol Med Rep,2011,4(3):553-559.
[14]Gardino AK,Yaffe MB.14-3-3 proteins as signaling integration points for cell cycle control and apoptosis[J].Semin Cell Dev Biol, 2011,22(7):688-695.
[15]Tzivion G,Gupta VS,Kaplun L,et al.14-3-3 proteins as potential oncogenes[J].Semin Cancer Biol,2006,16(3):203-213.
[16]Ko BS,Chang TC,Hsu C,et al.Overexpression of 14-3-3ε predicts tumour metastasis and poor survival in hepatocellular carcinoma[J]. Histopathology,2011,58(5):705-711.
[17]Wang H,Huang H,Li W,et al.Nuclear localization of 14-3-3epsilon inversely correlates with poor long-term survival of patients with colorectal cancer[J].J Surg Oncol,2012,106(3):224-231.
Silencing of YWHAE expression suppresses the proliferation ability of gastric cancer MGC803 cells.
HUANG You-sheng,XIE Na,ZHANG Yi-xin,SUN Fang-jiao,LUO Zhi-fei,XUE Feng-gui.Department of Pathology,the First Affiliated Hospital of Hainan Medical University,Haikou 571101,Hainan,CHINA
ObjectiveTo investigate the effect of YWHAE expression silencing on the proliferation of gastric cancer cells.MethodsThe expression vector of short hairpin RNA(shRNA)sequences for YWHAE(interference group)and the control vector(control group)were constructed,which were used to infect the gastric cancer cells MGC803 after they were produced and packaged by lentiviruses.The expression levels of YWHAE were assayed by Western blot and RT-PCR.Proliferation was evaluated by MTT(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium bromide)colorimetric assay.Colony formation analysis was used to determine growth properties of transduced cells. Cell cycle and apoptosis were determined by flow cytometry.ResultsLentivirus-mediated shRNA-YWHAE was successfully transfected into gastric cancer cells.Compared with the control group,the expression of YWHAE was significantly decreased by 72.7%in the interference group by Western blot,RT-PCR analysis.The results of MTT showed that the proliferation ability of the interference group cells was significantly slower than that of the control group,and the cell growth times were 1.56 and 2.43 for 72 h,respectively(P<0.01).Cell cloning experiment results showed that the clone formation rate of the interference group was 6.24%,which was significantly lower than 31.00%of the control group(P<0.01).Flow cytometry showed that reduced YWHAE expression in gastric cancer cells lead to the increasing of cell apoptosis rate(from 3.23%to 9.83%),and the difference was statistically significant(P<0.01).Compared with the control group(57.88%),the proportion of the interference group cells(72.42%)in G1phase increased significantly(P<0.01). ConclusionThe expression silencing of YWHAE inhibits the proliferation ability of gastric cancer MGC803 cells, which may be associated with cell apoptosis promotion and cell cycle G1arrest.
YWHAE;Gastric cancer;RNAinterference(RNAi);Proliferation;Apoptosis
R735.2
A
1003—6350(2017)16—2581—05
10.3969/j.issn.1003-6350.2017.16.001
2017-04-01)
国家自然科学基金(编号:81260321)
黄幼生。E-mail:hys768811@yahoo.com.cn
