间充质干细胞体外修复DCD供肝的研究
2017-09-08尹明丽史源杨洋郑卫萍沈中阳宋红丽天津医科大学一中心临床学院天津3009天津市第一中心医院器官移植科天津市器官移植重点实验室天津3009
尹明丽,史源,杨洋,郑卫萍,沈中阳,宋红丽(.天津医科大学一中心临床学院,天津 3009;.天津市第一中心医院器官移植科,天津市器官移植重点实验室,天津3009)
随着肝移植技术的发展成熟和抗排斥药物的不断更新,肝移植已经成为各种终末期肝病患者最有效的治疗方法[1]。由于需要接受肝移植患者的不断增加,供肝的短缺问题日渐显著[2]。为了解决供肝短缺问题,心脏死亡器官捐献(donation after cardiac death,DCD)肝脏已成为我国肝移植的重要来源[3]。DCD供体可以扩大供体池[4],同时边缘性供肝作为扩大供肝来源的办法已越来越受到重视[5]。
DCD供肝存在热缺血时间长、移植物损伤严重和术后受体生存时间短等问题。缺血/再灌注是导致DCD供肝功能损伤的重要原因,目前尚缺乏有效的治疗手段[6]。研究发现,使用机械灌注的方法保存供肝能够减少供肝的缺血/再灌注损伤(ishemia reperfusion injury,IRI),从而改善肝移植的效果[7],而常温机械灌注(normothermic mechanical perfusion,NMP)能够提供更多的氧和营养物质,从而改善边缘供肝移植术后的效果[8]。肝窦内皮细胞在缺血/再灌注的早期即可出现结构及功能的损害[9],但NMP并不能修复肝窦内皮细胞等的损伤,因此,还需要增加一种方法在进行NMP的同时对肝脏进行修复。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)对IRI的肝脏具有明确的保护和修复的作用[10]。本研究在NMP系统的基础上,引进BMMSCs,研究其在NMP下对DCD肝脏的影响结果。
1 材料和方法
1.1 BMMSCs的获取:无菌提取BMMSCs,培养到第3代,进行检测[11]。
1.2 实验动物及分组:2~3周体重为40~60 g的健康雄性Wistar大鼠用于提取BMMSCs,5~8周体重为180~200 g健康的雄性Wistar大鼠用于DCD模型的建立。所有动物均由军事医学科学院实验动物中心提供,标准鼠食喂养。所有实验动物操作均遵循实验动物伦理条例,并由天津市第一中心医院伦理委员会批准进行。实验分组:随机分成3组,A组为冷保存组(n=5)、B组为单纯NMP组(n=5)、C组为NMP+BMMSCs组(n=5)。
1.3 动物模型的建立:取Wistar大鼠,单笼饲养,禁食12小时以上。腹腔麻醉后,充分暴露肝脏,下腔静脉注射0.4 ml(400 U)的肝素生理盐水[12],除去肝周围不用的组织,分离出门静脉、下腔静脉及胆总管,夹闭胸主动脉,计时45分钟。结束时快速进行门静脉、下腔静脉以及胆总管的插管。B组采用UW液进行冷保存,另两组进行机械灌注,C组在进行NMP前在器官室内从门静脉注射 BMMSCs 1ml(5×106个 /ml)。门静脉连接到膜肺的动脉出口,下腔静脉连接到膜肺的静脉入口。门脉压力灌注压力一般控制在5~8 mmHg(1 mmHg=0.133 kPa)[8],本实验灌注压力控制在5.5 mmHg监护仪持续监控,灌注速度为4 ml/min。灌注液是含有10%FBS的DMEM-F12培养液、1%双抗混合液以及5%的自体全血。
1.4 血生化仪检测血清肝功能酶的变化情况:出口阀抽取灌注液进行肝功能酶丙氨酸转氨酶(alanine aminotransferase, ALT)和天冬氨酸转氨酶(aspertate aminotransferase,AST)的分析,同时抽取A组肝下下腔静脉的保存液进行分析。
1.5 血气分析仪检测灌注液血气的变化情况:灌注过程中每小时从入口阀和出口阀抽取灌注液进行血气分析,观察各项指标。通过分析血气检测结果,计算灌注过程中肝脏的耗氧量。
1.6 组织形态学观察肝脏的情况:观察各组肝脏的外观情况。每组样本取自左外侧叶,浸在4%的甲醛溶液中,制成组织切片进行苏木精-伊红(hematoxylin-eosin, HE)染色,光学显微镜下观察。
1.7 统计学分析:采用SPSS 17.0统计软件进行统计学分析,数据以均数±标准差(x±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 BMMSCs的检测情况:培养BMMSCs到原代(图1a)和3代(图1b)分别拍照观察细胞状态,流式细胞术测得细胞表面标记表达率,检测显示第 3代 Wistar大 鼠 BMMSCs CD29、CD90、RT1A表达的阳性率分别为96.7%、95.5%和95.0%;而CD34、CD45、RT1B均为阴性,阴性率均>95%(图1),体外获得的细胞是BMMSCs。

图1 BMMSCs细胞生长状态(a、b)和流式检测结果(c、d、e)
2.2 各组ALT和AST的情况(图2):三组在机械灌注/冷保存前处于相同的状态,ALT和AST之间无明显的差异。实验后4小时发现B组ALT和AST水平明显低于A组(均P<0.05;);C组ALT和AST水平明显低于B组(均P<0.05);C组明显低于A组(均P<0.05)。NMP联合BMMSCs的修复作用明显优于单纯NMP和冷保存的作用。

图2 各组丙氨酸转氨酶和天冬氨酸转氨酶
2.3 B组和C组在灌注过程中耗氧量的变化情况比较(图3):两组开始灌注时耗氧量快速增加,灌注0小时和1小时两组之间没有差异(均P>0.05);灌注的第2小时C组明显高于B组(P<0.05);在灌注3小时和4小时耗氧量增加减慢,但C组仍明显明高于B组(均P<0.05)。NMP联合BMMSCs能够更好地修复DCD肝脏,使更多的肝细胞恢复活性。

图3 灌注组耗氧量的变化情况
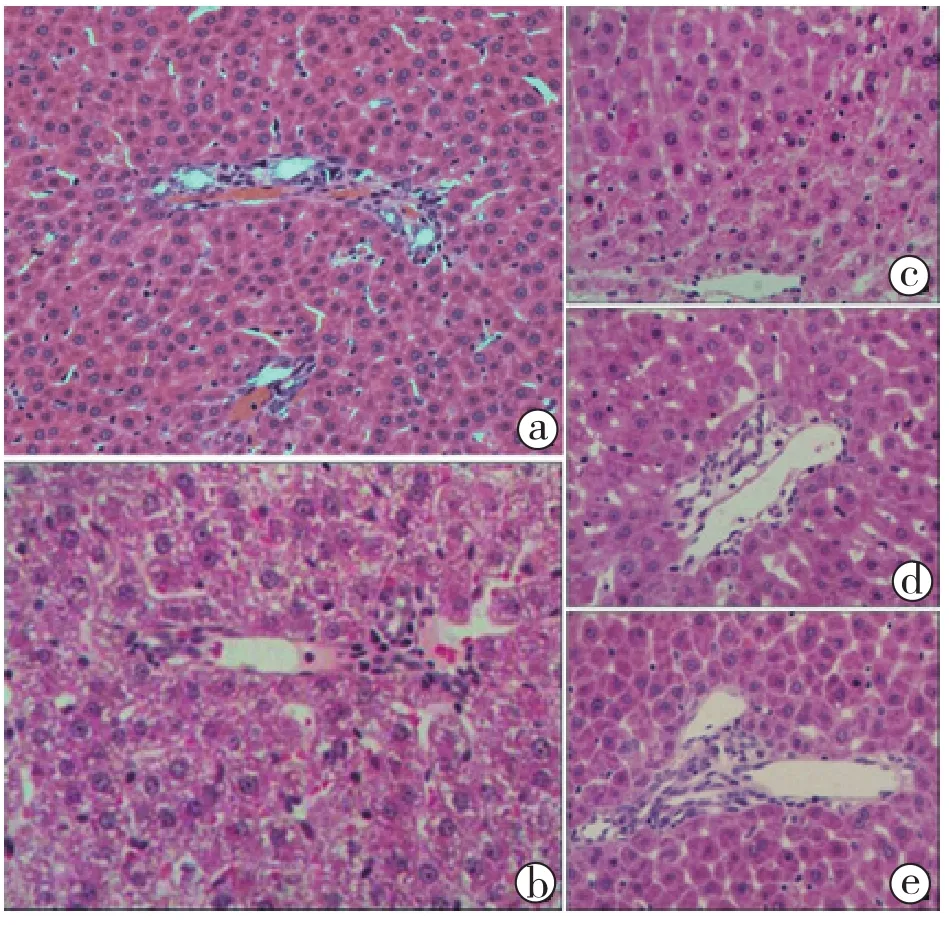
图4 各组肝脏汇管区组织学的情况(HE染色 低倍放大)
2.4 肝脏组织学(图4):肝脏热缺血45分钟后肝脏出现严重的损伤,肝窦淤血扩张、小叶间动静脉和小叶间胆管有明显的扩张,部分肝细胞有空泡样改变、点状坏死和灶状坏死(图4b)。A组热缺血4小时肝脏损伤加重,肝窦缩窄、小叶间动静脉和小叶间胆管官腔明显缩窄变形,汇管区塌陷,肝细胞空泡样变性加重(图4c)。B组热缺血4小时较A组肝窦、小叶间静脉明显扩张,汇管区明显改善(图4d);且肝细胞肿胀程度较热缺血45分钟的肝脏明显降低。C组热缺血4小时肝窦、小叶间动静脉和小叶间胆管轻微扩张,汇管区已基本恢复正常,肝脏实质细胞仍有轻微的空泡样变(图4 e);肝脏得到了明显的改善,且效果明显优于冷保存组和NMP组。
2.5 形态学的情况:正常大鼠肝脏色泽红润,呈鲜红色(图5a)。热缺血45分钟的肝脏出现严重的淤血(图5b),肝脏呈现暗红色,这也是缺血损伤的标志。灌注过程中肝脏色泽发生明显改变,C组4小时肝脏红润(图5e),B组4小时肝脏色泽变白(图5d)。C组肝脏的形态明显好于B组。而A组4小时肝脏色泽暗淡,表面出现花斑,明显次于灌注组的肝脏(图5c)。这提示NMP联合BMMSCs能更好修复DCD肝脏组织结构。

图5 各组肝脏形态学的情况
3 讨 论
肝移植是终末期肝病最有效的治疗方案[13],由于供肝短缺,阻碍了肝移植事业的发展。随着临床DCD供肝的使用,使得供肝匮乏的问题在一定程度上得以解决,并且扩大了可移植器官的范围,使供体数量增加了10%~20%[14],但DCD供肝存在IRI问题,致使发生原发性移植肝无功能及移植肝功能障碍的风险增加。IRI是由缺血的组织或器官重新恢复血流灌注而导致的组织结构、功能及代谢的变化,这些变化造成组织水肿、出血和坏死等。因此,减少DCD供肝的IRI至关重要,临床工作中应运用多种方式最大限度地降低DCD供肝IRI的发生,可以通过改善DCD供肝的获取途径、保存方式、微循环和减少DCD供肝的炎症反应等。目前,临床上常用的减少IRI损伤的方法主要有缺血预处理,药物治疗及器官保存方法的改进。缺血预处理和药物治疗只能在一定程度上缓解DCD供肝的IRI,并不能从根本上解决问题[15]。因此,找到一种新的器官保存方法进而改善DCD供肝的IRI是急需要解决的问题。BMMSCs是一类具有高度自我更新能力和多向分化潜能的成体干细胞[16]。BMMSCs可通过旁分泌或趋化富集于IRI受损器官,抗凋亡、促进血管生成、促进干细胞及祖细胞增殖分化、介导免疫调节、趋化到受损部位修复受损组织,从而发挥治疗作用[17]。本研究在NMP的同时加入BMMSCs,BMMSCs(从门静脉直接进入肝脏) 直接作用于肝脏,进而修复DCD供肝。
有研究显示,大鼠热缺血时间超过45分钟时,术后受体虽获得了短期的存活时间但生存时间很短,而热缺血60分钟时,供肝已发生不可逆转的损伤[18]。冷保存对DCD供肝的损伤严重,Mathur等[19]研究发现冷缺血时间每延长1小时,移植物功能障碍的发生率将增加6%,Mathur等[20]认为冷保存时间应<4小时。NMP能够明显改善DCD供肝的微循环[20-21],对于供肝细胞的复苏非常重要[22]。Xu等[7]的研究结果显示,经过4小时机械灌注肝脏得到了很大的修复,功能得到很好的改善。因此,我们通过预实验验证,最终选取热缺血45分钟做为本实验的DCD模型,灌注/冷保存4小时做为本实验的观察时间点,含有5%血清的细胞培养液做为循环液,进行实验观察实验效果。
冷保存4小时肝脏外观淤血呈暗红色、病理表现肝细胞水肿并严重坏死、ALT和AST含量持续增高,说明肝脏的损伤程度严重;采用单纯的NMP,4小时肝脏的淤血情况得到很好的改善,色泽变白,肝脏病理显示肝细胞水肿程度降低,ALT和AST水平降低;而NMP联合BMMSCs修复,4小时肝脏的外观色泽更红润光亮,病理表现中央静脉区和汇管区轻微异常,ALT和AST含量明显降低且显著低于NMP 4小时,说明NMP联合BMMSCs能够改善肝窦微循环和修复肝脏功能。 机械灌注两组耗氧量的比较也证实了这一点,NMP+BMMSCs组的耗氧量在1小时后均明显的高于NMP组,说明在同一灌注时间下,NMP联合BMMSCs能够使更多的肝脏细胞得到修复,使更多的肝脏细胞恢复活性。
含氧血液做为灌注液进行NMP可以显著改善DCD供肝的功能[23]。为了更好地修复DCD供肝,循环液的成分需要进一步的改进。同时修复时间也有待进一步延长和优化。DCD供肝后的IRI目前缺乏有效的针对性治疗手段,BMMSCs在其中的应用拓展了细胞治疗的应用范围,并为更多的DCD供肝应用于临床提供了可能的治疗手段。
总之,本研究显示常温机械灌注能够修复DCD热缺血45分钟的肝脏,常温机械灌注联合BMMSCs能够更好地修复受损的肝脏,这将为如何更好地修复DCD供肝并应用于临床提供新的重要思路。
