基于超短回波时间成像定量评估骨质疏松症患者骨皮质的研究
2017-09-08李仕红朱震方叶春涛彭玉尹浩霖林光武
李仕红,朱震方,叶春涛,彭玉,尹浩霖,林光武
复旦大学附属华东医院核磁共振室,上海200040
基于超短回波时间成像定量评估骨质疏松症患者骨皮质的研究
李仕红,朱震方,叶春涛,彭玉,尹浩霖,林光武
复旦大学附属华东医院核磁共振室,上海200040
目的探讨磁共振成像超短回波时间成像技术(UTE)进行在体定量评估骨质疏松。方法以治疗前后完整随访的26例骨质疏松症患者及10例健康志愿者为研究对象,对所有受试者进行胫骨中下段骨皮质的超短回波时间MRI成像,通过其与参照物信号强度的比对得到被检测部位骨皮质短T2成分信号的相对比值,结合受试者骨密度及骨代谢物等观察该值在不同分组患者中的意义。结果正常对照组胫骨骨皮质的UTE总体相对信号(0.53±0.06)高于骨质疏松组(0.37±0.09),差异具有统计学意义(<0.05)。骨质疏松治疗后组的骨皮质相对信号强度高于治疗前,但两者无明显差异。治疗前后的骨吸收标志物CTX、P1NP与胫骨骨皮质相对信号强度存在负相关,治疗后的M-M ID与其亦存在负相关。结论 以参照物比对法定量胫骨骨皮质的UTE信号可潜在用于骨质疏松的评估。
骨质疏松;超短回波时间成像;骨转换标志物;骨皮质
骨质疏松(osteoporosis,OP)的临床诊断主要依赖于以X射线为基础的双能X射线吸收法(dualenergy x-ray absorptiometry,DXA)测得的骨矿物密度值(bonem ineral density,BMD)。这种方法所提供的骨质信息尚不完整,因为从骨的构成看,矿物质只是其中一部分,水和有机质是骨的另外两个重要组成成分,对骨的强度、粘弹性等生物力学性质有很大贡献,但这两者并不能被BMD值所反应。因此,BMD在骨质疏松评估、抗骨松疗效监测、骨脆性骨折风险预测等方面提供的骨质信息不够全面[1]。
磁共振超短回波时间成像(ultrashortecho timeimaging,UTE)是近几年来新兴发展的乏质子成像技术,对骨皮质、软骨、肌腱、韧带、钙化组织、神经等具有独特的成像效果,尤其是在骨皮质的定量成像取得了较快速发展[1]。本研究使用磁共振UTE对骨质疏松症患者的胫骨进行成像,与外置参照物进行比对信号差异进行骨质疏松的评估,以期探索一种可行的在体评估骨质的方法。
1 资料和方法
1.1 研究对象
1.1.1 骨质疏松组 入组标准:(1)首次确诊,有明确的DXA检查报告,T值低于-2.5,临床诊断为OP的患者;(2)年龄在50岁及以上的患者;(3)3年来在我院规律就诊,依从性好、规则服药且能接受随访的患者。排除标准:(1)3年内服用过糖皮质激素、肝素等影响骨代谢的药物的患者;(2)3年内进行过椎体成形术、髋关节或膝关节置换术等影响骨密度测量准确性的治疗方案的患者;(3)精神、认知等障碍、重大合并症;(4)与医师无法产生良好沟通,不能耐受较长时间MRI检查者、且图像质量无法达到质控标准者。病例来源于复旦大学附属华东医院骨科门诊及骨松门诊,最终入组OP病例为男性3例,女性23例,年龄51~82岁,平均年龄(66.5±8.3)岁,共26侧胫骨MRI图像纳入本研究,初诊后服药依从性好、能有效随访的病例。
1.1.2 正常对照组 来源于本院的10例健康中青年人,共20侧胫骨MRI图像入组,男4例,女6例,年龄26~43岁,平均年龄(32.3±4.8)岁。入组标准:(1)无骨折、无药物滥用等病史。(2)无其他明确的躯体疾病等;(3)知情同意本研究。排除标准:(1)精神、认知等障碍、重大合并症;(2)与医师无法产生良好沟通,不能耐受较长时间MRI检查者、且图像质量无法达到质控标准者。
1.2 骨密度及骨代谢测定 临床骨质疏松评估一般情况通过门诊系统以及随访收集资料,记录患者性别、年龄、体质指数、服用药物等情况。骨密度测定所有受试者均应用我院门诊骨密度室双能X线骨密度仪测量腰椎(L1-4)、股骨颈(neck)、全髋(total)的骨密度值。参数以骨矿密度(BMD,g/cm2)表示。血标本采集的时间为2014年1月-2016年12月。所有受试者均采集晨起空腹血4m L,由本院检验科全自动生化分析仪由专业人员进行测定。复查随访的患者以MRI检查时间最近的骨代谢值记入本研究。
1.3 骨皮质的UTE-MRI成像
1.3.1 参照物选择 使用3D-UTE多回波成像结合CPMG法测定预选橡皮的T2*值,将T2*值与骨皮质相近的橡皮设定为本次测量的参照物,使用医用胶带固定于被检查者胫骨中下段,以橡皮标记处为中心进行等中心扫描。
1.3.2 UTE成像及参数 磁共振成像设备为:Siemens Magnetom Skyra 3.0T,15通道膝关节专用线圈(Tx/ Rx)覆盖被检者一侧胫骨中下段用于信号发送和接收。3D UTE序列成像参数包括:FOV=300mm,viewpoints=60000,分辨率=384×384,带宽=343kHz,层厚=0.78mm,翻转角=5°,TR=4.7ms,TE=0.07ms,每侧胫骨总的扫描时间约为4min56sec。每例扫描完成后使用水模置入膝关节线圈,并进行MRI成像,得到水模图像。
1.3.4 定量方法导出所有被检数据,使用ImageJ进行处理。对被检者胫骨前缘最厚骨皮质放置感兴趣区ROI1,测得被检区的UTE信号强度值为S1,同时测定胫骨旁参照物橡皮的ROI 2的UTE信号强度值为S2,复制上述ROI置于水模图像上,得出水模相应区域的UTE信号强度值S1和S2。胫骨前缘ROI的UTE信号强度相对值校正为:S=(S1/s1)/(S2/s2),基于前期及其他研究显示,骨皮质种信号来源主要为结合水和自由水[1],前者相关于骨内有机质,后者相关于骨皮质孔隙度,因此,如果测出橡皮内总质子含量百分比f,那么f×S即可得到骨皮质的总的水含量,由于橡皮在空气中暴露不易引起质子丢失,f相对固定,所以S代表了骨皮质内总体水分子的含量(即结合水、自由水)。
1.4 统计学方法 采用SPSS 22.0统计软件(IBM,美国)进行数据处理及统计分析,定量资料用均数±标准差(±s)表示,治疗前后定量资料的比较采用配对样本的 检验进行分析,对志愿者及OP治疗前的数据进行组间比较,采用两独立样本 检验。治疗前后所有数据均采取双侧检验,以=0.05为检验水准,以<0.05为差异有统计学意义。
2 结果
2.1 部分受试者胫骨前缘骨皮质的UTE成像图像,A图为1例青年志愿者,参照物橡皮呈较高信号,骨皮质信号与橡皮信号对比度良好。B图为后处理后图像,清晰显示了胫骨和腓骨的影像。C图和D图为本研究采用的计算示意图。E、F图为1例OP患者治疗前后随访所见骨皮质UTE图像,两次成像参数均相同。2.2各组受试者骨密度、骨皮质UTE相对信号强度及骨代谢标志物,如表1所示,经配对样本的双尾检验发现,对照组骨皮质UTE的相对信号强度高于OP组(与治疗前比较)。治疗前后的股骨颈BMD值及各组骨代谢产物均存在统计学差异。
2.3 骨皮质UTE相对信号强度与骨转换标志物的相关关系,如图2所示,治疗前后的骨吸收标志物CTX、P1NP与胫骨骨皮质相对信号强度存在负相关,R2分别为0.50和0.39,治疗后的M-M ID与治疗后骨皮质的总体相对信号强度亦存在负相关,R2为0.30。
3 讨论
OP是一个“沉默的疾病”(thesilentdisease)[2],其发病隐匿,因为它在骨量丢失的早期阶段,通常情况下是无症状的,或者只有比较轻微的临床不适。但是,一旦进展为OP,可能的症状和体征包括:腰背部疼痛,随着时间推移患者身高变矮、弯腰驼背姿势,且比预期的更容易发生骨折。因此,骨质疏松通常被患者和临床所忽视,尤其是在大多数国家进入老龄化社会以后,很多OP患者直至发生低能量骨折(lowenergy fracture),即骨质疏松引起的脆性骨折后,才逐渐被人们所重视[3]。
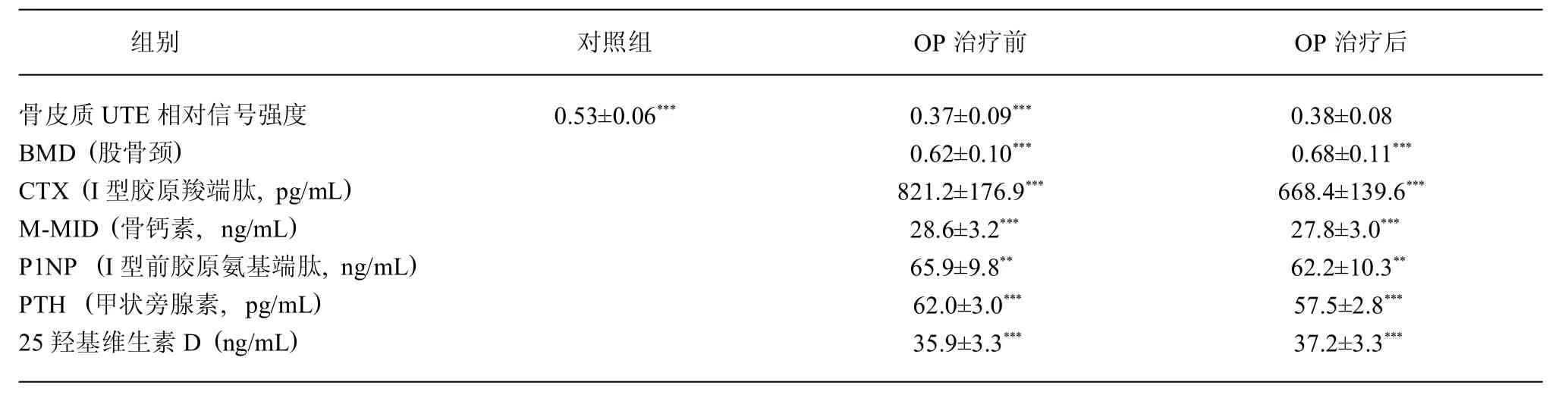
表1 各组受试者骨密度、骨皮质UTE相对信号强度及骨代谢标志物
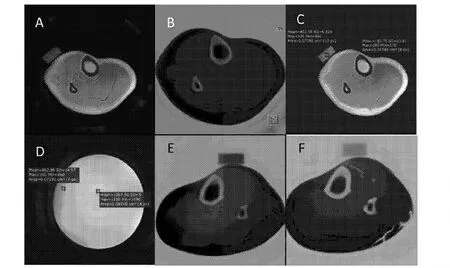
图1 1例受试者胫骨的UTE图像及本研究采用的相对信号强度计算方法。A图示一例青年志愿者的UTE原始采集图像,B为经过后处理得到的胫腓骨骨皮质显像。C图为两个不同ROI分别检测骨皮质的UTE信号和参照物橡皮的信号,D图为水模图像,将C的ROI复制到水模相应位置,可见信号强度不均,提示局部磁场的不均匀性,通过比值纠正局部磁场不均匀引起的信号偏差。图D、E为1例OP患者治疗前后随访所见骨皮质UTE图像,两次成像参数均相同。
双能X线检测仪检测骨密度是骨质疏松性临床评估不可缺少的一项检查。骨密度BMD无论是对骨质疏松性诊断,还是对抗骨质疏松治疗疗效监测均至关重要。但是,多项临床研究表明了BMD的临床局限性[4-6]。老年人的椎体骨折与BMD呈弱相关性[6],一项研究表明7 806例非椎骨骨折患者中,仅有44%的女性患者T值低于-2.5,而男性患者的相关比例甚至更低,仅有21%[4,7]。BMD自身预测骨折的检测率在30%~50%,已有报道表明BMD与皮质骨强度之间呈弱相关性[5]。骨质疏松患者在进行骨质吸收抑制剂的治疗干预后,BMD的变化与骨折风险存在着较强的不一致性[8]。总体而言,从60岁到80岁,患者随着增龄变化骨折风险增加了13倍,但是据估计,BMD值单方面的降低仅能说明骨折风险增加了1倍[9]。为了综合临床诸多因素对骨折风险评估的影响,结合患者测定的BMD值,WHO推荐的FRAX骨折风险评估工具在临床得到普遍推广,但是,在近年来却遭受质疑,被认为可能存在过度诊断,它在某种程度上可能只适合于部分人群[10,11]。因此,临床需要更加敏感地评估骨折风险的指标,比如骨的微观结构、孔隙度、有机质含量、水的含量以及骨的灌注情况等。
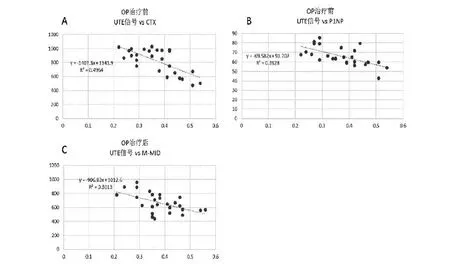
图2 对UTE探测的骨皮质相对信号强度与血液骨代谢产物进行Pearson相关分析示:A、B,在OP治疗前发现骨皮质的UTE相对信号强度负相关于CTX和P1NP,两者显示的R2值分别为0.4964和0.3928。C,为OP治疗一年后其测得的UTE相对信号强度与血清M-M ID呈负相关,R2值为0.3013。
骨皮质是一种短T2组织,在常规MRI中一般被认为是“无”信号。但是,磁共振UTE可以以最低回波时间(TE)达8sec进行乏质子组织的激发与成像。近年来UTE逐步用于骨皮质的成像与定量评估,特别是在骨皮质有机质和自由水的定量评估等方面,与骨的生物力学性质呈现较好的相关,因此,超短回波成像在评估骨皮质有机质相对含量、骨皮质孔隙度、骨皮质力学性质、骨强度等方面显示了非常好的应用前景。
骨内的物质构成可以分为三类:矿物质、有机质、水。前者通过BMD可有效评估,是临床现行不可替代的骨质疏松评估手段;而基于后两种物质目前较好的影像学评估手段即为UTE成像技术。在骨皮质中,水分子以4种不同状态存在[12]:(1)孔隙水(pore, free,ormobile water),也称为自由水、游离水,主要存在于哈弗管(Haversian canals,直径>30m)或骨陷窝(lacunae,~10m)、骨小管系统(canaliculi,~0.5m)中[12,13]。(2)疏松结合水(looselyboundwater),可见于骨胶原纤维的表面以及胶原与矿物质相之间,由于胶原分子的某些残基是亲水性的(例如:赖氨酸,精氨酸和羟脯氨酸),水分子很自然地结合在骨基质中。以上两种水组分信号可以被UTE探及。而另外两种水即:(3)紧密结合水(tightly bound water)和(4)结构水(structuralwater)含量极微,目前无法使用UTE探及。
在我们前期的离体样本实验研究中表明[14,15]:骨皮质(牛骨和人骨)的短T2信号可分离成结合水信号和自由水信号,采用双指数模型可以有效实现结合水和自由水的分离,并得到结合水和自由水在骨皮质中的相对百分比,结合水约占80%,余下约20%为自由水信号,量化的重要意义在于其比例的变化分别相关于骨能承受的峰值压力和骨皮质的孔隙度。对骨的强度的评估和骨折风险的预测而言无疑是对BMD的有力补充。
本研究使用UTE成像序列激发出骨皮质内短T2成分的总信号,根据前期的离体实验研究,我们认为这些信号主要来自于两种水的信号。通过与参照物的比对探讨了骨质疏松组和健康组之间存在显著的差异,表明健康志愿者的胫骨骨皮质短T2信号的相对值要高于骨质疏松组,这可能是由于骨质疏松患者在骨量丢失(BMD下降)的同时,伴随了有机质的量的减少,从而导致结合水(占80%左右)含量相对降低。但是,从结构生物学特点看,骨质疏松患者骨皮质内的孔隙度也会增加,其内自由水理论上也会增加,那么对总体UTE信号强度的贡献也会增加,因此,骨质疏松患者骨皮质的UTE总体信号仍有可能会高于健康组的骨皮质相对信号(当自由水信号占据主导地位时)。
在本组OP患者治疗随访过程中,治疗后患者骨皮质UTE信号相对强度均值较治疗前增高,经配对样本的t检验显示统计学上虽无统计学差异,但UTE信号相对强度均值的增加潜在提示了骨皮质有机质含量的相对增加,在一定程度上反映了抗骨松治疗的效果,或可间接提示骨质生物力学性质的改善。根据前期实验研究结果,自由水只占不到20%的比例,结合水(有机质)占了较大比重,离体样本和在体骨皮质的信号本身会存在差异,加之骨代谢的复杂性,因此,本研究中的骨皮质UTE总体信号的增加不能完全归因于结合水的增加。
骨转换标志物是骨细胞活性与骨基质代谢水平的生化产物,通常分为骨形成标志物和骨吸收标志物两类。前已述及BMD本身并不能为OP的鉴别诊断提供更多的临床信息,在判断骨转换率、选择干预措施、疗效监测和依从性等方面,骨代谢生化标志物可从一定程度上弥补BMD在OP诊治过程中的不足。在本研究中,入组患者的骨代谢产物I型胶原羧端肽和I型前胶原氨基端肽(P1NP),与患者骨皮质UTE相对信号强度显示了一定程度的负相关性(R2分别为0.50、0.39),即骨吸收标志物含量下降,骨皮质UTE总体信号增加,提示抗骨松治疗改善时UTE信号的激发可能更多的来源于骨皮质中增多的有机基质结合水成分,这与我们离体实验样本的研究基本吻合。本研究中同样发现另一代谢产物骨钙素,其在抗骨松治疗中呈下降趋势,其与骨皮质UTE的相对信号强度呈负相关(R2=0.30)。
因此,根据本研究,UTE骨皮质信号相对强度的动态变化可能是潜在的评估骨质疏松的指标之一,但是本研究尚存在以下几方面的缺陷:(1)骨皮质的弛豫特性非常复杂,本研究对骨皮质UTE总体信号进行了精简的分析,忽略了对其T1的纠正。(2)虽然正常组和OP组显示了一定的差异,治疗前后的信号强度与部分骨转换标志物有一定相关性,但样本量较小可能使结果存在统计的偏倚。(3)骨质疏松的最严重并发症是低能量骨折,BMD和骨转换标志物都有潜在评估骨折风险的能力,本研究尚未探讨骨皮质UTE信号相对强度与骨质生物力学之间的直接关系,但本研究为下一步进行在体骨皮质结合水和自由水的分离、进而预测评估骨折风险奠定了基础。
总之,UTE技术激发了骨皮质内的有机质结合水和自由水产生信号,通过与参照物的比对,可潜在的用于骨质疏松的评估。
[1]Du J,Carl M,Bydder M,.Qualitative and quantitative ultrashort echo time(UTE)imaging of cortical bone[J].J Magn Reson,2010,207(2):304-311.
[2]Cosman F,deBeurSJ,LeboffMS,.Erratum to:?Clinician's guide to preventionand treatmentofosteoporosis[J].Osteoporos Int,2015,26(7):2045-2047.
[3]Warriner AH,Patkar NM,Yun H,.M inor,major,lowtrauma,and high-trauma fractures:whatare thesubsequentfracture risksand how do they vary[J].CurrOsteoporosRep,2011,9 (3):122-128.
[4]SchuitSE,Van derkliftM,WeelAE,.Fracture incidence and association w ith bone m ineral density in elderly men and women:theRotterdam Study[J].Bone,2004,34(1):195-202.
[5]Kanis JA,Johnell O,Oden A,.Ten year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds[J].Osteoporos Int,2001,12(12):989-995.
[6]Faulkner KG.Bonematters:are density increases necessary to reduce fracture risk?[J].JBoneM inerRes,2000,15(2):183-187.
[7]杜江,高嵩,包尚联.应用超短回波MRI技术综合定量评价骨皮质质量[J].中国医学影像技术,2013(4):659-662.
[8]Cumm ingsSR,KarpfDB,HarrisF,.Improvementinspine bone density and reduction in risk of vertebral fractures during treatmentw ith antiresorptivedrugs[J].Am JMed,2002,112 (4):281-289.
[9]De Laet CE,Van Hout BA,Burger H,.Bone density and risk of hip fracture inmen and women:cross sectionalanalysis [J].BM J,1997,315(712):221-225.
[10]Järvinen TL,M icha?lsson K,Jokihaara J,.Overdiagnosis of bone fragility in the quest to prevent hip fracture[J].BM J, 2015,350:h2088.
[11]Jarvinen TL,Jokihaara J,Guy PA,.Conflictsat theheart of the FRAX tool[J].CanMed Assoc J,2014,186(3):165-167.
[12]GrankeM,DoesMD,Nyman JS.The roleofwatercompartments in thematerialpropertiesof corticalbone[J].Calcif Tissue Int, 2015,97(3,SI):292-307.
[13]包尚联,杜江,高嵩.核磁共振骨皮质成像关键技术研究进展[J].物理学报,2013(8):1.
[14]Li S,Chang EY,BaeWC,.The effectof excitation and preparation pulses on nonslice selective 2D UTE bicomponent analysisof bound and freewater in corticalboneat3T[J].Med Phys,2014,41(2):022306.
[15]LiS,Ma L,Chang EY,.Effectsof inversion timeon inversion recovery prepared ultrashort echo time(IR-UTE)imaging of bound and porewaterin corticalbone[J].NMRBiomed,2015, 28(1):70-78.
Ultra-shortEcho-time Imaging in Quantitative AssessmentofCorticalBone in Caseswith Osteoporosis
LiShihong,Zhu Zhenfang,Ye Chuntao,Peng Yu,Yin Haolin,Lin Guangwu*
MRICenter,Huadong Hospital Affiliated to Fudan University,Shanghai,200040,P.R.China
Objective To discuss the application of ultra-shortecho-time(UTE)imaging of MRIin quantitative assessmentofosteoporosis in vivo.Methods 26 casesw ith osteoporosisand 10 norm were enrolled in the study and all the cases
UTE imaging of cortical bone in the lower tibia;the relative signal intensity ratio of the short T2 componentof the corticalbone in thescanned sitewasgained through thecomparisonw ith thesignalintensity of the reference,and thesignificance of thevalue in differentgroupswasobserved in combinationw ith thebonemineraldensity and bonemetabolitesof the cases.Results Theoverall relativesignalintensity ofUTE imaging in tibialcorticalboneof the casesin normalcontrolgroup(0.53±0.06) washigher than thatin osteoporosisgroup(0.37±0.09)and the differencewasof statisticalsignificance(<0.05);the relative signal intensity of corticalbone of the cases in osteoporosisgroup after treatmentwashigher than thatbefore treatmentbutw ith no obviousdifference;the relative signal intensity of CTX,P1NPand tibial corticalbonewas in negative correlation after treatment to thatbefore treatment,aswellasM-M ID after treatment.Conclusions The UTE imaging signalof corticalbone quantified by the comparisonw ith the referencemay be potentially applied in theassessmentofosteoporosis.
osteoporosis;ultra-shortecho-time(UTE)imaging;bone turnovermarker;corticalbone
2017-06-08)
(本文编辑:陈培莲)
上海市科委西医引导类项目(14411962700),江苏省自然科学基金面上项目(BK20151293)
林光武,lingw01000@163.com
*Corresponding author:Lin Guangwu,E-mail:lingw01000@163.com
