玉米须中多糖及黄酮类成分的提取与抗氧化活性分析
2017-09-08郑姗姗
郑姗姗
广东岭南职业技术学院,广东 清远 511500
玉米须中多糖及黄酮类成分的提取与抗氧化活性分析
郑姗姗
广东岭南职业技术学院,广东 清远 511500
目的:通过实验对玉米须中多糖、黄酮类化合物抗氧化活性的检测,探究以多糖或黄酮类化合物为主要成分制备绿色保鲜剂和除锈剂的可行性。方法:采用超声技术提取玉米须的主要成分多糖和黄酮类化合物,用Molish反应和HCl-Zn粉反应分别对多糖、黄酮类成分进行定量和定性检测,并简单与空气对比保鲜、与蒸馏水对比除锈效果。结果:玉米须中多糖提取率为5.3%,黄酮提取率为1.2%;黄酮及多糖都能使水果表面的氧化速度变慢,黄酮能去除铁钉上的铁锈,而多糖不能。结论:黄酮类及多糖成分有保鲜功能,可作为绿色保鲜剂的制备材料之一;黄酮类成分有除锈性质,可制备绿色除锈剂。
玉米须;多糖;黄酮;提取
药理研究表明,玉米须提取物有降血糖[1],抗氧化,抗菌[2],抗肿瘤[3]和利尿[4]等功效。玉米须还可用于治疗泌尿系统结石[5],提高机体免疫力,治疗I型过敏性疾病[6],加速血液凝固[7]。
笔者采用超声提取法提取玉米须中的多糖、黄酮类成分,并对其进行定性和定量测定,做到物尽其用,并检测玉米须多糖、黄酮类成分的抗氧化活性。现报告如下。
1 仪器与材料
1.1 仪器 实验所用主要仪器及生产厂家见表1。
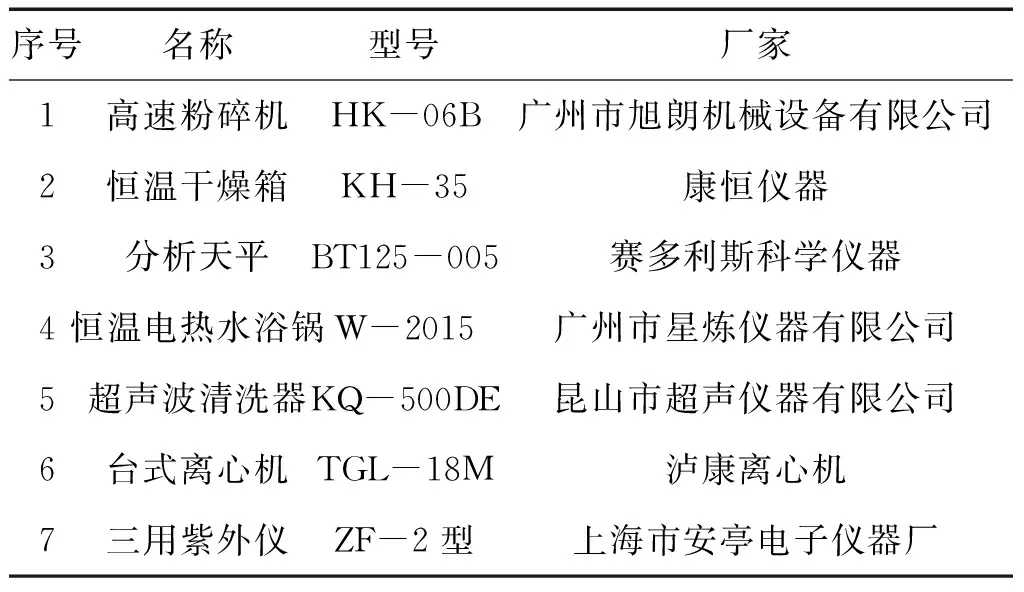
表1 仪器与生产厂家
1.2 材料与试剂 实验主要用到的材料:苹果,梨子,山药,生锈铁钉。玉米须粉末制备:新鲜玉米须,去杂、蒸馏水洗净,置于80℃恒温干燥箱烘干至恒重,粉碎,过60目筛,装瓶备用。
实验所用主要试剂,其规格、生产厂家见表2。其中,芦丁标准品生产批号为20160122,葡萄糖标准品生产批号为10040422。
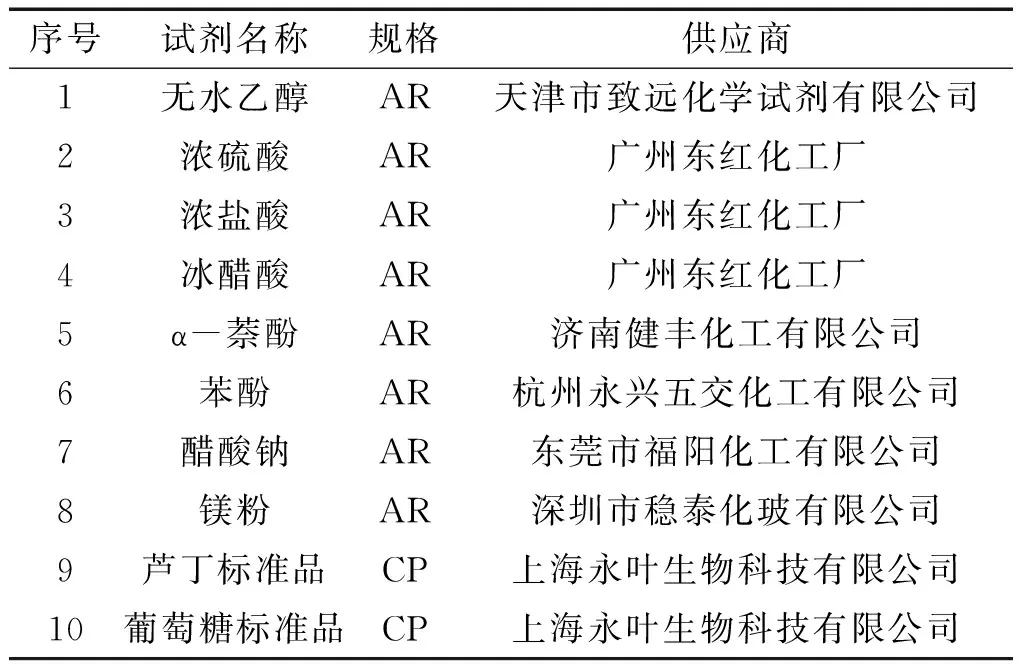
表2 原料与试剂的来源与规格
2 实验方法
2.1 水溶性多糖的提取、定性与定量
2.1.1 葡萄糖标准曲线的绘制 精密吸取葡萄糖标准液0.0、2.0、4.0、6.0、8.0和10.0 mL于6个100mL的容量瓶中,用蒸馏水定容至刻度线,摇匀,依次标号0~5。分别吸取上述溶液各0.6mL (含糖4~28μg),置于试管中,各加入50g/L苯酚溶液1.2mL,混合后迅速加入6.0mL浓H2SO4,摇匀,置于40℃水浴30min,冷却至室温。(0号可改为:1mL蒸馏水+2mL苯酚溶液+10mL浓H2SO4)。以0号溶液为空白对照,在490 nm波长处分别测定1~5号溶液的吸光度值。以葡萄糖浓度为横坐标,溶液吸光度为纵坐标,用最小二乘法作线性回归,绘制标准曲线。详见表3。
2.1.2 水溶性多糖的提取及含量测定 准确称取2.5 g玉米须粉末,置于250mL烧杯中,按液料比(1g比30mL)加入蒸馏水75 mL,浸泡60 min,在60℃下超声波提取90 min。将提取液进行离心(3000r/min),离心完毕,精密吸取上层清液2.0mL置于100mL的容量瓶,用蒸馏水定容至刻度线。精密吸取上述溶液0.6 mL置于试管中,加入50g/L苯酚溶液1.2 mL,混合后迅速加入6.0mL浓H2SO4,摇匀,置于40℃水浴30min,冷却至室温,得多糖含量待测液。使用紫外分光光度法,以0号溶液为空白对照,在490 nm波长处测定多糖含量待测液的吸光度值。
2.1.3 水溶性多糖的定性 取多糖待测液1mL置于试管,滴加2滴Molish试剂,振摇,充分混合。倾斜试管,沿管壁缓慢加入1mL浓H2SO4,缓慢立起试管,浓H2SO4在试液下形成两层,在二液分界处有紫红色环出现。
2.2 黄酮类化合物的提取、定性与定量
2.2.1 芦丁标准曲线的绘制 精密吸取芦丁标准品溶液0.0、1.0、2.0、3.0、4.0和5.0mL置于6个25 mL的容量瓶中,各加入1%AlCl3无水乙醇溶液9mL,用75%乙醇定容至刻度线,摇匀,放置10min,依次标号0~5。以0号溶液为空白对照,在272 nm波长处分别测定2~6号溶液的吸光度值。以芦丁浓度为横坐标,溶液吸光度为纵坐标,用最小二乘法作线性回归,绘制标准曲线。详见表4。
2.2.2 黄酮的提取及定量测定 准确称取2.5 g玉米须粉末,置于250mL烧杯中,按液料比(1g比20mL),加入75%乙醇50mL,调溶液pH至9,浸泡60min。在60℃下超声提取30min。将提取液进行离心(3000r/min),离心完毕,取上层清液1.0mL置于50mL容量瓶,加1%AlCl3无水乙醇溶液18mL,用75%乙醇定容至刻度线,摇匀,放置10min,配置黄酮含量待测液。使用紫外分光光度法,以0号溶液为空白对照,在272nm波长处测定待测液的吸光度值。
2.2.3 黄酮的定性 取黄酮含量待测液1mL,置于试管中,加少许锌粉,振摇,再滴加3滴浓盐酸,微热,显淡红色。
2.3 多糖、黄酮抗氧化活性的检测及比较 取适量黄酮提取液离心后的上层清液(乙醇含量75%)置于试管中,作为保鲜剂或除锈剂,标号A。
取适量75%乙醇置于试管中,作为空白对照溶液,标号a。
取适量多糖提取液离心后的上层清液置于试管中,作为保鲜剂或除锈剂,标号B。
取适量蒸馏水置于试管中,作为空白对照溶液,标号b。
切开苹果,梨子,山药,在各自的新鲜切面上分别滴加2滴A液,B液,a液,b液,15min后观察结果。
取4根有明显锈迹的铁钉置于不同试管中(记录现象),分别加入适量A液,B液,a液,b液至完全浸没,24h后观察结果。
3 实验结果
3.1 多糖的定性与定量
3.1.1 多糖的定性 在多糖待测液与浓硫酸二液分界处有紫红色环出现。Molish反应呈阳性,说明待测液中含有多糖。见图1。

3.1.2 多糖的定量 精密称定葡萄糖质量:0.1043g,配制葡萄糖标准液浓度:1.043mg/mL。采用Excel 2010软件对实验数据进行处理,得出回归方程为:y= 4.3912x-0.0008。代入待测液吸光度值,得多糖浓度Q=0.04960mg/mL。多糖提取率按下式计算:
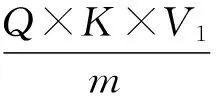
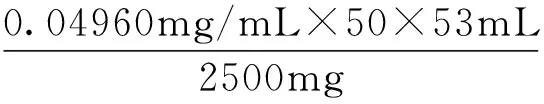
其中,W为玉米须多糖提取率(%),Q为多糖浓度(mg/mL),K为稀释倍数,V1为离心后提取体积(mL),m为玉米须粉末质量(mg)。结果见表3、图2。
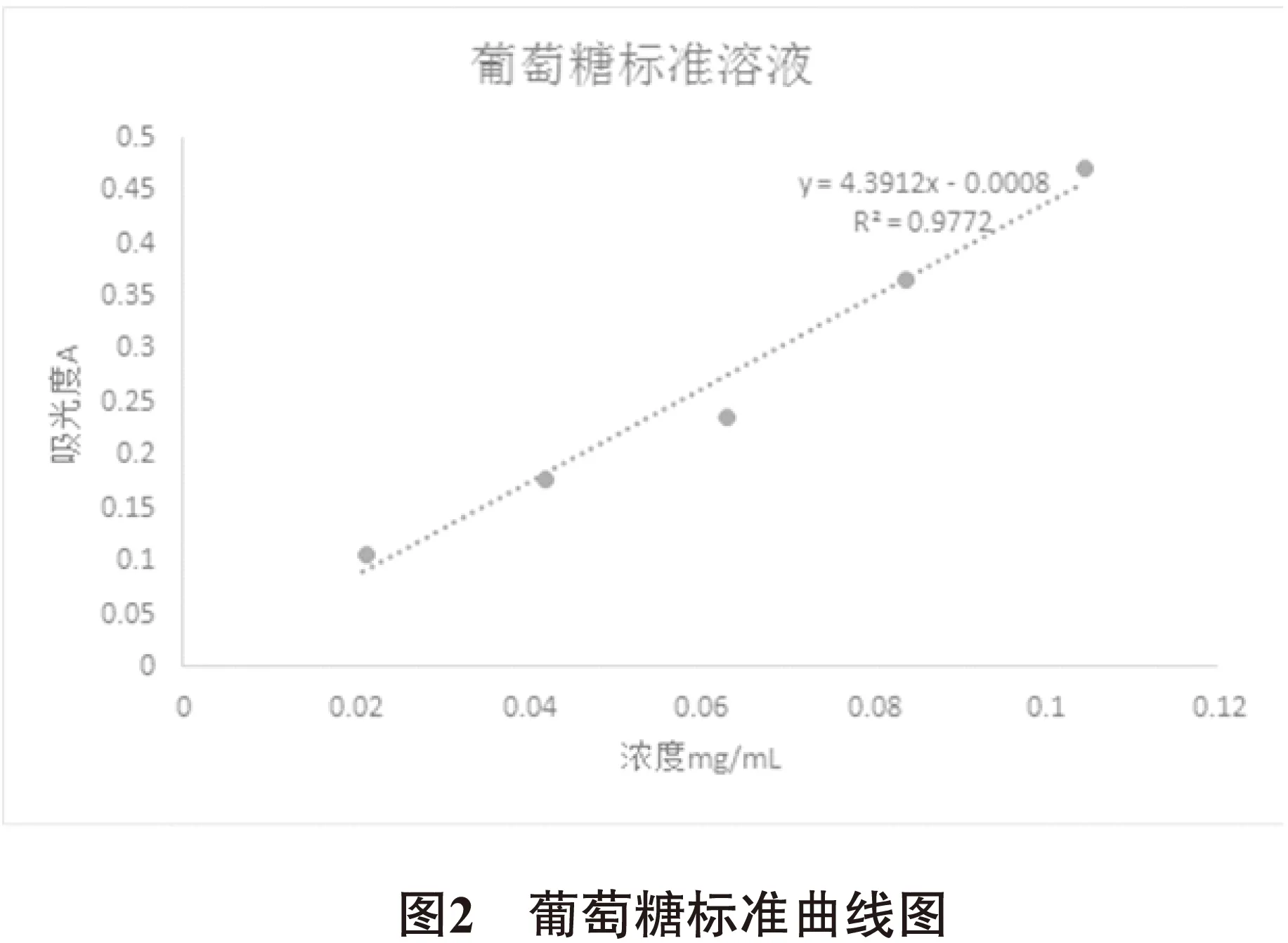
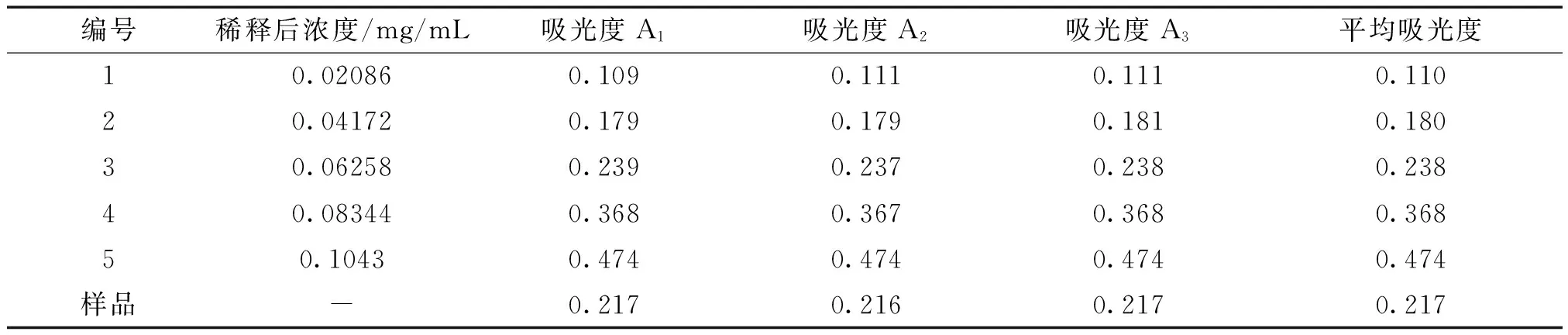
表3 葡萄糖标准曲线制作结果
3.2 黄酮类化合物的定性与定量
3.2.1 黄酮的定性 如图3所示,左边为黄酮待测液,右边为HCl-Zn粉反应后的黄酮待测液,显淡红色。右边溶液反应后呈淡红色,说明待测液中有黄酮类化合物。

3.2.2 黄酮的定量 精密称定芦丁质量:0.0225 g,配制芦丁标准液浓度:0.225 mg/mL。采用Excel 2010软件对实验数据进行处理,得出回归方程为:y= 31.267x+ 0.0516。代入待测液吸光度值,得黄酮浓度C=0.024 mg/mL。黄酮提取率按下式计算:
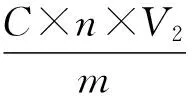
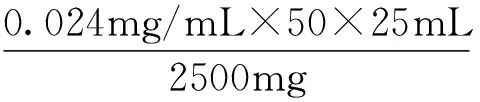
其中,E为玉米须黄酮提取率(%),C为黄酮浓度(mg/mL),n为稀释倍数,V2为离心后提取体积(mL),m为玉米须粉末质量(mg)。详见表4、图4。
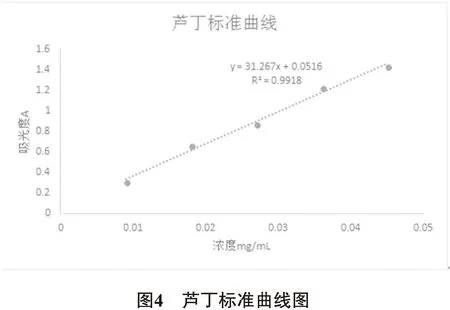
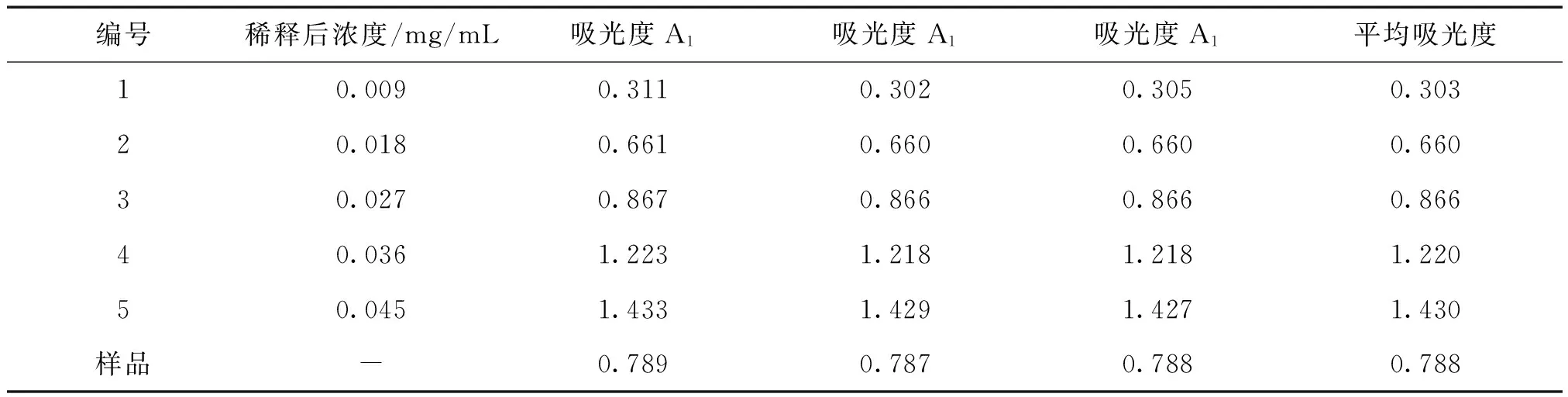
表4 芦丁标准曲线制作结果
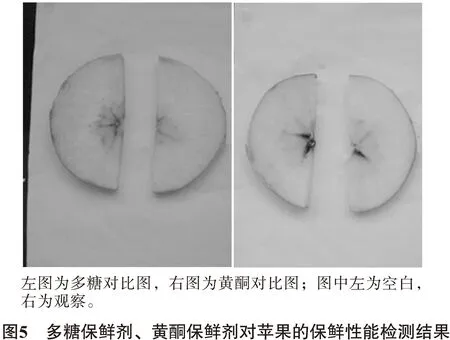
3.3 多糖、黄酮抗氧化活性的检测及比较结果 从图5、6可知,右边涂了多糖的苹果、山药明显氧化程度低,说明多糖具有抗氧化性。右边涂了黄酮的苹果、山药明显氧化程度较左边低,说明黄酮具有抗氧化性。
从图7可知,从左到右的溶液依次是蒸馏水,芦丁溶液,多糖待测液,黄酮待测液。可以看出芦丁溶液铁锈脱落程度最明显,黄酮待测液次之,多糖待测液最后。说明多糖跟黄酮都有除铁锈的功能。


4 小结与讨论
纤维素酶是一种复合酶,具有很高的木聚糖
酶活力,在分解纤维素时起生物催化作用,而实验过程并没有加入纤维素酶,故对玉米须浸泡60 min,将超声30 min改为90 min,最后得多糖提取率5.3%,相比加纤维素酶的提取率略高,说明超声方法对多糖的提取更加有效。对于黄酮的定量,可以采用高效液相色谱法精确测定,得出黄酮提取率为1.2%。对于玉米须黄酮的抗氧化活性,可以采用清除有机自由基DPPH法进行精确测定[8]。然而,由于实验时间有限,故直接把提取液涂在易氧化褐变的水果切面上,方法简便,操作快速,现象明显,既可检验多糖、黄酮类化合物的抗氧化活性,又可贴近实际地检验其作为保鲜剂或除锈剂的有效性。
利用超声提取技术从玉米须中提取得到多糖及黄酮类化合物,提取率高,充分利用了玉米资源,达到了物尽其用的目的。实验得到的多糖、黄酮类化合物提取液能明显除去铁制品锈迹和抑制水果褐变。因此,在铁金属制品工业和食品工业领域,玉米须多糖、黄酮类成分有望成为一种绿色环保型除锈剂和保鲜剂。
[1]Menczl E. Hypoglycemic substances[J]. Bulletin of the Research Council of Israel, 1963(102):235-236.
[2]纪丽莲, 范怡梅. 玉米须提取物对食品腐败菌及致病菌抑制作用的研究[J]. 食品科学, 2000, 21(12):131-134.
[3]Habtemaram S. Extract of silk(stigma ofZeamays) inhibits the tumor necrosis factor-A- and bacteria illpopoly saccharide-induced cell adhesion and ICAM-1 expression [J]. planta. medica. 1998(64):314-318.
[4]Muneer A. Salman W, HusniT. Tribulus terrestris preliminary study of its diuretic and contractile effects and comparison withZeamays[J]. Journal of Ethnopharmacology, 2003(85):257-260.
[5]Dzhamalieva I. B D. Pharmacological action of an extract of corn silk [J]. Ser. Fizioli. Med. 1954(3):81.
[6]Namba, Tsuneo. Inhibition of IgE formation in mice by glycoproteins from corn silk [J]. Phytother Res, 1993, 7(3):227.
[7]Garg D K. Matlogical and hepatotoxic effects of silken styles of corn in albino rats [J]. J. Appl. Toxic, 1992, 12(5):359.
[8]聂少平,谢明勇,罗珍. 用清除有机自由基DPPH法评价茶叶多糖的抗氧化活性 [J]. 食品科学,2006(03):34-36.
郑姗姗(1992-),女,汉族,本科,助教,研究方向为药学。E-mail:839821112@qq.com
R284.1
A
1007-8517(2017)16-0033-04
2017-06-15 编辑:程鹏飞)
