过硫酸钾及过硫酸钾与过渡金属离子协同体系氧化吸收Hg影响因素研究
2017-09-06马超
马 超
(徐州市环境监测中心站, 江苏 徐州 221018)
0 引言
Hg是一种公认的具有剧毒性、生物累积性、持久性的重金属元素,矿石燃料的燃烧是造成目前环境Hg污染的主要原因。2011年我国出台了修正后的GB 13223—2001《火电厂烟气排放标准》,其中明确了自2015年1月1日起,我国火电厂烟气Hg的排放限值为0.03 mg/m3。由此可见,环境Hg污染受到了国内外的广泛关注,Hg污染控制工程、高性能的Hg去除剂的开发将成为21世纪最重要的环保课题之一。
过硫酸钾(K2S2O8)具有强氧化性,可产生硫酸根自由基(SO4-·),具有较高的反应的活性,但S2O82-分解成自由基的摩尔热力学能为130 kJ/mol,在室温下反应速度较慢,通过加热、光照或加入过渡金属离子的方式可以起到加速反应的效果[1-3]。
本试验分别以K2S2O8,K2S2O8与过渡金属离子的协同体系作为Hg氧化吸收剂,对初始K2S2O8浓度、催化剂种类及投加量、氧化吸收液初始pH值、反应温度、入口Hg浓度进行综合考察和分析,确定最优脱Hg体系及其适合的运行条件。
1 材料及步骤
1.1 实验材料
K2S2O8(AR)购于上海金山化学试剂厂;硫酸铜(CuSO4,AR),硫酸钴(CoSO4,AR),硫酸亚铁(FeSO4,AR),硫酸锰(MnSO4,AR),氢氧化钠(NaOH,AR),盐酸(HCl,AR)均购于天津市天河化学试剂厂;Hg渗透管(苏州青安仪器有限公司,操作温度90℃,Hg渗透量 90 ng/min);氮气(N2)(>99.9%,徐州宏源达气体供应站);燃煤烟气测汞仪(QM201H,苏州青安仪器有限公司)。
1.2 实验装置
具体实验装置见图1。

图1 试验装置
1.3 实验步骤
(1)试验系统的稳定性分析
分别以25,60,90℃作为反应温度条件,Hg渗透管温度为60℃,气体总流量为1 L/min,其中载气量300 mL/min,平衡气气量为700 mL/min,取250 mL去离子水作为空白吸收液置于主反应装置中,分别在U型左侧入口处、右侧出口处和主反应器出口处取样并测定各部分烟气中的Hg含量,计算相对误差φ1(U 型管右侧出口)和φ2(主反应器出口),每个温度条件下重复测试3次,取3次平均值。不同温度试验背景值见表1。
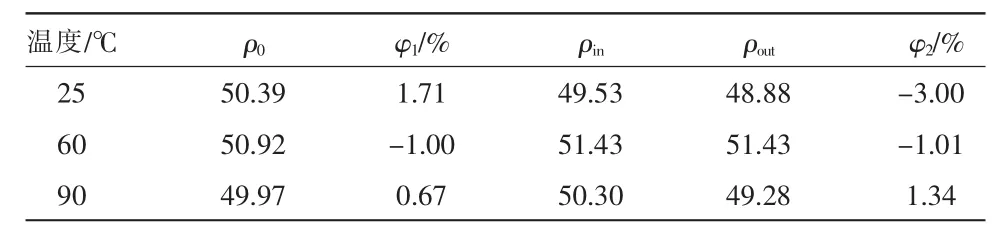
表1 不同温度下试验背景值 μg﹒m-3
系统稳定约1.5 h后,U型管出口处Hg浓度与反应塔进口处浓度基本相同,Hg蒸气流经管壁及其他装置时因吸附、冷凝等原因造成的误差损失在总量的-1.00%~1.71%之间,测试系统的稳定性及可靠性较好。
(2)按照Ontario-Hydro方法准备和配置尾气吸收和清洗试剂。
(3)在分析之前,先打开测汞仪预热40~60 min,设置取样测试时间,清洗时长、调整取样流量,同时打开水浴锅并设定水浴温度。
(4)当水浴温度达到所需要的温度时,打开N2阀门,通入N2,赶走管路和反应器中的残存的少量Hg蒸气及空气,同时检查管路的气密性,稳定反应系统约1.5 h左右。过程中,隔一定时间补充恒温水浴的水,保证水深和U型管加热面积不变。
(5)将250 mL背景溶液(去离子水)加入鼓泡反应器,稳定约1.5 h后用开始用测汞仪定时采样,采样间隔为5 min,单一条件下重复采样3次,测定的结果即为此工作条件下Hg蒸气的进口浓度。
(6)待气流等参数稳定后,加入配置好的氧化吸收液进行试验,氧化吸收液的pH值用浓度为0.1 mol/L H2SO4和 0.1 mol/L NaOH 进行调节。
(7)用QM201H燃煤烟气测汞仪作为反应器出口处Hg蒸气浓度的检测仪器,重复采样。每个样品重复测试3次,结果取其平均值。
2 结果与讨论
2.1 K2S2O8初始浓度对Hg脱除效率的影响
试验条件:Hg渗透管温度(T1)为60℃,反应温度(T2)为 45 ℃,溶液 pH 值 =5,c(Co2+) =0.8 mmol/L时,K2S2O8及K2S2O8/Co2+体系的脱Hg效率与K2S2O8浓度之间的关系见图2。
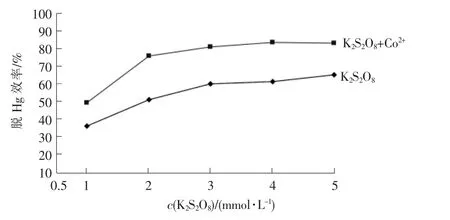
图2 Hg脱除效率随K2S2O8,K2S2O8+Co2+浓度的变化
K2S2O8以及过渡金属离子Co2+参与的协同体系与Hg的反应迅速,在2.5 min内均可取得较高的脱除效率。随着K2S2O8浓度的增加,脱Hg效率也随之增长,而Co2+的加入对K2S2O8氧化Hg有明显的促进作用。加入Co2+(c=0.8 mmol/L)后,脱Hg效率在K2S2O8的各浓度条件下均有明显的提高,增幅在13.2% ~ 24.8%之间。 当 K2S2O8浓度由 1 mmol/L增长至3 mmol/L时,与未加入过渡金属离子(Co2+)的K2S2O8相比,脱 Hg 效率分别由 35.55%,59.60%增长至 48.75% ,80.35% , 增 长 率 分 别 为 37.13% 和34.81%,效果明显;但可能是由于溶液中Co2+有限,限制了催化反应的进行,当c(K2S2O8)继续升高,脱Hg 效率的增长幅度明显下降,c(K2S2O8)=5 mmol/L时,脱 Hg 效率为 82.65%,与c(K2S2O8)=3 mmol/L 时的80.35%基本相当。出于经济性考虑,在本实验条件下,选取K2S2O8浓度为3 mmol/L作为最适浓度。
2.2 过渡金属离子对K2S2O8脱Hg效率的影响
K2S2O8催化剂多以 Ag(Ⅰ),Ni(Ⅱ),Co(Ⅱ)等稀有金属作为的催化剂,由于价格昂贵且不易回收,在实际工业生产中的应用价值不高[4-6]。本实验选取Fe2+,Co2+,Mn2+,Cu2+4 种廉价过渡金属离子作为反应的催化剂,考察4种过渡金属离子与K2S2O8协同脱Hg的效果,建立K2S2O8与过渡金属离子协同脱Hg体系,并找出催化性能好,实用性强的过渡金属离子,并确定最适投加比。
c(K2S2O8)=3 mmol/L,pH 值 =5,不同过渡金属离子及其投加量与脱Hg效率间的关系见图3~图6。

图3 Fe2+对K2S2O8脱Hg效率的影响

图4 Co2+对K2S2O8脱Hg效率的影响

图5 Cu2+对K2S2O8脱Hg效率的影响
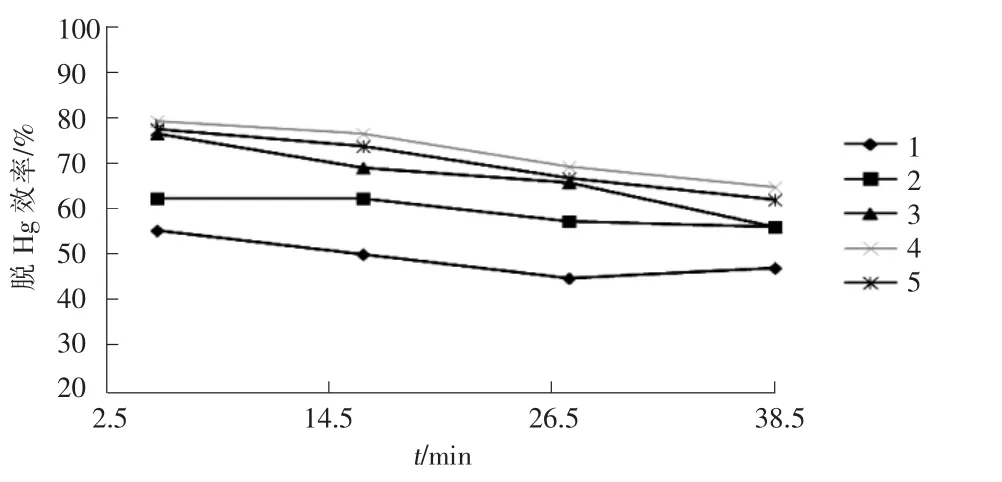
图6 Mn2+对K2S2O8脱Hg效率的影响
由图3~图6可知,与K2S2O8相比,加入Fe2+,Cu2+,Co2+,Mn2+4种过渡金属离子后,脱Hg效率均有不同程度的提高,不同金属离子氧化还原电对的标准电极电势(E0)见表2。 Fe2+,Co2+,Mn2+3 种过渡金属离子没有氧化性,Cu2+或Cu+的氧化性较弱,4种过渡金属离子不足以直接对 Hg(E0(Hg2+/Hg0) =0.85 V)产生氧化作用,这说明协同体系脱Hg效率的提高主要原因是过渡金属离子的加入促进了K2S2O8对Hg的氧化吸收。
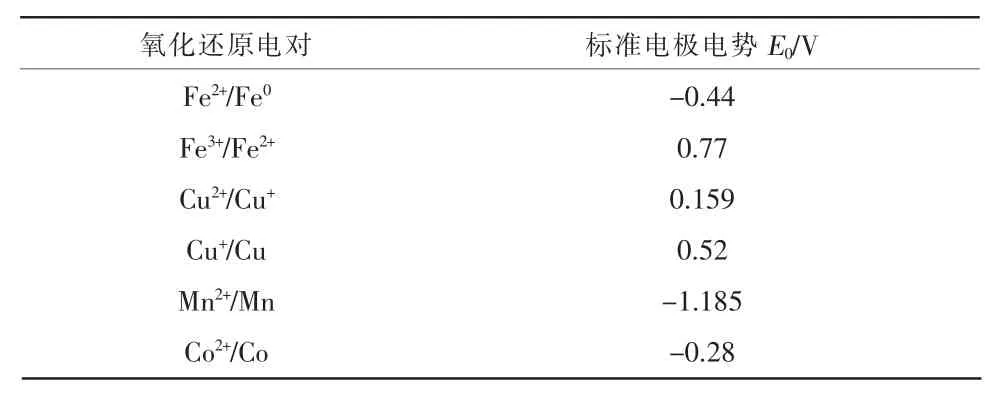
表2 不同氧化还原电对的标准电极电势
随着4种过渡金属离子投加量的增加,协同体系的脱 Hg 效率也随之增加,当 Fe2+,Co2+,Cu2+,Mn2+离子浓度增至1.5 mmol/L时,4种过渡金属离子的催化效应由高到低分别为Fe2+>Co2+>Cu2+>Mn2+,Fe2+/K2S2O8体系的脱Hg性能最为突出。由图3可知,当K2S2O8浓度为3 mmol/L,Fe2+浓度为1 mmol/L时,脱Hg效率为94.61%, 与 Fe2+浓度为 1.5 mmol/L 时的 94.78%相当,出于经济性考虑,本试验选取K2S2O8浓度为3 mmol/L,Fe2+浓度为 1 mmol/L 作为 Fe2+/K2S2O8体系的最佳投加量,K2S2O8与Fe2+的最佳投加比为3∶1。
随着反应时间的积累,Fe2+,Co2+,Mn2+因不断被S2O82-氧化生成 Fe3+,Co3+,Mn3+(或者Mn4+),从而丧失或部分丧失了催化效应。另外,SO4-·的半衰期仅为4 s,较长的接触时间也增加了自由基的猝灭机率,影响反应进行。为了解决这一问题,一些研究者[10]采用添加螯合剂或续批加入过渡金属离子的方式以保持体系的稳定性。
在40 min的反应时间内,Cu2+/K2S2O8的脱Hg效率维持在80.56%~83.43%之间,体系的脱Hg效率没有明显下降,稳定性尤为突出。这一现象说明Cu2+与K2S2O8之间可能经历了不同于Fe2+,Co2+等离子的催化反应过程。Cu2+的d轨道分布在不对称的非线性体系中,缺少1个电子的d9组态电子云的分布是不对称的,Cu2+结构也因此发生畸变,产生了姜-泰勒效应,体系的能量降低,易于与K2S2O8中的过氧键结合,形成过渡态配合物,这种过渡态配合物的形成也降低了K2S2O8的分解活化能,促进了K2S2O8均裂分解反应的进行[7]。而Cu2+并未因氧化吸收反应的进行而减少,保持了体系的反应活性,Cu2+/K2S2O8具有较为突出的稳定性。
2.3 初始pH值对Hg脱除效率的影响
Fe2+,Mn2+,Cu2+,Co2+4 种离子浓度均为 1 mmol/L,溶液初始pH值与脱Hg效率之间的关系见图7。
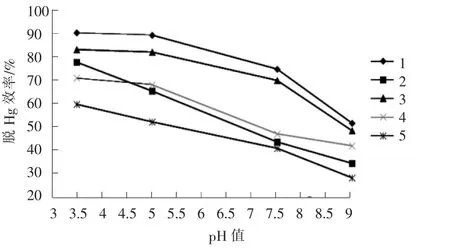
图7 K2S2O8初始pH值对氧化吸收效率的影响
由图7可以看出,pH值对K2S2O8氧化吸收Hg效率有显著影响,当体系 pH 值 =3.5时,K2S2O8,Fe2+/K2S2O8,Co2+/K2S2O8,Cu2+/K2S2O8,Mn2+/K2S2O8体 系 所对应的脱 Hg 效率分别为 64.77%,91.37%,85.12%,74.53%,80.52%,随着 pH 值的升高,各体系的脱Hg效率均有不同程度的下降,当pH值升高至9时,各体系脱 Hg效率分别下降至 37.18%,57.78%,54.96%,49.24%,42.12%,下降幅度较大。
pH值环境不但影响K2S2O8自身的氧化性能,而且也关系着过渡金属离子在溶液中的存在形态。首先,随着体系pH值升高,在相同温度条件下,K2S2O8的活化程度下降,在酸性条件下,H+与K2S2O8过氧键的结合能力较强,形成了类似氢键的过渡键,削弱了过氧键的键能,K2S2O8中的O-O键可能通过对称裂解的方式, 生成 SO4-·,OH·,H2O2等中间产物,反应式见(1) ~ (6)[8]。
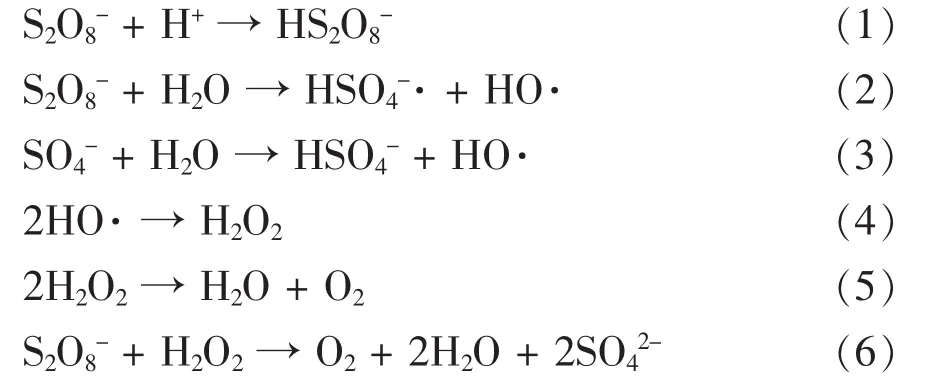
除了影响K2S2O8的活性,环境pH值还与过渡金属离子在溶液中的存在形态有着紧密关系,随着溶液pH值的升高,一些过渡金属离子可能与OH-结合形成氢氧化物沉淀,限制了过渡金属离子的催化性能。
各过渡金属离子相应氢氧化合物的溶度积常数(KSP)见表3。
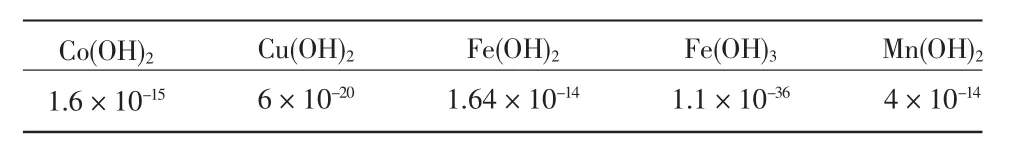
表3 几种过渡金属离子相应氢氧化合物的KSP
由表3可知,Fe(OH)2的KSP最大,理论上当pH值>8.39时,溶液中的Fe2+开始沉淀,试验结果也证实,当pH值在3.5~5之间时,Fe2+/K2S2O8体系的脱Hg效率处于稳定状态。而与理论值相比,在较低的pH值环境中,脱Hg效率即呈现出较大幅度的下降, 当 pH 值由 4.5增至 7.5时,Fe2+/K2S2O8的脱Hg效率90.58%下降至 77.78%,降幅明显。其原因可能与Fe2+及Fe3+的溶解性能有关。在催化反应过程中Fe2+被 K2S2O8氧化生成了更易沉淀的Fe3+,而 Fe(OH)3的形成可能对协同体系的催化过程产生了负面的影响。CAO[9]的试验证明,pH值<1.5时,底物林丹降解的动力学常数远大于3.5~9的pH值环境,说明碱性酸性基体环境更有益于K2S2O8及其过渡金属催化体系的氧化,这也与本实验结果相似。
Cu(OH)2的溶度积常数最小,当pH值>5.8时,Cu2+即可形成Cu(OH)2沉淀,由图7也可以看出,当pH值由3.5增长到5时,Cu2+/K2S2O8体系的脱Hg效率由 74.54%下降至 69.62%,下降幅度不大;而当 pH值上升至7.5时,脱Hg效率迅速下降至53.75%,与pH值=5时的 69.62%相比,脱 Hg效率下降了15.87%,这说明 pH 值在 5~ 7.5的范围内,由于 Cu2+因与OH-结合形成Cu(OH)2沉淀而大量减少,Cu2+/K2S2O8体系的脱Hg效率严重下降,这同时也说明与Cu2+,K2S2O8之间形成的配合物相比,Cu2+与 OH-的结合能力更强,pH值对体系的影响更为突出。
2.4 初始Hg浓度对Hg脱除效率的影响
试验条件:K2S2O8浓度为 3 mmol/L,Fe2+,Mn2+,Cu2+,Co2+4种过渡金属离子浓度均为1 mmol/L,T2=45 ℃,Q=1 L/min,V=250 mL,t=2.5 min,pH 值 =5。入口Hg浓度与脱Hg效率之间的关系见图8。

图8 入口Hg浓度对氧化效率的影响
由图8可知,在试验条件下,随着入口Hg浓度的增加,各体系的脱Hg效率略有提高,但增幅并不明显,基本保持稳定。以K2S2O8溶液为例,当K2S2O8浓度为3 mmol/L时,Hg渗透管的温度由25℃(Hg渗透量约为24 μg/m3)升至90℃(Hg渗透量约为90 μg/m3),脱 Hg 效率由 40.17%增长至 44.37%,增幅仅 为 4.2% 。 K2S2O8/Fe2+,K2S2O8/Co2+,K2S2O8/Cu2+,K2S2O8/Mn2+也呈现出相似的变化趋势。理论上,入口Hg浓度的增加提高了Hg的气相推动力,加速了气液间传质,反应速率加快,但试验结果表明这种促进作用十分有限。这可能是由于氧化吸收液中K2S2O8的含量处于过量状态,由于反应的累积时间较短(t=2.5 min),入口Hg浓度的改变对氧化吸收液的冲击影响不大,同时,由于K2S2O8及其过渡金属离子协同体系对Hg的氧化速率极快,入口Hg浓度的增加可能提高了反应液中Hg2+的绝对量,但对其相对质量浓度的影响很小。
2.5 反应温度对Hg脱除效率的影响
反应温度与脱Hg效率之间的关系见图9。

图9 反应温度对氧化效率的影响
由图9可知,不同脱Hg体系对反应温度变化的适应性不同。当反应温度由30℃升至60℃,K2S2O8的脱 Hg 效率由 47.91%升高至 60.28%,但当反应温度继续升高,脱Hg效率又转而下降,当反应温度为70℃时,脱Hg效率下降至49.78%。理论上,随着温度的升高,Hg蒸气的饱和蒸汽压随之增加,气相推动力增大,对反应有促进作用,K2S2O8分解的摩尔热力学能为130 kJ/mol,加热会激发K2S2O8过氧键的断裂生成SO4-·。
在25~60℃范围内随着温度的升高,K2S2O8分解活性增加,脱Hg效率呈上升趋势;但当反应温度超过60℃时,脱Hg效率又转而下降。随着温度的升高,Hg的饱和蒸汽压增大,Hg在液相中的溶解度降低,氧化吸收反应受到限制。所以在本试验中,K2S2O8脱Hg的最适反应温度为60℃。
Fe2+/K2S2O8,Cu2+/K2S2O8体系脱 Hg效率随反应温度变化的情况与K2S2O8相似,45℃是Fe2+/K2S2O8和Cu2+/K2S2O8体系脱Hg的最适反应温度,与K2S2O8相比,最适温度向低温方向移动。这可能是由于:①Fe2+的催化作用降低了O-O分解能力,在较低的温度(T2< 45℃)范围内 K2S2O8即可分解生成 SO4-·,温度的升高对Hg氧化反应的影响并不显著,却降低了Hg在水中的溶解度,Hg的溶解量成为了最主要的控制因素;②向K2S2O8溶液中加入过渡金属离子后,产生的如SO4-·等自由基是氧化Hg的主要成分,温度升高使得自由基释放过快,反应并不完全,自由基利用率降低,另外,不断较高的温度也加快了自由基不规则的布朗运动,增加了自由基因的复合机率。
3 结论
(1)加入Fe2+,Co2+等过渡金属离子催化K2S2O8产生氧化性能更强的SO4-·,可大幅提高K2S2O8与Hg的反应活性。
(2)试验所选取的4种过渡金属离子催化性能由高到低分别为 Fe2+> Co2+> Cu2+> Mn2+,K2S2O8浓度为 3 mmol/L,K2S2O8与 Fe2+的摩尔比为 3 :1,反应温度为45℃时,Fe2+/K2S2O8体系的脱 Hg效率为94.61%,Hg脱除效果最佳。在相同的反应条件下,Cu2+/K2S2O8体系脱 Hg 效率在 74.84% ~ 78.26%之间,该体系的稳定性更为突出。
(3)pH值影响过度金属离子在体系中的形态,在3.5~9的范围内,pH值的升高对于协同反应体系不利。 pH 值在 4.5 ~ 5.5 之间,Fe2+/K2S2O8体系的脱汞效率在90%以上,与石灰石—石膏湿法烟气脱硫系统协同作用,可达到同时脱硫脱汞的目的。
(4)反应温度在 25 ~ 90 ℃内,Fe2+/K2S2O8,Cu2+/K2S2O8体系氧化吸收效率呈钟型分布,反最佳反应温度为45℃,脱 Hg效率为93.25%,Co2+/K2S2O8系体系对于反应温度的适应性较好,去除效率基本保持 81.47% ~ 85.16%之间。
(5)入口Hg浓度的改变对各体系的脱Hg性能影响不大,体系抗冲击负荷能力较强。
